2024年CSCO大会期间,【肿瘤资讯】特邀南加州大学 (USC) /诺里斯综合癌症中心Heinz-Josef Lenz教授与中山大学肿瘤防治中心王峰教授深度对谈,邀请中山大学肿瘤防治中心何叶教授进行主持,从中国和国际视角交流临床实践的观点,深入讨论免疫疗法在结直肠癌(CRC)治疗中的临床意义。
双免获益,惊艳全球:CheckMate 8HW深入剖析,双免方案或将改变临床实践
Q1:CheckMate 8HW研究的结果会对临床实践带来哪些影响?
Lenz教授:CheckMate 8HW是一项大型、随机对照、Ⅲ期临床研究,对比了纳武利尤单抗联合伊匹木单抗与化疗在MSI-H/dMMR mCRC患者一线治疗中的疗效。入组患者随机接受纳武利尤单抗联合伊匹木单抗或研究者选择的化疗方案,主要研究终点为无进展生存期(PFS)。研究于2024年ASCO大会报告的结果显示,中位随访31.5个月时,双免方案对比化疗显著延长了PFS,HR达到了0.21,特别是亚洲亚组的HR达到惊人的0.03;双免组的2年PFS率达到了72%,优势明显(化疗组2年PFS率14%),该研究结果将有望改变临床实践。未来双免方案将有望成为MSI-H/dMMR mCRC患者的一线标准治疗方案。
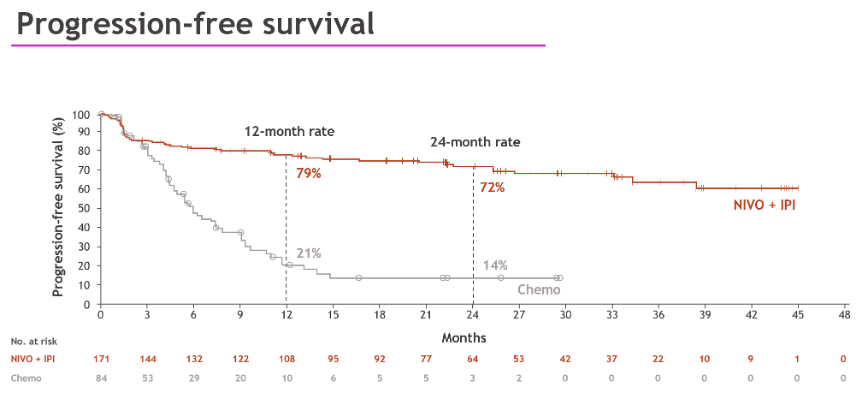
关于安全性问题,基于此前在黑色素瘤临床研究中的安全性表现,CheckMate 142研究设计中将CTLA-4单抗剂量设置为1mg/kg,结果显示并未增加额外的毒性,提示了该方案的可行性,后续该结果在CheckMate 8HW研究中也得到验证。
王峰教授:此前在CheckMate 142研究中,双免方案一线治疗的客观缓解率(ORR)便达到了71%,提示了该方案作为未来标准治疗的潜力,未来随着CheckMate 8HW研究数据的进一步更新,该方案的疗效将持续得到验证。此外,临床实践中的应用还需要考量不同的个体化因素,例如患者经济能力。目前,伊匹木单抗在国内尚未纳入医保,这可能影响患者的用药可及性。如果未来双免方案能有效降低支付门槛,或将会考虑为更多患者推荐双免方案。
好药先用,获益更多:PFS2指标提示患者全程获益,MSI-H/dMMR mCRC患者一线首选免疫治疗
Q2:CheckMate 8HW和KEYNOTE 177两项研究都考察了PFS2这一研究终点,您对这个指标怎么看?PFS2对临床有什么指导意义?
Lenz教授:PFS2是非常有趣的临床指标,临床治疗中后续治疗也非常重要,如果一线治疗中没有选择合适的方案,可能会因为交叉耐药的缘故,导致后线治疗的获益受损。因此,在肿瘤特别是实体瘤的治疗中,需要按照特定的序贯使用抗肿瘤方案。而在mCRC的免疫治疗中,前线方案的选择也会影响到后续方案的疗效,基于此,我认为应当采取“好药先用”的原则,尽早使用免疫治疗,提高后续治疗的敏感性。此前在日本研究者开展的关于胃癌的免疫治疗的临床研究中,便观察到一线免疫治疗对后线化疗疗效的增强,而在本次研究中,我们也在mCRC中观察到了类似的结果。CheckMate 8HW研究中双免组的PFS2 HR也达到了0.27,这是既往其他一线治疗方案的PFS2难以达到的疗效表现。基于此,PFS2数据提示我们,应尽量在一线治疗中应用双免方案,以为患者带来更长的全程获益。
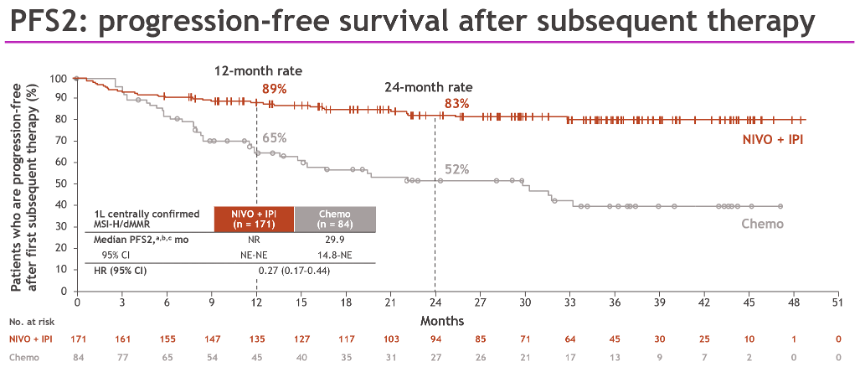
王峰教授:我也同意PFS2的重要临床价值。我中心开展的一项评估抗血管生成药物与化疗二线治疗晚期胃癌的III期研究中也观察到了类似的结果,既往在一线治疗中接受免疫治疗的患者,在二线抗血管生成药物治疗中的获益更多,因此,应当在一线治疗中优先使用免疫治疗。
双免模式,获益更广:亚组分析提示各类患者均可获益,双免模式为更多患者带来福音
Q3:有研究显示:肝转移、腹膜转移+腹水等是单免治疗疗效不佳的相关因素。此前KEYNOTE 177研究也显示了部分亚组获益受限,帕博利珠单抗在中国获批的适应证也同样排除了BRAF/KRAS/NRAS突变的人群。此次双免疫治疗临床研究显示全部亚组均全面获益,这对您的治疗选择是否有帮助?您会基于哪些因素进行选择?
Lenz教授:基于CheckMate 8HW研究的亚组分析,我们发现包括BRAF/KRAS/NRAS突变、肝转移、腹膜转移人群,均可从双免治疗中获益,其中亚洲人群、肝转移人群的获益最多。此前KEYNOTE-177研究结果显示,以上特殊人群接受单免治疗的获益有限,其中特别值得探讨的是BRAF/KRAS/NRAS突变且MSI-H人群,对于这部分患者,应如何选择治疗方案?基于目前CheckMate 8HW研究数据,这部分患者毫无疑问应当首选双免治疗。靶向治疗的确也存在一定疗效,但并不尽如人意,且患者可能很快产生耐药。同时在临床实践中,我们还惊喜地发现, CTLA-4单抗,在微卫星稳定(MSS)型患者中也可显示显著的获益,应答率可达到20%,优于既往我所经历的任何治疗方案。
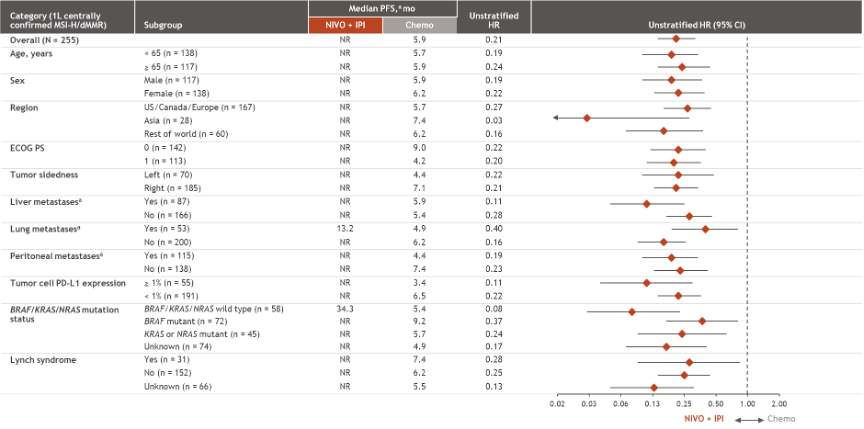
王峰教授:我非常赞同,尽管在Keynote-177研究中我们观察到部分亚组患者的获益不佳,但并不意味着这部分患者不应接受免疫治疗,而CheckMate 8HW研究则进一步显示了包括BRAF/KRAS/NRAS突变、肝转移、腹膜转移人群,均可从双免治疗中获益。因此,对于该类患者,我们会推荐采取双免治疗。
MSS型患者则是另一种情况,既往在REGOTORI研究中,肝转移患者接受免疫联合抗血管生成治疗的获益有限。然而在CheckMate 8HW研究中,肝转移患者接受双免治疗获益非常显著,因此该类患者并不应被排除双免方案的获益人群。
强力缩瘤,改变实践:高缓解率提示或可豁免手术,精准检测技术可辅助筛选CR患者
Q4:CheckMate 8HW研究中,有部分患者进行了转化手术,pCR率达到60%,这对于MSI-H/ dMMR肠癌的转化治疗有何启示?经免疫治疗已达完全缓解的患者,是否还有必要手术?
王峰教授:CheckMate 8HW研究中,部分患者接受了手术,病理完全缓解(pCR)率达到了60%,这已经是非常高的数据。实际上,并非所有患者都需要接受手术,我们也通常不会考虑对转移性疾病患者进行手术。此前,在Ⅱ期研究中,即使患者仅接受2周期的PD-1单抗和1周期的CTLA-4单抗治疗,pCR率便已经超过了80%。因此,双免治疗可以达到非常好的疗效,或许未来早期患者连手术都不需要,因为肿瘤已经都被杀死了。
Lenz教授:根据我的经验,很多患者在接受双免治疗后,肿瘤都明显缩小了,或许并不需要手术切除,或接受放疗、化疗等其他治疗手段的干预,这将是双免治疗为患者带来的巨大变化。但我们需要准确地找到通过治疗达到pCR的患者,或许可以通过液体活检等技术进行检测。
王峰教授:临床完全缓解(cCR)的评估非常困难,既往在Ⅱ期研究中我们评估cCR的中位时间约为5.2个月,实际上可能需要更长的时间。根据MSKCC的统计,采用不同的评估手段需要的评估时间不同,ctDNA是最快的评估方法,但大概也需要1.5个月的时间来评估cCR。PET-CT的评估较常规MRI更快,或许未来可以通过PET-CT与ctDNA的联合来进行评估,但这依然非常困难。目前国内有很多的Panel可供选择,我们还需要找出最合适的Panel来进行ctDNA检测。
探索前移,希望无限:辅助免疫治疗最佳周期仍有待探索,期待新辅助免疫治疗更多探索成果
Q5:好的治疗模式总是会探索向前线推进。NICHE-2(N+I)和2024 ASCO上徐瑞华教授团队公布的国产双免新辅助的研究均证实了免疫治疗在CRC围术期的临床价值。对于MSI-H/dMMR肠癌免疫治疗的前移您有何看法?在这个领域,还有哪些有待解决的问题?
Lenz教授:最佳治疗周期目前尚没有答案,局晚期患者是个不同的类别。对于晚期患者,我们通常治疗达到2年,目前一些数据显示或许治疗1年也可,但我目前还是会按照循证医学证据在辅助阶段采取2年的治疗周期,或许根据肿瘤的远处转移部位,最佳治疗周期也会有所不同。
NICHE-2、NICHE-3等研究将支持免疫治疗在MSI-H患者中的新定位。新辅助免疫治疗取得了很好的疗效,反应率非常高,提示我们找到了合适的新辅助治疗方案,或许有助于患者豁免手术、放疗。这些研究的成功仅仅是开始,期待未来免疫治疗在新辅助治疗中的更多探索。
Professor of Medicine and Biochemistry & Molecular Medicine, Keck School of Medicine, University of Southern California
J. Terrence Lanni Chair in Cancer Research, Keck School of Medicine, University of Southern California
Co-Director ,USC Center for Cancer Drug Development, Keck School of Medicine, University of Souther California
Professor of Medicine, Division of Medical Oncology, Keck School of Medicine, University of Southern California
Professor of Preventive Medicine, Division of Medical Oncology, Keck School of Medicine, University of Southern California
Deputy Director for Research Programs at USC Norris Comprehensive Cancer Center
He is PI on the NCI CTEP UM1 and NCI CTEP UM1 grant
He is PI on the NCI U2C grant on Molecular Characterization of Colorectal Cancer
He is Member of the NCI Investigational Drug Steering Committee
He has published over 600 papers with H-index of 124
中山大学肿瘤防治中心院长助理/内科主任
UT MD Anderson 肿瘤中心博士
教育部青年长江学者
中国抗癌协会青年理事会 副理事长
中国抗癌协会肿瘤靶向治疗专业委员会青委 副主任委员
广东省抗癌协会肿瘤靶向治疗专业委员会青委 主任委员
广东省抗癌协会多原发和不明原发肿瘤专业委员会 副主任委员
中国临床肿瘤学会 理事
中国临床肿瘤学会青委会 常委
长期致力于消化道肿瘤的临床诊疗及基础转化研究,主持国家自然科学基金国际(地区)合作与交流项目、面上项目在内的科研基金14项,参与863计划、国家重点研发计划等重大项目研究。以第一/共一或通讯/共通讯作者,在 Nature Medicine, Cancer Cell, Journal of Clinical Oncology, The Lancet Gastroenterology and Hepatology 等杂志发表论文57篇。设计并牵头全国多中心II、III期临床研究27项。荣获国家科技进步奖二等奖、教育部科技进步一等奖、中华医学会科技进步一等奖、教育部科技进步奖一等奖、中国医学科学院“2022年度重要医学进展”奖、广东青年五四奖章等省部级奖项。曾多次受邀在美国ASCO年会、欧洲ESMO年会、中国CSCO年会等重大国际会议做口头报告。
中山大学肿瘤防治中心内科
美国密歇根大学访问学者
美国密歇根大学The Abraham H. Grant Award获奖者
主持中国博士后面上项目1项,国家自然科学青年基金1项
发表SCI论文多篇
文稿:1506-CN-2400559
排版编辑:肿瘤资讯-Kaela











 苏公网安备32059002004080号
苏公网安备32059002004080号


