
NTRK基因融合是多种癌症的致癌驱动因素,可见于各种成人和儿童实体瘤,整体阳性率为 0.3%。成年患者(≥18岁)和儿童患者(<18岁)的NTRK基因融合阳性率分别为 0.28%和1.34%。在中国(或亚洲)癌症患者中,NTRK基因融合阳性率为 0.4%1。其中,NTRK基因融合肺癌的发生率约为0.1~0.2%2-4,作为近年来被发现的肺癌关键驱动基因之一,其在肺癌发生发展中的作用日益受到重视。
拉罗替尼是一种first-in-class、高选择性、具有中枢神经系统活性的TRK抑制剂,基于在各种肿瘤类型患者中显示的稳健和持久的疗效,2022年拉罗替尼在国内获批用于治疗患有NTRK基因融合的局部晚期或转移性实体瘤的成人和儿童患者,是首个不限瘤种实体瘤的精准靶向药物。
近期,拉罗替尼的多项重磅研究接连亮相国际学术盛会,吸引了肿瘤领域内学者的高度关注。基于此,我们邀请到中山大学附属第一医院唐可京教授和中山大学肿瘤防治中心张玉教授为我们解读这几项研究并探索拉罗替尼在TRK融合肿瘤治疗领域中的价值以及发展前景。
特邀专家
医学博士,主任医师,博士生导师,博士后合作导师、中山大学附属第一医院呼吸与危重症医学科副主任,药学部主任/党总支部书记、感染性疾病科主任
美国范德堡 (Vanderbilt) 大学医学中心访问学者
美国德州大学西南医学中心 (UTSW) Harold C. Simmons综合癌症中心访问科学家
中山一院肺癌MDT首席专家,Ⅲ期肺癌多学科联合规范化诊疗中心、肺癌诊疗一体化中心、肿瘤免疫治疗不良反应MDT团队负责人
中国医师协会呼吸医师分会肺癌工作委员会委员
中国肺癌防治联盟免疫治疗委员会常委
中国抗癌协会个案管理专业委员会常务委员
中国初级卫生保健基金会胸部肿瘤精准治疗专委会常务委员
广东省医师协会临床试验专业委员会副主任委员
广东省临床试验协会(GACT / CTONG)理事
广东省基层医药学会肺癌专业委员会副主任委员
广东省女医师协会肺癌专业委员会常务委员
广东省医师协会呼吸科医师分会常务委员,感染与重症专业工作组组长
广东省医学会临床药学分会副主任委员
广东省医学会呼吸病学分会常务委员
广东省女医师协会呼吸与危重症医学专业委员会副主任委员
广东省临床医学学会呼吸病学专业委员会副主任委员
美国南加州大学洛杉矶儿童医院访问学者
广东省抗癌协会肿瘤病理专业青年委员会常务委员
广东省抗癌协会小儿肿瘤专业委员会常务委员
广东省抗癌协会肿瘤病理专业委员会委员
广东省医学会病理学分会青年委员会委员
广东省医师协会甲状腺专业医师分会常务委员
广州市医学会甲状腺疾病委员会委员
研究速递
ESMO 2024(#628P) :拉罗替尼一线治疗TRK融合肿瘤
本研究纳入了三项关键的临床试验(NCT02637687 [SCOUT],NCT02576431 [NAVIGATE]和NCT02122913)中接受拉罗替尼一线治疗的非原发性中枢神经系统(CNS)TRK融合的肿瘤患者。主要终点是由独立审查委员会(IRC)根据实体瘤反应评估标准(RECIST)v1.1评估的客观缓解率(ORR)。数据截止日期为2023年7月20日。
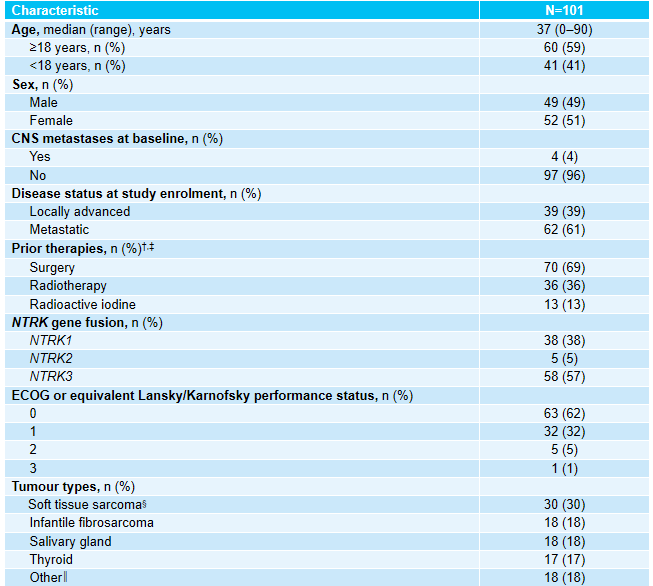
本研究最终共纳入101例接受拉罗替尼一线治疗的NTRK基因融合肿瘤患者,其中4例在基线时存在CNS转移。NTRK基因融合情况主要由NGS测序确定(81/101, 80%)。在25种基因融合中,ETV6::NTRK3最为常见(n=50, 50%)。其他患者基线情况见表1。
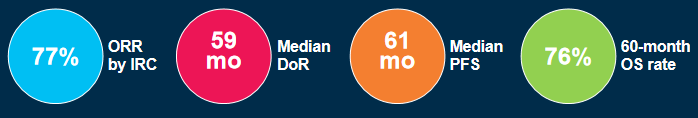
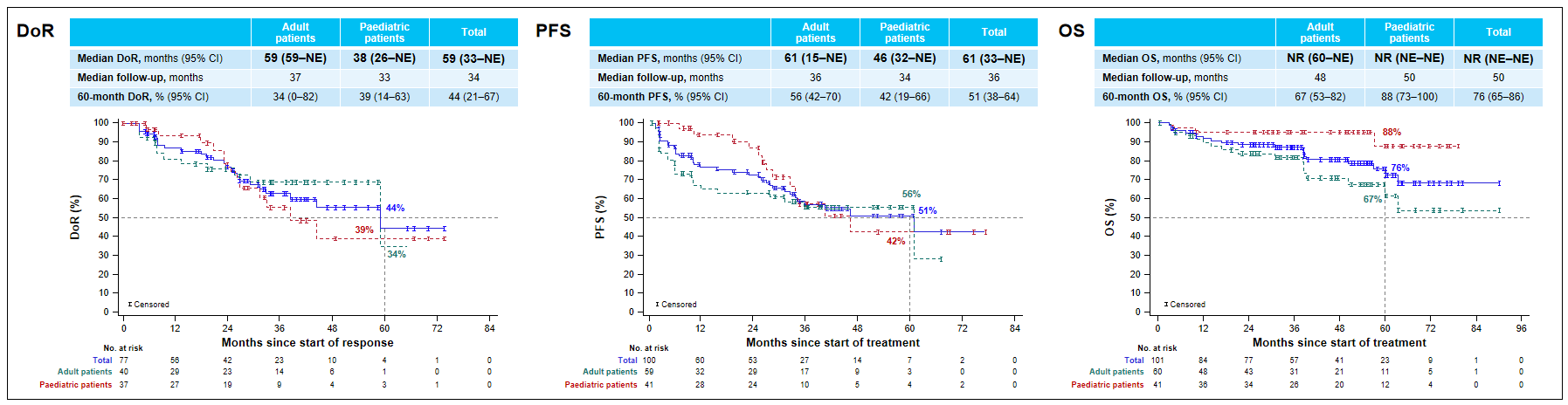
在100例符合IRC评估条件的患者中,总ORR为77%(95% CI 68-85),其中局晚期患者的ORR达到90%(95% CI 76-97),基线转移患者的ORR为69%(95% CI 56-80)。所有患者的中位缓解持续时间(DoR)为59个月(33-NE)、中位无进展生存期(PFS)为61个月(33-NE)、中位总生存期(OS)为NR(NE-NE)(图1)。
与治疗相关的不良事件(TRAEs)主要为1/2级,有26例(26%)患者报告了3/4级TRAEs。最常见的为丙氨酸转氨酶升高(n=5,5%)、体重增加(n=4,4%)、天冬氨酸转氨酶升高(n=3,3%)和中性粒细胞减少(n=3,3%)。10例(成人5例,儿童5例)患者在治疗过程中发生骨折,均与拉罗替尼治疗无关。1例(1%)患者因TRAE(低通气)而停止治疗。未出现治疗相关死亡。
ESMO 2024(#627P):拉罗替尼治疗TRK融合肿瘤

本研究纳入了三项关键的临床试验(NCT02637687 [SCOUT],NCT02576431 [NAVIGATE]和NCT02122913)中接受拉罗替尼治疗的非原发性CNS TRK融合的肿瘤患者。主要终点是由IRC根据RECIST v1.1评估的ORR。数据截止日期为2023年7月20日。
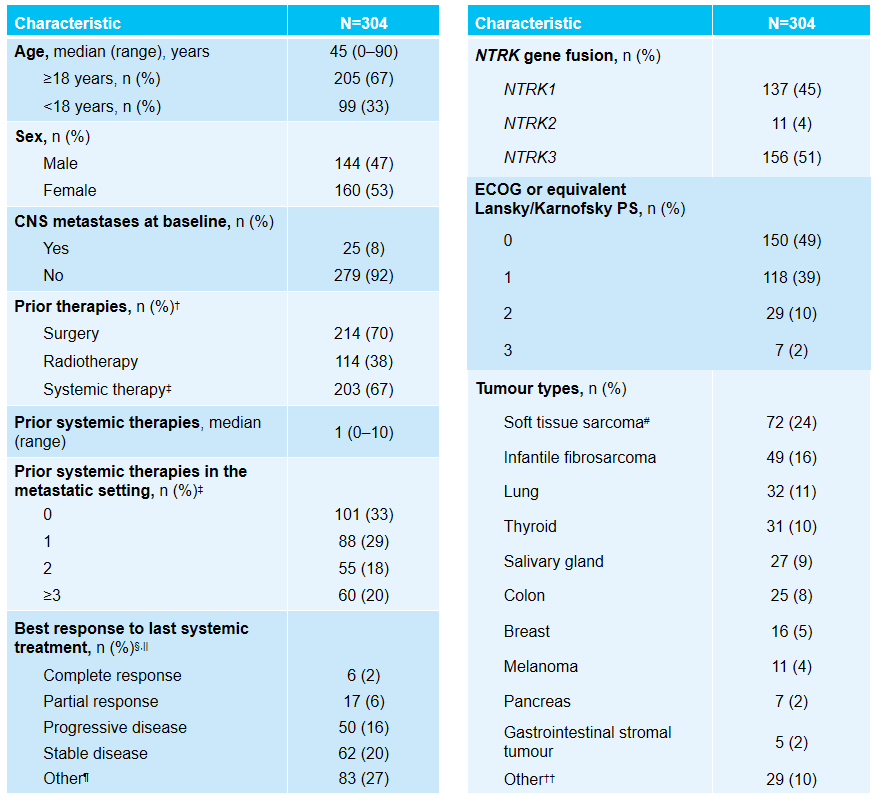
本研究最终纳入304例接受拉罗替尼治疗的NTRK基因融合肿瘤患者,肿瘤类型共计28种,其中25例在基线时存在CNS转移。NTRK基因融合情况主要由NGS测序确定(267/304, 88%)。在71种基因融合中,ETV6::NTRK3最为常见(n=119, 39%)。其他患者基线情况见表2。
在302例符合IRC评估条件的患者中,总ORR为65%(95% CI 59-70),儿童群体的ORR为54%(95% CI 47-61)。所有患者的中位DoR为43个月(33-NE)、中位PFS为28个月(20-36)、中位OS为NR(63-NE)(图2)。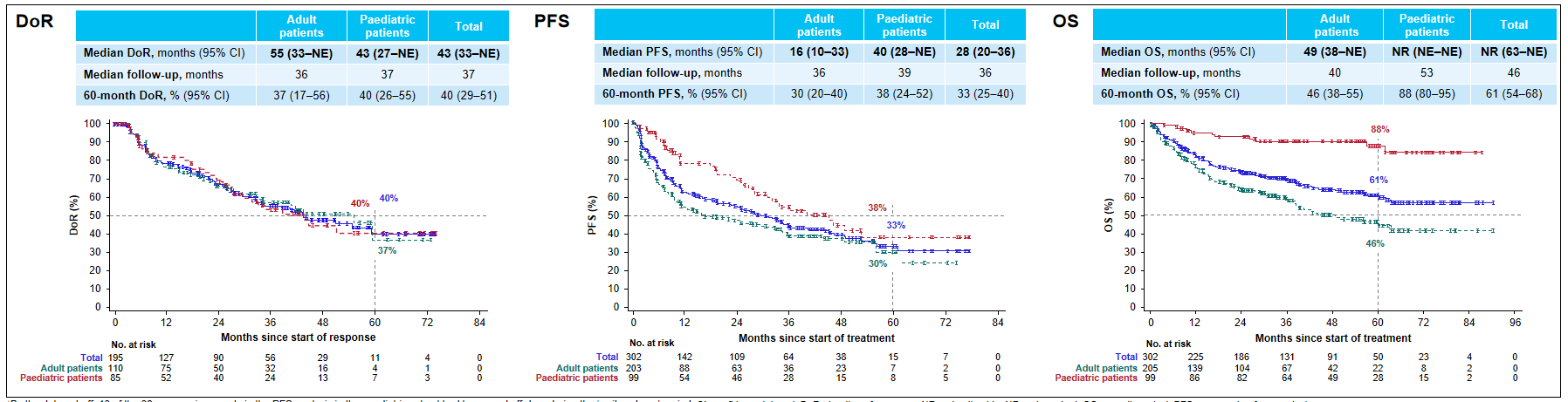
TRAEs主要为1/2级,有68例(22%)患者报告了3/4级TRAEs。最常见的为丙氨酸转氨酶升高(n=13,4%)和中性粒细胞减少(n=12,4%)。26例(9%,成人14例,儿童12例)患者在治疗过程中发生骨折,仅有1例与拉罗替尼治疗相关。5例(2%)患者因TRAEs(情感冷漠、低通气、不适感、中性粒细胞减少、丙氨酸转氨酶以及天冬氨酸转氨酶升高)而停止治疗。未出现治疗相关死亡。
WCLC 2024(#MA 06.12):拉罗替尼治疗TRK融合肺癌

本研究纳入了两项关键的临床试验(NCT02576431和NCT02122913)中接受拉罗替尼治疗的TRK融合肺癌患者。这些患者均在入组前经过NGS检测确认存在NTRK基因融合。主要终点是由IRC根据RECIST v1.1评估的ORR。数据截止日期为2023年7月20日。
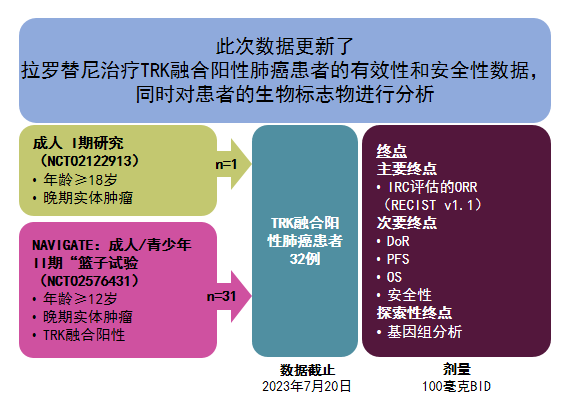
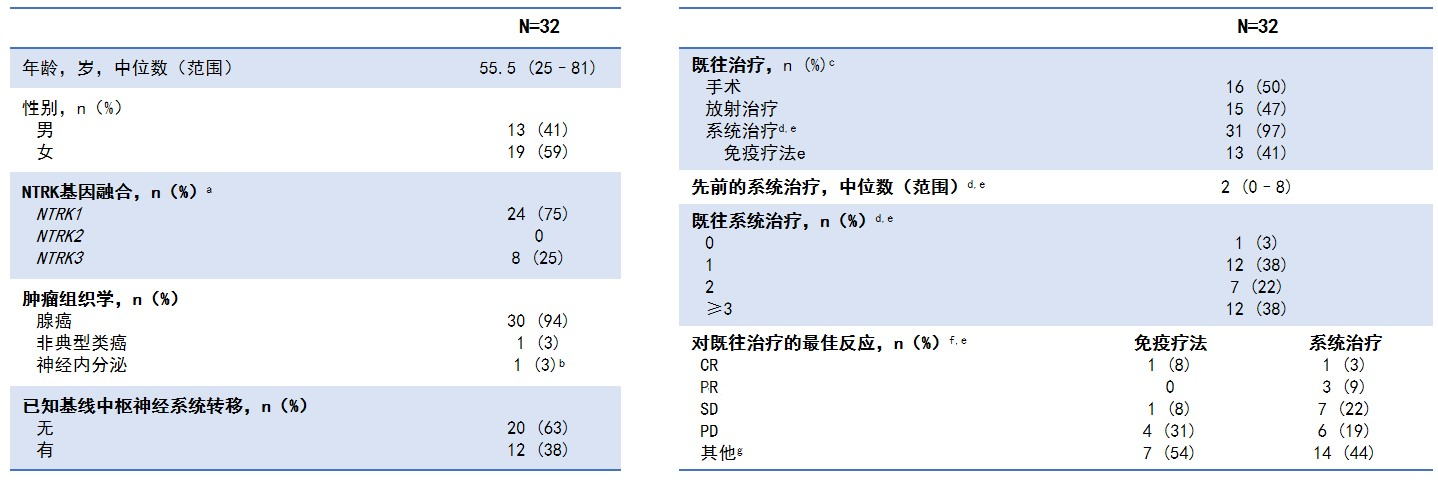
本研究共纳入32例NTRK基因融合肺癌患者,中位年龄为55.5岁,其中12例在基线时存在CNS转移。在NTRK基因融合类型方面:75%的患者为NTRK1,25%的患者为NTRK3。其他患者基线情况见表3。
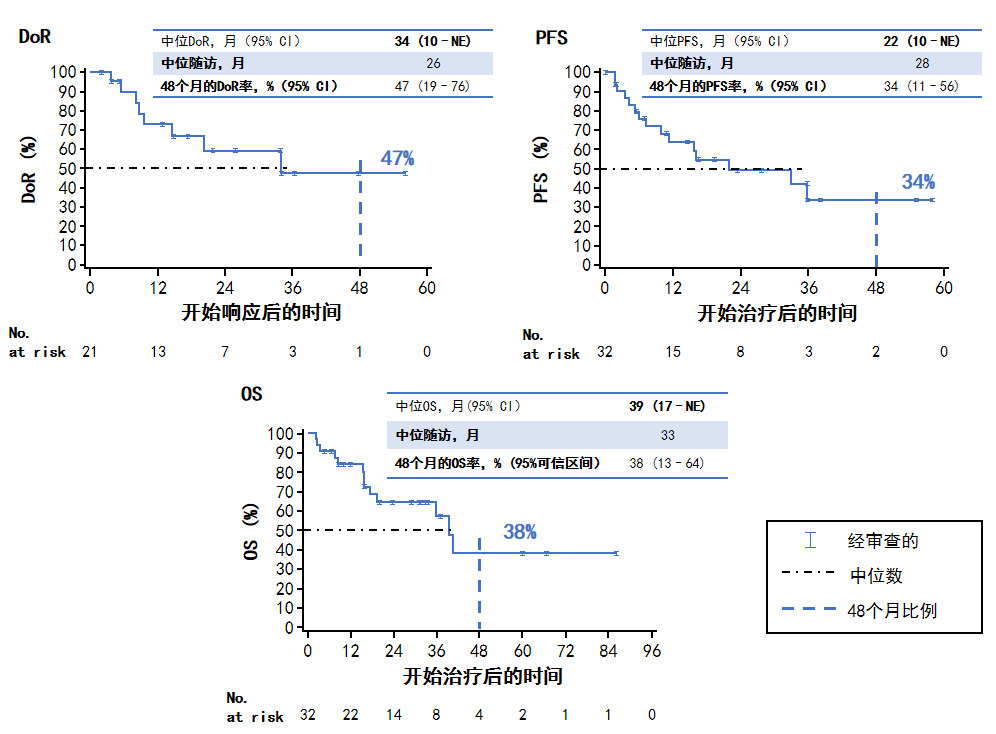
在27例符合IRC评估条件的患者中,总ORR为66%(95% CI 47-81),对于已知存在CNS转移的患者,ORR为67%(95% CI 35-90)。所有患者的中位DoR为34个月(10-NE)、中位PFS为22个月(10-NE)、中位OS为39个月(17-NE)(图4)。
在探索性终点方面,共有16名患者提供了基线基因组数据,这些数据来源于ctDNA(n=15名患者)或组织DNA(n=13名患者)。基线ctDNA分析在15名患者中的6名中检测到了NTRK基因融合。在16名患者中,有6名患者还发现了额外的基线NTRK基因和已知或可能的致癌共突变(图5)。
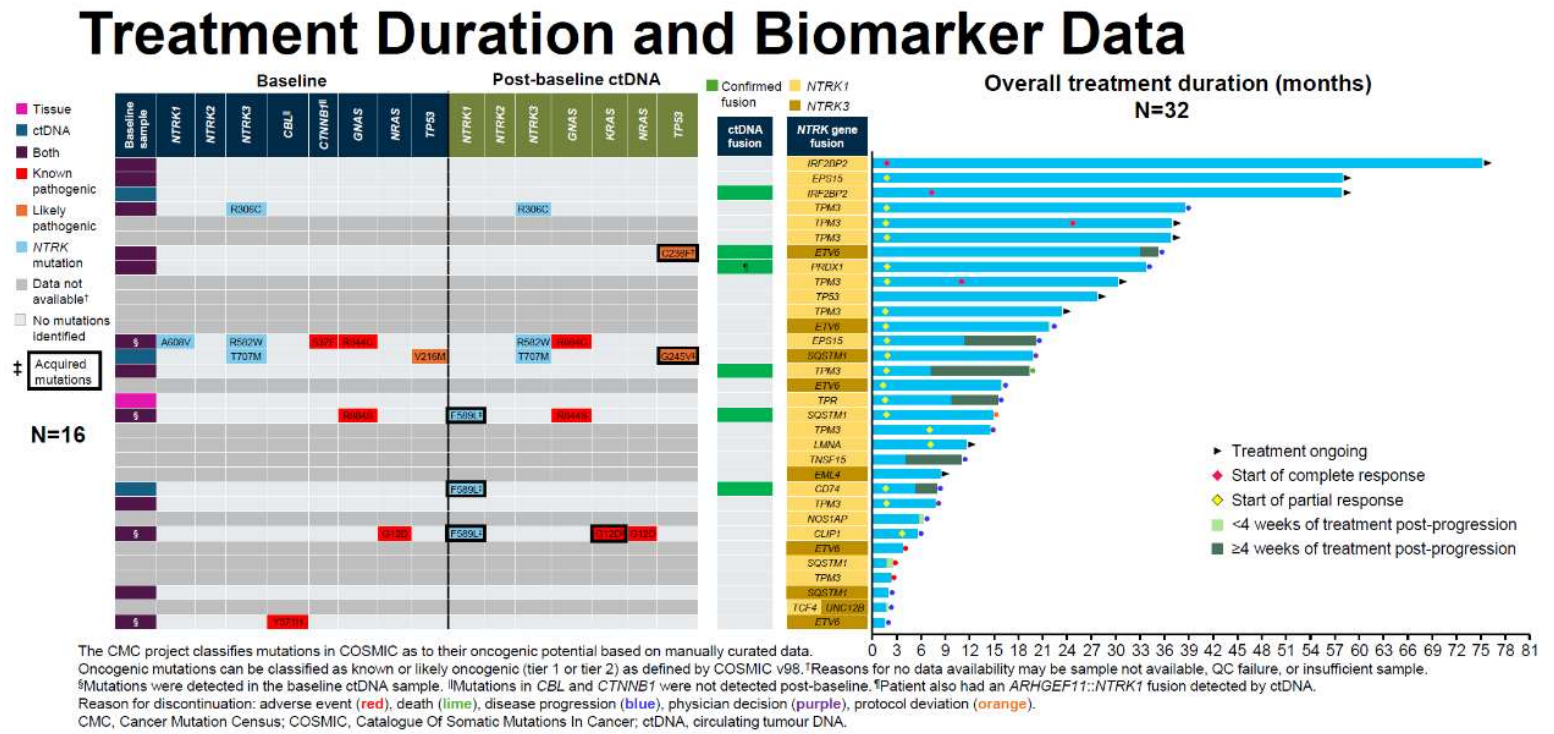
安全性方面,拉罗替尼治疗的长期随访数据未显示新的安全信号。TRAEs主要为1/2级,有9例患者报告了3/4级TRAEs。1例患者因TRAEs(丙氨酸转氨酶、天冬氨酸转氨酶和γ-谷氨酰转移酶升高)而停止治疗。未出现治疗相关死亡。
【专家点评】
唐可京教授:NTRK基因融合作为近年来被发现的肺癌关键驱动基因之一,其在肺癌发生发展中的作用日益受到重视。拉罗替尼作为一种高选择性的NTRK基因融合抑制剂,已在临床试验中展现出对NTRK基因融合阳性肺癌患者的显著疗效。2024年NCCN指南将拉罗替尼推荐为NTRK基因融合阳性NSCLC的优选一线治疗及后续治疗5;同样地,2024年更新的CSCO指南也推荐拉罗替尼作为IV期NTRK融合NSCLC患者的一线治疗(I级推荐)6。
此次WCLC 2024报道的研究,进一步评估了拉罗替尼在这一患者群体中的有效性和安全性是否可持续。在此次报道的结果中还值得我们重点关注的是基线存在CNS转移的患者的ORR与总体人群的ORR一致(67% vs 66%),进一步证实了拉罗替尼在穿透血脑屏障方面的能力。CNS转移是肺癌患者预后不良的重要因素之一,且相当比例的肺癌患者在疾病初诊或进展时都伴随着脑转移。本研究结果提示随着拉罗替尼用药时间的延长,已有脑转移或者脑转移高危的TRK融合肺癌患者可能从中获益更多。此外,本研究的结果也支持NGS用于NTRK基因融合的检测以确定可能受益于靶向治疗的患者,且ctDNA NGS亦可用于检测NTRK基因融合,但是阴性结果应使用基于组织的NGS进行复测。
总之,拉罗替尼在晚期TRK融合肺癌患者中,包括那些在基线时就存在CNS转移的患者中,继续表现出快速且持久的疗效、延长的生存获益,并具有良好的安全性。
张玉教授:分子生物学及检测技术的飞跃推动了肺癌治疗领域的革新,特别是驱动基因如NTRK基因融合的发现与靶向药物(如拉罗替尼)的研发,为NSCLC等肿瘤治疗开辟了新途径。近年来,已有较多关于拉罗替尼在NTRK基因融合阳性肿瘤中的疗效报告,其安全性和有效性获得高度认可。然而,NTRK基因融合作为关键治疗靶点,其检测对TRK抑制剂治疗至关重要。病理学科室需结合常规病理与先进分子技术,精准识别NTRK融合,以支持个体化医疗决策。NTRK基因融合作为已知的致癌和转化的主要分子改变,其可以通过免疫组化(IHC)、荧光原位杂交(FISH) 、逆转录聚合酶链反应(RT-PCR)或下一代测序(NGS)来检测。NGS已在多研究中发挥高效识别NTRK基因融合的能力,如ESMO 2024中拉罗替尼治疗的研究中,80%甚至88%的患者通过NGS检测确认了NTRK融合[19]。
此外,值得强调的是,在儿童肿瘤群体中,NTRK基因融合阳性率高于成人。这意味着,在儿童实体瘤的诊断中更应充分应用分子病理工具,及时识别出NTRK基因融合,提供基于分子分型的个性化治疗方案对于儿童患者的预后改善具有至关重要的作用,特别是避免传统化疗和放疗带来的长期毒性影响。《中国实体瘤 NTRK基因融合临床诊疗专家共识》强力推荐对所有晚期儿童实体瘤患者行 NTRK基因融合检测,并根据不同种类肿瘤的特性采取不同的检测策略;对于晚期儿童肿瘤患者,推荐于标准治疗前或治疗期间行NTRK基因融合检测;对于 NTRK 基因融合发生率高的局部晚期肿瘤患者,应在行新辅助治疗前行NTRK 基因融合检测[7,8]。总体而言,随着分子病理技术的进步,病理科医生在癌症的早期诊断、精准分型以及指导靶向治疗方面的作用将进一步增强。通过提高检测的敏感性和特异性,能够为临床提供更可靠的依据,从而帮助患者获得更好的治疗效果和生存预期。
[1]中国实体瘤NTRK融合基因临床诊疗专家共识
[2] Forsythe A, et al. Ther Adv Med Oncol. 2020;12:1–10.
[3] Solomon JP, et al. Mod Pathol. 2020;33:38–46.
[4] Farago A, et al. JCO Precis Oncol. 2018;2:1–12.
[5] NCCN Guidelines version 2. 2024: Non-Small Cell Lung Cancer.
[6] 20234CSCO非小细胞肺癌诊疗指南.
[7] Gatalica Z, Xiu J, Swensen J, et al. Molecular characterization of cancers with NTRK gene fusions[J]. Mod Pathol, 2019, 32(1):147-153.
[8]Xu C, Si L, Wang W, et al. Expert consensus on the diagnosis and treatment of NTRK gene fusion solid tumors in China. Thorac Cancer. 2022;13(21):3084-3097. doi:10.1111/1759-7714.14644.
审核号:
MA-LAR-CN-0232-1
排版编辑:肿瘤资讯-Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


