引言:MET 14号外显子跳跃突变(METex14)是NSCLC相对罕见的致癌驱动因素。近年来,MET抑制剂已被证实可以改善METex14患者预后,已获批相关适应症。然而,不同METex14阳性NSCLC患者对各种治疗反应和预后各异,提示METex14可能存在一定的异质性。为了探索和更好地表征METex14阳性NSCLC患者的异质性,上海市胸科医院研究团队基于超120例METex14阳性NSCLC患者进行了聚类分析,并对不同亚型的生物学和临床意义进行了分析和验证。相关结果已于2024年7月发表于NPJ Precis Oncol杂志(影响因子:6.8),本文对此进行简要解读和分享,希望能为医务工作者提供新的科研和临床参考,造福更多肺癌患者。
背景
METex14是1-3%非小细胞肺癌(NSCLC)的致癌驱动因素,包括肺腺癌(LUAD)和肺鳞癌(LUSC)。METex14阳性NSCLC可对MET酪氨酸激酶抑制剂(MET-TKIs)治疗有反应,报道的客观缓解率(ORR)范围为32%至67.9%,中位无进展生存期(mPFS)为5.4-9.7个月。因此,并非所有METex14阳性NSCLC患者都能从MET抑制剂治疗中获益,METex14阳性NSCLC肿瘤间的异质性可能导致了METex14阳性NSCLC对MET-TKIs反应的差异。
复杂的基因组位置和变异类型是导致METex14阳性NSCLC生物学行为异质性的重要原因。MET基因在METex14阳性NSCLC患者中的表达量也存在差异。据报道,MET过表达的METex14阳性NSCLC从MET抑制剂治疗中获益更多。另一方面,携带METex14的NSCLC患者在转录和蛋白水平上均表现出更高的PD-L1水平,先前的研究也报道了更高的免疫浸润和IFN-γ通路特征。然而,免疫治疗对METex14阳性NSCLC患者的治疗效果仍存争议。上述转化和临床研究均强烈表明METex14阳性NSCLC存在潜在的异质性。
然而,目前尚未有系统研究揭示METex14阳性NSCLC肿瘤间的异质性。为了探索这一可能,需要同时进行全面的基因组和转录组分析,以及肿瘤微环境的免疫表型分析。更好地了解METex14 NSCLC的生物学和肿瘤微环境多样性,可能有助于更准确地评估疾病早期复发的风险,也可能为晚期/转移性METex14 NSCLC患者提供新的治疗方法。
结果
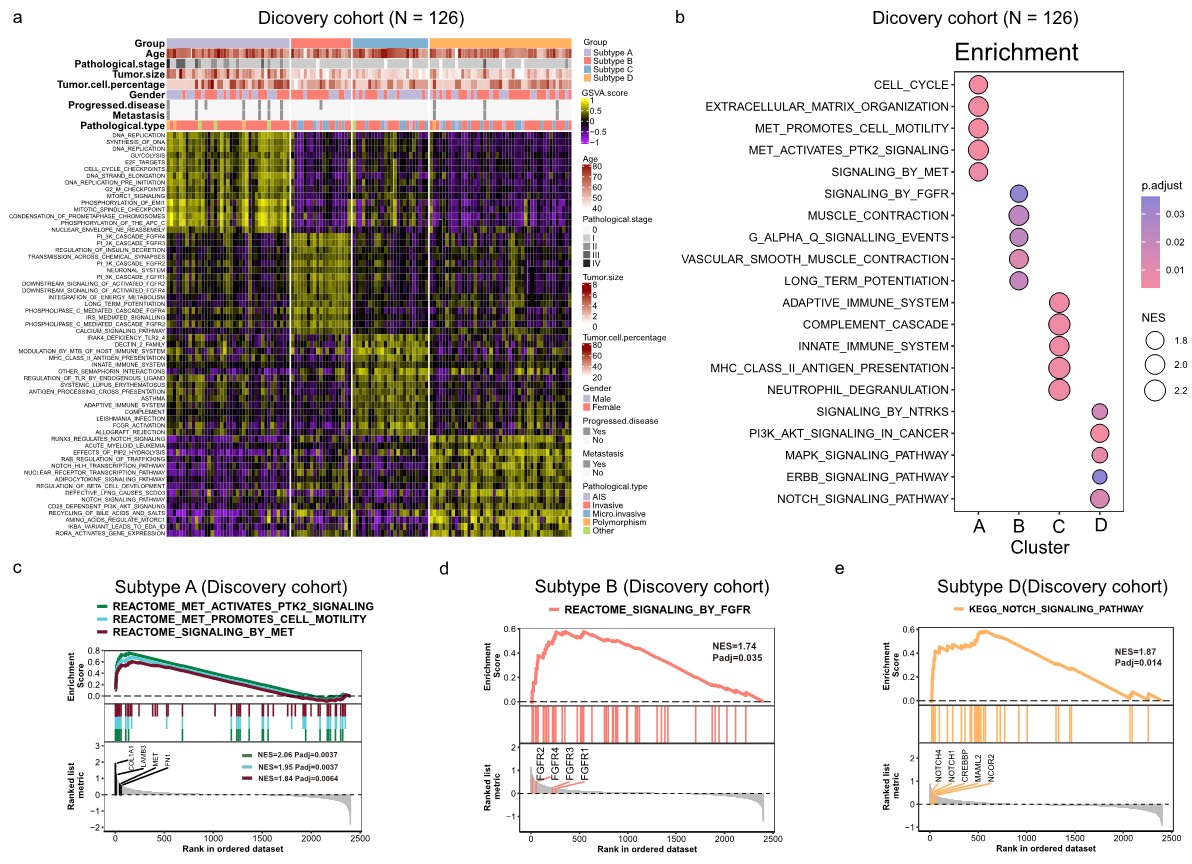
在不同基因组位置MET ex14 NSCLC中只检出了有限的差异表达基因,这表明基因组位置对MET ex14的异质性影响有限。该研究分别对发现队列和验证队列进行了靶向RNA测序,成功率分别为97.67%(126/129)和95.52%(64/67)(图1)。为了了解肿瘤间异质性,利用来自发现队列(n = 126)的RNA-seq数据,对每个样本中KEGG、Reactome、Hallmark通路的富集程度进行了评估,然后进行k-means聚类。根据共识累积分布函数(CDF)和CDF曲线下面积(AUC)的相对变化,本研究首次从发现队列中鉴定出METex14 NSCLC四个亚型(κ = 4)(图1,图2a、b),其中A亚型38例(30.2%),B亚型19例(15.1%),C亚型24例(19.0%),D亚型45例(35.7%)。
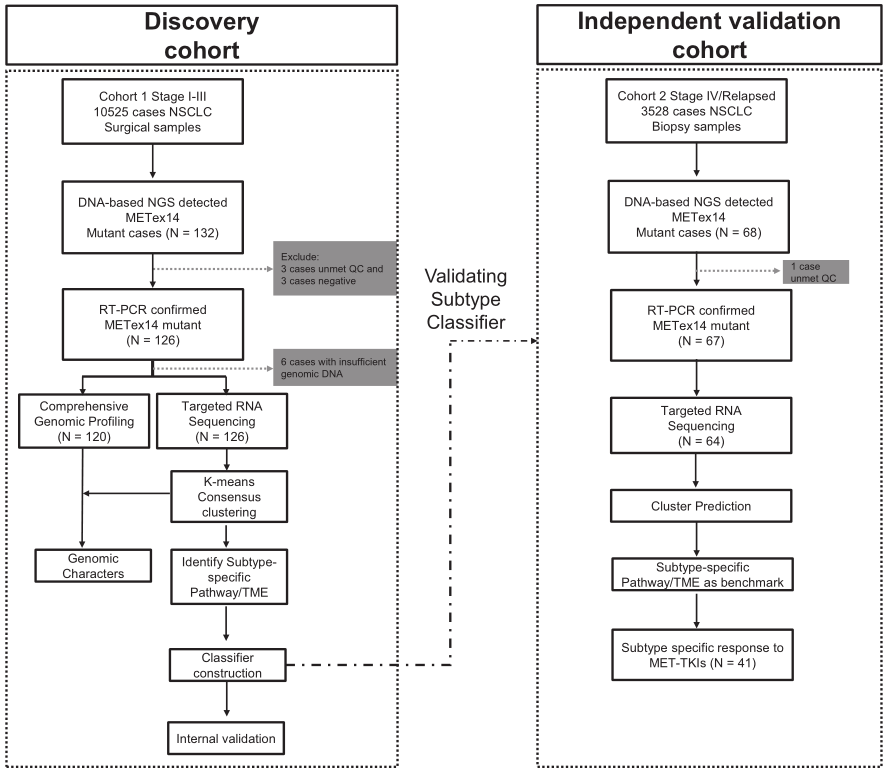
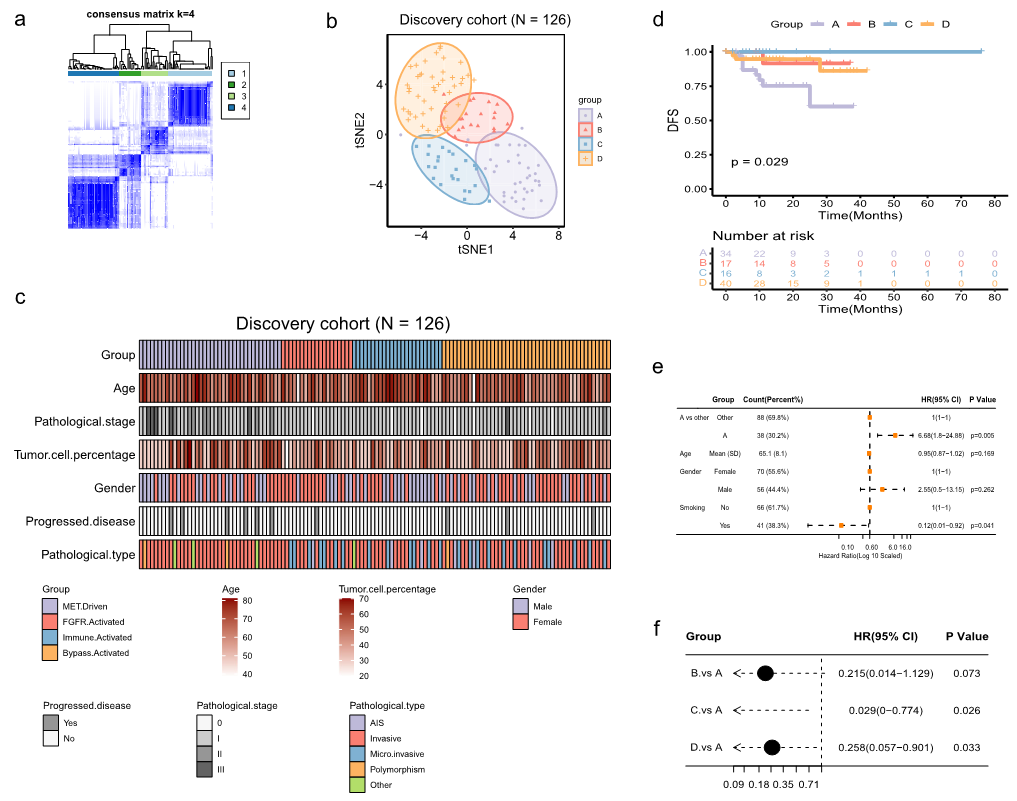
图2 对发现队列中METex14 NSCLC进行分类。a 对RNA-seq数据进行无监督聚类分析,共识矩阵展示确定的最佳聚类数(k=4)。b t-SNE图显示了四种NSCLC类别的定位。c 不同分子亚型患者之间临床特征的比较。d 发现队列中四种亚型的无病生存率。森林图展示与DFS相关的分子亚型和临床危险因素的多变量(e)和单变量(f)分析。
A亚型与临床(P=0.0023)或病理(P<0.001)II/III期显著相关,尤其是与临床或病理T2-3(P<0.001)相关(图2c,表1)。亚型A在临床病理学上更具侵袭性,如侵袭性病理亚型(P<0.0001)和胸膜侵袭(P=0.004)(图2c,表1)。在107例接受长期随访的患者中,A和C亚型患者的预后分别最差和最好(图2d,P=0.029)。值得注意的是,C亚型的三年DFS率达到100%(图2d)。多变量和单变量cox回归分析显示,A亚型与较短的DFS独立相关(风险比[HR]=6.68 [95%CI 1.80-24.88],P=0.005)(图2e,f)。
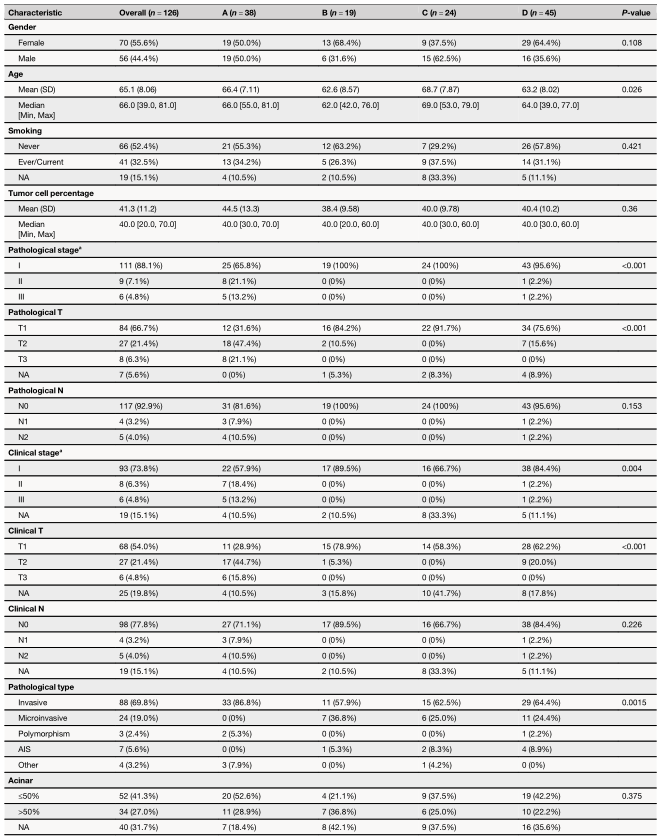
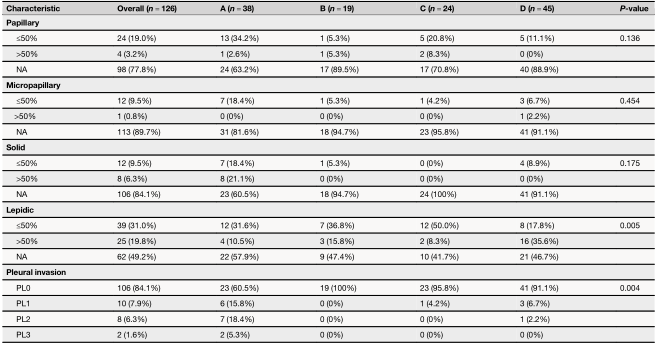
为了探索亚型特异性基因组特征,研究者对入组患者进行了全面的基因组分析。MET扩增(120个样本中发生率约为5%)在四种亚型之间基本均衡。TP53在A亚型中的突变频率为31.6%,在其他亚型中则相对罕见。无论是在整个队列中还是仅在亚型A中,都没有观察到TP53突变与预后之间的相关性。A亚型中FGF19、AKT2和FGF3扩增发生率明显更高;FGF3、PDCD1和FGF19缺失更常见于B和D亚型。这些CNV的增加/减少与预后、mRNA表达、肿瘤微环境特征、信号通路富集之间没有相关性。在4种亚型中没有发现显著差异的特异性突变特征。在这4种亚型中也没有观察到MET ex14变体基因组位置的分布差异。
METex14的变异等位基因频率(VAF)在A亚型中最高(图3a,P=0.0022),MET基因和c-MET蛋白过表达比例也显著更高(图3b-f,P<0.001)。促进细胞周期、DNA复制和MET驱动的细胞运动以及PTK2信号传导等通路在亚型A中显著富集(图4a-c)。B亚型主要与FGFR通路有关,如PI3K_CASCADE_FGFR1-4以及活化FGFR 1-4的信号传导(图4a,b),其主要特征是FGFR2过表达(图4d)。C亚型的特征是免疫相关通路富集,如MHC_CLASS_II_ANTIGEN、先天免疫系统和适应性免疫系统(图4a,b)。在D亚型中发现了多种信号通路的激活,如NOTCH、FGFR、PIP2、PI3K-AKT、ERBB2和IKBA(图4a、b)。对“NOTCH_SIGNALING_PATHWAY”通路的进一步分析表明,NOTCH4、NOTCH1、CREBBP、MAML2和NCOR2基因高表达(图4e)。
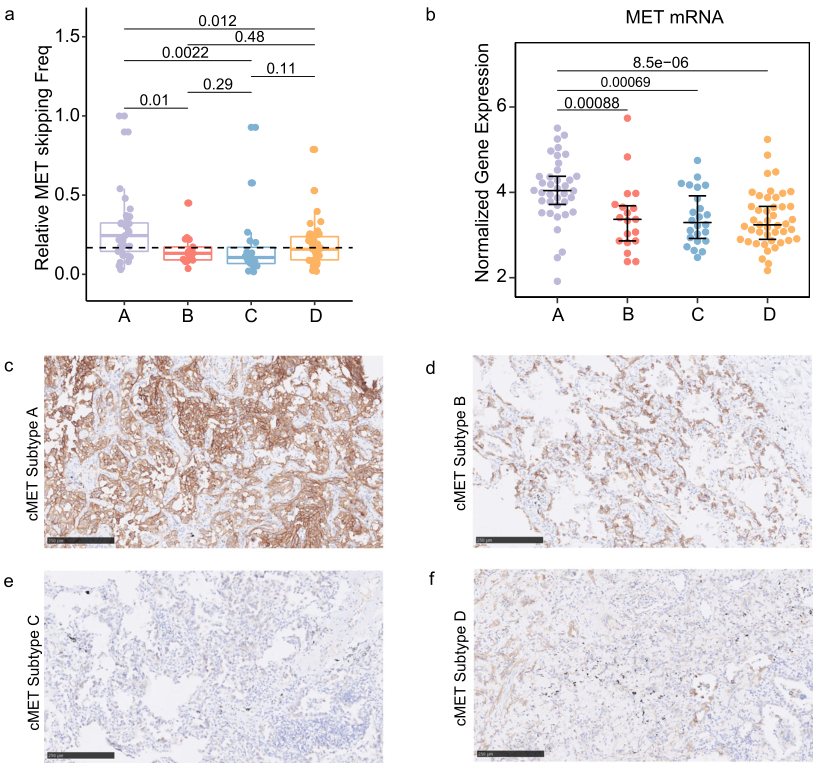
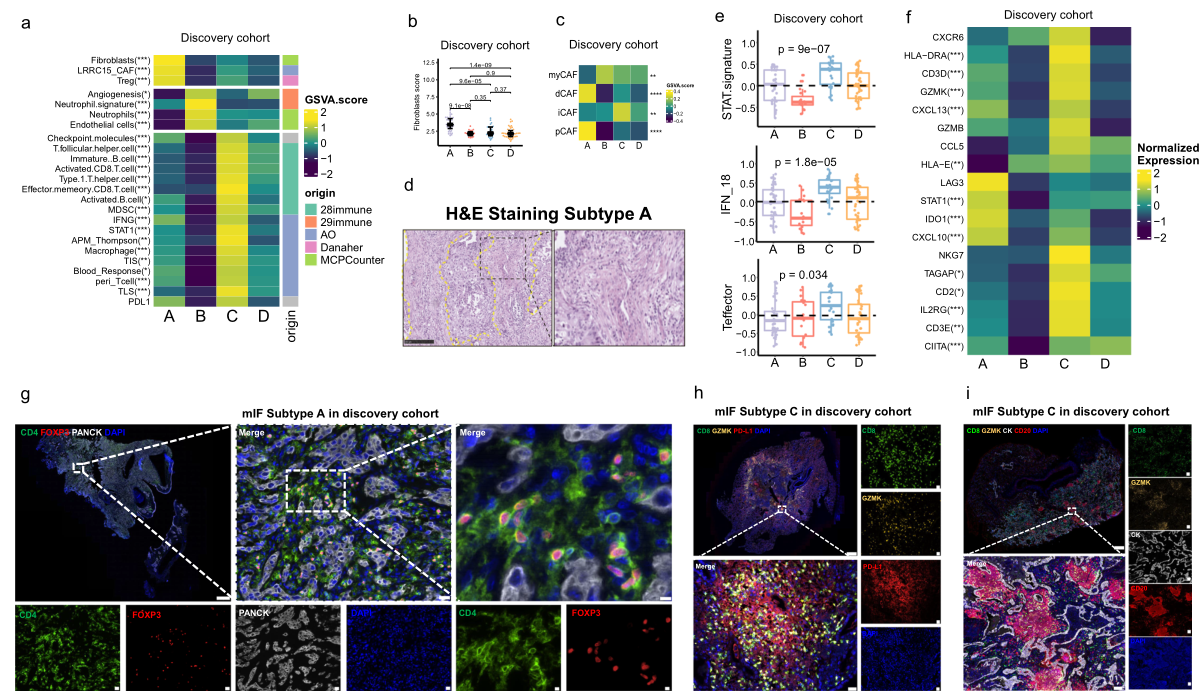
部分METex14 NSCLC患者可受益于免疫检查点抑制剂(ICI)治疗,提示METex14 NSCLC中存在异质性肿瘤微环境。本研究同样发现每种分子亚型都显示出不同的肿瘤微环境(TME)表型(图5a)。A亚型表现出高度免疫抑制性TME,其特征是调节性T(Treg)细胞的浸润和PDCD1(PD-1)的高表达(图5a、b)。同时,在A亚型肿瘤中也可以观察到高度富集的肿瘤相关成纤维细胞(CAF)特征,尤其是全CAF(pCAF)、促结缔组织增生性CAF(dCAF)和LRRC15+ CAF(图5c)。组织学上,H&E染色中密集的促纤维增生表型和纤维化进一步支持了A亚型中CAF特征富集的发现(图5d)。另一方面,C亚型的抗肿瘤免疫表型更为突出,效应细胞、T细胞、Th1特征、B细胞、共激活分子的富集显著增加,炎症性CAF(iCAF)的丰度升高(图5c)。此外,与其他亚型相比,C亚型中STAT、IFN-γ和效应T细胞特征等促炎特征也显著富集(图4e)。值得注意的是,IFN-γ相关基因在C亚型中也高度上调(图4f)。与此同时,多重免疫荧光(mIF)显示A亚型肿瘤组织中CD4+/FOXP3+ Treg细胞聚集(图5g),但在其他三种亚型的肿瘤组织中几乎不可见。与其他三种亚型相比,C亚型有更多的浸润性效应CD8+T细胞,且与PD-L1+肿瘤细胞的空间分布相关(图5h)。在C亚型中也检测到更多的以CD20+ B 细胞为特征的三级淋巴结构(TLS)(图5i)。这些发现表明,在发现队列METex14 NSCLC中,免疫富集亚型患者可能对ICI更为敏感,而A亚型、显著纤维化和Treg浸润的患者则可能对ICI耐药。
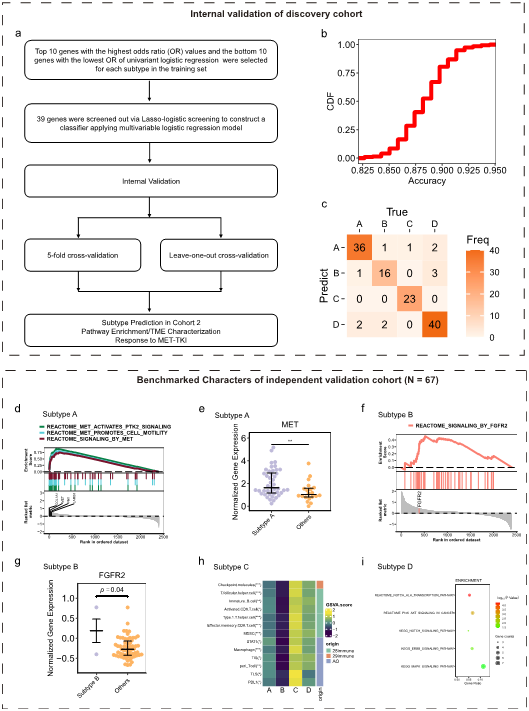
为了将本研究发现的METex14 NSCLC的生物多样性转化为临床可用的工具,基于发现队列中的转录组数据构建了一个亚型分类模型(图6a)。研究者纳入了一个独立的复发/转移性NSCLC患者队列(图1),以验证亚型分类模型的性能。为确保生物学可比性,采用t-SNE法分析了发现队列和验证队列患者之间基因表达、肿瘤微环境和信号通路富集的差异。总体而言,在早期和晚期METex14突变NSCLC之间发现了表达谱基本均衡。
简而言之,使用单变量逻辑回归对每种亚型筛选20个主成分基因,共获得80个基因。80个基因中的39个基因进一步通过lasso-logistic回归构建分类模型,还鉴定了亚型特异性基因。5×交叉验证和LOOV分别证实分类模型准确率超过80%(图6b),以及90.5%的LOOV总体一致率(图6c)。基准MET相关信号通路也在预测的亚型A(MET驱动)中富集(68.8%)(图6d),该亚型中MET基因的表达明显更高(图6e)。观察到FGFR相关信号通路在预测的B亚型(FGFR激活)中的富集趋势(图6f),FGFR2基因表达显著上调(图6g)。该验证集中每种亚型的TME表型分析同样显示,预测的C亚型(免疫激活)(21.9%)免疫激活程度更高(图6h)。在预测的D亚型(旁路激活)中同样观察到NOTCH、PI3K-AKT、ERBB2和MAPK的激活(图6i)。
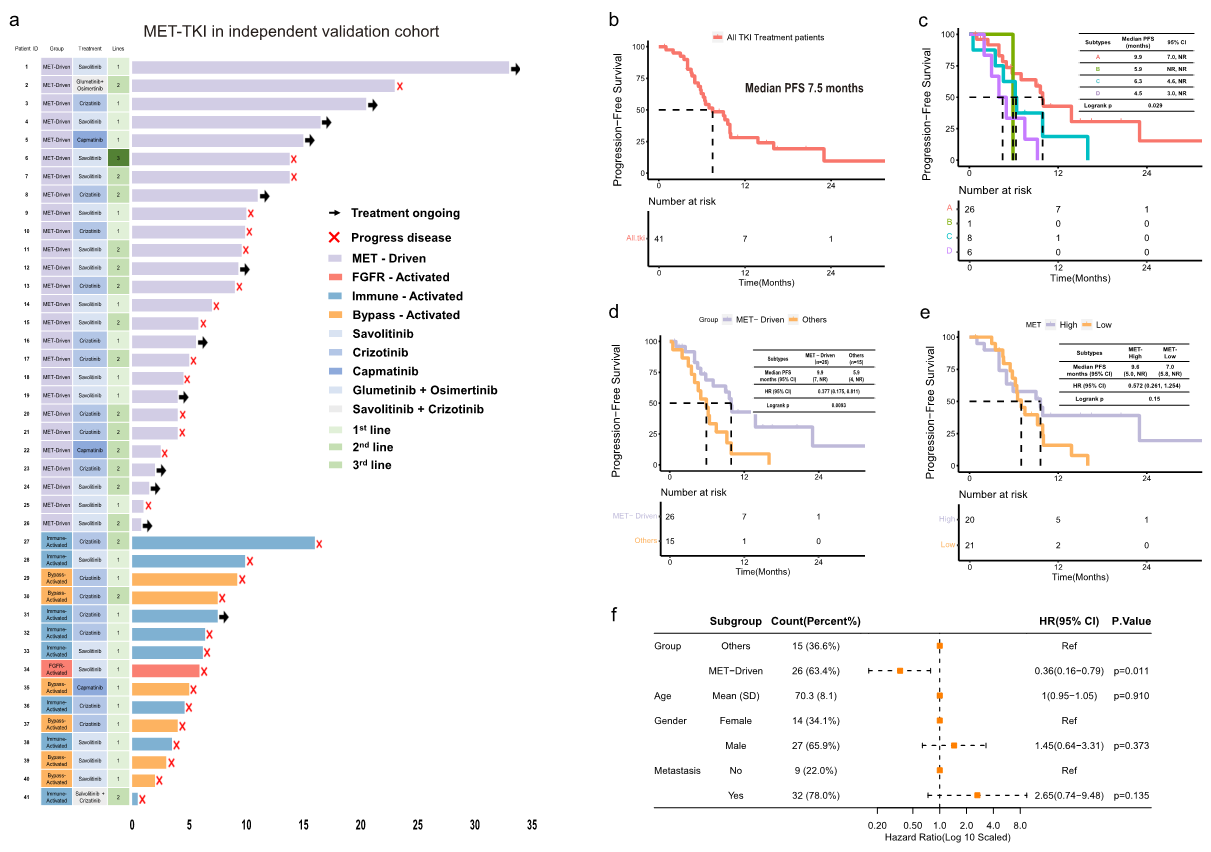
为了了解METex14 NSCLC各亚型的药物敏感性,对独立验证队列中41例接受MET抑制剂治疗的患者生存率进行了分析(图7a)。26例患者为MET驱动型(亚型A),15例患者属于其他亚型。MET驱动型患者与其他三种亚型患者的基线特征具有可比性。随访截止日期为2023年6月,41例患者的mPFS为7.5个月(图7b)。MET驱动型患者对MET抑制剂的反应性更好,并且显示出比其他三种亚型患者更长的PFS(mPFS 9.9个月vs 5.9个月vs 6.3个月vs 4.5个月,P=0.029,图7a、c和d)。此外,MET驱动型与MET抑制剂的获益独立相关(P=0.011,图7f)。然而,MET高表达患者和MET低表达患者的PFS没有显著差异(mPFS 9.6个月vs 7.0个月,P=0.15,图7e)。上述结果表明,MET抑制剂可能更适用于MET驱动型患者。
结论
本研究为METex14 NSCLC肿瘤间分子异质性提供了新的见解,基于转录组数据首次发现了四种不同的分子亚型,其具有独特的生物学和临床意义。本研究的发现有助于METex14 NSCLC患者的精准诊疗。
本文主要参考Chen S, Hu T, Zhao J, et al. Novel molecular subtypes of METex14 non-small cell lung cancer with distinct biological and clinical significance. NPJ Precis Oncol. 2024;8(1):159. Published 2024 Jul 26. doi:10.1038/s41698-024-00642-6。
审批编号CN-143038,过期日期2024-12-18
声明:本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Shiro











 苏公网安备32059002004080号
苏公网安备32059002004080号


