食管癌(EC)是全球高发且致命的恶性肿瘤之一。根据最新版全球恶性肿瘤统计报告数据显示,2022年中国EC的新发病例24.4万,死亡病例18.8万,分别位居恶性肿瘤发病率第7位和死亡率第5位。大多数患者确诊时已处于中晚期,导致预后不佳。近年来,免疫疗法的深入研究为EC患者带来了新的治疗选择和希望。目前,多项免疫联合治疗的研究正在进行中,旨在进一步提高疗效并改善患者的预后,这些研究为临床实践提供了重要的循证医学支持。
《Hi Strong-消化道病例精粹》系列专栏深入剖析消化道肿瘤免疫治疗优秀临床病例,分享宝贵临床经验,以期共同推动消化道肿瘤免疫治疗学科发展,助力健康中国2030。
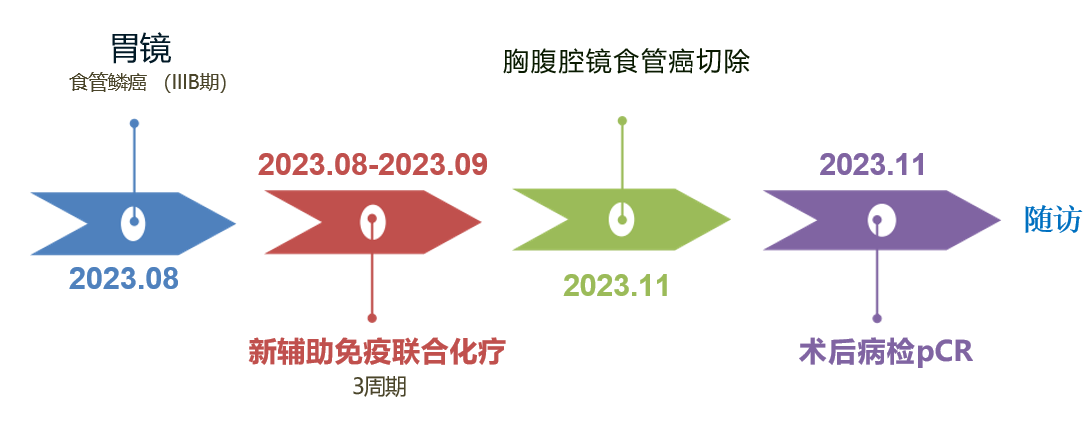
本期西南医科大学附属医院戴天阳教授团队分享一例IIIB期食管中下段鳞癌接受新辅助免疫联合化疗治疗病例。患者,男,62岁,吞咽困难10天,确诊为食管中下段鳞癌(cT3N2M0,IIIB期)。患者接受了3个周期的白蛋白紫杉醇、卡铂联合斯鲁利单抗治疗后,评估未见纵隔、肝胃韧带旁淋巴结肿大,随后进行胸腹腔镜食管癌切除,术后病理检查显示食管鳞状上皮轻度增生伴炎症改变,未见肿瘤细胞;各切缘及淋巴结均未见癌转移,达到病理完全缓解(pCR)。
病例作者:
主要从事肺癌、食管癌、纵隔肿瘤的诊疗
2021胸外联盟手术案例大赛全国总决赛冠军
第五届“胸外科可视化手术网(CGTVS)”手术视频大赛全国三等奖
第三届“肺凡新生”病例总决赛全国三等奖
2023大中华胸腔镜手术菁英赛西部赛区决赛—肺段组二等奖
第一、二届CSCO肺癌规范化诊疗项目青年MDT病例大赛四川赛区冠军、西中国区第二名
第一届四川省青年医师肺癌临床思维诊疗大赛亚军
2021中国医师协会肿瘤多学科诊疗专委会-中青年医师文献解读大赛川渝赛区第一名
2022中华医学会《中华医学信息导报》病例演讲比赛省级赛一等奖
四川省国际医学交流促进会第二届胸外科分会委员
四川省医创会肺癌临床研究专业委员会委员
四川省西精会胸部肿瘤多学科综合治疗青年医师专业委员会委员
四川省针灸学会肿瘤康复专业委员会委员
发表多篇核心期刊论文,SCI论著2篇;参编专著2本
主持吴阶平基金会临床科研项目1项,白求恩中青年科研能力培养项目1项
病史简介
基本情况
患者,男,62岁。
主诉
吞咽困难10天。
现病史
患者自“吞咽困难10天”于2023-08月入院,ECOG评分0分。
既往疾病史
无。
个人史
吸烟30余年,约20支/天;饮酒30余年,约150g/天,已戒10天。
辅助检查
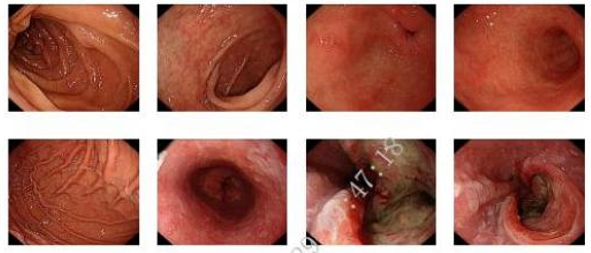
胃镜及病理(2020.7.29):检查所见:距门齿30-34cm可见一菜花样新生物;周边堤状隆起,中央凹陷,表面污秽,约3/4圈,食管腔狭窄,内镜可通过,贲门未受累及。胃底黏膜光滑,黏液池清亮,胃角呈弧形,胃窦黏膜充血水肿,红疹样变,可见点状糜烂。幽门圆,开放好;球腔无畸形,未见白苔及溃疡;降段黏膜无异常(图1)。
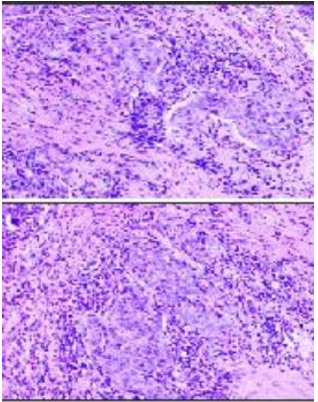
病理检查:食管鳞状细胞癌(图2)。
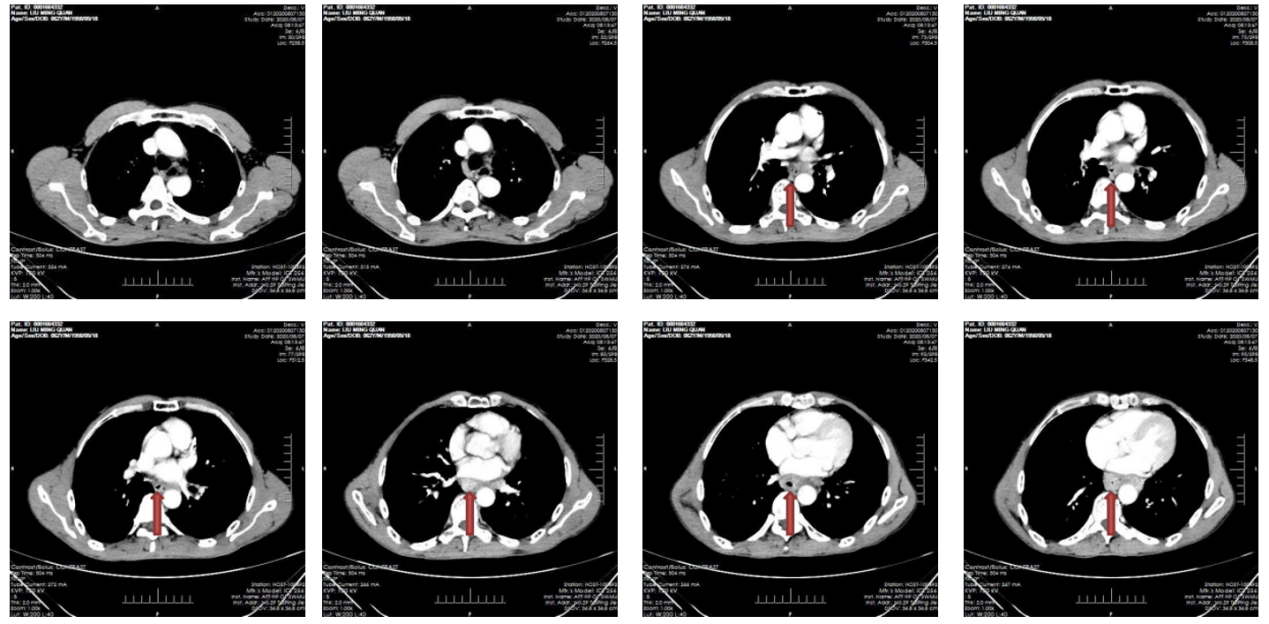
胸腹部增强CT:食管中下段(T8-9椎体层面)管壁明显增厚,管腔狭窄,增强明显强化,周围脂肪组织间隙模糊;考虑食管癌;纵隔内食管旁、腹主动脉旁、肝胃韧带旁多发淋巴结肿大,考虑转移(图3)。
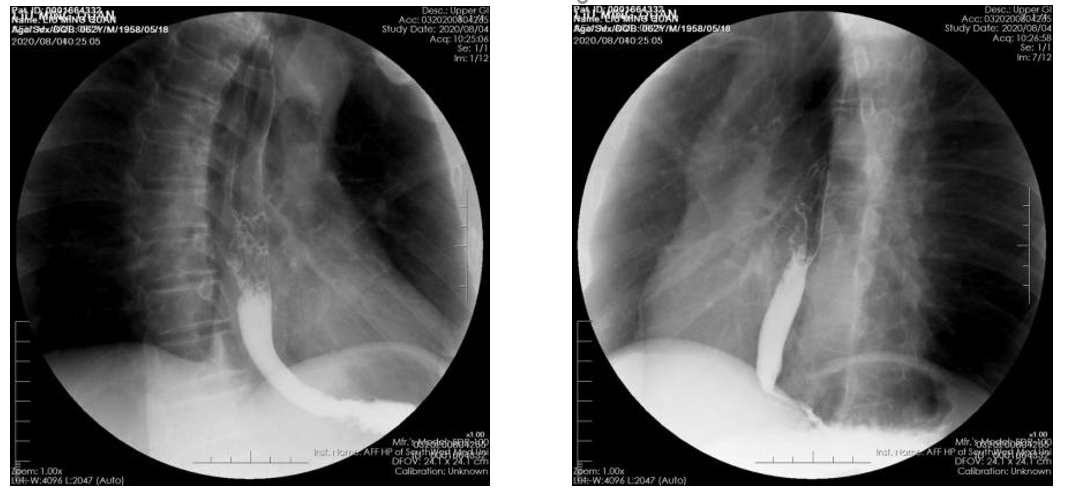
上消化道造影:食管中下段局限性不规则狭窄,狭窄上方食管扩张(图4)。
诊断
食管中下段鳞癌(cT3N2M0,IIIB期);
慢性萎缩性胃炎。
诊疗经过
2022.8.8、2023.9.2、2023.9.27行斯鲁利单抗 300mg D1+卡铂D2 400mg/m2 +白蛋白紫杉醇 300mg的新辅助免疫联合化疗3周期。
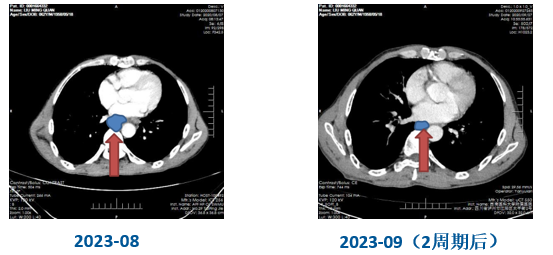
疗效评价(第2周期后)(图5)
食管病灶退缩明显,纵隔内食管旁及肝胃韧带旁淋巴结缩小(PR)。
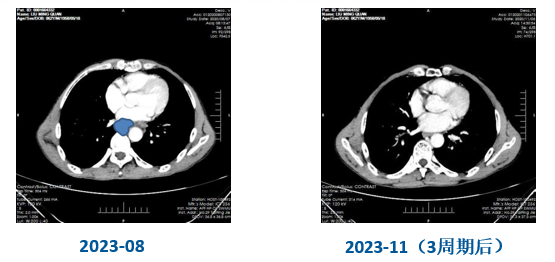
疗效评价(第3周期后)
食管下段管壁稍增厚,呈轻度均匀强化;纵隔、肝胃韧带旁淋巴结未见肿大(图6)。
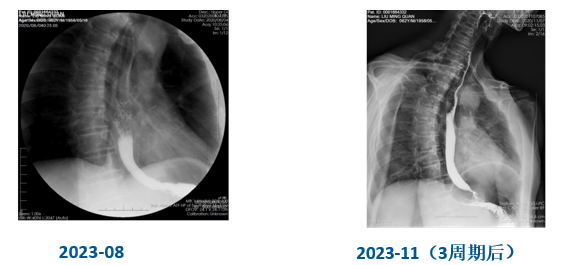
食管黏膜完整、规则,无增粗、破坏、充盈缺损等(图7)。
后续治疗方案
目前诊断:食管中下段鳞癌新辅助免疫联合化疗后(ycTxN0M0,I期);慢性萎缩性胃炎。行胸腹腔镜联合食管中下段鳞癌切除+淋巴结清扫+管胃代食管左颈吻合手术治疗。
术后病检
病检:送检食管全部取材,食管鳞状上皮轻度增生,见充血水肿、纤维组织增生伴多量淋巴细胞浸润,未见肿瘤细胞;食管切缘及胃切缘未见癌,食管胃吻合口切缘未见癌;左喉返神经旁淋巴结0/5,右喉返神经旁淋巴结0/1,第7组0/7,第8U组0/1,第8m组0/1,第15组0/4,第16组0/2,第17组0/8,第18组0/6淋巴结均未见癌。术后病理提示pCR。
术后胸部CT
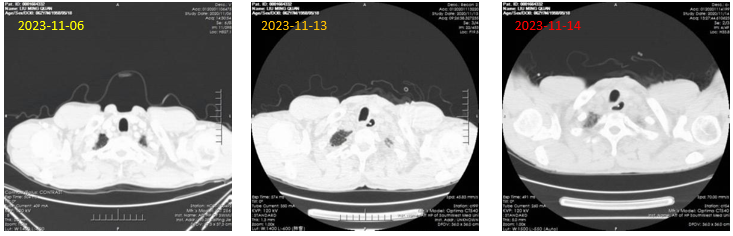
2023-11-6:双肺下叶炎变;右肺中叶内侧段、 左肺上叶下舌段少许慢性炎变;
右肺上叶、右肺水平裂区左肺上叶尖后段实性微小结节。
2023-11-13:“食管癌术后”表现;双肺多发渗出及大片实变;双侧胸腔少量积液,纵隔多发淋巴结显示;左冠脉壁多发钙化。
2023-11-14:“食管癌术后”表现;双肺多发渗出、部分实变;双侧胸腔少量积液,双侧胸腔引流术后表现(图8)。
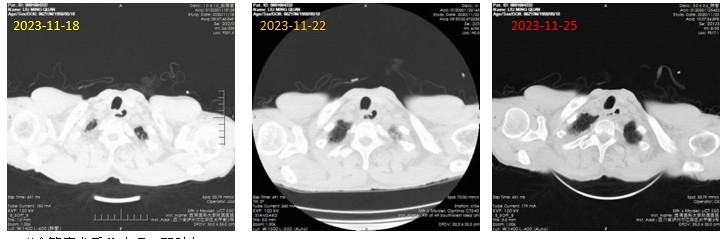
2023-11-18:“食管癌术后”表现:双肺多发渗出,实变;双侧胸腔少量积液,双侧胸腔引流术后表现。与2023-11-14旧片比较:双肺渗出稍减少。
2023-11-22:“食管癌术后”表现;双肺多发渗出;右肺上叶后段空洞。与2023-11-18旧片比较:双肺渗出稍减少。
2023-11-25:“食管癌术后”表现:双肺多发渗出;右肺上叶后段空洞;与2023-11- 22旧片比较:双肺渗出病变有所减少,右侧胸腔出现少量积液(图9)。
术后诊断
食管中下段鳞癌(ypT0N0M0);
食管癌新辅助免疫治疗相关性肺炎;
慢性萎缩性胃炎。
术后随访胸部CT(图10,11)
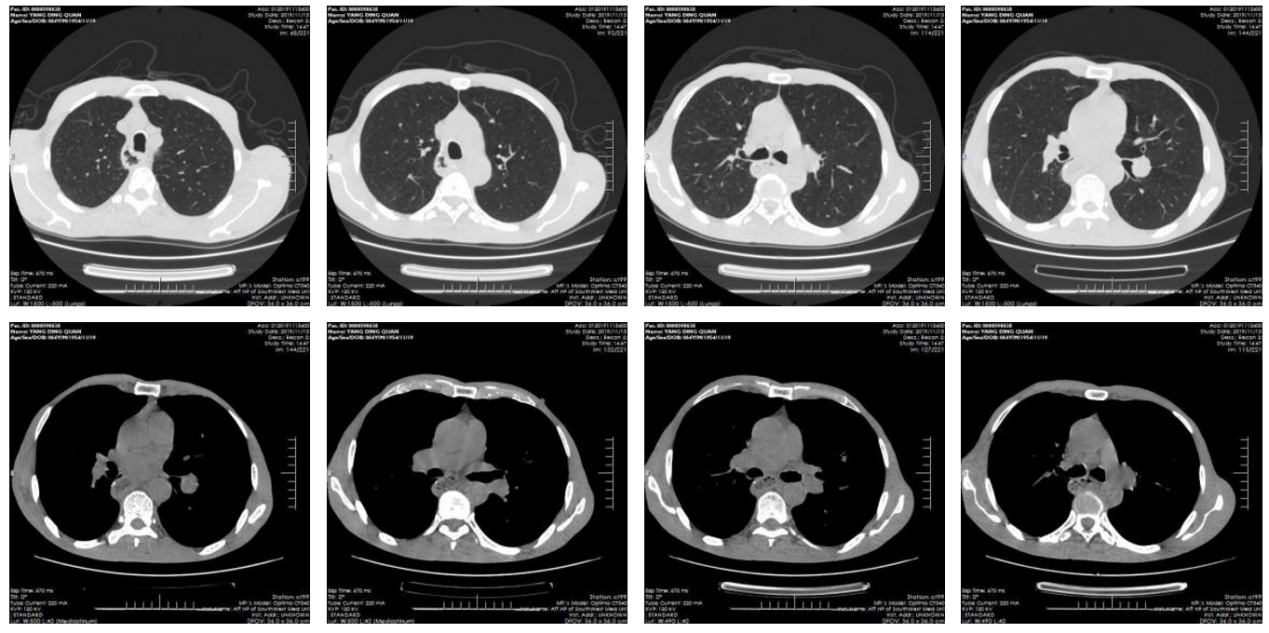
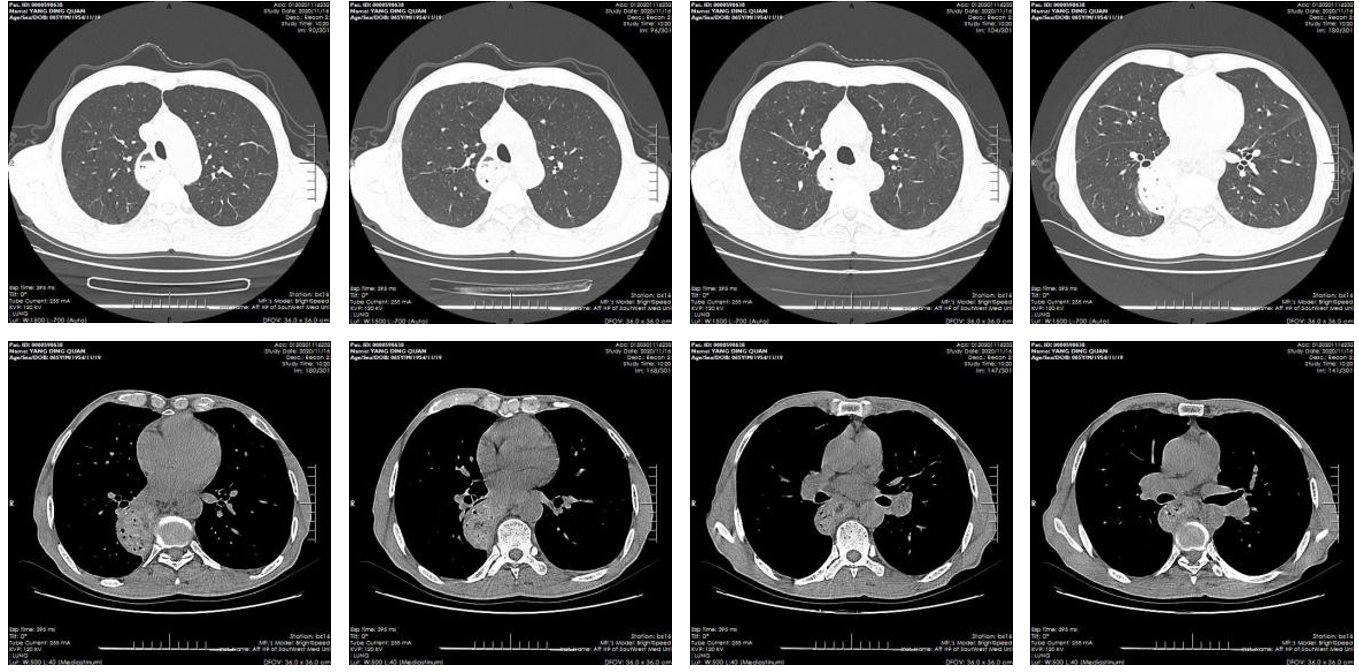
具体诊疗经过见下图(图12)。
专家点评
中国医师协会胸外分会委员
中国医师协会住培评估委员会委员
中国医师协会住培胸心外科专业委员会委员
中国研究型医院学会胸外科学专业委员会委员
中国症症肌无力联盟委员会委员
中国胸壁外科联盟委员会委员
海峡两岸医药卫生交流协会胸外科分会会员 四川省胸外科医师协会副组长
四川省肺癌专委会副主任委员
四川省食管癌专委会副主任委员
四川省食道疾病专委会副主任委员
四川省纵隔专委会副主任委员
西南医科大学附属医院肺癌 MDT 组长
中国肺癌杂志编委 西南医科大学学报编
戴天阳教授:免疫治疗已深刻改变晚期食管癌的治疗格局。基于7项国内外多中心Ⅲ期临床研究的成果[1-7],免疫联合化疗在一线治疗食管鳞癌中的地位已经确立,这为将免疫治疗纳入食管鳞癌新辅助治疗奠定了基础。一项随机、双盲、多中心的Ⅲ期临床研究(ASTRUM-007),旨在评估斯鲁利单抗对比安慰剂联合化疗在既往未接受治疗、PD-L1阳性(PD-L1 CPS≥1)的晚期食管鳞癌患者中的疗效和安全性[1]。结果显示,试验组和对照组的中位OS分别为15.3个月与11.8个月(HR=0.68,P=0.0020),中位无进展生存(PFS)分别为5.8个月与5.3个月(HR=0.60,P<0.0001)。斯鲁利单抗联合化疗不仅带来了总生存期(OS)和无进展生存期(PFS)的生存获益,而且展现出良好的安全性。该研究成果2023年2月发表于Nature Medicine杂志。
目前,化疗联合免疫在食管癌围手术期的探索正如火如荼地开展。2023年ESMO Asia 会议公布了一项度伐利尤单抗联合化疗新辅助治疗可切除的IIB-IVA ESCC患者的研究[8],患者接受新辅助度伐利尤单抗联合化疗4个周期后进行手术。结果显示,接受手术治疗的患者中,R0切除率高达95%。3例(15.8%)患者达到pCR(ypT0N0),2例患者(10.5%)原发肿瘤(ypT0N1)完全缓解(CR)。ORR为80.8%,DCR为100%。这些结果提示,度伐利尤单抗联合化疗在局部晚期ESCC中获得更高的病理缓解率,且不会增加围术期并发症。我们中心参与的ESCORT-NEO研究[9]评估了新辅助卡瑞利珠单抗加化疗后辅助卡瑞利珠单抗,相比单独新辅助化疗在可切除局晚期ESCC中的作用。结果显示卡瑞利珠单抗联合白蛋白紫杉醇和顺铂组pCR率为28.0%,显著高于卡瑞利珠单抗联合紫杉醇和顺铂组(15.4%)以及和紫杉醇联合顺铂组(4.7%)的pCR率。与单独新辅助化疗相比,在可切除的局晚期ESCC患者中,新辅助免疫联合化疗显示出更好的pCR和可耐受的安全性,但这种pCR能否转化为OS的获益还有待后续结果公布。
该病例在围术期出现了免疫相关性肺炎。研究表明,免疫治疗相关性肺炎(CIP)总体发生率并不高,G3以上的发生率更低。如果患者在免疫治疗过程中出现了CIP,可以根据指南标准对其进行分级,然后采取个体化治疗策略。大多数CIP可以通过暂停给药和/或联合皮质类固醇激素治疗得到控制,并且可以逆转。本病例在围术期发现免疫相关性肺炎,在使用激素治疗后得到缓解。这也证实只要尽早识别并诊断出免疫相关性肺炎,早期采取干预措施,绝大部分会是可以治愈的。
在后免疫治疗时代,如何筛选出新辅助免疫治疗优势人群及易发生免疫相关不良反应人群,是未来研究的重要方向之一。希望随着研究数据的积累和研究的深入,我们能够不断改善进展期食管癌新辅助免疫治疗格局,让更多的患者获得治愈。
[1]. Jing Huang, et al. 2023 ASCO,#e16016.
[2]. Jong-Mu Sun, et al. Lancet. 2021 Aug 28;398(10302):759-771.
[3]. Jean-Philippe Metges, et al. 2022 ASCO Gastrointestinal Cancers Symposium.#241
[4]. Yuichiro Doki, et al. N Engl J Med . 2022 Feb 3;386(5):449-462.
[5]. Ken Kato,et al. 2023 ASCO GI.#290.
[6]. Huiyan Luo, et al. JAMA . 2021 Sep 14;326(10):916-925. [7]. Zi-Xian Wang, et al. Cancer Cell . 2022 Mar 14;40(3):277-288.e3.
[8] Jia He, et al. 2023ESMO Asia, 203P.
[9] Yin Li, et al. 2024 ASCO GI, Abstract LBA244.
排版编辑:肿瘤资讯-CYY











 苏公网安备32059002004080号
苏公网安备32059002004080号


