食管癌是最常见的恶性肿瘤之一 [1],临床上2/3的食管癌患者为局部晚期,手术是主要治疗手段之一,但患者单纯手术后5年生存率为20%-34%。与单纯手术相比,新辅助放化疗联合手术治疗有可能著提高患者的局控率和生存率,但有增加手术难度、毒性和并发症的风险 [2-4]。探索能使食管癌患者获益更大的综合治疗模式是一个亟待解决的临床难题。
免疫治疗在局部晚期ESCC中的应用现已成为目前的研究热点之一。如何筛选或早期识别能从免疫治疗中获益的人群,是在当今治疗现状背景下提出的新的问题。研究人员尝试用寻找生物标志物,影像组学等方法预测免疫治疗的疗效和预后[5-7]。然而,这些客观的指标仅能从某些方面反映疗效或者预后的,且其评价的水平因肿瘤发生发展的时间和空间的较大变化而受到限制。
患者报告结局(patient-reported outcome, PRO)指的是在未经医疗专业人士解释的情况下,直接来源于患者对自身健康状况和治疗结果的主观评价[8],作为美国FDA建议使用的新型结局指标[9],因其在测量患者日常功能及症状领域的可靠性、灵敏性和易操作性,目前已应用在欧美临床研究、药物审批和医疗服务质量评估等方面[10]。基于国内外的研究现状以及关于PRO的前期研究结果,由广东省人民医院胸外科乔贵宾教授牵头开展了一项“基于PRO评价局部晚期食管鳞癌术前免疫治疗联合短程放化疗的前瞻性、单臂、II期临床研究”。基于该研究,本期分享一例基于PRO评估后局部晚期食管鳞癌患者术前免疫联合短程放化疗新辅助治疗的病例,总生存(OS)超过21个月。
患者基本情况
苏XX,65岁,女性。
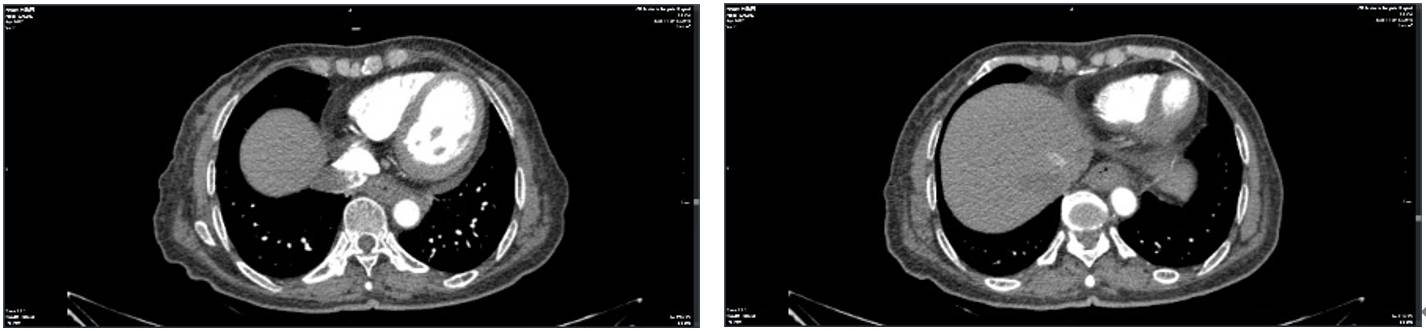
治疗前在外院检查:胃镜示食管占位;PET-CT示食管胸下段走行区(胸8-10椎体层面)条块状高代谢病灶增强扫描不均匀强化,考虑为食管癌,纵隔(8R、9L组)、肝门区及腹主动脉左旁(胃底层面)多发淋巴结转移。
广东省人民医院增强CT:胸下段约T9-10椎水平壁增厚,上下累及范围约23mm,增强扫描不均匀明显强化。主动脉前方见淋巴结影与食管壁分界不清。气管隆突下见增大淋巴结,较大者大小约19mm×7mm,增强扫描均匀强化。考虑食管胸下段壁增厚,符合食管癌,考虑纵隔及肝门部淋巴结转移。
肿物部位:胸下段;
病理类型:鳞状细胞癌,中分化;
临床分期:cT3N2M0(III期)。
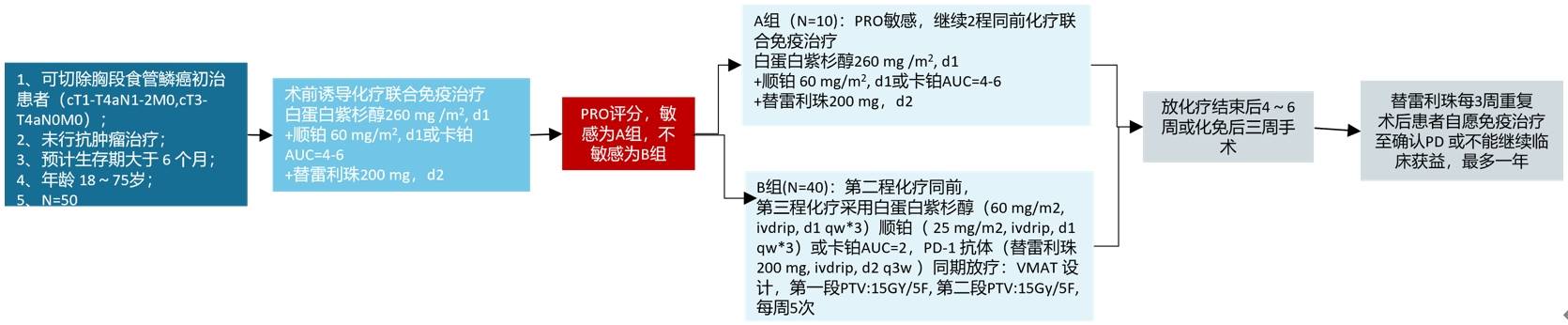
治疗方案
2022-11-10替雷利珠单抗+白蛋白紫杉醇+卡铂
治疗一疗程后进行PRO评价。根据PRO评分显示化免治疗不敏感,拟于第三周期增加术前短程放疗;
2022-12-02替雷利珠单抗+白蛋白紫杉醇+卡铂;
2022-12-28 VMAT技术,剂量30Gy/10F,替雷利珠单抗+白蛋白紫杉醇+卡铂;
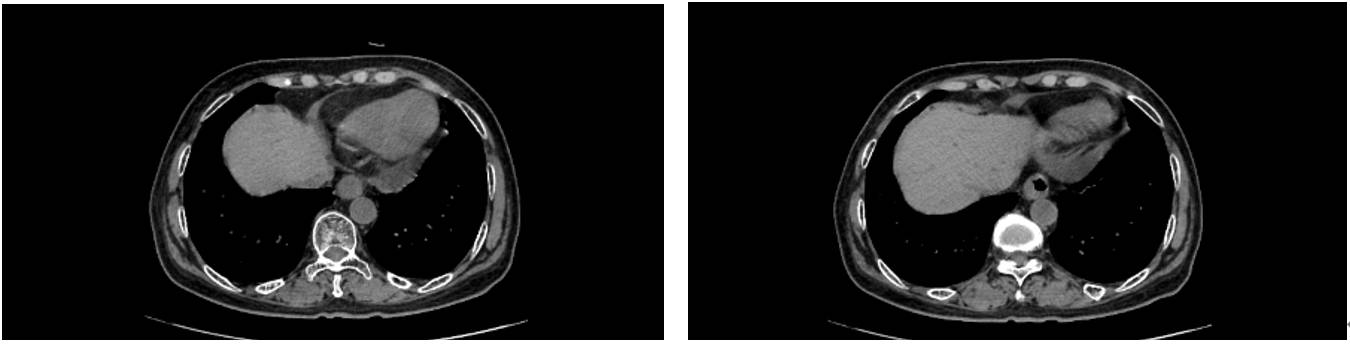
2023-5-24在广东药科大学附属第一医院进行术前影像检查:
手术切除及病理
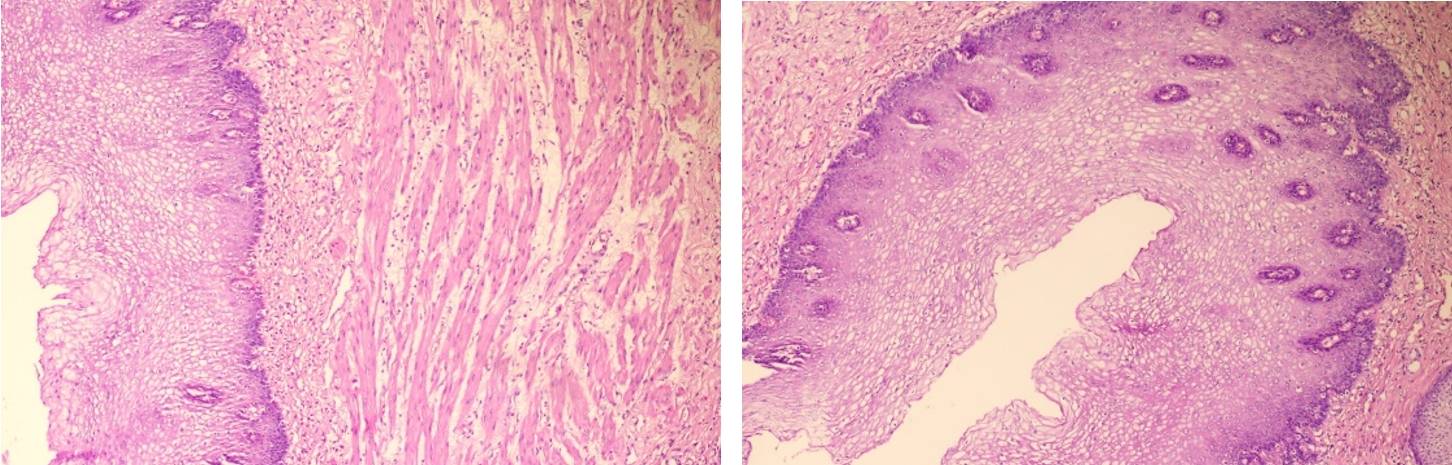
外科评估患者经新辅助治疗后,病灶明显缩小,由于新冠原因于2023-6-12进行手术切除,病理学检查显示:
1、送检食管经充分取材,食管黏膜鳞状上皮呈良性增生,上皮下血管充血,慢性炎症细胞浸润,未见癌,结合临床新辅助化疗史,病变符合黏膜慢性炎,根据Mandard标准,新辅助化疗病理学评估:I级(未见癌残留)。胃组织未见癌。
2、(食管远端)未见癌。
3、(膈上淋巴结、贲门淋巴结)送检组织为纤维、脂肪、血管,未见癌。
4、(胃左淋巴结)未见癌转移(0/2)。
患者情况:术后达到pCR,并且没有术后并发症,未行辅助治疗,定期复查;随访至2024-7-20,肿瘤未复发,生存至今,OS超过21个月。
本期特邀专家——乔贵宾 教授
博士研究生、主任医师、博士研究生导师
广东省医师协会胸外科医师分会主任委员
广东省精准医学应用学会食管癌分会主任委员
广东省医疗行业协会胸外科管理分会主任委员
广东省医学会胸外科学分会副主任委员
广东省抗癌协会食管癌专业委员会副主任委员
广东省药学会胸外科专家委员会顾问
广东和谐医患纠纷人民调解委员会医学专家顾问
中国医师协会内镜医师分会常务委员
中国医药教育协会胸外科专业委员会副主任委员
中国研究型医院学会胸外科学专业委员会常务委员
国家肺脏移植技术医疗质量控制中心专家委员会委员
中华医学会器官移植学分会委员会肺移植学组委员
中国器官移植发展基金会肺移植会肺移植专项基金管理专委会委员
中华医学会胸心血管外科学会胸腔镜外科学组委员
中华医学会胸心血管外科学分会食管疾病学组委员
中华医学会肠外肠内营养学分会胸部疾病营养治疗协作组委员
广州市干部保健专家
广东省医疗保障医药服务临床专家
广东省卫生健康人才高级职称评审委员会评委
国家自然基金和国家科技进步奖以及各省市自然基金和科技奖评委
《Journal of Thoracic Disease》、《中国微创外科杂志》、《国际肿瘤学杂志》编委
近20多年来,致力于各种胸部疾病微创外科技术的提升,在围术期管理和快速康复方面进行了大量实践;对肺癌和食管癌等胸部肿瘤的早期诊断、综合治疗和耐药机制等方面开展了大量研究
先后承担国家和省市级等科研课题13项;获得学术奖励4项;主编专著8部;牵头制订共识、指南4项;获得胸外科临床实践相关的专利9项。在胸外科及肿瘤学领域的相关主流学术(SCI收录)杂志上共发表第一作者/通讯作者(含共同)SCI论著44篇,累计影响因子(IF)超过240分,其中IF>10分的2篇, 10>IF>5分的13篇;发表中文论著41篇
2001年全军科技进步三等奖获得者;2003年陕西省科技进步二等奖获得者; 2015年首届“羊城好医生”称号获得者;2016年首届“岭南名医”称号获得者;2019年羊城晚报 “绣花精神”新时代榜样匠心人物获得者;2019年任职广东省医疗行业协会胸外科管理分会主任委员;2021年广东省科技进步奖一等奖获得者;2022年中华医学科技奖一等奖获得者
专家点评
患者报告结局(PRO)与生物学和其它临床结局指标不同,由患者本人评价自身症状功能状态比由医护人员测量更为准确[11]。最新的大规模临床试验显示,在晚期化疗患者中应用PRO症状监测预警不仅可以改善生活质量,更可显著延长患者生存[11-13]。
有研究指出,治疗过程中出现首发或主诉肿瘤相关症状的早期缓解,可能是有效评估疗效的预测因素[14]。与食管鳞癌最息息相关的症状为进行性的吞咽后梗阻感或吞咽困难。临床上常观察到,局部晚期食管癌患者接受首程放/化疗后2至3周后,其吞咽困难症状出现了缓解。在免疫治疗的队列人群中,此现象更是频繁的发生。课题组前期通过使用European Organization for Research and Treatment of Cancer (EORTC) OES-18 量表,前瞻性地跟踪随访128例局部晚期食管鳞癌患者多时点(初诊、治疗第1/2/3周期、术前访视和术后1月) 的自我症状报告。从EORTC OES-18量表提取中评估吞咽困难症状的3个问题“您能吃固体食物吗?”、“您能吃流质或半流质食物吗?”、“您能喝液体(如水、饮料)吗?”,并记录初治时和第一周期时的患者自我报告分数,经过计算后得出对应的个体症状负担,通过ROC曲线计算约登指数,将症状缓解程度的截断值取70%。缓解程度大于70%的人群定义为早期症状缓解(early remission),其他则定义为非早期症状缓解(latent remission)。研究观察到,早期持续缓解组pCR率显著高于非早期持续缓解组(84.2% vs 4.7%,χ2 = 41.75, P<0.001)。研究结果显示,早期症状缓解是pCR状态的唯一显著独立预测因素(OR = 3.267, 95% CI 1.661 ~ 6.428, P<0.001),吞咽困难缓解程度(△吞咽困难%)的ROC曲线分析提示AUC值达0.961 (95% CI: 0.922~0.999, P < 0.001)[15]。因此PRO指标有望筛选出食管癌免疫治疗敏感患者指导后续治疗。
基于国内外的研究现状以及本课题组关于PRO的前期研究结果,本项目开展基于PRO评价局部晚期食管鳞癌术前免疫治疗联合短程放化疗的前瞻性、单臂、II期临床研究。
来自本研究的病例治疗结果显示了术前接受采用替雷利珠单抗+白蛋白紫杉醇+卡铂化疗方案诱导化疗联合免疫治疗一疗程后进行PRO评价,根据PRO评分分到不敏感组,不敏感组在术前第三疗程增加短程放疗,外科评估患者经新辅助治疗后,病灶明显缩小,进行手术切除,达到pCR,并且没有发生术后并发症,至今未复发,生存时间超过21个月。
本研究目前已经入组了35例患者,经过PRO评估后,对于分到化免不敏感组的患者,术前增加短程放疗,经手术后pCR率达到50%,并且安全可控。
综上所述,通过PRO评估筛选免疫治疗敏感人群优化治疗策略,对于化免不敏感人群,增加术前短程放疗对化免不敏感的局部晚期食管鳞癌患者具有较好的疗效和安全性,没有术后并发症,可以进一步优化食管癌的新辅助治疗模式。
1.Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68: 394-424..
2.Lordick F, Mariette C, Haustermans K, et al. Oesophageal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016;27(suppl 5):v50-v57.
3.Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA 1999;281:1623-1627.
4.Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol 2002;20:1167-1174.
5.Ma X, Guo Z, Wei X, et al. Spatial Distribution and Predictive Significance of Dendritic Cells and Macrophages in Esophageal Cancer Treated With Combined Chemoradiotherapy and PD-1 Blockade. Front Immunol 2021; 12:786429.
6.Yan C, Ma X, Guo Z, et al. Time-spatial analysis of T cell receptor repertoire in esophageal squamous cell carcinoma patients treated with combined radiotherapy and PD-1 blockade. Oncoimmunology 2022; 11(1):2025668.
7.Zhu Y, Yao W, Xu BC, et al. Predicting response to immunotherapy plus chemotherapy in
patients with esophageal squamous cell carcinoma using non-invasive Radiomic biomarkers. BMC Cancer 2021; 21(1):1167.
8.FDA. U. Guidance for industry Patient-report outcome measures: use in medical product development to support labeling claims 2009. Available at: https://www.fda.gov/downloads/drugs/guidances/ucm193282.pdf.
9.FDA. U. Clinical Outcome Assessment (COA): Glossary of Terms. 2015.
10.Calvert M, Kyte D, Mercieca-Bebber R, et al. Guidelines for Inclusion of Patient-Reported Outcomes in Clinical Trial Protocols: The SPIRIT-PRO Extension. Jama 2018; 319(5):483-494.
11.Basch E. Patient-Reported Outcomes - Harnessing Patients' Voices to Improve Clinical Care. N Engl J Med 2017; 376(2):105-108.
12.Abola RE, Bennett-Guerrero E, Kent ML, et al. American Society for Enhanced Recovery and Perioperative Quality Initiative Joint Consensus Statement on Patient-Reported Outcomes in an Enhanced Recovery Pathway. Anesth Analg 2018; 126(6):1874-1882.
13.Basch E, Deal AM, Dueck AC, et al. Overall Survival Results of a Trial Assessing Patient-Reported Outcomes for Symptom Monitoring During Routine Cancer Treatment. Jama 2017; 318(2):197-198.
14.Ribi K, Koeberle D, Schuller JC, et al. Is a change in patient-reported dysphagia after induction chemotherapy in locally advanced esophageal cancer a predictive factor for pathological response to neoadjuvant chemoradiation? Support Care Cancer 2009; 17(8):1109-16.
15.Shujie Huang,Yong Tang,Hansheng Wu, et al. Early and Persistent Dysphagia Relief Predicts Tumor Response in Esophageal Squamous Cell Carcinoma Patients Treated with Immunochemotherapy. Ann Surg Oncol. 2023;30(8):5171-5181.
排版编辑:肿瘤资讯-高惠
下期预告
一例颈段食管癌患者化免诱导后接受dCRT序贯免疫维持治疗,持续cCR长达17个月
往期回顾:
【食管癌】有一种爱,是我陪你一起抗癌:一例晚期食管鳞癌患者多线免疫治疗病例分享
【食管癌】局部晚期不可手术切除食管鳞癌经放化疗联合替雷利珠单抗治疗后成功转化手术并获得长期生存病例
【食管癌】替雷利珠单抗联合同步放化疗为不可手术的局部晚期食管鳞癌老年患者带来新希望











 苏公网安备32059002004080号
苏公网安备32059002004080号


