
近年来结直肠癌(CRC)领域研究成果丰硕,但未来治疗领域面临的挑战也愈加清晰。本期C对话非常荣幸地邀请到了国内肠癌领域的杰出青年学者——来自空军军医大学西京消化病医院的卢瑗瑗教授担任主持,中南大学湘雅医院的曾珊教授和浙江大学医学院附属第一医院的方维佳教授担任讨论嘉宾,与来自比利时鲁汶大学Gasthuisberg医院的Eric Van Cutsem教授进行深入的中外交流。
本次C对话聚焦于结直肠癌热点研究与未来发展方向,从2023 ESMO转移性结直肠癌(mCRC)诊治指南梳理mCRC一线治疗格局、mCRC后线治疗研究等,并结合今年大会热点研究例如肝移植联合化疗治疗结直肠癌肝转移(CRLM)和结直肠癌免疫治疗的挑战等前沿热点问题,分享中西方对于CRC精准治疗的实践与见解。
空军军医大学西京医院消化内科副主任
消化系肿瘤整合防治全国重点实验室 PI
国家自然科学基金杰青、优青获得者
美国Vanderbilt大学博士后
中国抗癌协会理事、青年理事会副理事长
中华医学会消化病学分会消化道肿瘤协作组副组长
中国临床肿瘤学会结直肠癌专委会委员
Cancer Letters、Cellular Oncology期刊编委
长期从事消化系肿瘤尤其是胃肠道肿瘤的基础和临床研究,在靶向治疗和免疫治疗方面积累了较多经验。以第一/通讯作者在Cell、Nature Medicine、Journal of Clinical Investigation、Molecular Cancer、Journal for ImmunoTherapy of Cancer等期刊发表SCI论著40余篇,编撰专著12部,编撰临床肿瘤指南11部。负责国家自然科学基金5项,国家十四五重点研发项目课题负责人,获陕西省科技进步一等奖、空军高层次科技人才、陕西省三秦学者、肿瘤青年科学家奖
中南大学湘雅医院肿瘤化疗科主任
中国老年学和老年医学学会肿瘤康复分会精准医疗专业委员会副主任委员
中华医学会食管癌专委会常委
中国医师协会肿瘤多学科诊疗专业委员会常委
中国临床肿瘤学会(CSCO)结直肠癌专家委员会常委
中国临床肿瘤学会(CSCO)胃癌专家委员会常委
中国抗癌协会神经内分泌肿瘤专委会常委
中国抗癌协会肿瘤化疗热灌注专业委员会常委
中华医学会肿瘤内科专家委员会委员
中国医师协会结直肠肿瘤专家委员会委员
中国医师协会内科医师分会委员
中华医学会胰腺肿瘤学组委员
湖南省医学会恶性肿瘤精准诊疗学组组长
湖南省医学会肿瘤专业委员会胸部肿瘤内科学组副组长
湖南省医学会癌症康复与姑息治疗专业委员会主任委员
湖南省抗癌协会肿瘤协作专委会候任主任委员
近10年先后获得国家重大科技专项子项目、国家自然科学基金面上项目、湖南省重点研发计划应用
基础研究专项等各项科研项目资助16项
在Lancet、British Medical Journal、Hepatology、 Advanced Science、European Journal Of Cancer、Cancer Letters等杂志发表SCI论文36篇
获湖南省科技进步三等奖和湖南省卫生厅科技进步二等奖各1项
浙江大学医学院附属第一医院肿瘤内科主任
国家卫健委能力建设及继教肿瘤专委会委员
中国临床肿瘤学会理事
中国临床肿瘤学会胆道肿瘤专委会常委
中国临床肿瘤学会放射介入专委会常委
中国医师协会肿瘤医师分会委员
中国医师协会多学科综合治疗专委会委员
中国转化/精准医学学会细胞治疗分会 委员
浙江省可持续发展研究会医疗专委会 委员
浙江省抗癌协会整合肿瘤专委会副主委
香港大学访问学者
美国印第安纳大学访问学者
Professor and Division Head of Digestive Oncology at University of Leuven(KUL)and University Hospitals Gasthuisberg, Leuven, Belgium
Member of the Belgian Royal Academy of Medicine
President of the Belgian Foundation against Cancer
Co-founder of ESMO GI/World Congress on Gastrointestinal Cancer and the Chair of the meeting in Barcelona, Spain
Executive board of ESMO
Program committee and international affairs committee of ASCO

专题讲座:Eric Van Cutsem教授谈结直肠癌热点与未来方向
近年来CRC治疗方案不断推陈出新,新药研发也在持续发力,使得治疗方案的选择变得尤为关键,其中抗EGFR单抗的精准化治疗、基于基因分型的靶向治疗和免疫治疗等联合用药策略霸占话题榜。
抗EGFR单抗在mCRC中的个体化精准治疗策略
在mCRC的一线治疗中,抗EGFR单抗的选择和应用成为关键问题。原发肿瘤位置(左半/右半)和分子分型(RAS/BRAF野生型或突变型)在治疗分层中具有重要的指导意义。ESMO指南为不同类型的mCRC患者提供了相应的推荐方案。对于RAS/BRAF野生型mCRC,尤其是左半结直肠癌患者,建议采用两药化疗联合抗EGFR单抗;而对于RAS/BRAF野生型的右半结肠癌患者,则推荐两药化疗联合贝伐珠单抗。由于抗EGFR单抗在右半结肠癌患者中的缩瘤效果相对较好,在特定情况下期望实现手术切除可以考虑使用两药化疗联合抗EGFR单抗[1]。
值得注意的是,TRIPLETE研究表明,RAS/BRAF野生型mCRC的初始治疗应优先选择抗EGFR单抗联合两药化疗,而非三药方案。研究结果显示,在主要研究终点客观缓解率(ORR)上,三药化疗联合抗EGFR单抗并未优于两药化疗联合抗EGFR单抗(73% vs 76%,OR:0.87,P=0.526) [2]。
在RAS/BRAF野生型mCRC的后线治疗中,“抗EGFR单抗再挑战”是后线精准治疗策略之一。这一策略指的是,RAS野生型mCRC患者在一线接受抗EGFR单抗联合化疗治疗后疾病进展,中断抗EGFR单抗治疗可导致耐药性肿瘤细胞克隆性衰变,再次恢复肿瘤细胞对抗EGFR单抗治疗的敏感性。从2021版CSCO指南开始,西妥昔单抗在mCRC中的再挑战应用被纳入推荐。目前,越来越多的治疗证据支持这一策略[3,4],证明了其有效性和良好的耐受性。
肝移植联合化疗在CRLM中的前景
对于CRLM患者,TRANSMET研究是近期备受关注的研究之一。47例患者被随机分配到化疗联合肝移植组或单纯化疗组,结果显示肝移植组的5年生存率为73%,而单纯化疗组仅为9%,因此化疗联合肝移植相比单纯化疗,可显著改善不可切除结直肠癌肝转移患者的长期生存预后[5]。TRANSMET研究也证实了肝移植联合化疗在CRLM中的优势和潜力。但该研究也引发了关于肝脏捐献和肝移植优先级等伦理问题的讨论。
KRAS G12C突变mCRC的突破
KRAS突变是mCRC中常见的基因突变类型。目前针对KRAS突变的mCRC,临床一线治疗仍以传统化疗联合贝伐珠单抗为主。然而,随着KRAS G12C抑制剂的成功开发,mCRC的治疗格局将迎来改变。目前已有两款针对KRAS G12C突变的抑制剂临床试验成功,分别是索托拉西布(Sotorasib)和阿达格拉西布(Adagrasib),它们在KRAS G12C突变的肿瘤中展现出显著的抗肿瘤活性。
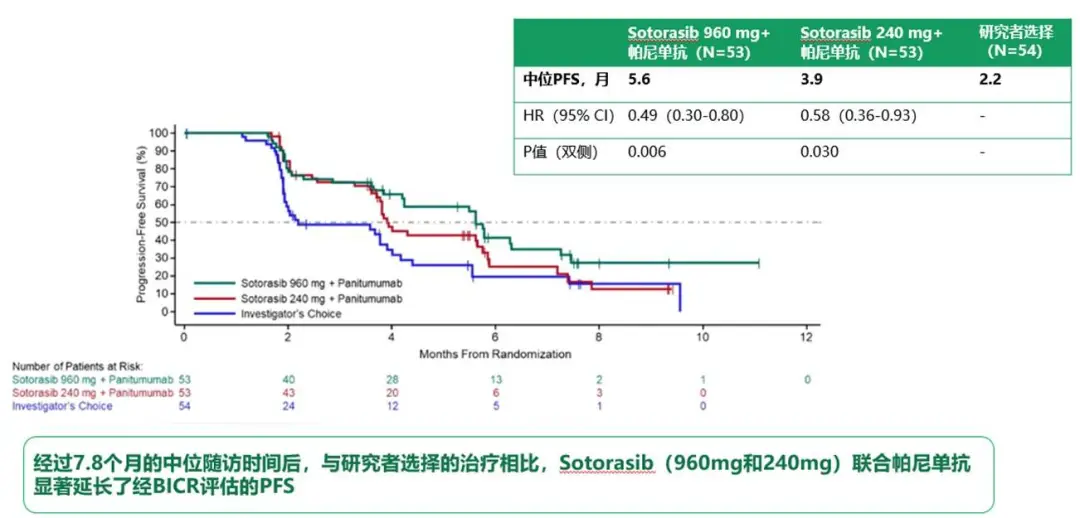
尽管KRAS G12C抑制剂在KRAS G12C突变的mCRC中单药效果有限,但与抗EGFR单抗联合使用后,患者的治疗获益显著提高。近期发布于《新英格兰医学杂志》(New England Journal of Medicine)的CodeBreak 300研究纳入了既往未接受过KRAS G12C抑制剂治疗且对化疗耐药的KRAS G12C突变型mCRC患者。研究显示,960mg/240mg Sotorasib联合抗EGFR单抗,相较于标准治疗显著改善了患者的生存获益和抗肿瘤活性。
960mg Sotorasib联合抗EGFR单抗组和240mg Sotorasib联合抗EGFR单抗组的中位无进展生存期(PFS)分别为5.6个月和3.9个月,而标准治疗组为2.2个月。与标准治疗组相比,960mg Sotorasib联合抗EGFR单抗组疾病进展或死亡的风险比(HR)为0.49(P=0.006),240mg Sotorasib联合抗EGFR单抗组疾病进展或死亡的风险比(HR)为0.58(P=0.03)[6]。
此外,Ⅲ期KRYSTAL-10研究旨在评估Adagrasib联合西妥昔单抗对比化疗在二线治疗KRAS G12C突变mCRC中的疗效和安全性,该研究已完成入组[7]。我们期待这一研究的结果发布,进一步推动KRAS G12C突变mCRC治疗的进展。
KRYSTAL-10研究:二线的KRAS G12C突变型mCRC Adagrasib+西妥昔单抗对比化疗的全球、开放标签、随机Ⅲ期试验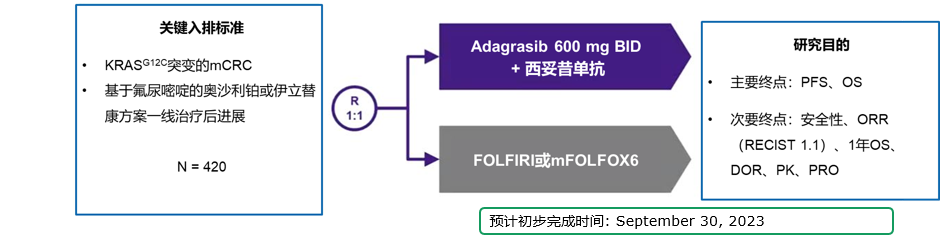
结直肠癌免疫治疗的关键话题
在结直肠癌的免疫治疗中,帕博利珠单抗已经获批用于MSI-H患者的一线治疗。近期公布的CheckMate 8HW研究结果引发了广泛关注。这项聚焦于一线治疗的三臂随机对照试验比较了化疗、纳武利尤单抗单药和纳武利尤单抗联合CTLA-4抗体伊匹木单抗的疗效。目前,纳武利尤单抗单药对比化疗的结果尚未公布,但纳武利尤单抗联合伊匹木单抗相较于化疗的PFS显著提升[未达到(NR) vs 5.9个月,HR达到0.21(P<0.0001)],生存曲线明显分开,并且患者的生活质量得到了显著改善[8]。
在局晚期错配修复缺陷(dMMR)结肠癌治疗中,荷兰的Myriam Chalabi 教授在《新英格兰医学杂志》发表的最新研究显示,采用纳武利尤单抗联合伊匹木单抗的双免疫方案在Ⅱ期dMMR结肠癌患者中展现出显著疗效,95%的患者实现了主要病理学缓解(MPR),68%的患者实现了完全缓解(CR)[9]。虽然局晚期结肠癌的免疫治疗方案尚未成为标准治疗,但这一领域的研究进展快速,未来或能为局晚期CRC的患者提供更多选择。
同时,关于将免疫治疗应用于直肠癌的研究也在不断推进。与结肠癌不同,直肠癌患者在接受放化疗和手术后可能会面临诸如低位前切除术综合征、排尿功能障碍、性功能障碍等问题。针对dMMR型直肠癌,尤其是在局晚期MSI-H直肠癌患者中,化疗和放化疗的使用正在减少,而免疫治疗成为优先选择。
未来,如何转化结直肠癌的“冷肿瘤”类型,即具有肿瘤突变负荷低、淋巴细胞浸润少等特征的MSS型肿瘤,将是免疫治疗领域的关键挑战。目前,多种PD-1单抗联合药物的Ⅱ期研究正在进行,例如阿替利珠单抗联合MEK抑制剂、瑞戈非尼联合纳武利尤单抗、帕博利珠单抗联合仑伐替尼等,这些组合初步展现了潜在的治疗效果,但仍需更多研究数据支持其广泛应用。其中,Fc增强型抗CTLA-4单抗Botensilimab联合PD-1单抗巴替利单抗的研究尤为引人瞩目,近期ESMO-GI上发布了一项这一组合在MSI-H/MSS型结直肠癌中的研究,结果显示,在局晚期MSI-H/MSS型肿瘤(超70%为MSS型)中,超过50%的患者实现了病理学缓解,所有MSI-H结肠癌患者均达到主要病理学缓解(MPR)[10],这同时为MSS型肿瘤的治疗带来了一线希望。
尽管免疫治疗在CRC的应用还有诸多问题亟待解决,但相关研究推进迅速,尤其在MSI-H型肿瘤中,免疫治疗展现出了广阔的应用前景。而在MSS型肿瘤中,免疫联合策略也显示出了初步的应用价值,未来有望成为这类患者的标准治疗方案,值得持续关注。
KRAS抑制剂联合抗EGFR单抗在结直肠癌治疗中的前景与策略
针对KRAS G12C或其他RAS突变的mCRC,单药治疗效果有限,KRAS抑制剂联合抗EGFR单抗的联合用药策略可能更有效。基因检测和液体活检对个性化治疗至关重要,新一代KRAS抑制剂的活性和疗效持续时间需进一步研究验证。
RAS突变会导致RAS蛋白持续激活,促进肿瘤细胞的增殖和转移,即使使用EGFR单抗阻断上游信号也无法抑制肿瘤进展。目前单独使用KRAS G12C/G12D抑制剂的效果并不理想,单药治疗往往难以取得显著疗效。而通过联合抗EGFR单抗,阻断上下游信号,能更有效地应对RAS突变和信号串扰,改善治疗效果[6,11,12]。
随着CodeBreak 300等研究证实KRAS G12C抑制剂与抗EGFR单抗联合使用的临床价值,且该方案也得到国际指南的推荐。此外,未来的新一代KRAS抑制剂可能会具有更强的活性,延长缓解的持续时间,但这仍有待进一步研究确认[12]。同时也需要更多的研究数据来优化治疗策略,并通过基因检测来选择最合适的患者。未来的研究将继续探索如何延长治疗的缓解持续时间,并进一步提高治疗效果。
负向超选基因在抗EGFR单抗治疗mCRC临床应用中的价值
在mCRC的治疗中,"负向超选基因"的预测价值正逐渐受到重视,而ctDNA技术检测这些基因变异有助于指导抗EGFR单抗治疗的精准治疗决策。
随着ctDNA检测技术的不断进步,其在预测抗EGFR治疗疗效中的潜力逐渐受到重视,特别是在RAS基因野生型的mCRC患者中。PARADIGM研究揭示了在RAS野生型mCRC患者中,一线使用mFOLFOX6联合帕尼单抗治疗相比于联合贝伐珠单抗,能够带来更长的中位总生存期(OS),分别为37.9个月和34.3个月(HR=0.82,P=0.031)。然而,在右半结肠癌患者中,两种治疗方案的OS并无显著差异[13]。在2023年的美国临床肿瘤学会胃肠肿瘤研讨会(ASCO GI)上,一项基于PARADIGM研究的生物标志物探索性研究被公布。该研究评估了ctDNA指导下负向超选基因在RAS野生型mCRC患者中抗EGFR单抗治疗选择中的作用[14]。研究者分析了ctDNA中的基因突变特征,这些特征包括KRAS、NRAS、PTEN、EGFR突变以及HER2、MET扩增,还有ALK、RET、NTRK1的融合等。研究结果显示,经过ctDNA负向超选的患者接受抗EGFR单抗治疗,与接受贝伐珠单抗治疗相比,展现出了更长的OS。在529例(72%)未检测到这些基因改变的患者中,无论肿瘤的原发部位,接受帕尼单抗治疗的患者OS均优于贝伐珠单抗治疗的患者。在整个研究人群中,帕尼单抗和贝伐珠单抗治疗的中位OS分别为41.3个月和34.4个月(HR=0.75;95%CI,0.62~0.92)。
这项研究强调了ctDNA超选后的基因突变状态在预测RAS野生型mCRC患者接受抗EGFR单抗治疗的生存预后中的重要性,且这一预测与肿瘤的原发部位无关。研究结果提示,通过ctDNA指导下负向超选,可能较依据肿瘤原发部位更为精确地指导一线抗EGFR单抗治疗的选择。
会议专家们一致认为,对负向超选基因的深入研究将是未来研究的重要方向。此外,为了探索更有效的联合治疗方案,还需要进行更多的临床试验。这些研究将有助于为mCRC患者提供更加个性化和精准的治疗选择。
局晚期MSI-H/dMMR CRC的临床策略探讨
免疫双药似乎比免疫单药在MSI-H/dMMR CRC一线治疗中更有疗效潜力,但在局晚期CRC中是否依然适用?为患者选择治疗方案时需综合考虑个体差异和当下标准治疗实践,需要谨慎选择并依赖于更多的临床试验数据支持。
KEYNOTE-177研究显示,29%的MSI-H mCRC 患者接受帕博利珠单抗后出现原发性耐药[15]。这意味着在某些情况下,单药ICI可能不足以应对,可能需要考虑双药联合治疗等,考虑加入其他药物如CTLA-4抑制剂、抗血管生成药物西妥昔单抗等来增强疗效。另外,MSI-H患者中存在的继发性耐药问题,需要通过检测特定蛋白(MLH1、PMS2、MSH2和MSH6)来确认dMMR状态,并据此调整治疗策略。
准确识别原发性耐药人群也是提高疗效的关键。尽管目前缺乏明确的生物标志物来指导两药方案的选择,但初步研究数据显示,双药免疫方案在一线转移患者中可能比单药治疗更有效且在患者生活质量方面优于化疗[8]。
因此在面对转移性疾病时,Eric教授提出,可能会给身体状况良好且肿瘤负荷大的患者推荐一线使用两药免疫方案。虽然目前基于循证医学证据的指南中,手术仍然是局晚期可切除患者的标准治疗方案。但如果数据支持,也可能倾向于使用双药免疫方案,尤其是在目标为保存器官并避免手术的情况下。但我们未来仍需更多相关随机对照临床试验的开展,来帮助更好地为患者分层和选择个性化治疗方案。
总结来说,免疫治疗在MSI-H/dMMR结直肠癌中的应用具有显著潜力,但其具体的应用策略仍需根据患者的具体情况以及生物标志物进行调整。双药联合治疗可能在某些情况下优于单药治疗,但其选择需要谨慎,并依赖于更多的临床试验数据支持。
小结
在本次C对话中,来自中外的肠癌领域专家就CRC前沿治疗策略展开了深入探讨,涵盖了mCRC精准化治疗策略、KRAS突变mCRC治疗探索以及ctDNA指导下负向超选策略等多个热点问题。期待此次C对话能为CRC治疗带来创新思路,并为未来的研究指明方向。
1. Cervantes, A et al. “Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up.” Annals of oncology : official journal of the European Society for Medical Oncology vol. 34,1 (2023): 10-32. doi:10.1016/j.annonc.2022.10.003
2. Rossini D, Antoniotti C, Lonardi S, et al. Upfront Modified Fluorouracil, Leucovorin, Oxaliplatin, and Irinotecan Plus Panitumumab Versus Fluorouracil, Leucovorin, and Oxaliplatin Plus Panitumumab for Patients With RAS/BRAF Wild-Type Metastatic Colorectal Cancer: The Phase III TRIPLETE Study by GONO. J Clin Oncol. 2022;40(25):2878-2888. doi:10.1200/JCO.22.00839
3. Cremolini C, Rossini D, Dell’Aquila E, et al. Rechallenge for patients with KRAS and BRAF wild-type metastatic colorectal cancer with acquired resistance to first-line cetuximab and irinotecan: a phase 2 single-arm clinical trial[J]. JAMA Oncol, 2019, 5(3): 343-350.
4. Troiani T, Martinelli E, Ciardiello D, et al. Phase II study of avelumab in combination with cetuximab in pre-treated RAS wild-type metastatic colorectal cancer patients: CAVE (cetuximab-avelumab) Colon. Journal of Clinical Oncology 2019;37:TPS731-TPS
5. Rene Adam,et al.Chemotherapy and liver transplantation versus chemotherapy alone in patients with definitively unresectable colorectal liver metastases: A prospective multicentric randomized trial (TRANSMET).2024 ASCO, Abstract 3500.
6. Fakih, Marwan G et al. Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. The New England journal of medicine vol. 389,23 (2023): 2125-2139. doi:10.1056/NEJMoa2308795
7. https://clinicaltrials.gov/ct2/show/NCT04793958
8. Heinz-Josef Lenz,et al.Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Expanded efficacy analysis from CheckMate 8HW.2024 ASCO, Abstract 3503.
9. Chalabi M, Verschoor YL, Tan PB, et al. Neoadjuvant Immunotherapy in Locally Advanced Mismatch Repair-Deficient Colon Cancer. N Engl J Med. 2024;390(21):1949-1958. doi:10.1056/NEJMoa2400634
10. Kasi PM et al. Neoadjuvant botensilimab plus balstilimab in resectable mismatch repair proficient and deficient colorectal cancer: NEST-1 clinical trial. JCO 42, 117-117(2024).
11. Corcoran RB. A single inhibitor for all KRAS mutations. Nat Cancer. 2023;4(8):1060-1062. doi:10.1038/s43018-023-00615-x
12. Ros J, et al. Targeting KRAS G12C Mutation in Colorectal Cancer, A Review: New Arrows in the Quiver. Int J Mol Sci. 2024 Mar 14;25(6):3304.
13. Takayuki Yoshino et al. Panitumumab plus mFOLFOX6 versus Bevacizumab plus mFOLFOX6 as first-line treatment in patients with RAS wild-type metastatic colorectal cancer: results from the phase 3 PARADIGM trial. Abs LBA1, 2022 ASCO.
14. Hiroyuki Uetake,et al.Acquired gene alteration patterns and post-progression survival: PARADIGM study analysis.2024 ASCO, Abstract 3507.
15. Diaz LA Jr, Shiu KK, Kim TW, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022;23(5):659-670. doi:10.1016/S1470-2045(22)00197-8
往期回顾:
C对话 | 第一期:王照元教授与陈功教授三问三答,海峡两岸专家解析肠癌外科难点疑点
C对话 | 第二期:王照元教授答陈功教授,释局晚直肠癌术前治疗模式
C对话 | 第三期:转移瘤不可切除的mCRC,原发灶是否应该切除?——陈功教授答王照元教授
C对话 | 第四期:梁逸歆教授答王晰程教授,析少见突变结直肠癌临床治疗难题
C对话 | 第五期:王晰程教授答梁逸歆教授,解肠癌治疗热点问题
C对话 | 第六期:陈功教授对话谢燿宇教授,深入交流两岸肠癌诊疗之同与异
C对话 | 第七期:中外观点碰撞,解读BRAF突变肠癌最佳治疗
C对话 | 第八期:云端再会首,RAS/BRAF野生型肠癌抗EGFR治疗策略名家观点相辉映
C对话 | 第九期:中外专家“面对面”,畅谈肠癌生物标志物检测与治疗
C对话 | 第十期:基于数据,归于经验——中英名家对话,探讨MSI-H/dMMR肠癌免疫治疗具体策略
C对话 | 第十一期:中外专家双视角,深度剖析结直肠癌CSCO与NCCN指南更新之表里
C对话 | 第十二期:中西对话OPTICAL,“精准”聚焦结肠癌新辅助
C对话 | 第十三期:中西对话IMPROVE,从“间歇给药”到CRC“免疫治疗全景观”
C对话 | 第十四期:中西对话CRC策略优化关键词:“三药or两药”、“漏斗效应”、“最佳决策”
C对话丨第十五期:中西话肠癌前沿:“耐药标志物”、“原发灶与转移灶免疫微环境”
C对话丨第十六期:中西对话,洞悉KRAS突变转移性结直肠癌的临床现状与未来方向
C对话 | 第十七期:ESMO热点回顾,中西专家研讨肠癌四大关键议题,洞悉新趋势与突破
C对话 | 第十八期:中西对话mCRC热点突变靶向治疗新格局探索(上):BRAF突变mCRC临床实践难点与方向
C对话 | 第十九期 | 中西对话mCRC热点突变靶向治疗新格局探索(中):KRAS突变型mCRC临床策略与挑战
C对话 | 第二十期:中西对话,mCRC热点突变靶向治疗新格局探索(下):PAM通路和液体活检对抗EGFR单抗治疗策略的影响
排版编辑:肿瘤资讯-WJX











 苏公网安备32059002004080号
苏公网安备32059002004080号


