
彭琴, 吴宁, 黄遥, 等. 常用血清肿瘤标志物及联合胸部CT对ⅠA期肺癌的辅助诊断作用[J]. 中华肿瘤杂志, 2023, 45(11):934-941. DOI:10.3760/cma.j.cn112152-20220208-00082.
目的
探讨临床常用血清肿瘤标志物及联合胸部薄层CT在ⅠA期肺癌诊断中的价值。
方法
收集2016年1月至2020年10月就诊于中国医学科学院肿瘤医院的ⅠA期肺癌患者1155例为肺癌组,200例肺部良性结节患者为良性组。术前1个月内均接受6种临床常用血清肿瘤标志物[癌胚抗原(CEA)、糖类抗原125(CA125)、鳞状上皮细胞癌相关抗原(SCCA)、细胞角蛋白19片段(CYFRA21-1)、神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(ProGRP)]检测和胸部薄层CT扫描。以病理诊断结果为金标准,依次比较肺癌组与良性组、肺癌中低分化组与高分化组、腺癌组与鳞状细胞癌组、腺癌附壁型组与非附壁型组、基于薄层CT的肺实性结节组与亚实性结节组及ⅠA1~A3期肺癌各亚组间的血清肿瘤标志物水平,采用受试者工作特征(ROC)曲线分析血清肿瘤标志物单独及联合CT对ⅠA期肺癌的诊断效能。
结果
肺癌组6种血清肿瘤标志物单项检测的阳性率在2.32%~20.08%,良性组为0~13.64%,其中仅肺癌组的SCCA阳性率高于良性组(分别为10.81%和0, P =0.022),其他血清肿瘤标志物的阳性率两组差异无统计学意义(均 P >0.05)。6种肿瘤标志物联合检测,肺癌组的阳性率高于良性组(分别为40.93%和18.18%, P =0.004),腺癌组的阳性率低于鳞状细胞癌组(分别为35.66%和47.41%, P =0.045),低分化组和中分化组患者的阳性率高于高分化组(分别为46.48%、43.75%和22.73%, P =0.025),腺癌非附壁型组的阳性率高于附壁型组(分别为39.51%和21.74%, P =0.001),亚实性结节组的阳性率低于实性结节组(分别为30.01%和58.71%, P =0.038),ⅠA1期组、ⅠA2期组和ⅠA3期组的阳性率依次为33.33%、48.96%和69.23%,显递增趋势( P =0.005)。6种肿瘤标志物联合检测诊断ⅠA期肺癌的灵敏度和特异度分别为74.00%和56.30%,ROC曲线下面积(AUC)为0.541。6种血清肿瘤标志物联合检测+CT诊断ⅠA期肺癌的灵敏度和特异度分别为83.0%和78.3%,AUC为0.721。
结论
对于ⅠA期肺癌,目前临床常用肿瘤标志物的阳性率普遍不高,6种肿瘤标志物联合检测可以提高阳性率。6种肿瘤标志物联合检测的阳性率在中低分化癌、鳞状细胞癌或实性较大结节相对较高。肿瘤标志物检测联合薄层CT对ⅠA期肺癌诊断效能提高有限。
【关键词】 肺肿瘤; 诊断; 肿瘤标志物; 体层摄影术,X线计算机
因症状隐匿,57%的初诊肺癌患者已有转移,其5年生存率仅为6%,而Ⅰ期肺癌患者的5年生存率可达67.8%~88.1%,因此早期诊断是提高肺癌患者生存率的关键。随着多排螺旋CT的广泛应用和越来越多的医疗机构开展低剂量螺旋CT肺癌筛查工作,肺结节的检出率明显增高,但存在假阳性率高及过度诊断、过度治疗等问题。如何在大量的肺结节中识别早期且需要及时处理的肺癌是备受关注的热点。肿瘤标志物检测是临床常用的一种辅助诊断方法。目前肺癌辅助诊断、鉴别诊断和疗效监测最常用的肿瘤标志物包括癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原125(carbohydrate antigen, CA125)、鳞状上皮细胞癌相关抗原(squamous cell carcinoma associated antigen, SCCA)、细胞角蛋白19片段(cytokeratin 19 fragment, CYFRA21-1)、神经元特异性烯醇化酶(neuron-specific enolase, NSE)和胃泌素释放肽前体(pro-gastrin-releasing peptide, ProGRP),但其在早期肺癌尤其是ⅠA期肺癌辅助诊断的作用尚无大样本研究报道。在本研究中,我们回顾性分析了大样本ⅠA期肺癌患者的6种血清肿瘤标志物、胸部薄层CT及病理学资料,旨在评价常规肿瘤标志物和胸部CT对ⅠA期肺癌的诊断效能。


1.病例选择:
肺癌组患者的纳入标准:(1)经术后病理证实为ⅠA期肺癌,病理分期为pT1a~1cN0M0;(2)术前1个月内有胸部薄层CT检查,图像可在图像存储与传输系统(picture archiving and communication system, PACS)中调阅;(3)术前1个月内有CEA、CA125、SCCA、CYFRA21-1、NSE和ProGRP 6种血清标志物的检测结果。排除标准:(1)合并其他恶性肿瘤;(2)经术后病理证实的同时性多原发肺癌或1年内的异时性多原发肺癌;(3)合并代谢性疾病、血液系统疾病、免疫系统疾病等其他可能影响肿瘤标志物检测的疾病。最终纳入2016年1月至2020年10月就诊于中国医学科学院肿瘤医院的ⅠA期肺癌患者1155例。另外收集200例经手术证实的肺部良性结节患者为良性组,其血清肿瘤标志物检测和CT检查要求同肺癌组。
2.CT检查方法:
CT扫描仪包括Toshiba Aquilion 64排螺旋CT、Siemens Somatiom Definition Edge CT、GE Lightspeed VCT、GE Medical Systems Discovery HD750、GE Revolution CT、GE Medical Systems Optima CT660。扫描范围:自肺尖至少包括肾上腺,1次屏气从头侧向足侧扫描。扫描参数:矩阵512×512,层厚5 mm,层间距5 mm,重建层厚为1.0 mm或1.25 mm,重建层间距0.8 mm或1.0 mm。扫描图像常规传送至PACS内进行储存。
3.图像分析:
在不了解病理诊断结果的情况下,由放射科医师对患者术前1个月内的胸部薄层CT图像进行分析,对结节的密度、大小、形态进行评定。依据Fleischner学会的定义,将肺结节分为实性结节、部分实性结节、非实性结节(纯磨玻璃密度结节)3类,其中非实性结节与部分实性结节统称为亚实性结节。结节大小测量在轴位肺窗的最大截面进行,取轴位最大径与垂直径的平均值作为平均径。部分实性结节平均径的测量包括整个病灶的平均径和实性成分的平均径。
4.血清肿瘤标志物检测:
采集患者清晨空腹静脉血5 ml,分离血清,采用全自动化学发光免疫分析方法检测血清CEA、CA125、SCCA、CYFRA21-1、NSE和ProGRP水平。正常值范围:CEA:0~5.0 ng/ml,CA125:0~35 U/ml,SCCA:0~1.5 ng/ml,CYFRA21-1:0~3.33 ng/ml,NSE:0~16.3 ng/ml,ProGRP:0~63 pg/ml。6种标志物的检测值均在正常值范围内视为阴性,1种及以上标志物的检测值超出正常值范围视为阳性。
5.病理诊断:
病理诊断依照2015版世界卫生组织肺部肿瘤分类标准。肺癌组患者依据分化程度分为高分化、中分化、低分化3组。肺腺癌的组织学亚型依据主要成分分为附壁型、腺泡型、乳头型、实体型,本组患者无微乳头为主型。依据2017年国际抗癌联盟第8版肺肿瘤TNM分期标准进行TNM分期,ⅠA1期肿瘤最大径≤1.0 cm,ⅠA2期肿瘤最大径为1.1~2.0 cm,ⅠA3期肿瘤最大径为2.1~3.0 cm。
6.统计学方法:
应用SPSS 23.0软件进行统计分析。符合正态分布的计量资料以(x̄± s)表示,两组间比较采用 t检验。组间血清肿瘤标志物阳性率的比较采用 χ 2检验。血清肿瘤标志物及CT的诊断效能评价采用受试者工作特征曲线分析,并计算灵敏度和特异度。检验水准α=0.05。


一、临床资料
肺癌组中男669例,女486例,年龄(59.42±7.60)岁。良性组中男116例,女84例,年龄(49.43±9.12)岁。肺癌组与良性组患者的性别、年龄差异无统计学意义( χ 2=5.01, P=0.081; t=-1.35, P=0.340)。肺癌组中腺癌765例(附壁型246例,腺泡型322例,乳头型165例,实体型32例),鳞状细胞癌(简称鳞癌)390例;高分化214例,中分化644例,低分化297例;ⅠA1期671例,ⅠA2期392例,ⅠA3期92例。良性组中肉芽肿性病变58例,错构瘤45例,肺结核31例,硬化性肺泡细胞瘤26例,机化性肺炎14例,局灶纤维化12例,炎性结节11例,真菌感染3例。
二、ⅠA期肺癌与肺部良性结节患者肿瘤标志物阳性率比较
良性组和肺癌组CYFRA21-1的阳性率分别为13.64%和20.08%,在单项肿瘤标志物中均为最高。肺癌组SCCA的阳性率为10.81%,高于良性组(0, P=0.022),而两组间CEA、CA125、CYFRA21-1、NSE和ProGRP的阳性率差异均无统计学意义(均 P>0.05)。肺癌组6种肿瘤标志物联合检测的阳性率为40.93%,高于良性组(18.18%, P=0.004;表1)。

三、ⅠA期肺癌临床病理特征与肿瘤标志物阳性率的关系
1.ⅠA期肺癌病理类型与肿瘤标志物阳性率的关系:
腺癌组与鳞癌组平均径分别为1.30和1.71 cm。腺癌组CEA和CA125阳性率均低于鳞癌组( P值分别为0.019和0.047),NSE阳性率高于鳞癌组( P=0.005)。6种肿瘤标志物联合检测,腺癌组阳性率为35.66%,低于鳞癌组(47.41%, P=0.045;表2)。

2.ⅠA期肺癌分化程度与肿瘤标志物阳性率的关系:
低分化组和中分化组患者的CEA阳性率、NSE阳性率均高于高分化组( P值分别为0.001和0.039)。6种肿瘤标志物联合检测,低分化组和中分化组患者的阳性率均高于高分化组( P=0.025),而低分化组与中分化组相近( χ 2=3.84, P=0.601;表3)。
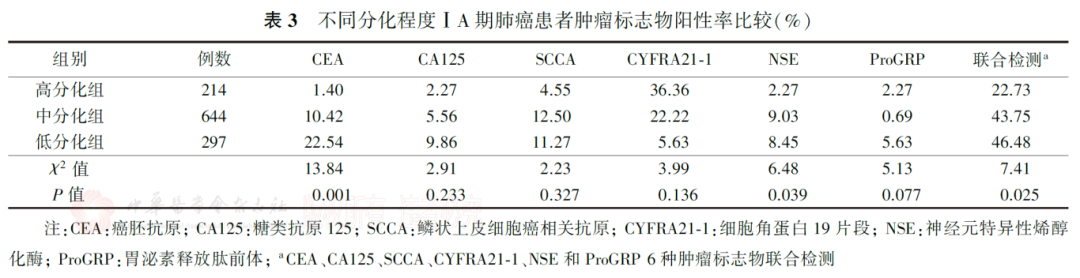
3.ⅠA期肺腺癌组织学亚型与肿瘤标志物阳性率的关系:
在肺腺癌中,肿瘤标志物单项检测,非附壁型组CEA和CA125的阳性率均高于附壁型组( P值分别为0.050和0.038)。6种肿瘤标志物联合检测,非附壁型组的阳性率高于附壁型组( P=0.001),其中乳头型患者的阳性率最高,为64.52%(表4)。
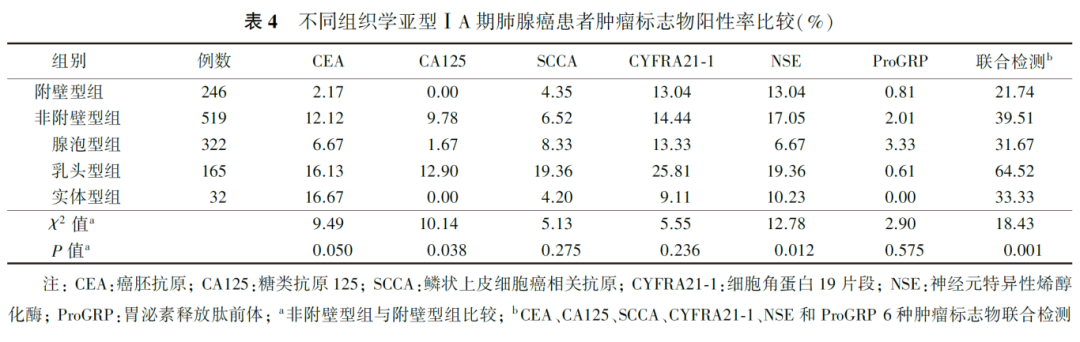
4.ⅠA期肺癌结节密度类型与肿瘤标志物阳性率的关系:
肿瘤标志物单项检测,亚实性结节组CEA和CYFRA21-1的阳性率低于实性结节组( P值分别为0.001和0.018),NSE的阳性率高于实性结节组( P=0.015),ProGRP在部分实性结节中阳性率为0。6种肿瘤标志物联合检测,亚实性结节组的阳性率低于实性结节组( P=0.038,表5),非实性结节组高于部分实性结节组( χ 2=7.01, P=0.040)。
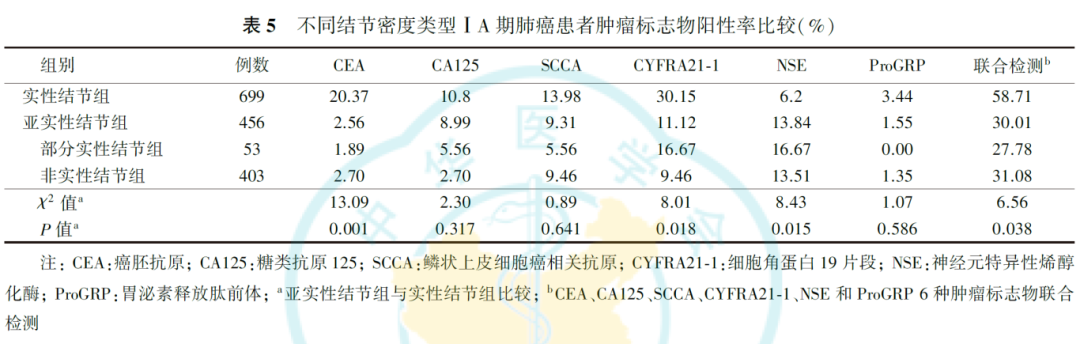
部分实性结节和非实性结节均为腺癌。在实性结节组中,腺癌309例,鳞癌390例。肿瘤标志物单项检测,鳞癌组CEA的阳性率高于腺癌组( P=0.021)。6种肿瘤标志物联合检测,鳞癌组的阳性率高于腺癌组( P=0.001,表6)。
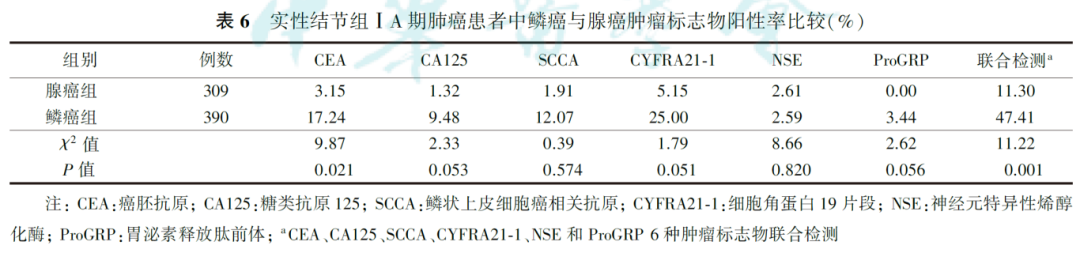
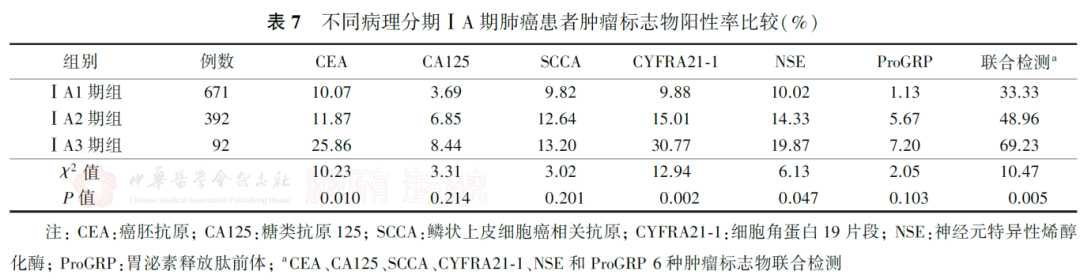
5.ⅠA期肺癌病理分期与肿瘤标志物阳性率的关系:
肿瘤标志物单项检测,ⅠA1期组、ⅠA2期组和ⅠA3期组CYFRA21-1与NSE的阳性率差异均有统计学意义( P值分别为0.002和0.047),且呈明显递增趋势。6种肿瘤标志物联合检测,ⅠA1期组、ⅠA2期组和ⅠA3期组的阳性率依次为33.33%、48.96%和69.23%,差异有统计学意义( P=0.005),也显递增趋势(表7)。
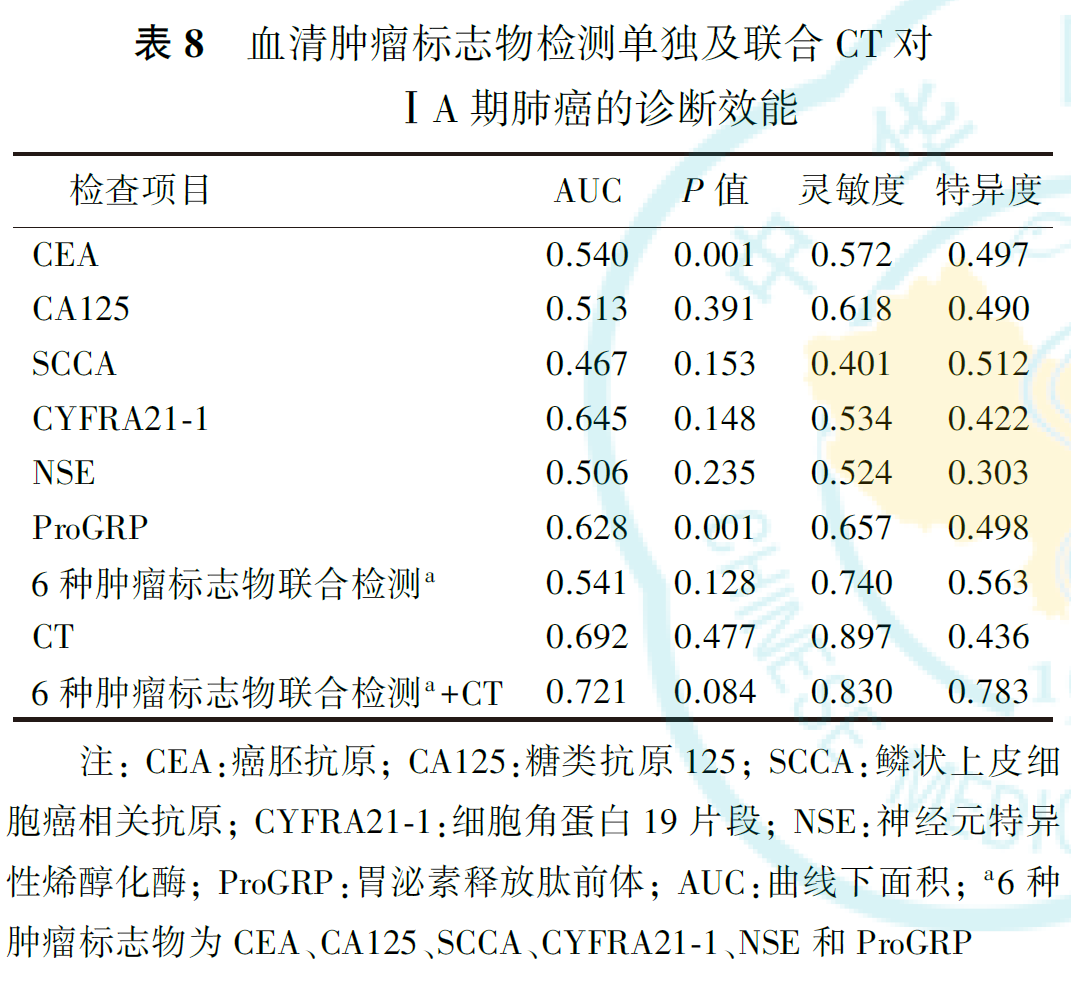
四、血清肿瘤标志物及联合胸部CT对ⅠA期肺癌的诊断效能
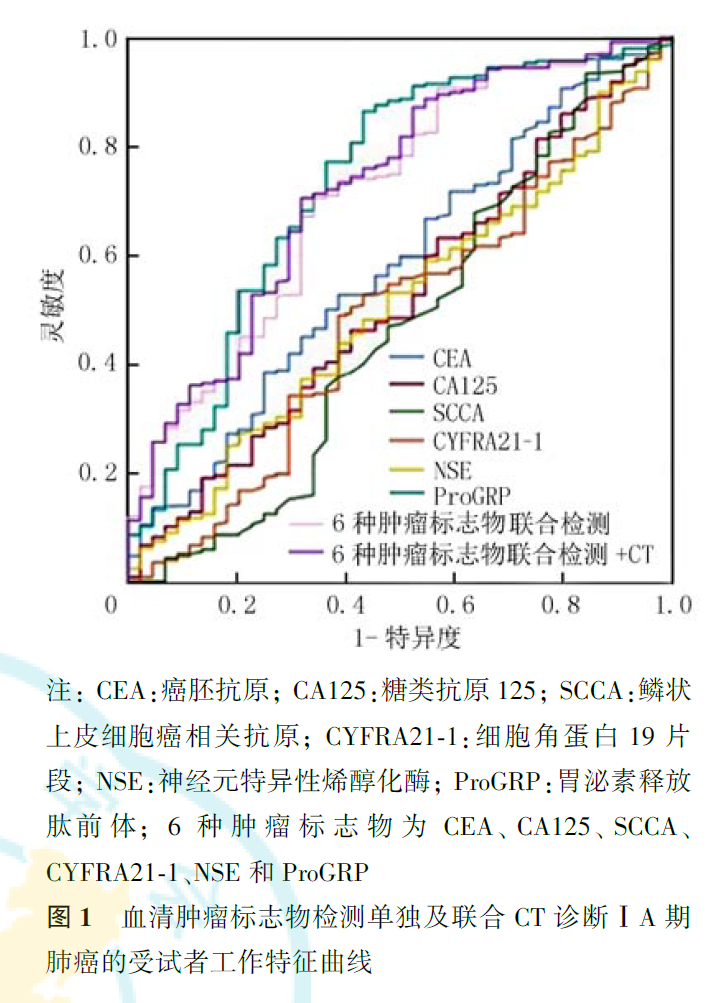
CEA、CA125、SCCA、CYFRA21-1、NSE和ProGRP 6种肿瘤标志物联合检测诊断ⅠA期肺癌的灵敏度和特异度分别为74.00%和56.30%。以肺结节平均径1.02 cm为临界值,CT诊断ⅠA期肺癌的灵敏度和特异度分别为89.7%与43.6%。6种肿瘤标志物联合检测+CT诊断ⅠA期肺癌的灵敏度和特异度分别为83.0%和78.3%(表8)。6种血清肿瘤标志物联合检测、6种肿瘤标志物联合检测+CT诊断ⅠA期肺癌的曲线下面积(area under the curve, AUC)分别为0.541和0.721,诊断ⅠA期鳞癌的AUC值分别为0.541和0.586,诊断ⅠA期腺癌的AUC值分别为0.440和0.635(图1,图2,图3)。
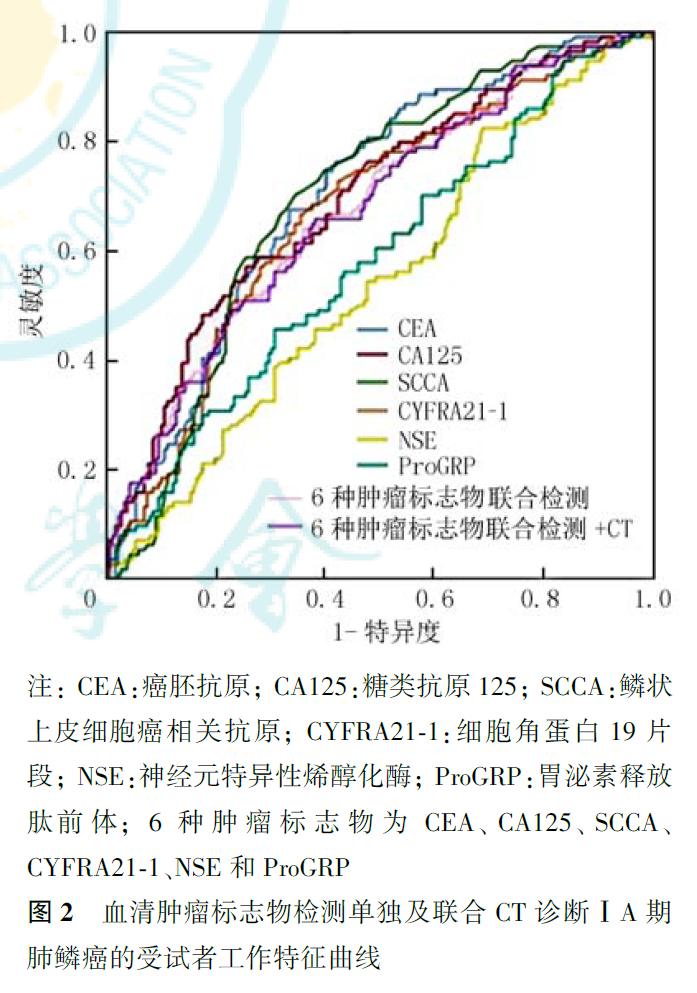
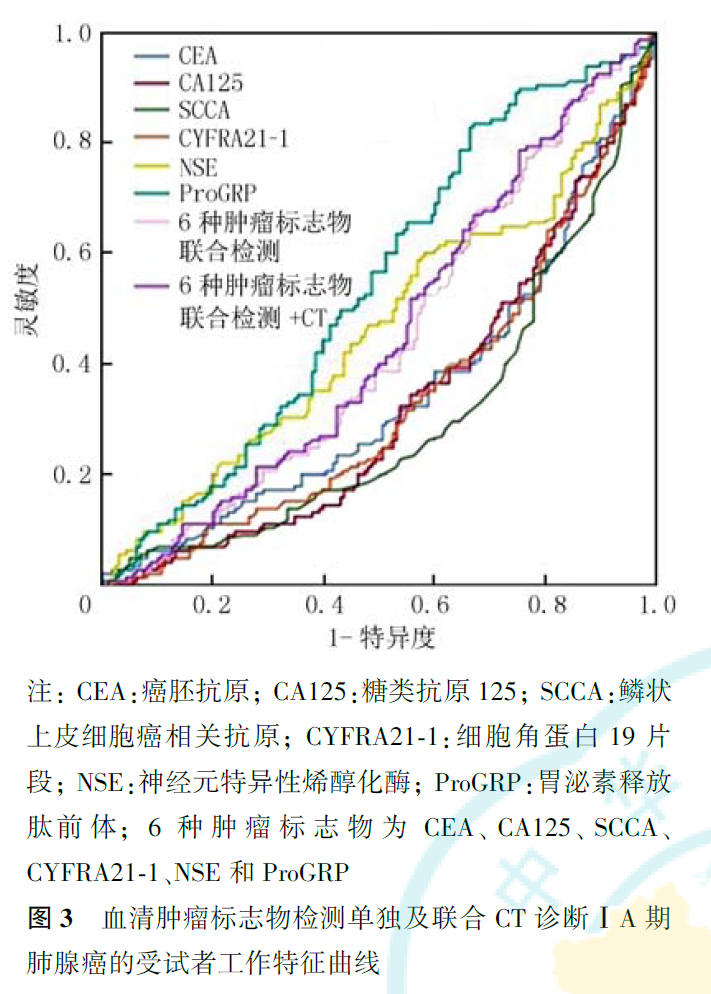


肿瘤标志物是指在恶性肿瘤发生和增殖过程中,由肿瘤细胞本身所产生的或是由机体对肿瘤细胞反应而异常产生和(或)升高的,反映肿瘤存在和生长的一类物质,被广泛应用于肿瘤的临床辅助诊断。一项647例原发性肺癌的队列研究显示,CEA、CA15.3、SCCA、CYFRA21-1、NSE和ProGRP 6种肿瘤标志物联合检测诊断肺癌的灵敏度可达88.5%,特异度达82%,值得注意的是,该研究中90.1%的病灶>3 cm。在本研究中,我们就常用血清肿瘤标志物检测对ⅠA期(≤3 cm)肺癌的诊断效能进行了评估,结果显示,肺癌组CEA、CA125、SCCA、CYFRA21-1、NSE和ProGRP 6种肿瘤标志物联合检测的阳性率高于良性组(分别为40.93%和18.18%, P=0.004)。单项检测时,肺癌组SCCA明显高于良性组,而良性组NSE和SCCA的阳性率均为0,提示肺结节SCCA升高时,肺癌的可能性增大。中低分化组肺癌6种肿瘤标志物联合检测阳性率高于高分化组(分别为46.48%和22.73%, P<0.05),故对于影像考虑恶性的肺结节,当6种肿瘤标志物联合检测阳性率升高时,可能提示肿瘤分化程度较低。肺鳞癌6种肿瘤标志物联合检测阳性率高于腺癌(分别为47.41%和35.66%, P<0.05),肺癌患者中肿瘤标志物单项检测阳性率以蛋白类标志物CYFRA21-1最高,且鳞癌高于腺癌(分别为25.00%和16.08%),表明CYFRA21-1诊断早期肺鳞癌灵敏度相对较高,与既往研究结果趋于一致。在Molina等以进展期肺癌为主的211例非小细胞肺癌相关研究中,CYFRA21-1阳性率鳞癌高于腺癌(分别为78%和69%),且CYFRA21-1表达水平高于本研究结果,此差异考虑与本组肺癌病例均为ⅠA期有关。本研究中肺腺癌患者CEA和CA125的阳性率均低于鳞癌患者,但有研究显示CEA和CA125在中晚期肺腺癌表达水平较高。CEA作为一种具有人胚胎抗原特异性的酸性糖蛋白,与诱导细胞凋亡、肿瘤细胞黏附密切相关,通常被认为是结直肠癌或肺腺癌的肿瘤标志物。但一项包括34项研究的Meta分析显示,肺腺癌与鳞癌的CEA表达水平差异无统计学意义,Veronesi等的研究则显示,术前肿瘤组织中的CEA表达水平可作为判断肺鳞癌预后的预测因子。CA125表达水平也可在大细胞肺癌、卵巢癌组织中升高。这些研究提示,CEA和CA125均是较广谱的肿瘤标志物,可在不同组织类型的肿瘤中表达。此外,本研究还显示腺癌病灶小于鳞癌(分别为1.30和1.71 cm),而且部分腺癌为肿瘤细胞含量较低的亚实性,因而可能使得腺癌的肿瘤标志物表达水平较低。在本研究的腺癌患者中,附壁型组6种肿瘤标志物联合检测的阳性率低于其他亚型,乳头型组高于其他亚型,提示6种肿瘤标志物的检测结果对早期腺癌的组织学亚型判断有一定的参考价值,或许能在一定程度上提示预后良好的附壁型腺癌与预后相对较差的非附壁型腺癌。此外,表现为实性结节的肺癌其标志物阳性率高于表现为亚实性结节的肺癌,提示肿瘤标志物检测应用于实性肺结节的鉴别诊断意义更大。
本研究结果显示,6种肿瘤标志物联合检测的阳性率随肿瘤的增大而逐渐升高,ⅠA3期肺癌的阳性率约为ⅠA1肺癌的2倍(分别为69.23%和33.33%),表明在早期肺癌中肿瘤标志物阳性率随肿瘤体积的增大而递增。有研究表明,血清肿瘤标志物水平与肿瘤负荷密切相关,随肿瘤分期升高而增高。在本研究中我们还发现,肿瘤标志物联合检测的阳性率较单项检测有明显提高,因此推荐肿瘤标志物联合检测。
近年来,CT的广泛应用大大提高了早期肺癌的检出率。在本研究中,我们就肿瘤标志物检测联合胸部CT在ⅠA期肺癌诊断中的价值进行了评估,结果显示,6种肿瘤标志物联合检测+CT诊断肺癌的灵敏度和特异度分别为83.0%和78.3%,AUC为0.721,提高了肿瘤标志物联合检测的灵敏度(74.0%)和CT诊断的特异度(43.6%)。由于本研究纳入的肺癌患者均属早期,目前临床常用的肿瘤标志物联合检测对恶性结节诊断虽有一定的灵敏度和特异度,但由于受诸多非病理因素影响,现有诊断效能尚不能满足对早期肺癌诊断的要求,仍需寻找更敏感的标志物。有研究表明,以肺癌自身抗体为代表的一些新型标志物,可在肿瘤负荷较低的情况下被检测出;在早期肺癌筛查中灵敏度为61%,特异度可达到90%,但仍需要大样本的临床研究进行验证。
本研究尚存在以下不足:(1)为单中心回顾性研究,研究结果需要前瞻性研究进一步证实;(2)所纳入病例的病理类型仅有腺癌和鳞癌,对肿瘤标志物的检测结果分析可能存在偏倚。
综上所述,对于ⅠA期肺癌,CEA、CA125、SCCA、CYFRA21-1、NSE和ProGRP等临床常用血清肿瘤标志物的阳性率普遍不高,联合检测的阳性率高于单项检测;中低分化肺癌、鳞癌及实性较大结节的阳性率相对较高;阳性率随肿瘤灶的增大呈升高趋势。临床常用血清肿瘤标志物联合薄层CT检查,可提高肿瘤标志物诊断的灵敏度和CT诊断的特异度,但诊断效能提高有限,更高灵敏度生物标志物与CT的联合应用有望进一步提高早期肺癌的检出率与诊断准确度。











 苏公网安备32059002004080号
苏公网安备32059002004080号


