三阴性乳腺癌 (triple-negative breast cancer,TNBC) 侵袭性强,易复发和转移。与其他类型的乳腺癌相比,TNBC早期复发风险更高,预后更差。由于缺乏特异的治疗靶点,目前国内对转移性TNBC(metastatic TNBC,mTNBC) 的一线治疗推荐仍以蒽环或紫杉醇 (paclitaxel) 为基础的单药或联合化疗为主。近年来,随着新型治疗药物在mTNBC 中的成功应用,国外已批准一些新型药物用于mTNBC 的治疗。该文拟对近年来mTNBC 分子分型、免疫以及抗体药物偶联物的研究进展作一综述。

范嘉躜, 黄硕涵, 孟艳春, 等. 转移性三阴性乳腺癌的新型药物治疗进展[J]. 世界临床药物, 2024, 45(7): 703-709. DOI :10.13683/j.wph.2024.07.002
三 阴性 乳 腺 癌 (triple-negative breast cancer, TNBC) 是指经荧光原位杂交技术(fluorescence in situ hybridization,FISH) 检测或免疫组织化学法检查,雌激素受体 (estrogen receptor,ER)、孕激素受体(progesterone receptor,PR) 以及人表皮生长因子受体(human epidermal growth factor receptor,HER)-2 表达均为阴性的乳腺癌(breast cancer,BC),占BC 的15% ~ 20%[1]。TNBC 大部分为浸润性导管癌,具有组织学分级高、有丝分裂率高、肿瘤异质性高[2]、T 细胞浸润率高、基因突变负荷高和程序性死亡配体(programmed death ligand,PD-L)1 高表达的生物学特征。与其他类型BC 相比,TNBC 具有更多的高危因素,如初诊时年轻、分期晚、淋巴结多受累、侵袭性高、更早发生复发及转移[3],临床预后差,生存时间劣于其他类型的BC,现有的治疗方法无法满足患者需求。由于缺乏特异的治疗靶点,目前国内转移性TNBC(metastatic TNBC,mTNBC) 一线治疗仍以蒽环或紫衫醇(paclitaxel)为基础单药或联合化疗为主。近年来,临床上一直致力于研究TNBC 的分子分型及新型药物( 靶向、免疫治疗) 的研发。本文拟对TNBC 的不同分子亚型以及其免疫、抗体药物偶联物(antibody-drug conjugate,ADC) 的研究进展作综述。
TNBC 的分子分型研究进展
转录组谱分析为TNBC 的分子异质性提供深刻见解,目前几种分子系统已被提出以识别相关亚型和生物标志物,进而指导治疗决策。Lehmann等[2] 基于21 个BC 的基因表达谱, 通过587 个TNBC 病例的聚类分析,确定6 个稳定的TNBC亚型:基底细胞样(basal-like,BL)1、BL2、免疫调节(immunomodulatory,IM)、间充质样细胞(mesenchymal,MES)、间充质样干细胞样(mesenchymal stem-like,MSL) 以及管腔雄激素受体类(luminal androgen receptor,LAR)。该分型可为治疗选择提供信息,例如BL1 和BL2 亚型在与细胞增殖和DNA 损伤反应相关的基因中高表达,表明基底样肿瘤患者可从优先靶向高度增殖肿瘤的药物获益,如抗有丝分裂和DNA 损伤药物[4-5],MES 亚型富含上皮间质转化和细胞运动分化相关基因,对哺乳动物雷帕霉素靶蛋白抑制剂敏感。
Lehmann 等[6]根据基因表达类似程度,确定IM 亚型和MSL 亚型分别来自浸润淋巴细胞和肿瘤相关基质细胞,将TNBC 的分子分型进一步缩小为BL1、BL2、MES 以及LAR4 种亚型,新的分型与预后联系更为紧密。
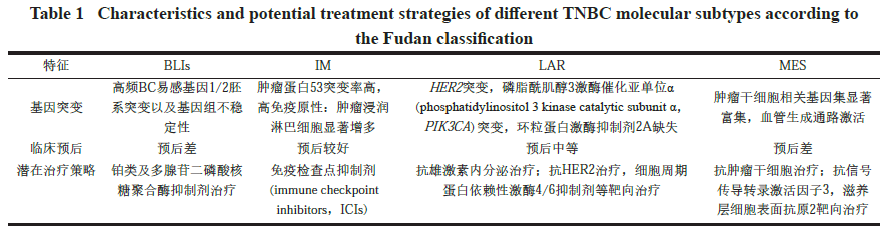
复旦大学附属肿瘤医院全面分析在复旦大学上海肿瘤中心接受治疗的465 例原发性TNBC 的临床、基因组和转录组学数据,提出基于中国人群数据的“复旦分型”[7],该研究基于信使RNA 的亚型将TNBC 分为4 种:①以雄激素受体信号传导为特征的LAR 亚型( 约占21.5%)。②显示高免疫细胞信号转导和细胞因子信号转导基因表达的IM 亚型( 约占22.8%)。③一种基底样免疫抑制(basal-like immunosuppression,BLIs) 亚型,其特征是DNA 修复激活和免疫反应基因下调( 约占36.3%)。④富含BC 干细胞通路的MES 亚型( 约占19.4%),详见表1。该研究证明不同种族群体之间分子特征的相似性和细微差异,如中国TNBC 队列中PIK3CA 突变的频率更高以及LAR 亚型的比例更高,是人类BC分子信息国际纲要的重要补充。此外,这项研究为TNBC 患者的亚型特异性治疗策略奠定基础,相关临床研究(NCT3805399) 目前正在进行中,等待初步结果的发布[8—9]。
表1 复旦分型中不同 TNBC 分子亚型的特征和潜在治疗策略
mTNBC的免疫治疗研究进展
TNBC 的基因突变率高,约为正常细胞的13.3倍,且会产生诱导免疫应答的新抗原,更易被免疫系统识别。此外,相较于其他亚型的BC,TNBC 具有更高水平的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs) 浸润,以及PD-L1 蛋白的表达[10]。
恶性肿瘤基因组图谱(the cancer genome atlas,TCGA) 数据库的数据证实,TNBC 患者乳腺组织样本中PD-L1 信使RNA 表达高于非TNBC 患者。提示TNBC 是免疫治疗潜在获益病种[11]。目前,针对mTNBC 也开展了一系列的免疫治疗探索研究。
ICIs单药治疗
研究比较帕博利珠单抗(pembrolizumab) 单药治疗与单药化疗[卡培他滨(capecitabine)、艾立布林(eribulin)、吉西他滨(gemcitabine)、长春瑞滨(vinorelbine)] 治疗既往接受过一线或二线针对mTNBC 系统治疗的复发mTNBC 患者的疗效[12]。
但该研究未达到首要研究终点,单药帕博利珠单抗未能显著改善患者总生存期。同样,其他 ICIs 单药治疗探索,包括阿维鲁单抗 (avelumab)、阿替利珠单抗 (atezolizumab) 等均提示 ICIs 单药治疗mTNBC 的疗效有限 [13]。
ICIs联合化疗
鉴于多项临床研究结果提示 ICIs 单药治疗mTNBC 的疗效欠佳,故更多的研究转而采用免疫治疗联合化疗的策略。一项研究将阿替利珠单抗和紫杉醇对比安慰剂联合紫杉醇,结果显示,治疗组和 mOS 延长 2.3 个月 [21 个月 vs 18.7 个月,风险比 (hazard ratio,HR)= 0.86,95% 置信区间(confidence interval,CI):0.72 ~ 1.02,P = 0.078],治疗组 PD-L 阳性者获益更明显,总生存期 (overall survival,OS)延 长 7 个 月 (25 个月 vs 18 个 月, HR = 0.71,95%CI :0.54 ~ 0.94),PD-L 阴性者生存期方面无获益(19.7 个月 vs 19.6 个月,HR = 0.97, 95%CI :0.79 ~ 1.20)[14]。对于 PD-L1 阳性的不可切除、局部晚期或 mTNBC 患者,使用阿替珠单抗联合白蛋白结合型紫杉醇作为一线治疗具有临床获益。但随后开展的研究却未达到首要研究终点,而二者研究的差别是从白蛋白紫杉醇替换为紫杉醇, 但白蛋白结合型紫杉醇和紫杉醇是同一类药物,故潜在原因还需进一步探索 [15]。2020 年 9 月 8 日, 美国 FDA 发文警示阿替利珠单抗联合紫杉醇对既往未经治疗、无法手术的局部晚期或 mTNBC 患者治疗无效。2021 年 8 月,罗氏主动撤回阿替利珠单抗联合白蛋白结合型紫杉醇治疗 PD-L1 阳性 TNBC患者的适应证。
一项研究帕博利珠单抗联合化疗 [紫杉醇、白蛋白结合型紫杉醇、吉西他滨 / 卡铂 (carboplatin)] 一线治疗 mTNBC 的疗效及安全性,证实帕博利珠单抗可显著改善 PD-L1 联合阳性分数 (combined positive score,CPS)≥ 10 的患者无进展生存期(progression free survival,PFS),延长 OS 达 6.9 个月,客观缓解率 (objective response rate,ORR)提高 11.9%。虽未对紫杉烷类型进行分层分析,但结果表明两种紫杉烷类药物组之间无差异。帕博利珠单抗联合化疗较单纯化疗可更好地提升晚期 TNBC 患者的抗肿瘤应答,尤其是 PD-L1 CPS ≥ 10 的患者,ORR 可提升 11.9%(52.7% vs 40.8%),疾病控制率可提升 10.6%(65% vs 54.4%),可延长 PD- L1 CPS ≥ 10 的晚期 TNBC 患者中位缓解持续时间(median duration of response,mDOR,12.8 个月 vs 7.3个月 )[16—17]。
目前 2023 年美国国立综合癌症网络指南推荐帕博利珠单抗联合化疗用于复发的、不可切除的或Ⅳ期 TNBC 系统性一线治疗 [18]。安全性方面,帕博利珠单抗联合化疗组治疗相关不良事件发生率与对照组相似,而免疫相关不良事件发生率较对照组升高 (26.5% vs 6.4%)。最常见的免疫相关不良事件为甲状腺功能减退,这些不良事件可控,且随着随访时间的延长,并未发现新发的未预知的不良事件。
免疫联合抗血管生成和化疗药物
抗血管生成药物或能进一步增强免疫治疗效果,可作为增敏剂与其他治疗联合使用,尤其是联合免疫治疗,可使肿瘤免疫环境从抑制状态转变为激活状态。肿瘤血管网络的正常化可直接缓解缺氧,促进 T 细胞浸润,减轻缺氧,优先诱导肿瘤相关巨噬细胞向 M1 样表型极化,降低调节性 T 细胞和髓系抑制性细胞的募集,肿瘤血管网络的正常化还可降低缺氧诱导的抑制性免疫信号,如改善灌注可降低 PD-L1 表达。此外,抗血管内皮生长因子药物可阻断树突状细胞分化的抑制信号,并降低总体髓系抑制性细胞库 [19]。
复旦大学附属肿瘤医院开展的FUTURE 系列研究探索卡瑞利珠单抗 (camrelizumab) 联合法米替尼(famitinib) 及白蛋白结合型紫杉醇治疗晚期 TNBC 中 IM 亚型患者的疗效 [20],FUTURE-C-PLUS 意向人群 ORR 为 81.3%,mDOR 为 14.9 个 月,mPFS 为 13.6 个月。提示免疫联合化疗及抗血管一线治疗mTNBC 初显获益。三联治疗方案耐受性良好,仅2 例(共 48 例 ) 患者因不良事件而停止治疗。最常见的 3 级或 4 级不良反应是中性粒细胞减少症(33.3%),在该研究中,通过剂量调整和使用集落刺激因子,这一通常是可控和可逆的。目前正在进行中的 FUTURE-SUPER 研究 (2020 年 5 月至 2023年 11 月 ),将进一步验证三药联合治疗的效果。
一项替雷利珠单 抗 (tislelizumab) 联 合Sitravatinib 以及白蛋白结合型紫杉醇治疗局部复发或 mTNBC 的Ⅱ期试验。目前已发表的数据显示,替雷利珠单抗+低剂量 Sitravatinib 组 ORR 为38.1%,mPFS 为 8.2 个月 ;替雷利珠单抗+高剂量Sitravatinib 组 ORR 为 32.5%,mPFS 数据尚不成熟。该研究同样表明免疫联合抗血管生成和化疗药物在mTNBC 中的抗肿瘤活性。免疫联合抗血管生成和化疗药物的多项研究均已显现出初步获益,但目前数据尚不成熟,有待进一步验证。
双特异性抗体联合化疗
KN046 是 一 种 抗 PD-L1/ 细 胞 毒 性 T 淋 巴细胞相关蛋白 (cytotoxic T lymphocyte-associated proteins,CTLA)-4 双特异性抗体,通过 B7 阻断CTLA-4 及 PD-1 通路来介导免疫治疗。
一项Ⅰ b/ Ⅱ期、开放、多中心临床研究评估KN046 联合白蛋白结合型紫杉醇在晚期 TNBC 患者中的有效性、安全性和耐受性。结果显示,KN046的整体安全性良好,无治疗相关的死亡病例,仅 3例 3 级免疫相关不良反应 ;此外,研究显示出积极的临床疗效,尤其是 PD-L1 阳性患者有 OS 获益, mOS 27.73 个月 [21]。
mTNBC的ADC药物研究进展
ADC 是一类新型抗肿瘤药物,该类药物的核心构成 3 要素为抗体、具有细胞毒性作用的药物和将这两者结合的连接子。靶向抗原的抗体借助针对靶细胞上特异性或优先表达抗原将强效细胞毒性药物靶向肿瘤细胞,为细胞毒性药物创造更有利的疗效窗口,不仅降低外周有毒药物的浓度,同时还提高有效抗肿瘤物质的效率和强度[22]。近年来已开展多项针对 mTNBC 的 ADC 药物的临床研究。
靶向HER-2的ADC治疗药物
T-DXd(DS-8201) 由新型 DNA 拓扑异构酶Ⅰ抑制剂 DXd、人源化抗 HER2 免疫球蛋白 G1 抗体和可裂解的四肽连接子组成。T-DXd 的药物抗体比高(8 ∶ 1),抗体连接的细胞毒性药物数量稳定,均一性极高。此外,还具有强效的旁观者效应,对靶细胞周围 HER2 低表达甚至零表达的肿瘤细胞也能产生杀伤作用 [23]。
DESTINY-Breast04(NCT03734029) 研究作为 首个针对 HER2 低表达人群进行且取得阳性结果的Ⅲ期临床试验,头对头对比 T-DXd 与 TPC 方案治疗既往转移性疾病阶段接受过一线或二线化疗、HER2 低表达晚期 BC 的疗效和安全性 [24]。试验组接受 T-DXd 治疗,对照组接受 TPC 治疗 ( 卡培他滨、艾立布林、吉西他滨、紫杉醇、白蛋白结合型紫杉醇 )。T-DXd 组较 TPC 组 PFS 分别为 10.1 个月和 5.4 个月 (HR = 0.51,95%CI :0.40 ~ 0.64,P < 0.0001)。关键次要终点结果显示,T-DXd 组对比 TPC 组,BICR 评估的总体人群的 PFS 分别为 9.9 个月和 5.1 个月 (HR = 0.50,95%CI :0.40 ~ 0.63, P < 0.0001),仍有接近 2 倍的生存优势。
T-DXd 是首个与 TPC 方案相比,在 PFS 和 OS方面表现良好的药物。在 HR 阳性 /HER2 低表达转移性 BC 患者中,T-DXd 治疗可延迟总体健康状况 / 生活质量评分恶化。与 TPC 方案相比,T-DXd 可改善患者生活质量评分获益。得益于研究的突破性获益,T-DXd 已获得 FDA 批准用于治疗既往在转移性疾病阶段接受过化疗、或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的不可切除或转移性 HER2 低表达 BC 成年患者。
安全性方面,T-DXd 组治疗后出现的不良事件的暴露校正发生率在所有总体参数中均低于化疗组,T-DXd 大多数不良反应是消化道或血液系统不良反应。间质性肺疾病 (interstitial lung disease,ILD) 是免疫治疗相关严重不良反应,应密切监测并积极管理[25]。
靶向Trop 2的ADC药物
戈沙妥珠单抗 (sacituzumab govitecan) 是一种ADC,由抗 -Trop-2 抗体通过专有的可水解连接子与化疗药物伊立替康 (irinotecan) 的代谢活性产物SN-38 偶联而成。Trop-2 在 TNBC 中表达率高达90%,且在正常组织中表达有限,故是一个有效的治疗靶点 [26]。
ASCENT 研究比较戈沙妥珠单抗与化疗 ( 卡培他滨,艾立布林,长春瑞滨或吉西他滨 ) 对既往接受过二线或者多线化疗、基线无脑转移 mTNBC 的疗效 [27]。结果显示,戈沙妥珠单抗组较化疗组能更好显著改善患者 mPFS(5.6 个月 vs 1.7 个月 )、OS(12.1 个月 vs 6.7 个月)和 ORR(35% vs 5%),降低 61% 疾病进展或死亡风险 ;亚组分析表明,无论年龄、种族、既往治疗方案数量、地理区域、是否用过 PD-1 或 PD-L1 抑制剂、有无肝转移,戈沙妥珠单抗组的临床疗效均优于化疗组。正是基于此项研究结果,FDA 将戈沙妥珠单抗先前的加速批准转为完全批准。戈沙妥珠单抗常见不良反应是中性粒细胞减少 (63%)、腹泻 (59%)、恶心 (57%)、脱发(46%)、疲劳 (45%) 和贫血 (34%)。3 级或以上常见不良反应是中性粒细胞减少 (51%)、白细胞减少(10%)、腹泻 (10%)、贫血 (8%) 和发热性中性粒细胞减少症 (6%)。最具临床相关性的 3 级或 4 级不良事件是中性粒细胞减少和腹泻,可通过既定的支持性措施进行管理。总体而言,戈沙妥珠单抗耐受性良好,因不良反应导致的停药率约为 5%,未发生治疗相关死亡事件。
在中国临床研究中,戈沙妥珠单抗治疗 mTNBC 同样有良好获益,经独立审评委员会评估的 ORR 为38.8%,戈沙妥珠单抗的安全性特征与此前研究中所 报告的相似,且未发现新的安全性信号[28]。
结语
根据分子分型的不同可将 TNBC 划分成不同的亚型。目前针对 TNBC 亚型特异性治疗的研究正在进行中,分子分型的发展将进一步准确化,为治疗的精准选择带来理论支持,治疗格局也将发生变化。既往由于缺乏确切的靶点,临床对 TNBC 患者多采用细胞毒性药物进行常规化疗,近年来的研究表明免疫治疗和 ADC 药物对 mTNBC 的治疗具有良好的应用前景。目前有多项研究显示出较传统化疗优越的疗效 ;也有部分研究未取得理想结果,需进一步对治疗方案进行探索,为患者提供个性化的治疗方案,进一步改善患者预后。











 苏公网安备32059002004080号
苏公网安备32059002004080号


