
抗体偶联药物(ADC)将特异性单克隆抗体与发挥细胞毒药物的有效载荷偶联,是近年来快速发展的一种新型疗法。多年来,针对有效载荷的开发,靶向微管的抑制剂和DNA插入剂一直处于ADC药物开发的最前沿。目前FDA已批准ADC药物中,最常见的有效载荷类型是微管蛋白抑制剂、DNA损伤剂和拓扑异构酶I抑制剂。
【HER2学社-大师课】第一期特邀武汉大学人民医院宋启斌教授详解新型ADC药物有效载荷的优选和独特设计。
一级主任医师、教授、博士研究生导师
肿瘤中心主任兼肿瘤学教研室主任、学科带头人
欧洲自然科学院院士
第五届“国之名医”一卓越建树专家
国家癌症中心肺癌质控专家
德曲妥珠单抗(DS-8201/T-DXd)
高效细胞毒“弹头”——DXd的衍生过程
DXd是一种I型拓扑异构酶抑制剂,在ADC药物早期设计时,拓扑异构酶抑制剂并没有得到重视,主要是由于当时最有效拓扑异构酶抑制剂的效力比美登素等药物要低超过100倍,这也是最初研究者对此类有效载荷缺乏兴趣的原因所在。目前被德曲妥珠单抗采用的DXd是喜树碱的水溶性非前体药物类似物,具有更强的拓扑异构酶Ⅰ抑制活性和更强的抗肿瘤活性。
喜树碱(CPT)是具有高度亲脂性五环结构的天然生物碱,具有天然的抗肿瘤活性,但水溶性差、成药困难。水溶性得到改善的喜树碱衍生物伊立替康(CPT-11)是目前临床常用药物,尤其常用于小细胞肺癌。伊立替康在肝脏中被代谢为7-乙基-10-羟基喜树碱(SN-38)而发挥抗肿瘤作用,SN-38的体外活性是伊立替康的100倍。因SN-38生物利用度较高、抗肿瘤活性强,已被ADC药物广泛采用。在SN-38的基础上,在C-7和C-9处进行环化得到DXd,这使得拓扑异构酶抑制剂的抑制活性得到进一步增强。总体而言,与其他喜树碱衍生物相比,DXd具有更强的拓扑异构酶Ⅰ抑制活性和更强的抗肿瘤活性,已被成功用于新一代ADC药物T-DXd、Dato-DXd等的研发。
“魔法弹头”DXd:具有高效抗肿瘤活性
半数抑制浓度(IC50)是一种重要的药物评价指标,指药物对某些生物程序抑制达到50%抑制效果所需的药物浓度,数值越低说明药物的抑制作用。早期开发的ADC药物通常采用传统细胞毒药物作为有效载荷,包括紫杉烷类、蒽环类药物等,这些化疗药物的疗效低,IC50值一般在微摩尔范围内。因此,早期ADC药物因疗效较差未能在抗肿瘤治疗领域得到广泛应用。细胞毒药物作为“弹头”,在肿瘤细胞内发挥杀伤作用;而克隆抗体在肿瘤细胞内的吸收和分布不良,可能导致不理想的药物暴露和低疗效。因此理想情况下的“弹头”应非常高效,IC50值应在纳摩尔、皮摩尔范围内。
拓扑异构酶I型抑制剂的成功是重大转折
一直以来,有效载荷的开发主要有两类药物处于ADC载药设计的前沿:微管抑制剂(美登素、奥瑞他汀等)和DNA烷化剂(如卡奇霉素、吡咯并苯二氮卓类等),但强烈的剂量限制性毒性限制了后续的临床开发,只有少数相关药物获得了FDA的批准。拓扑异构酶I型抑制剂的成功开发是近期取得的重大成功,代表了选择高效载荷的转折点,自2019年以来,已有两种基于拓扑异构酶I型抑制剂的ADC药物获得FDA批准,首个药物即为德曲妥珠单抗。
抗肿瘤活性是传统化疗的约1000倍
体外研究显示,DXd(德曲妥珠单抗的载药)、SN-38(戈沙妥珠单抗的载药)、KL610023(SKB264的载药)的IC50值分别为0.31、2.78、0.70umol/L。德曲妥珠单抗的有效载荷DXd的IC50值最低,与同为拓扑异构酶I抑制剂SN-38、KL610023相比,DXd的抗肿瘤活性是SN38的近10倍,是KL610023的2倍;是常规化疗药物的近1000倍。
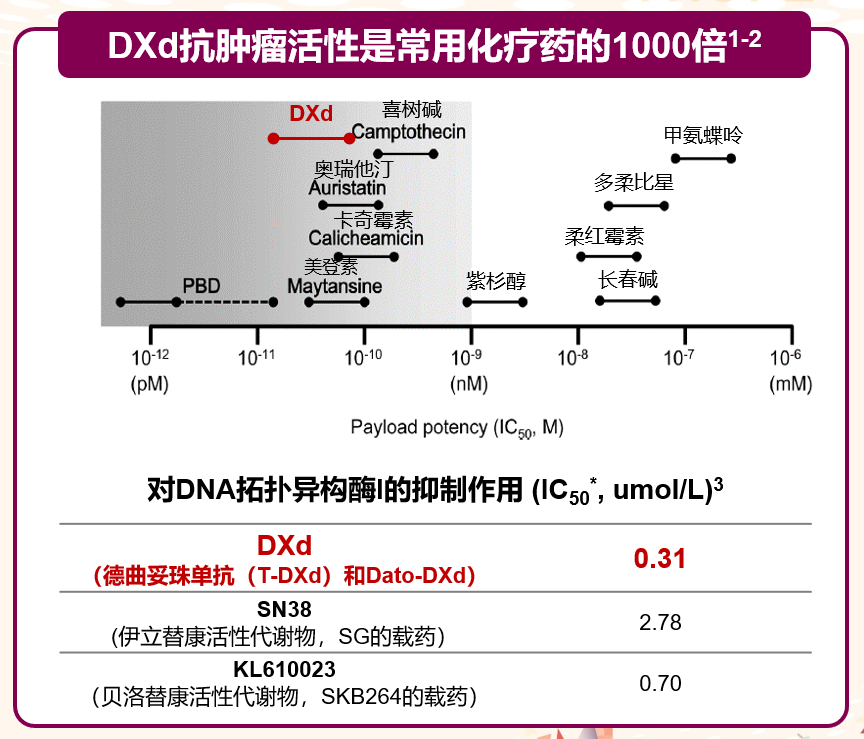 图1. 不同有效载荷及不同DNA拓扑异构酶I的IC50值
图1. 不同有效载荷及不同DNA拓扑异构酶I的IC50值
DXd:独特作用机制,避免交叉耐药
或克服耐药
紫杉类、长春瑞滨等化疗药物的作用机制为抗微管、抑制细胞有丝分裂。铂类化疗药物可引起DNA链间交联而影响DNA的转录和复制。渗透性糖蛋白(P-gp)是一种在细胞膜表达的外排转运蛋白,除了阻止化疗药物进入细胞外,还负责产生转运蛋白而导致肿瘤细胞的耐药性,是化疗药物常见的耐药机制之一。
DXd是一种拓扑异构酶抑制剂,拓扑异构酶位于细胞核内,其作用是控制和修复 DNA解螺旋、上游转录和复制过程中的 DNA超螺旋。拓扑异构酶可切割、修复超螺旋并重新连接DNA链。拓扑异构酶有两个家族:拓扑异构酶I切割单链DNA,拓扑异构酶II切割双链DNA。拓扑异构酶抑制剂可与DNA-拓扑异构酶复合物的界面特异性结合,从而抑制拓扑异构酶修复DNA,导致DNA损伤,进而导致细胞凋亡。其他ADC药物的载药包括DM1、MMAE、MMAF等,可影响微管蛋白聚合,抑制细胞分裂。
总体而言,DXd的独特作用机制,有助于对紫杉类或微管抑制剂耐药肿瘤的治疗,且DXd对药物泵P-gp高表达的肿瘤仍然有效。另外,临床研究显示,德曲妥珠单抗在恩美曲妥珠单抗耐药肿瘤中显示较好的疗效。德曲妥珠单抗的优异疗效与DXd独特作用机制、高效的抗肿瘤活性及整体药物设计密切相关。
疏水性DXd易透过细胞膜,可诱导更强旁
观者效应,且不损伤远处正常组织
不论是否表达靶抗原,被释放的有效载荷可扩散到周围异质性肿瘤细胞发挥旁观者杀伤作用,从而能进一步增强ADC药物的抗肿瘤活性,新型ADC药物一般都具有旁观者效应。由于肿瘤微环境、附近pH的变化或广泛存在的蛋白酶,有效载荷的释放可能发生在肿瘤细胞内或肿瘤细胞外以及肿瘤细胞附近;有效载荷在肿瘤细胞内的释放发生在ADC与抗原的复合物被内化之后。具体而言,德曲妥珠单抗是在肿瘤细胞内释放DXd,DXd的末端可自切割形成羟基,易透过细胞膜。DXd、Lys-SMCC-DM1(T-DM1的裂解产物)、MMAE(维迪西妥单抗的载药)的Log D值分别为2.3、0.2、1.52。Log D是评估载药膜通透性的有效参数,正值越大表示亲脂性越高,DXd具有更高的细胞膜通透性。
从机制角度,ADC药物发挥旁观者效应的效率取决于有效载荷的疏水性或亲水性。一般而言,疏水性有效载荷倾向于具有更高的膜渗透性,且能够更容易地穿过相邻细胞的细胞膜,从而增加诱导旁观者杀伤作用的可能性,DXd便是疏水性有效载荷的典型代表。亲水性有效载荷如β-内酰胺具有有限的细胞膜渗透性,需要更多地依赖于主动转运或受体介导的内吞作用等机制进入细胞。与疏水性有效载荷相比,这潜在降低了它们诱导旁观者杀伤作用的能力。比较德曲妥珠单抗和恩美曲妥珠单抗细胞毒疗效的研究显示,有效载荷的水溶性在介导旁观者效应具有重要作用。
DXd的旁观者杀伤效果已在临床前研究中得到证实,研究者将HER2+肿瘤细胞和HER2-肿瘤细胞共培养,实验组给予德曲妥珠单抗治疗。与对照组相比,治疗14天后,实验组中无论HER2+还是HER2-肿瘤细胞都消退。研究结果提示,DXd透过细胞膜,并通过旁观者效应杀伤了周围异质性肿瘤细胞。另有临床前研究,在小鼠右侧接种HER2+和HER2-混合肿瘤细胞,而左侧只接种 HER2-肿瘤细胞,德曲妥珠单抗治疗14天后发现,小鼠右侧混合肿瘤体积明显缩小,而左侧HER2-肿瘤体积无明显变化。 这提示旁观者效应不会渗透到非旁邻肿瘤,保证了系统用药的安全性。
游离DXd:半衰期极短,
利于系统治疗的安全性
表1 游离DXd半衰期极短
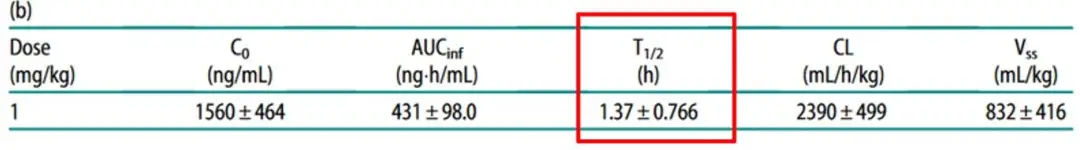 动物试验中,单次注射游离DXd可被快速代谢,DXd的半衰期非常短,仅为1.37小时。这提示,游离DXd可被快速清除,全身暴露及组织滞留风险低,可以更好地保证安全性。
动物试验中,单次注射游离DXd可被快速代谢,DXd的半衰期非常短,仅为1.37小时。这提示,游离DXd可被快速清除,全身暴露及组织滞留风险低,可以更好地保证安全性。
DXd与其他ADC药物载药区隔
大部分新型ADC药物都采用了拓扑异构酶I抑制剂作为高效“弹头”,且疏水性DXd可更强地诱导旁观者效应,而进一步增强ADC药物的抗肿瘤活性;DXd的独特抗肿瘤作用机制,可避免与既往使用化疗药物的交叉耐药,且在其他 ADC药物耐药肿瘤仍显示良好疗效。另外,游离DXd发挥高效抗肿瘤作用的同时,能被快速代谢,可确保系统治疗的安全性。
表2 不同ADC药物的载药特征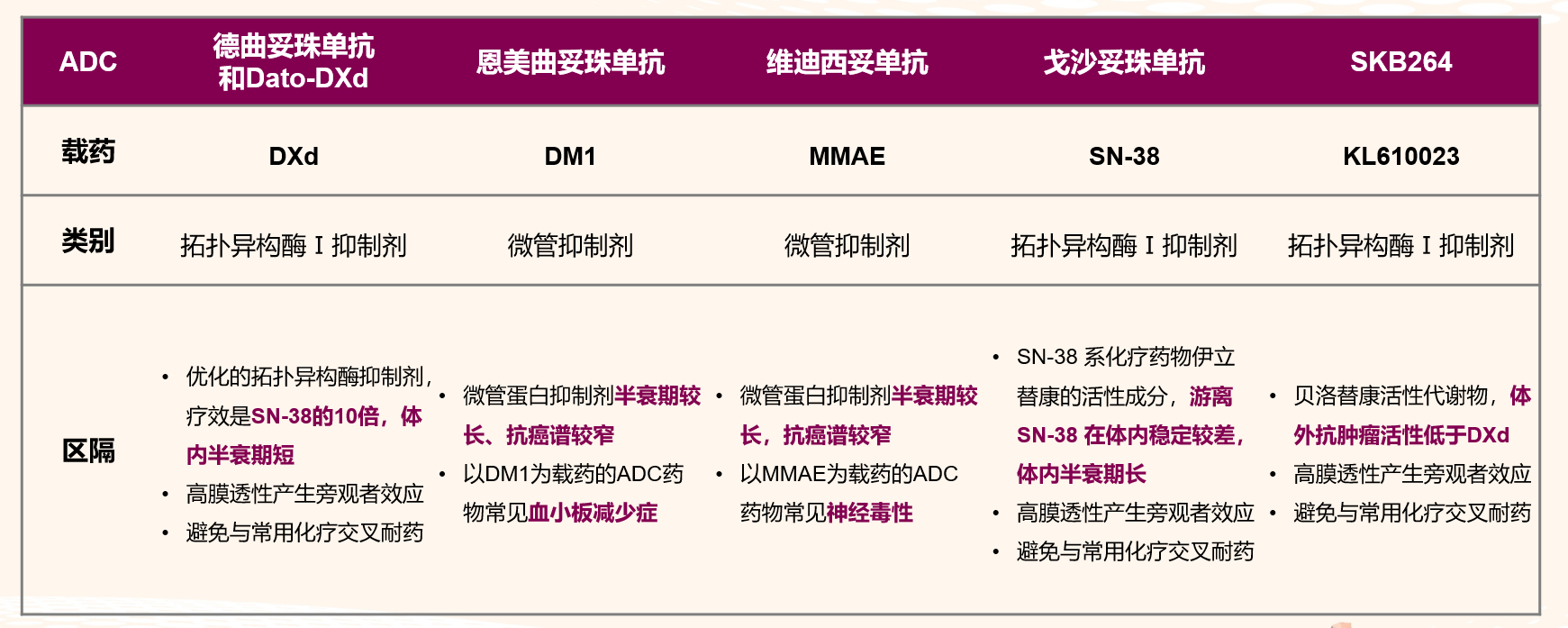
小结
经过不断的衍化,DXd成为目前喜树碱衍生物中活性最强的抗肿瘤药物,活性是SN-38的10倍,是传统化疗的近1000倍。新型ADC药物的高效“弹头”DXd是近年来关于有效载荷开发的重大突破;且游离DXd能被快速代谢,能保证全身系统的安全性。总体而言,高效低毒、机制独特的DXd作为关键组分之一,为肺癌领域首个FDA获批的ADC德曲妥珠单抗提供了重要保障。
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


