人表皮生长因子受体3(HER3)在乳腺癌的发病机制中扮演了关键角色,并在近年来逐渐成为新的研究热点。目前,靶向HER3的治疗策略已展现出令人鼓舞的临床前和早期临床结果[1-3]。本文将介绍HER3的特性,并全面梳理乳腺癌领域新型抗HER3药物的研究进展,包括单克隆抗体、双特异性抗体、抗体药物偶联物(ADCs),为未来的治疗策略提供新的思路。
追根溯源:HER3靶点简介
HER3是人类表皮生长因子受体家族的成员,该家族包括四个同源受体酪氨酸激酶:EGFR、HER2、HER3和HER4。HER3在50%-70%的乳腺癌中过表达[1]。且HER3在所有乳腺癌亚型的癌症进展、转移发展和耐药性中扮演着关键角色[1]。
由于其在癌症进展中的关键作用,过去十年来已经开发了许多 HER3 靶向疗法,但结果相互矛盾。全新一代ADC最近在表达 HER3 的实体瘤(包括乳腺癌)中显示出有希望的结果[1]。
在曲折中前行:抗HER3靶向药物研究进展
在最初开发靶向表皮生长因子受体(EGFR)家族成员的治疗方法(主要是单克隆抗体和TKI)时,HER3由于其激酶活性受损而被忽视。然而,随着对HER3在癌症进展和不同乳腺癌亚型中治疗耐药性中作用的深入理解,以及药物开发技术的进步,为靶向HER3的新型治疗策略铺平了道路(图1)[1]。
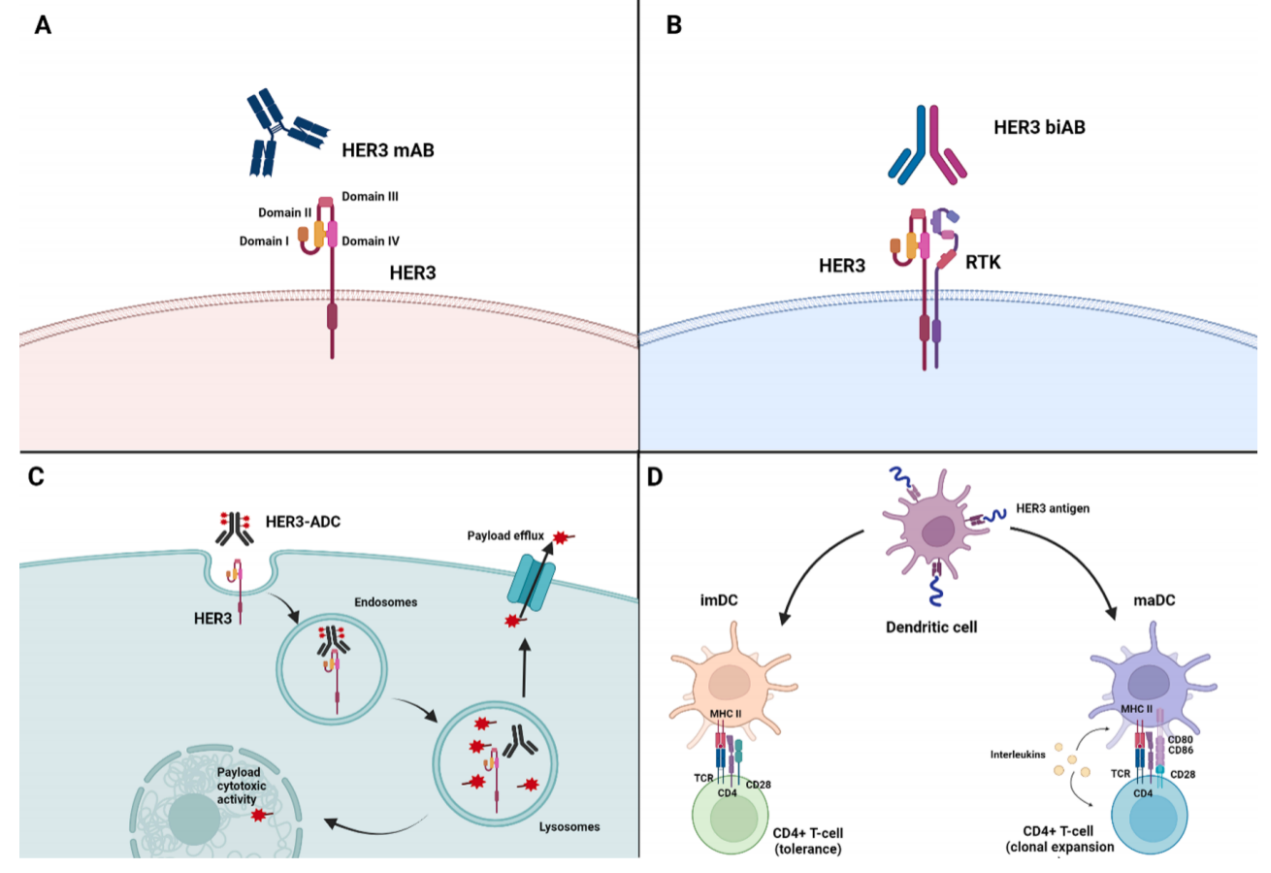 图1. 抗HER3治疗
图1. 抗HER3治疗
A:单克隆抗体;B:双特异性抗体; C:ADCs;D:疫苗[1]
单克隆抗体
Lumretuzumab(研发中止)
Lumretuzumab是一种抗HER3的人源化糖工程化IgG1单克隆抗体,通过结合HER3 ECD的亚结构域I来发挥作用,旨在阻止神经调节蛋白(NRG)与HER3的结合,从而抑制HER3的活化和下游信号传导。
Ib期试验(NCT01918254)[4]:评估Lumretuzumab与帕妥珠单抗和紫杉醇联合用于HER3+/HER2-low的转移性乳腺癌(mBC)患者。该试验设计包括剂量递增部分和两个扩展阶段队列:队列1(Lumretuzumab剂量为每21天1000mg静脉注射)和队列2(Lumretuzumab剂量为每21天2000mg静脉注射)。结果发现,尽管观察到初步的抗肿瘤活性(队列2的客观缓解率ORR为30%,一线治疗患者的ORR为55%),但许多患者即使在使用洛哌丁胺预防和剂量调整的情况下,仍经历了3级腹泻(队列1为100%,队列2为50%,队列3为30.2%)和低钾血症(队列1为100%,队列2为65%,队列3为38.5%)。因此,Lumretuzumab的研发被中止。
Seribantumab (MM-121)(初步II期结果表明在部分实体瘤中显示出反应性)
Seribantumab是一种抗HER3的人单克隆抗体IgG2,与NRG竞争结合HER3,阻断HER3二聚化并诱导其内化和降解。
II期试验(NCT01151046)[5]:比较Seribantumab联合依西美坦与安慰剂联合依西美坦用于绝经后ER/PR+, HER2-的局部晚期或mBC患者的无进展生存期(PFS),结果发现在未选择的人群中,Seribantumab并未显著延长PFS(Seribantumab组的mPFS为15.9周,安慰剂组为10.7周,HR 0.772,p = 0.249)。
II期试验(NCT03241810)[6]:评估Seribantumab与氟维司群联合用于NRG阳性、ER/PR+, HER2- mBC患者的PFS,但该研究提前关闭。
II期试验(NCT01421472)[7]:在HR+/HER2-和TNBC患者中探索Seribantumab新辅助治疗的活性,与紫杉醇联合,序贯多柔比星和环磷酰胺和手术。本研究的主要终点为pCR率。尽管在HR+组中观察到潜在获益(pCR率10.6% vs 3.3%),但在TNBC组中并非如此(41.1% vs 48.3%)。
II期试验(NCT04383210)[8]:该试验纳入复发性、局部晚期或转移性实体瘤,这些实体瘤含有NRG1基因融合。初步结果表明Seribantumab具有持久的反应性和良好的安全性。
Elgemtumab(LJM716)(I期试验显示部分联合方案毒性引起半数用药中断)
Elgemtumab(LJM716)是一种全人源IgG1单克隆抗体,结合HER3 ECD的II和IV域之间的表位,保持其闭合构象,防止信号激活。
I期试验(NCT02167854)[9]:Elgemtumab与曲妥珠单抗和Alpelisib联合用于PIK3CA突变的HER2+ mBC患者。然而,由于该联合疗法活性中等,且胃肠道毒性反应发生率较高(腹泻52%),59%的患者需要调整剂量或中断治疗,因此该组合疗法已停用。
Patritumab (U3-1287)(取得一定阳性结果)
Patritumab (U3-1287)是一种全人源IgG1单克隆抗体,通过抑制配体与HER3的结合并诱导受体内化和降解来发挥作用。
I/II期临床试验(NCT01512199)[10]:在HER2+ mBC中评估Patritumab与曲妥珠单抗和紫杉醇联合治疗,总体ORR率为38.9%,mPFS为274天。
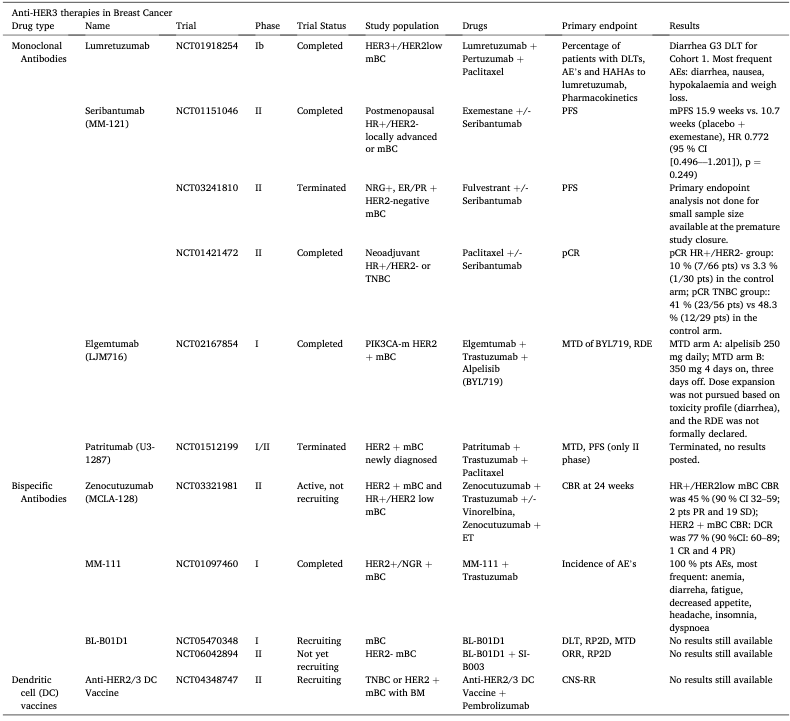
表1. 乳腺癌中的抗HER3疗法和试验
双特异性抗体
Zenocutuzumab (MCLA-128)(取得一定阳性结果)
Zenocutuzumab是一种人源化双特异性IgG1抗体,能够同时靶向HER2和HER3。它通过阻断HER3与NRG1的相互作用以及HER2/HER3的二聚化,从而抑制相关的信号传导。
I期试验[11]:Zenocutuzumab在既往接受过大量治疗、NRG1融合、接受HER2治疗后进展的mBC患者中,安全性特征(输注相关反应是最常见的AE,其次是腹泻、皮疹和疲乏)和抗肿瘤活性耐受良好(8例mBC患者:1例PR,7例SD;临床获益率CBR为70%)。
II期试验(NCT03321981)[12]:该试验评估了Zenocutuzumab联合曲妥珠单抗和/或长春瑞滨在HER2+和HR+/HER2-low mBC患者中的CBR。在HER2+ mBC患者中,DCR为77%(1例CR,4例PR);在HR+/HER2-low患者中,CBR为45%(2例患者PR,19例SD)。
ADC
Patritumab-deruxtecan(HER3-DXd)(取得一定阳性结果)
HER3-DXd是一种ADC,由Patritumab(一种抗HER3抗体)与一种拓扑异构酶I抑制剂(exatecan衍生物)通过可裂解的肽链连接。该设计使得HER3-DXd能够特异性地将药物传递到HER3表达的癌细胞中,从而在细胞内释放药物并发挥杀伤作用。
I期SOLTI TOT-HER3试验(NCT04610528)[13]:评估单剂量HER3-DXd(6.4 mg/kg或5.6 mg/kg)在未经治疗的HR+/HER2-或TNBC患者中的生物和临床活性。在HR+/HER2-乳腺癌患者中,观察到45%的临床总体响应率,响应者与非响应者相比,CelTIL评分有增加趋势。CelTIL评分的变化与基线HERB3 mRNA和HER3蛋白水平无关。
II期VALENTINE试验(NCT05569811)[14]:一项正在进行的、非比较性、三组、随机化、1:2:2开放标签、多中心研究,旨在评价HER3-DXd联合/不联合来曲唑作为新辅助治疗方案在原发性可手术HR+/HER2-乳腺癌(ki 67 ≥ 20%和/或高基因组风险)患者中的临床获益和生物学效应。主要终点是手术时的pCR率(ypT0/is ypN0),目前尚未公布结果。
I/II期U31402-A-J101试验(I/II期)[15,16]:首个评估HER3-DXd在广泛预处理的HER3表达的mBC患者中的研究。试验包括剂量递增和剂量确定阶段,涉及HER3高表达乳腺癌患者(IHC 2+或3+),以及剂量扩展阶段,涉及HER3高或低表达的HR+或HER2+乳腺癌患者,或HER3高表达的TNBC。结果发现,在HR+/HER2-乳腺癌中,ORR为30.1%,mPFS为7.4个月,OS为14.6个月。在TNBC中,ORR为22.6%,mPFS为5.5个月,OS为14.6个月。在HER2+乳腺癌中,ORR为42.9%,mPFS为11.0个月,OS为19.5个月。安全性方面,71.4%的患者出现3级以上的治疗相关不良事件(TEAEs),常见包括中性粒细胞减少、血小板减少、贫血和白细胞减少。
II期ICARUS-BREAST01研究(NCT04965766)[17]:评估HER3-DXd在HR+和HER2-乳腺癌患者中的临床活性和生物标志物,入组患者在接受CDK4/6抑制剂治疗后进展,大多数未筛选HER3表达。结果表明,HER3-DXd的安全性可管理(疲劳89.3%,恶心76.8%;3级以上不良事件为疲劳14.0%和1例G1 ILD 1.8%),3个月的响应率(RR)为28.6%。
BL-B01D(尚未公布结果)
BL-B01D1是一种首创的EGFRxHER3双特异性ADC,通过可裂解的链接将EGFRxHER3双特异性抗体与新型拓扑异构酶I抑制剂连接。
I期试验(NCT05470348)[18]:评估BL-B01D1在不可切除的局部晚期乳腺癌或转移性乳腺癌中的剂量限制毒性(DLT)、推荐的剂量扩展(RDE)和最大耐受剂量(MTD)。目前尚未公布结果。
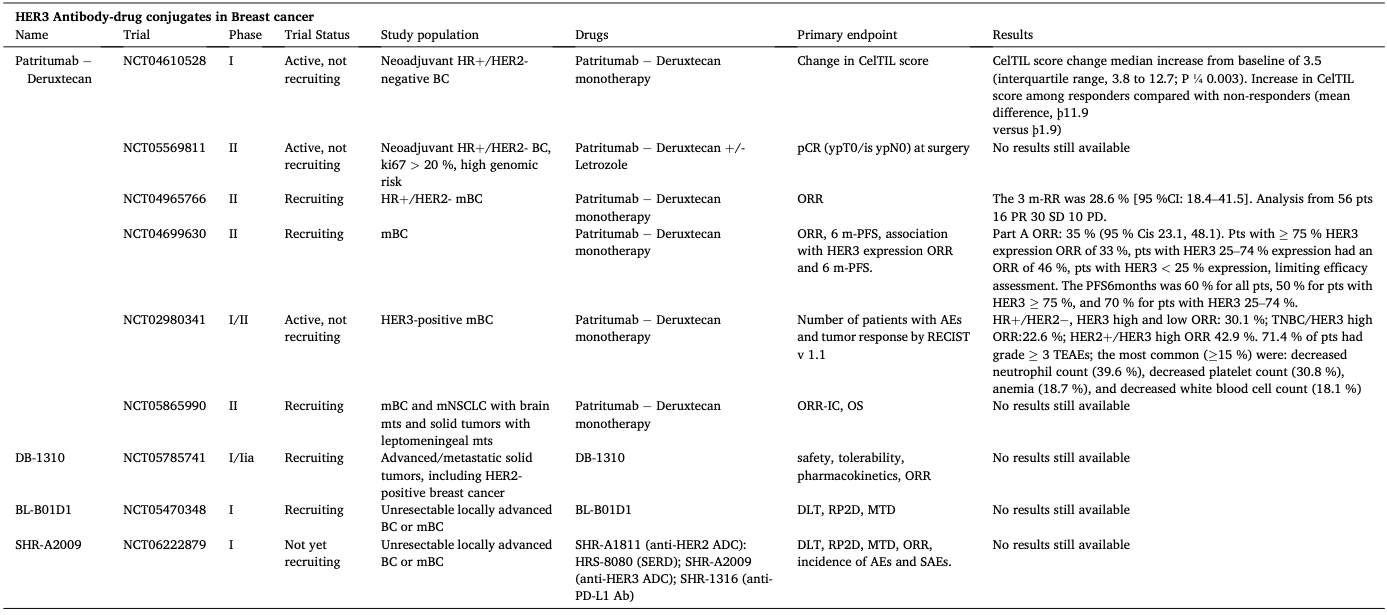
表2. 抗HER3-ADC在乳腺癌中的临床开发
曙光初现:HER3靶向治疗未来方向和前景
HER3靶向治疗在乳腺癌治疗中的潜力正逐渐被认可。随着对HER3在乳腺癌发展和治疗抗性中作用的深入了解,以及新型治疗策略的不断涌现,有理由相信,HER3将成为乳腺癌治疗中一个重要的靶点。
尽管目前还没有针对HER3的治疗被批准用于乳腺癌的临床治疗,但如HER3-DXd这样的新兴药物已经展现出希望的曙光。随着免疫调节技术的不断发展,未来的治疗方法可能会使HER3的检测在乳腺癌的诊断和治疗过程中变得不可或缺,从而影响治疗策略的制定。随着临床试验的深入和新药的不断开发,我们期待HER3靶向治疗能为乳腺癌患者带来更有效的治疗选择。
[1] Papa F, Grinda T, Rassy E, Cheickh-Hussin R, Ribeiro J, Antonuzzo L, Pistilli B. Long road towards effective HER3 targeting in breast cancer. Cancer Treat Rev. 2024 Jun 13;129:102786.
[2] Uliano J, Corvaja C, Curigliano G, Tarantino P. Targeting HER3 for cancer treatment: a new horizon for an old target. ESMO Open. 2023 Feb;8(1):100790.
[3] Majumder A. HER3: Toward the Prognostic Significance, Therapeutic Potential, Current Challenges, and Future Therapeutics in Different Types of Cancer. Cells. 2023 Oct 25;12(21):2517.
[4] Schneeweiss, A, Park-Simon, TW, Albanell, J. et al. Phase Ib study evaluating safety and clinical activity of the anti-HER3 antibody lumretuzumab combined with the anti-HER2 antibody pertuzumab and paclitaxel in HER3-positive, HER2-low metastatic breast cancer. Invest New Drugs 36, 848–859 (2018).
[5] Finn G, et al. Abstract A14: A randomized trial of exemestane +/- seribantumab (MM-121) in postmenopausal women with locally advanced or metastatic ER/PR+ HER2- breast cancer: Final analysis and extended subgroup analysis. Clin Cancer Res 2017;23:A14–.
[6] Kaufman PA, et al. Abstract OT3-06-01: SHERBOC: A double-blind, placebocontrolled, phase 2 trial of seribantumab (MM-121) plus fulvestrant in postmenopausal women with hormone receptor-positive, heregulin positive, HER2 negative metastatic breast cancer whose disease progressed after prior systemic therapy. Cancer Res 2018;78.
[7] Holmes FA, et al. Abstract P3–11-03: A randomized, phase 2 trial of preoperative MM-121 with paclitaxel in triple negative (TN) and hormone receptor (HR) positive, HER2-negative breast cancer. Cancer Res 2015;vol. 75.
[8] Carrizosa D.R., Burkard M.E., Elamin Y.Y., Desai J., Gadgeel S.M., Lin J.J., Waqar S.N., Spigel D.R., Chae Y.K., Cheema P.K., et al. CRESTONE: Initial efficacy and safety of seribantumab in solid tumors harboring NRG1 fusions. J. Clin. Oncol. 2022;40:3006.
[9] Mukai H, et al. Patritumab plus trastuzumab and paclitaxel in human epidermal growth factor receptor 2-overexpressing metastatic breast cancer. Cancer Sci 2016; vol. 107:1465–70.
[10] Mukai H, et al. Patritumab plus trastuzumab and paclitaxel in human epidermal growth factor receptor 2-overexpressing metastatic breast cancer. Cancer Sci 2016; vol. 107:1465–70.
[11] Alsina M, et al. First-in-human phase 1/2 study of MCLA-128, a full length IgG1 bispecific antibody targeting HER2 and HER3: Final phase 1 data and preliminary activity in HER2+ metastatic breast cancer (MBC). J Clin Oncol 2017;vol. 35:2522.
[12] E. P. Hamilton et al., «Clinical activity of MCLA-128 (zenocutuzumab), trastuzumab, and vinorelbine in HER2 amplified metastatic breast cancer (MBC) patients (pts) who had progressed on anti-HER2 ADCs.», Journal of Clinical Oncology, vol. 38, fasc. 15_suppl, pp. 3093–3093, mag. 2020, doi: 10.1200/JCO.2020.38.15_suppl.3093.
[13] Oliveira M, et al. Patritumab deruxtecan in untreated hormone receptor-positive/ HER2-negative early breast cancer: final results from part A of the window-ofopportunity SOLTI TOT-HER3 pre-operative study. Ann Oncol, ago 2023.
[14] M. Oliveira et al., «155TiP A randomised phase II trial of neoadjuvant multi-agent chemotherapy (CHT) OR patritumab deruxtecan (HER3-DXd; U3-1402) +/- endocrine therapy (ET) for high-risk hormone receptor-positive (HR+/HER2-) early breast cancer (EBC): SOLTI-2103 VALENTINE trial», ESMO Open, vol. 8, fasc. 1, p. 101494, mag. 2023, doi: 10.1016/j.esmoop.2023.101494.
[15] I. E. Krop et al., «Results from the phase 1/2 study of patritumab deruxtecan, a HER3-directed antibody-drug conjugate (ADC), in patients with HER3-expressing metastatic breast cancer (MBC).», Journal of Clinical Oncology, vol. 40, fasc. 16_ suppl, pp. 1002–1002, giu. 2022, doi: 10.1200/JCO.2022.40.16_suppl.1002.
[16] I. E. Krop et al., «Patritumab Deruxtecan (HER3-DXd), a Human Epidermal Growth Factor Receptor 3–Directed Antibody-Drug Conjugate, in Patients With Previously Treated Human Epidermal Growth Factor Receptor 3–Expressing Metastatic Breast Cancer: A Multicenter, Phase I/II Trial», JCO, p. JCO.23.00882, ott. 2023, doi: 10.1200/JCO.23.00882.
[17] B. Pistilli et al., «189O A phase II study of patritumab deruxtecan (HER3-DXd), in patients (pts) with advanced breast cancer (ABC), with biomarker analysis to characterize response to therapy (ICARUS-BREAST01)», ESMO Open, vol. 8, fasc. 1, p. 101378, mag. 2023, doi: 10.1016/j.esmoop.2023.101378.
[18] Zhang L, et al. 1316MO BL-B01D1, a first-in-class EGFRxHER3 bispecific antibodydrug conjugate, in patients with non-small cell lung cancer: Updated results from first-in-human phase I study. Ann Oncol 2023;34:S758.
排版编辑:肿瘤资讯-Annie











 苏公网安备32059002004080号
苏公网安备32059002004080号


