乳腺癌作为全球女性最常见的致命癌症之一,其治疗和研究进展备受医学界和公众关注。HER2阳性(HER2+)乳腺癌因其较高的侵袭性和较差的预后而成为研究的焦点。尽管抗HER2治疗药物的应用显著提高了HER2+乳腺癌患者的生存率,但原发性和获得性耐药性问题仍是临床治疗中的重大挑战。近年来,微小RNA(miRNA)作为调控基因表达的关键因子,其在HER2靶向治疗反应中的作用逐渐受到重视。本系统综述聚焦于miRNAs在HER2+ BC治疗反应中的作用,旨在揭示miRNAs作为治疗反应预测标志物的潜力[1]。【肿瘤资讯】特对主要内容予以整理,以飨读者。

研究背景
乳腺癌的发病率和死亡率在全球范围内一直居高不下,尤其是在女性恶性肿瘤中占据首位。HER2的过表达会通过激活磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)和Ras/Raf/丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERKs)等途径促进细胞生长和分化[2],HER2的扩增是乳腺癌预后不良的重要指标[3]。自1998年FDA批准曲妥珠单抗(Trastuzumab)以来,HER2靶向治疗药物的种类不断增加,包括帕妥珠单抗(Pertuzumab)、T-DM1(Trastuzumab emtansine)等,这些药物在提高治疗效果方面发挥了重要作用。然而,随之而来的耐药性问题也日益凸显。HER2+乳腺癌的治疗耐药机制复杂,涉及多种分子和信号通路的变化。
为了克服耐药性,研究人员开始探索新的治疗策略。miRNA是一类长度约为20-25个核苷酸的单链非编码RNA,它们在肿瘤发生、转移和治疗反应中的基因表达调控中扮演着重要角色[4]。研究表明,在HER2阳性乳腺癌中,特定的miRNAs表达变化与耐药性的形成和治疗反应密切相关[5],这为临床治疗提供有价值的生物标志物,从而指导治疗策略的制定和优化提供了可能。
筛选方法
本研究遵循PRISMA指南,截至2023年5月,通过检索Cochrane Library、PubMed、EMBASE和Scopus等数据库,纳入标准为HER2+乳腺癌靶向药物反应的miRNA生物标志物。通过两位评审者独立筛选和评估标题和摘要,排除不符合条件或重复的文献,并由第三位评审者解决分歧,最终纳入23项研究进行分析。
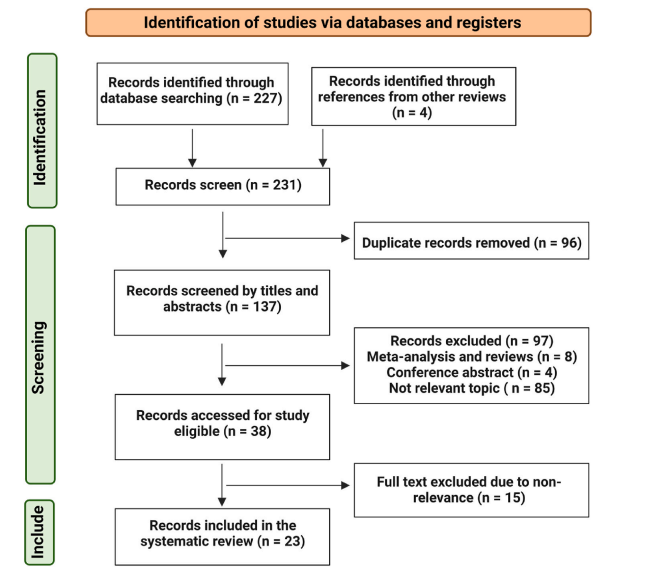 图1.PRISMA流程图展示文献搜索策略
图1.PRISMA流程图展示文献搜索策略
HER2靶向治疗药物的分类与作用机制
HER2靶向治疗药物通过多种机制发挥作用,主要包括单克隆抗体、抗体药物偶联物(ADC)和酪氨酸激酶抑制剂(TKIs)如图2所示。靶向机制包括抑制HER2的裂解、阻断PI3K/AKT信号通路、激活p27kip1诱导细胞周期停滞,以及通过抗体依赖性细胞介导的细胞毒性(ADCC)机制招募免疫细胞至肿瘤部位。帕妥珠单抗则通过结合HER2的另一个位点来阻止HER2的二聚化,从而增强曲妥珠单抗的效果。ADC如T-DM1,将化疗药物与抗HER2抗体结合,利用抗体将药物直接送至癌细胞。TKI如拉帕替尼(Lapatinib)和奈拉替尼(Neratinib),通过抑制HER家族受体的磷酸化,阻断MAPK/AKT信号传导,从而抑制肿瘤细胞的增殖和存活。
 图2. HER治疗的作用机制:HER2受体与其他HER受体的二聚化激活了调节增殖、存活、侵袭和血管生成的下游信号通路
图2. HER治疗的作用机制:HER2受体与其他HER受体的二聚化激活了调节增殖、存活、侵袭和血管生成的下游信号通路
miRNA介导的HER2治疗耐药机制
PI3K/AKT/mTOR信号通路
PI3K/AKT/mTOR信号通路在调节细胞周期中起着重要作用,与癌症的直接关系通过细胞生长、增殖、凋亡或血管生成等多种活动调节。该通路的突变或信号失调导致对HER2治疗的获得性耐药。例如,miR-221通过调节PTEN和PDCD4促进曲妥珠单抗耐药性[6-7]。miR-542-3p的下调通过激活PI3K/AKT通路促进耐药性[8]。miR-141的下调通过ERBB4过表达导致耐药性[9]。miR-375通过IGF1R和PI3K/AKT途径调节耐药性[10]。
其他机制
癌症干细胞(CSCs)作为肿瘤内的一部分细胞,能够逃避抗癌治疗。miRNAs在调节乳腺癌干细胞(BCSC)中的作用及其与耐药性的关系已被多项研究所探讨。例如,miR-205-5p通过调节ERBB2和EGFR影响BCSC[11]。miR-200c的下调通过直接靶向ZEB1和ZNF217激活TGF-β信号,导致耐药性[12]。miR-16通过调节CCNJ和FUBP1影响曲妥珠单抗和拉帕替尼的效果[13]。
miRNAs调节HER2+乳腺癌治疗敏感性
除了作为HER2治疗耐药性的标志物外,miRNAs还在调节HER2靶向治疗的敏感性中发挥作用。例如,miR-210的水平与HER2+乳腺癌患者对曲妥珠单抗的敏感性直接相关[14]。miR-135b-5p通过下调cyclin D2增强曲妥珠单抗的抗增殖和抗侵袭效果[15]。miR-129-5p通过调节rpS6影响曲妥珠单抗的敏感性[16]。miR-7通过抑制EGFR表达和HER2δ16活性,使HER2δ16表达细胞对曲妥珠单抗敏感[17]。
挑战与未来展望
尽管HER2+乳腺癌在所有乳腺癌病例中占有重要比例,但预测HER2靶向治疗反应的生物标志物仍然有限。样本选择和处理程序的标准化,以及生物信息学技术、机器学习和先进工具的快速发展,将有助于数据分析和功能下游分析的改进。未来的研究将更深入地探讨miRNAs在HER2治疗耐药性和敏感性中的作用,以及它们在为HER2+乳腺癌患者选择适当治疗方法或增强现有HER2靶向药物敏感性方面的潜力。
1. Vo T.H., Abdelaal E.E.-S., Jordan E., et al. "miRNAs as biomarkers of therapeutic response to HER2-targeted treatment in breast cancer: A systematic review." Biochemistry and Biophysics Reports. 2024;37:101588.
2. Arteaga C.L., Sliwkowski M.X., Osborne C.K., Perez E.A., Puglisi F., Gianni L. "Treatment of HER2-positive breast cancer: current status and future perspectives." Nat. Rev. Clin. Oncol. 9 (1) (2011) 16–32.
3. Slamon D.J., Clark G.M., Wong S.G., Levin W.J., Ullrich A., McGuire W.L. "Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene." Science 235 (4785) (1987) 177–182.
4. Bartel D.P. "Metazoan MicroRNAs." Cell 173 (1) (2018) 20–51.
5. Hu W., Tan C., He Y., Zhang G., Xu Y., Tang J. "Functional miRNAs in breast cancer drug resistance." OncoTargets Ther. 11 (2018) 1529–1541.
6. Ye X., Bai W., Zhu H., Zhang X., Chen Y., Wang L., et al. "MiR-221 promotes trastuzumab-resistance and metastasis in HER2-positive breast cancers by targeting PTEN." BMB Rep 47 (5) (2014) 268–273.
7. De Mattos-Arruda L., Bottai G., Nuciforo P.G., Di Tommaso L., Giovannetti E., Peg V., et al. "MicroRNA-21 links epithelial-to-mesenchymal transition and inflammatory signals to confer resistance to neoadjuvant trastuzumab and chemotherapy in HER2-positive breast cancer patients." Oncotarget 6 (35) (2015) 37269–37280.
8. Ma T., Yang L., Zhang J. "MiRNA-542-3p downregulation promotes trastuzumab resistance in breast cancer cells via AKT activation." Oncol. Rep. 33 (3) (2015) 1215–1220.
9. Han G., Qiu N., Luo K., Liang H., Li H. "Downregulation of miroRNA-141 mediates acquired resistance to trastuzumab and is associated with poor outcome in breast cancer by upregulating the expression of ERBB4." J. Cell. Biochem. 120 (7) (2019) 11390–11400.
10. Ye X.M., Zhu H.Y., Bai W.D., Wang T., Wang L., Chen Y., et al. "Epigenetic silencing of miR-375 induces trastuzumab resistance in HER2-positive breast cancer by targeting IGF1R." BMC Cancer 14 (2014) 134.
11. De Cola A., Volpe S., Budani M.C., Ferracin M., Lattanzio R., Turdo A., et al. "miR-205-5p-mediated downregulation of ErbB/HER receptors in breast cancer stem cells results in targeted therapy resistance." Cell Death Dis. 6 (7) (2015), e1823.
12. Bai W.D., Ye X.M., Zhang M.Y., Zhu H.Y., Xi W.J., Huang X., et al. "MiR-200c suppresses TGF-β signaling and counteracts trastuzumab resistance and metastasis by targeting ZNF217 and ZEB1 in breast cancer." Int. J. Cancer 135 (6) (2014) 1356–1368.
13. Venturutti L., Cordo Russo R.I., Rivas M.A., Mercogliano M.F., Izzo F., Oakley R. H., et al. "MiR-16 mediates trastuzumab and lapatinib response in ErbB-2- positive breast and gastric cancer via its novel targets CCNJ and FUBP1." Oncogene 35 (48) (2016) 6189–6202.
14. Jung E.J., Santarpia L., Kim J.-Y., Esteva F.J., Moretti E., Buzdar A.U., et al. "Plasma microRNA 210 levels correlate with sensitivity to trastuzumab and tumor presence in breast cancer patients." Cancer 118 (2012).
15. Li Z., Qin Y., Chen P., Luo Q., Shi H., Jiang X. "miR-135b-5p enhances the sensitivity of HER-2 positive breast cancer to trastuzumab via binding to cyclin D2." Int. J. Mol. Med. 46 (4) (2020) 1514–1524.
16. Lu X., Ma J., Chu J., Shao Q., Zhang Y., Lu G., et al. "MiR-129-5p sensitizes the response of her-2 positive breast cancer to trastuzumab by reducing Rps6." Cell. Physiol. Biochem. 44 (6) (2017) 2346–2356.
17. Huynh F.C., Jones F.E. "MicroRNA-7 inhibits multiple oncogenic pathways to suppress HER2Δ16 mediated breast tumorigenesis and reverse trastuzumab resistance." PLoS One 9 (12) (2014), e114419.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编号:CN-135997
Expiration Date: 2025-5-24
排版编辑:肿瘤资讯-Wendy











 苏公网安备32059002004080号
苏公网安备32059002004080号


