胆管癌(CCA)预后不良,目前尚缺乏可预测治疗反应和预后的生物标志物。有研究显示三级淋巴结构(TLS)可反映肿瘤免疫微环境特征。一项 2023 年发表在 Frontiers in Immunology 上的研究探索了CCA 中 TLS 的临床价值,提示 TLS 丰度和空间分布与预后及免疫检查点抑制剂(ICI)治疗反应显著相关,有望成为 CCA 新型生物标志物[1]。【肿瘤资讯】整理如下,以飨读者。
研究背景
CCA 是一种胆道系统上皮恶性肿瘤。大多数患者在诊断时处于晚期,放疗和化疗对生存改善有限[2]。多项研究发现肿瘤免疫微环境(IME)在肿瘤进展中具有关键作用,因此 IME 特征有助于开发新型有效个体化治疗方式[3-5]。
CCA 的典型组织病理学特征是淋巴、成纤维细胞和多种免疫细胞等丰富基质包围和浸润肿瘤结构。肿瘤细胞和 IME 细胞的相互作用可导致 CCA 进展和转移。TLS 是肿瘤中的异位聚集淋巴细胞,由包括生发中心的 B 细胞带和周围 T 细胞带构成,包含多种类型的 T 细胞,树突状细胞和高内皮细胞小静脉(HEV)。 TLS 是淋巴细胞分化和抗原提呈的主要部位,可代表 IME 局部炎症浸润状态,因此是抗肿瘤体液和细胞免疫的关键环境。TLS 在多种肿瘤中和更佳预后及免疫治疗反应改善相关。
研究方法
研究包括 2 个队列:CCA 手术队列由 471 例手术切除的 CCA 患者组成;CCA 免疫治疗队列由 100 例接受一线化疗联合 ICI 治疗以防止术后复发的患者组成,所有患者均为 R1 或 R2 切除,接受一线 GC(吉西他滨+顺铂)联合 PD-1 抑制剂信迪利单抗治疗。
下载 GEO 数据集 70 例样本的转录组数据,包括 32 例 CCA 组织,32 例周围肝(SL)组织,6 例正常肝内胆管组织。使用 MCP 计算工具推测每个样本的 IME。TCGA 数据库下载 mRNA 测序、临床信息和肿瘤基因突变分析数据。使用 TCGA CHOL 队列将 TLS 阳性和 TLS 阴性病例进行差异化基因分析。使用患者免疫组化(IHC)结果进行 TLS 定性和定量分析。
研究结果
CCA 的 IME 构成
使用 MCP 工具对 32 例 CCA 和 32 例 SL 组织进行免疫浸润分析,发现 CCA 和 SL 组织的免疫微环境组成具有显著差异(图 1A)。大多数 CCA 组样本富含 B 细胞,T 细胞,单核细胞谱系和细胞毒淋巴细胞,提示 TLS 的存在。
由于多种趋化因子和 TLS 相关,研究 2 组趋化因子表达。结果显示 CCA 组 CCL5,CCL8,CCL18 等趋化因子和 TLS 相关因子显著上调(图 1B)。此外,和正常胆管组织相比,CCA 组的 CCL5,CCL18,CXCL9和 CXCL11 表达升高(图 1C)。结果证实 CCA 组织具有更高的肿瘤浸润免疫细胞聚集和适应 TLS 的免疫微环境。
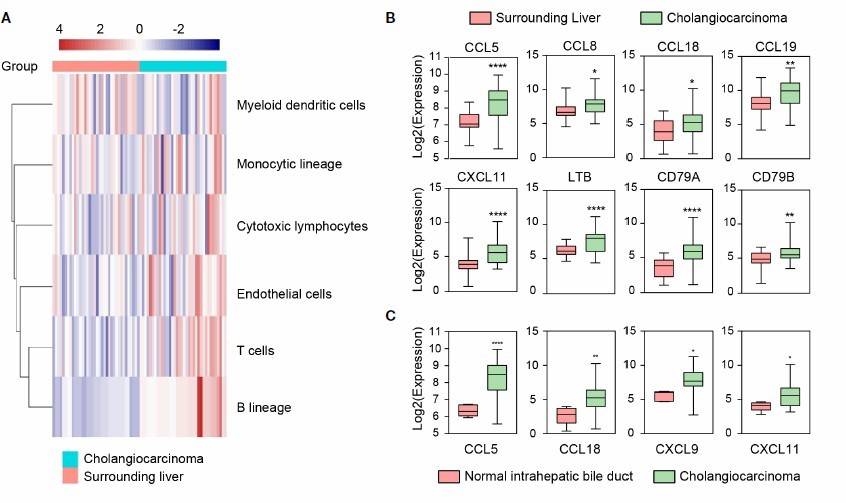
图 1 不同组织的 IME(A)CCA 和 SL 组织 IME 构成;(B,C)TLS 相关因子和趋化因子表达
CCA 中 TLS 具有成熟度差异
H&E 染色和 IHC 显示 TLS 由CD20+B 细胞带和 CD3+T 细胞带簇构成,由 B 细胞组成的滤泡结构是主要 TLS 成分(图 2A)。CCA 患者中, CD23+滤泡树突状细胞(FDCs)和 CD20+B 细胞聚集程度提示 TLS 的存在,CD68+巨噬细胞和 CD56+自然杀伤(NK)细胞散在分布于聚集细胞之间(图 2B)。TLS可见于 CCA 的肿瘤内(T)和肿瘤周围(P)组织(图 2C)。
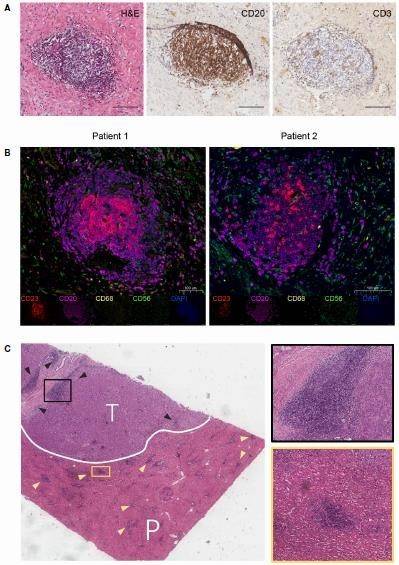 图 2 CCA TLS 特征(A)典型 TLS 染色;(B)TLS 鉴别;(C)T 和 P 区域 H&E 染色
图 2 CCA TLS 特征(A)典型 TLS 染色;(B)TLS 鉴别;(C)T 和 P 区域 H&E 染色
多种实体瘤中,TLS 通过不同成熟阶段进化。淋巴细胞聚集是 TLS 的典型结构。CCA H&E 染色可观察到TLS 的多阶段成熟(早期 TLS,初级 TLS,次级 TLS)(图 3A)。分析免疫细胞类型,显示 CD20+B 细 胞,CD3+T 细胞和 MECA-79+HEV 分布于 CCA 的初级和次级 TLS(图 3B,C)。次级 TLS 中可见 CD21+CD23+FDCs 网络中以B 细胞为中心的滤泡结构,多种 T 细胞成簇分布于滤泡周围。而没有CD23+滤泡结构的 TLS 中 T 细胞散在,因此被分类为初级 TLS。
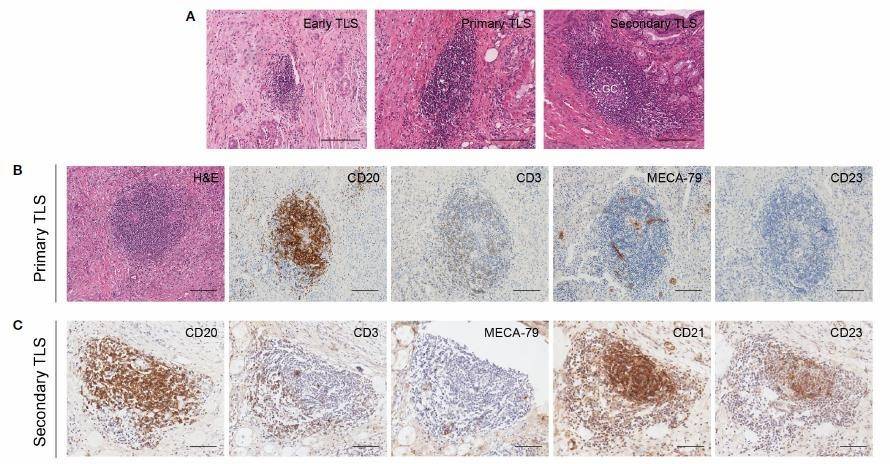
图 3 CCA TLS 不同成熟度及相应特征(A)TLS 不同成熟度;(B)初级 TLS;(C)次级 TLS
CCA 的潜在 TLS 标志物
使用 TCGA 胆管癌队列的 H&E 染色组织切片定量 TLS(图 4A)。将样本分为 2 组(TLS 阴性组和 TLS 阳性组),发现不同 TLS 状态组的基因突变差异富集无显著差异(图 4B),表明基因突变可能不是影响 TLS存在的主要因素。
分析 TCGA 数据库中 TLS 阳性和 TLS 阴性 CCA 病例的差异基因表达特征,显示 TLS 阳性组具有更高的 B 细胞和 T 细胞免疫相关基因表达。PAX5,TCL1A,TNFRSF13C 和 CD79A 4 个基因表达在 TLS 阳性组显著升高(图 4C)。进一步评估这 4 个基因作为 TLS 特征的能力,发现其在 TLS 区域均为强染色,作为 TLS 特征具有广阔应用前景(图 4D,E)。
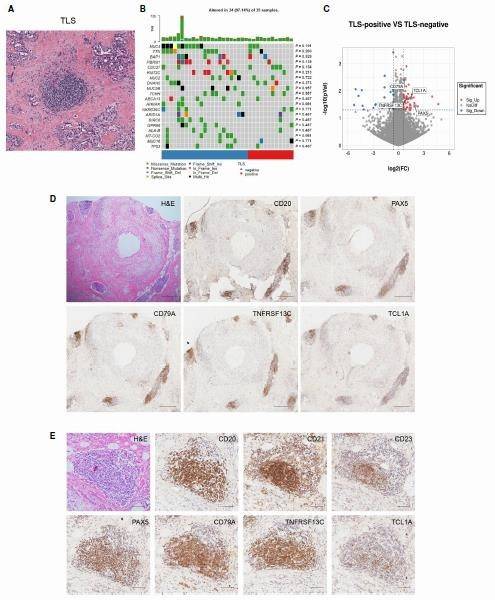
图 4 发现和验证 TLS 鉴别 4 基因特征(A)TLS H&E 染色;(B)TLS 和基因突变的相关性;(C)TLS 阳性和阴性病例的差异基因表达;(D,E)4 基因染色
不同区域 TLS 预测CCA 不同预后
在 CCA 手术队列中探索 TLS 和临床特征之间的相关性。使用 TLS 评分系统分析队列 TLS 特征。分析每个病例肿瘤内区域(T 评分)和肿瘤周围区域(P 评分)的 TLS 评分。将 T 评分和 P 评分均分为 4 类。CCA 组织中 438/471 例(93.0%)具有 TLS。471 例 CCA 病例可分为 4 组:ThighPhigh 组(1 组,31/471, 6.6%),ThighPlow 组(2 组,79/471,16.8%),TlowPhigh 组(3 组,152/471,32.3%),TlowPlow 组(4组,209/471,44.4%)。
相关性分析显示高 T 评分肿瘤直径小于低 T 评分肿瘤(p=0.010)。高低 T 评分组的肿瘤转移和病理分化级别无显著差异。高 P 评分患者较低 P 评分患者具有更高的卫星灶(p=0.048)和淋巴转移(p=0.040)发生率。更高的 P 评分和脂肪肝呈正相关(p=0.022)。因此,T 评分和肿瘤较小相关,P评分和卫星灶、淋巴转移和脂肪肝相关。这表明肿瘤内和肿瘤周围 TLS 具有本质上的差异。
之后探索 TLS 评分是否影响 CCA 患者生存,发现较高的 P 评分和较差的无进展生存期(PFS, p=0.001)和总生存(OS,p=0.003)相关,高 P 评分组的中位 PFS 5 个月,中位 OS 14 个月;而低 P 评分组的中位 PFS 6 个月,中位 OS 22 个月(图 5A,B)。相反,更高的 T 评分和 PFS(p=0.038)和 OS(p=0.002)改善相关,高 T 评分组的中位 PFS 7.567 个月,中位 OS 29 个月,而低 T 评分组中位PFS 5 个月,中位 OS 17 个月(图 5C,D)。这些数据表明不同区域的 TLS 丰度差异可预测 CCA 患者的不同预后。
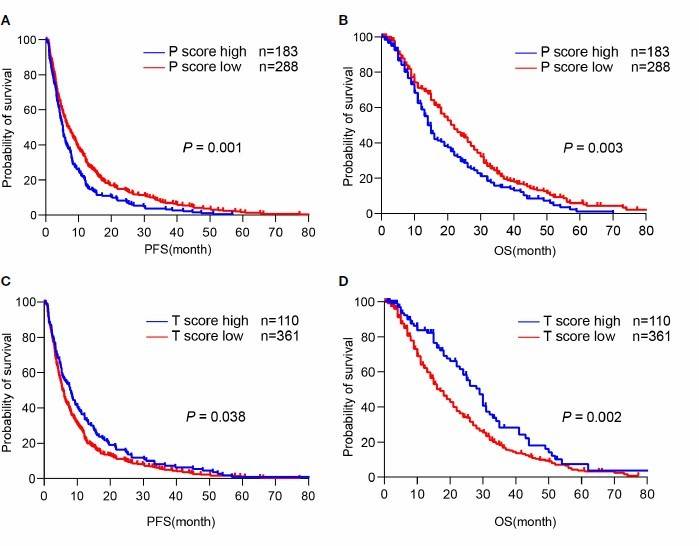
图 5 不同区域 TLS 预测 CCA 不同预后(A,B)根据 P 评分的 PFS 和 OS;(C,D)根据 T 评分的 PFS和 OS
高T 评分和 ICI 治疗的更佳预后相关
在 CCA 免疫治疗队列中探索 TLS 是否可预测 ICI 反应,发现和低 P 评分患者相比,高 P 评分患者具有相对较短的 PFS(p=0.042)和 OS(p=0.003),患者中位 PFS 5 个月,中位 OS 7 个月(图 6A,B)。但是高 T 评分组较低 T 评分组具有显著延长的 PFS(p=0.021)和 OS(p=0.010),中位 PFS 14 个,中位 OS 23 个月(图 6C,D)。4 个基因表达的 TLS 特征和患者生存不相关,肿瘤细胞 PD-L1 表达和 TLS 的空间分布及丰度也不相关。总之,数据表明治疗前肿瘤组织高 T 评分可预测免疫治疗更佳预后,肿瘤内TLS 的存在和 OS 及 PFS 延长相关。
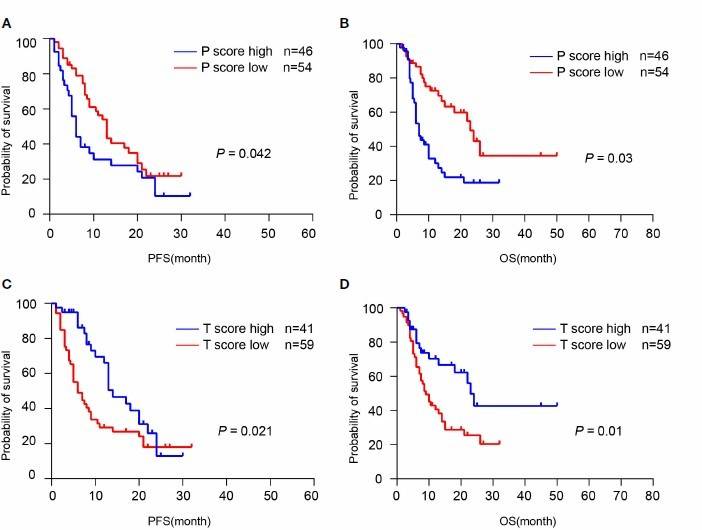
图 6 TLS 和 ICI 反应相关(A,B)根据 P 评分的 PFS 和 OS;(C,D)根据 T 评分的 PFS 和 OS
讨论
现有证据显示 IME 在 CCA 进展和转移中具有重要作用。研究发现 CCA 中存在高水平的免疫细胞浸润, 伴趋化因子的显著上调。发现不同成熟度的 TLS 存在于 CCA 中,包括不成熟 TLS,初级 TLS 和次级TLS。抗原提呈和 B 细胞成熟可能发生于 CCA 的成熟 TLS 中,导致原位免疫反应。近来多项研究报道TLS 参与抗肿瘤免疫反应。
28.9%病例含有明显的淋巴细胞聚集簇,部分含有生发中心,定义为“TLS 阳性”标本。通过分析 TLS 阴性和阳性组的差异基因表达特征,发现 TNFRSF13C,PAX5,CD79A 和 TCL1A 是鉴别 TLS 的潜在分子。其中 TNFRSF13C 和 PAX5 和 B 细胞谱系相关,PAX5 参与 CCA 进展,CD79A 是活化 B 细胞的标志物,TCL1A 是癌基因。这些分子在 TLS 区域中具有强染色,证实其作为 CCA TLS 特征的可行性。
研究提示 CCA 中基于空间定位和密度的 TLS 具有预后作用。肿瘤内 TLS 是良好预后的强力预测因子,而肿瘤周围 TLS 和 CCA 更差预后相关。这一 TLS 差异也见于肝细胞癌和乳腺癌,但是潜在机制还不清楚。研究确认肿瘤内 TLS 和抗 PD-1 抑制剂的更佳疗效相关,而肿瘤周围更高的 TLS 丰度和低免疫反应及不良预后相关。CCA 不同区域 TLS 不同的成熟和功能可能是导致这一差异的原因。
总结
总之,研究发现了 4 个基因可作为 TLS 鉴别的实用生物标志物,证实了 TLS 的空间分布和丰度极大影响CCA 的预后和免疫治疗反应,为 TLS 功能和临床干预应用提供了新视角。
[1] Shang TY, Jiang TY, Lu T, et al. Tertiary lymphoid structures predict the prognosis and immunotherapy response of cholangiocarcinoma. Frontiers in Immunology.2023;14:1166497.
[2] Valle J, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med.2010;362(14):1273-81.
[3] Lin J, Dai Y, Sang C, et al. Multimodule characterization of immune subgroups in intrahepatic cholangiocarcinoma reveals distinct therapeutic vulnerabilities. J Immunother
Cancer.2022;10(7):e004892.
[4] Job S, Rapoud D, Dos Santos A, et al. Identification of four immune subtypes characterized by distinct composition and functions of tumor microenvironment in intrahepatic
cholangiocarcinoma. Hepatology.2020;72(3):965-81.
[5] Xue R, Chen L, Zhang C, et al. Genomic and transcriptomic profiling of combined
hepatocellular and intrahepatic cholangiocarcinoma reveals distinct molecular subtypes. Cancer Cell.2019;35(6):932-47.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-139188
有效期至:2025/7/16
排版编辑:肿瘤资讯-REX











 苏公网安备32059002004080号
苏公网安备32059002004080号


