晚期 BTC 侵袭性强,中位生存时间不到 12 个月。全身化疗选择仍然有限,并在过去二十几年中几乎没有有意义的进展。Devimistat(CPI-613)可选择性靶向肿瘤细胞中的线粒体三羧酸(TCA)循环,从而选择性地作用于癌细胞。以往 Devimistat 治疗转移性胰腺癌有令人鼓舞的结果,那么 Devimistat 用于晚期胆道癌的结果如何呢?一项 2023 年发表在 Clin Cancer Res 杂志上的研究表明,devimistat 2000mg/m2 与吉西他滨和顺铂联合用药 2 小时耐受性良好[1]。【肿瘤资讯】整理如下,以飨读者。
研究背景
胆道癌(BTC)包括肝内和肝外(肝门周围和远端)胆管癌和胆囊癌。晚期 BTC 是一种侵袭性恶性肿瘤, 中位生存时间不到 12 个月。尽管接受治疗,五年生存率仍低于 5%[2,3]。全身化疗选择仍然有限,在过去二十几年中几乎没有取得任何有意义的进展。在 ABC-023 研究中,410 例局部晚期或转移性 BTC 患者被随机分配接受吉西他滨+/−顺铂治疗组,结果显示联合组的客观缓解率(ORR)为 26.1%,改善了 OS(11.7 个月 vs. 8.1 个月,HR 0.64;P<0.001)[2,3]。
Devimistat(CPI-613®)是硫辛酸的正常瞬时酰化催化中间体的稳定类似物,硫辛酸是线粒体酶的重要辅助因子,包括丙酮酸脱氢酶(PDH)、α-酮戊⼆酸脱氢酶(KGDH)。这些酶都是三羧酸循环的核心。硫辛酸中间体及通过这些酶的通量由调节系统监测,这些调节系统在癌症中被显著改变,使得这些肿瘤内的酶更容易收到 Devimistat 的影响。Devimistat 选择性灭活 PDH 和 KGDH,阻断葡萄糖和谷氨酰胺衍生碳进入 TCA 循环。PDH 和 KGDH 的失活会破坏肿瘤细胞中的线粒体代谢,并导致细胞凋亡和坏死性细胞死亡途径的过度激活[4,5]。
基于 devimistat 联合改良 FOLFIRINOX 治疗转移性胰腺癌的Ⅰ期临床试验令人鼓舞的结果[6],以及胰腺癌与 BTC 的临床相似性,我们研究了 devimistat 联合吉西他滨和顺铂(GC)在 BTC 中的作用。
在此,我们报告了 devimistat 联合吉西他滨和顺铂治疗晚期 BTC 的 1b 期临床试验的体外研究和结果。
研究方法
细胞培养
在 RPMI140 培养基中培养 TFK-1、RCB1292 和 RCB1293 人 BTC 细胞系。
细胞活力测定
细胞(n=3000)在 96 孔板上每孔播种,允许粘附过夜,然后用 devimistat,吉西他滨和顺铂处理。3d后用结晶紫法测定细胞活力。
临床研究设计
该临床试验设计为单臂、开放标签、多中心、Ⅰb 期剂量递增研究,纳入先前未接受治疗的晚期 BTC 患者, 以评估安全性,并确定 devimistat 的推荐Ⅱ期剂量(RP2D)。Ⅰb 期的主要终点是存在或不存在剂量限制性毒性。次要终点包括安全性和耐受性、ORR、无进展生存期(PFS)和 OS。
用药方案为 devimistat(剂量水平 500、1000、1500 和 2000 mg/m2)输注超过 2 小时,联合吉西他滨1000 mg/m2 和顺铂 25 mg/m2,在 21 天治疗周期的第 1 天和第 8 天静脉输注。
研究结果
体外研究-药物协同作用和输注持续时间
我们使用了 TFK-1(肝外;RRID:CVCL_2214)和 RCB1292(肝内;RBE,RRID:CVCL_4896)和 RCB1293(肝内;RRID:CVCL_4902)人 BTC 细胞系进行实验。我们用吉西他滨和顺铂、单用 devimistat 或联合处理细胞,然后检查细胞活力并计算协同作用评分。使用 SynergyFinderPlus11 结果显示,devimistat、吉西他滨和顺铂的联合使用对 RCB1292 和 RCB1293 具有协同作用(协同得分分别为 11.24 和 10.85), 对 TFK-1 具有相加作用(协同得分 5.47;图 1A)。
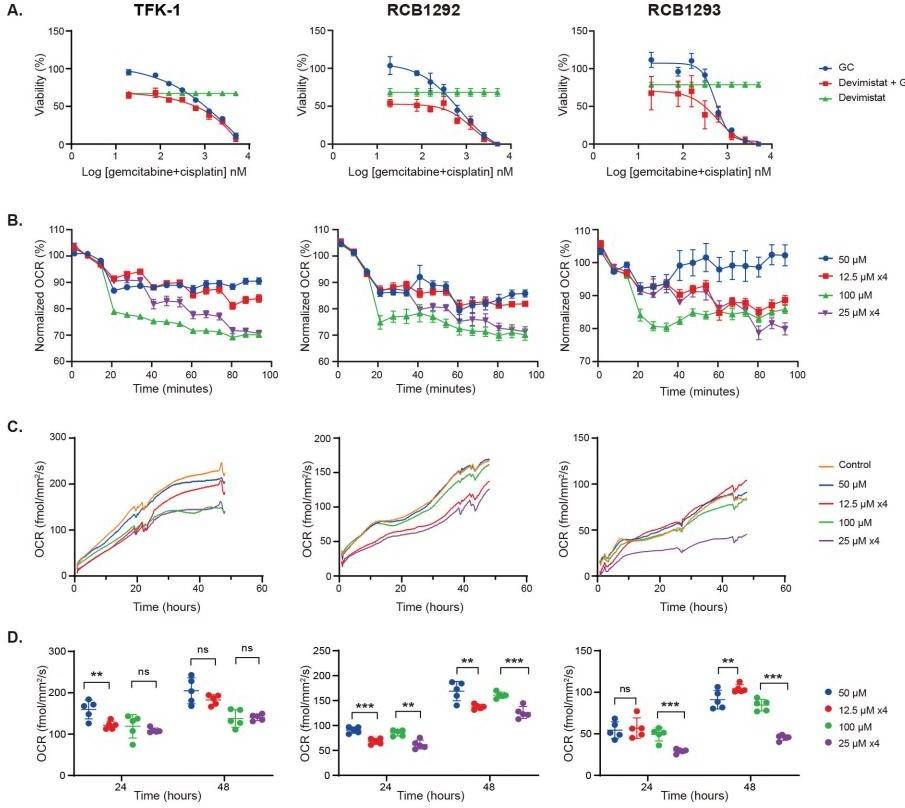
图 1 devimistat 联合化疗的协同作用以及对胆道细胞系线粒体呼吸的作用
Ⅰ期试验
在 devimistat 剂量水平为 500mg/m2 (n=1)、1000mg/m2 (n=1)或 1500mg/m2 (n=2)时, 未观察到 DLT。在 2000mg/m2 (n=16)时,1 例 DLT 伴有 2 级肾功能不全(基线时肌酐为 0.91mg/dL, 第 1 周期第 8 天肌酐为 2.26 mg/dL)。根据 TiTE 连续重新评估方法估计的毒性后验概率,确定 RP2D 为devimistat 2000mg /m2、吉西他滨 1000mg/m2 和顺铂 25mg /m2;
该研究Ⅰb 期部分的患者接受了中位 9 个治疗周期(范围 3-19)。所有 20 名受试者的治疗相关不良事件列于表 1 中。没有 4 级毒性。最常见的 3 级血液学毒性包括中性粒细胞减少症(n=11.55%)和贫血(n=4.20%)。3 级非血液学毒性包括感染(n=3,15%)和发热性中性粒细胞减少(n=2,10%)。15 例(75%)患者需要减少剂量,4 例(20%)患者需要使用白细胞生长因子。只有一名患者因毒性而停止了研究治疗(第 1 周期的 DLT)。
在 20 例接受Ⅰb 期治疗的患者中,现场放射科医生测量的 ORR 为 45%,包括 1 例完全缓解患者和 8 例部分缓解患者(40%)(图 2)。中位 PFS 估计为 10 个月(95%Cl,7.1-14.9),其中 2 例患者仍在接受治疗。14 例(70%)患者仍然存活,中位 OS 尚无法估计。采用反向审查法,中位随访时间 15.6 个月。
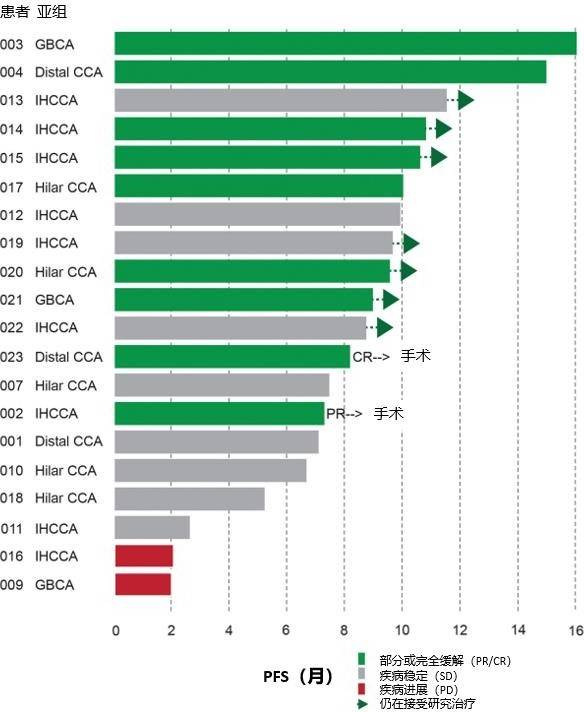 图 2 Ⅰ期试验患者治疗的 Swimmer’s 图
图 2 Ⅰ期试验患者治疗的 Swimmer’s 图
讨论
这项 devimistat 联合吉西他滨和顺铂治疗先前未经治疗的晚期 BTC 患者的Ⅰb 期研究成功确定了 RP2D,并证明了良好的安全性。
治疗相关不良事件的类型和频率与 ABC-02 和 TOPAZ-1 试验中接受治疗患者报告的类似,并且未观察到意外毒性。ORR、PFS 和 OS 看起来很有希望;然而,由于样本量有限,这些初步疗效指标无法与历史数据进行比较。最终疗效数据将需要在本研究的随机Ⅱ期部分进行评估。此外,如果随机部分显示添加devimistat 后有显著改善,devimistat 联合吉西他滨、顺铂、度伐利尤单抗将为 BTC 一线治疗带来新进展。
结论
本研究发现,devimistat 在体外靶向 BTC 的线粒体代谢。本研究报告的Ⅰb 期结果表明,devimistat 2000mg/m2 与吉西他滨和顺铂联合用药 2 小时耐受性良好,具有可接受的安全性,且初始疗效有希望。
1.Mohan A, Griffith KA, Wuchu F, et al. Devimistat in combination with gemcitabine and cisplatin in biliary tract cancer: Pre-clinical evaluation and phase 1b multicenter clinical trial
(BiIT-04). Clin Cancer Res.2023 29(13):2394-2400.
2.Nathan H, Pawlik TM, Wolfgang CL, et al. : Trends in survival after surgery for cholangiocarcinoma: a 30-year population-based SEER database analysis. J Gastrointest Surg 11:1488–96; discussion 1496–7, 2007 [PubMed: 17805937]
3.Valle J, Wasan H, Palmer DH, et al. : Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 362:1273–81, 2010 [PubMed: 20375404]
4.Stuart SD, Schauble A, Gupta S, et al. : A strategically designed small molecule attacks alphaketoglutarate dehydrogenase in tumor cells through a redox process. Cancer Metab 2:4, 2014 [PubMed: 24612826]
5.Zachar Z, Marecek J, Maturo C, et al. : Non-redox-active lipoate derivates disrupt cancer cell mitochondrial metabolism and are potent anticancer agents in vivo. J Mol Med (Berl) 89:1137–48, 2011 [PubMed: 21769686]
6.Reid MA, Bose S, Pladna KM, et al. : Predictive targeting of mitochondrial metabolism in Acute Myeloid Leukemia patients with a lipoic acid analog. medRxiv:2021.06.03.21257935, 2021
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-139339
有效期至:2025/7/15
排版编辑:肿瘤资讯-REX











 苏公网安备32059002004080号
苏公网安备32059002004080号


