目前为止,全身化疗依然是胆道癌(BTC)的主要治疗手段。但是胆道癌对化疗的反应有所不同,而且目前缺乏有效预测化疗疗效的手段,化疗方案的研发受到阻碍[1]。一项发表在 Cell Reports Medicine 上的研究成功构建了胆道癌患者来源的类器官(BTC PDO)库, 并证明了患者来源的类器官(PDO)可以预测胆道癌患者的化疗反应,为将来胆道癌患者的个体化治疗提供依据[1]。【肿瘤资讯】整理如下,以飨读者。
研究背景
胆道癌是人类最致命的恶性肿瘤之一,手术切除联合术后化疗是 BTC 患者目前唯一可能治愈的方法。但是多数 BTC 患者确诊时已处于不可切除阶段,对于这些患者只能进行全身治疗[1-6]。全身化疗仍是目前姑息治疗的主要方案。目前缺乏对于化疗方案的有效预测方法,使治疗方案的开发受阻[7-9]。在这项研究中,我们建立了一个活体 BTC 类器官库,其中包括 61 个人类BTC 类器官培养物,代表每位患者的肿瘤特征。我们分析了成功或失败的类器官培养物组织的分⼦特征。对使⽤药物治疗的患者来源类器官(PDO)进⾏个性化药物筛选。最后,我们确定了 PDO 中 BTC 组织对药物不同敏感性的基因表达特征,并建⽴了基因表达的 panel,为 BTC 患者提供新颖的临床决策⽀持⼯具。
研究结果
建立活体 BTC 类器官生物库
为了建立活的 BTC 类器官生物库,我们从 72 名肿瘤患者中获取了 82 份原发肿瘤和恶性腹水样本。该器官生物库再现并保留了组织学特征及其原始肿瘤细胞的遗传特征。
常规化疗药物筛选建立 BTC PDO
为了探索 BTC 患者来源的肿瘤类器官对不同化疗药物的反应,其中包括七种常用化疗
药物:吉西他滨、顺铂、卡培他滨或 5-氟尿嘧啶(5-FU)、SN-38、丝裂霉素、紫杉醇。我们观察到不同 BTC 患者的类器官对化疗药物的反应不同(图 1A)。BTC PRO 分为三个亚组:耐药(AUC 最高 33%)、敏感(最低 33%AUC)和中等反应(中等 34%AUC)。BTC PDO 的药物敏感性在患者之间有一定的差异。有些 PDO 对吉西他滨、顺铂、5-FU、奥沙利铂具有耐药性,有些对 SN-38、丝裂霉素 C、紫杉醇(图 1C)部分敏感或敏感。因此, BTC PDO 可能是药物筛选的有效工具。
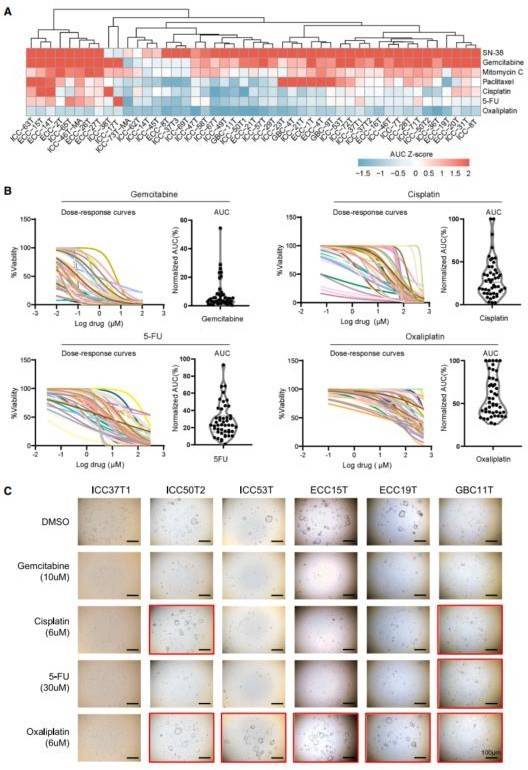 图 1 离体 BTC 类器官的临床相关应答
图 1 离体 BTC 类器官的临床相关应答
(A) 图像包括 47 个 BTC 类器官的化疗敏感性反应,其中包含吉西他滨、顺铂、5-FU、SN-38、奥沙利铂、丝裂霉素 C 和紫杉醇(n=3)。使用 AUC Z 评分评定化疗敏感性。颜色从蓝色(分数低,代表抵抗)到红色(分数高,代表敏感)。
(B) 体外 47 个BTC 类器官的化疗敏感性反应总结,结果以剂量-反应曲线表示(n=3)。
(C) 使用类器官形成实验对化疗药物疗效的影响。红色方块,抵抗;没有方块,无成活细胞。
BTC PDOs 中的药物反应状态在 PDOX 小鼠模型以及在相应的随访患者中得到证实
为了验证 BTC PDO 的药物筛选结果,我们建立了 PDOX 小鼠模型。根据 ICC47T-PDO(图 2B)、ICC46T-PDO(图 S2A)和 ICC62T-PDO(图 S2E)的体外药检结果,我们选择吉西他滨作为敏感药物,奥沙利铂作为耐药药物。通过药物筛选得出了 ICC46T-PDO 和ICC62T-PDO 的类似结论(图 S2A 和图 S2E)。正如预期的那样,我们观察到吉西他滨治疗组的肿瘤生长受到显著抑制,而奥沙利铂治疗组的小鼠在 ICC47T-PDOX(图 2C)、ICC46T-PDOX(图 S2B)和 ICC62T-PDOX 中没有表现出任何反应(图 S2F)。
我们进一步通过实际临床治疗和结果验证了 BTC 患者 PDO 的药物筛选结果(图 3A)。对 13 名接受化疗并在其衍生器官中进行药物筛选的 BTC 患者进行了 4 至 26 个月的随访。 7 名患者术后接受了辅助治疗。在这些患者中,病例 ECC1T、ICC65T 和 ECC27T 是临床敏感应答者,这与 PDO 中的药物反应一致(图 3A)。此外,六名晚期 BTC 患者接受了姑息化疗。四名患者(ECC20T、ICC69T、ICC71T 和 ECC17T)表现出部分缓解或疾病稳定。所有接受姑息化疗的六名患者均与PRO 的药物敏感性测试一致(图 3A)。总体来说,12/13 BTC 患者表现出与其衍生的 PRO 中观察到的药物反应一致。这些结果表明,PDO 是药物筛选和预测 BTC 患者反应的有用工具。
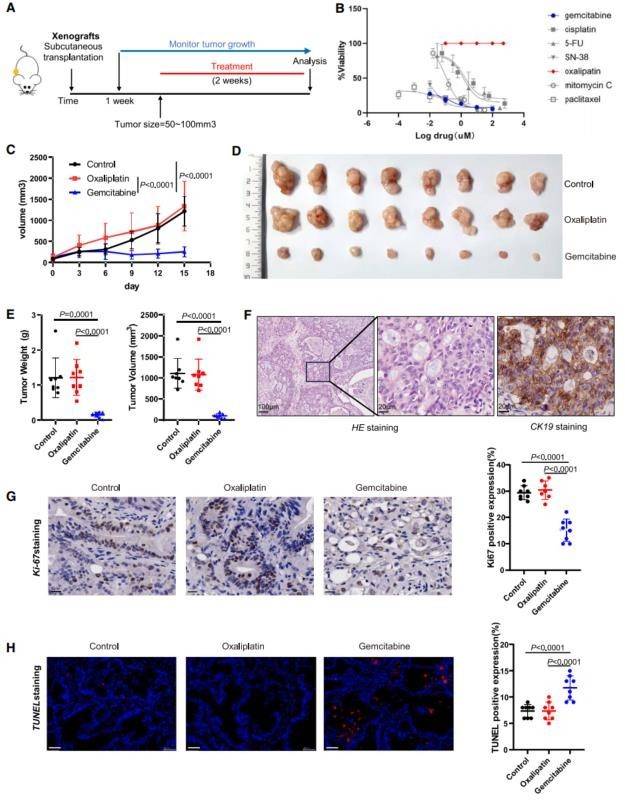
图 2 体内 BTC 类器官对化疗的临床相关应答
(A)实验设计。将 BTC 类器官皮下移植至免疫功能低下的 NCG 小鼠中。当肿瘤增大至 50-100mm3 时,每周用化疗药物或载体治疗两次。
(B)PDO 灵敏度曲线。化疗药物治疗BTC 类器官的剂量-反应曲线,用细胞滴度-glo 细胞活力测定法测量(n=3)。
(C)PDO 皮下异种移植物在NCG 小鼠体内的生长曲线。小鼠接受奥沙利铂、吉西他滨或载体治疗,每周2 次,持续14 天(n=8)。结果显示为肿瘤体积(平均值±SD)。
(D) 在奥沙利铂、吉西他滨或载体治疗 14 天后收获的肿瘤异种移植物的代表性图像(n=8)。
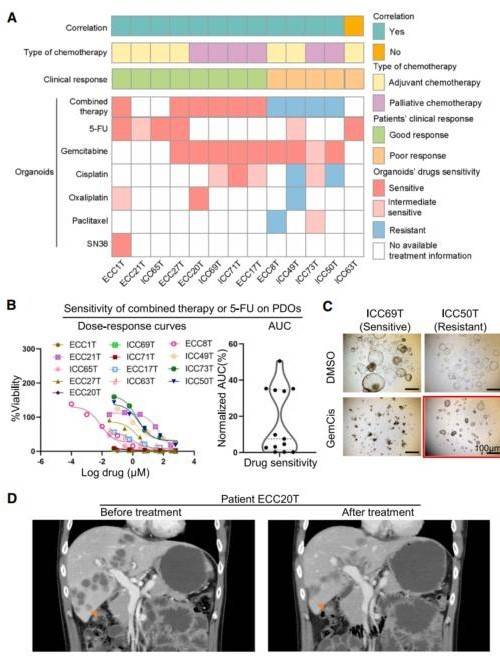
图 3 药物治疗患者与相应肿瘤类器官的药物反应比较
(A) 图像总结了 13 种PDOs 的结果以及相应患者的药物反应。
(B) 以剂量-反应曲线的形式显示了 13 个BTC 类器官对联合化疗或 5-FU 的体外化疗敏感性(每个独立实验 n=3)
(C) 使用器官形成实验对吉西他滨加顺铂治疗可行性的影响。
(D) 吉西他滨联合奥沙利铂治疗前和治疗后 3 个月患者ECC20T 的 CT 扫描。
BTC PDO 的转录特征与化疗反应相关
吉西他滨联合顺铂 (GemCis) 是当前晚期BTC 的标准化疗方案。我们进一步比较不同PDO 的转录特征对顺铂的反应,进一步分为顺铂敏感组、顺铂中等敏感组、顺铂耐药组(图S4A)。数十个基因受影响,例如 DNAJC12、HTR7、IFRD1 和 DLL4(图 S4A)。药物蛋白表达抗性相关基因在 PDO 和肿瘤组织中得到验证(图 S4B 和图 S4C)。敏感生物标志物用于预测肿瘤的化疗反应,例如 CEACAM5 和ZC3H12D 在顺铂敏感组中表达上调(图S4A)。
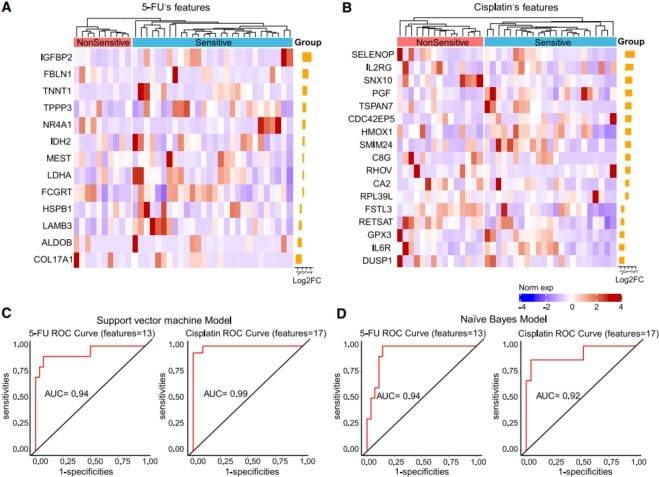 图 4 BTC 类器官药物敏感性的预测模型
图 4 BTC 类器官药物敏感性的预测模型
(A 和 B)图像显示 5-FU(A)和顺铂在敏感组和非敏感组中不同表达基因的药物反应特征。
(C) 基于 5-FU 和顺铂药物敏感性的 SVM 模型 ROC 曲线。
(D) 基于 5-FU 与顺铂药物敏感性的 NB 预测模型 ROC 曲线。
讨论
在本研究中,我们成功生成了 BTC PDO 库并证明PDO 可以预测化疗反应。我们的 BTC 类器官库包含 61 个人类BTC 类器官培养物,代表每位患者的肿瘤特征。类器官的培养成功率为 74.4%。我们评估了BTC PDO 的表型和遗传特征,并证实了类器官与其相应肿瘤组织之间的一致性。我们的结果表明,BTC PDO 与其相应原发肿瘤的亚型表现出相似的组织学特征和蛋白表达。因此,BTC 类器官是适合用于肿瘤研究和体外药物反应评估。
我们进一步探讨了敏感性的潜在机制,通过RNA 测序对BTC 类器官化疗反应进行分析。在对化疗敏感的类器官中,多个基因上调,包括 RUNX328 和CDT1。
总之,我们建立的 PDO 是个性化化疗药物筛选的有效工具。根据 BTC 类器官的药物敏感性建立化疗反应预测基因 panel,帮助个体 BTC 患者选择有效药物。
1.Ren,X.X., Huang M., Weng W.X., et al. Personalized drug screening in
patient-derived organoids of biliary tract cancer and its clinical application.Cell Rep Med.2023;4(11):101277.https://doi.org/10.1016/j.xcrm.2023.101277.
2.Sia, D., Hoshida, Y., Villanueva, A., et al. Integrative molecular analysis of intrahepatic cholangiocarcinoma reveals 2 classes that have different outcomes. Gastroenterology.2013;144:829-840.http://doi.org/10.1053/j.gastro.2013.01.00 1.
3.Valle, J.W., Kelley, R.K., Nervi, B., et al. Biliary tract cancer. Lancet.2021;397:428-444.http://doi.org/10.1016/S01406736(21)00153-7.
4.Wang, Y., Li, J., Xia Y., et al. Prognostic nomogram for intrahepatic cholangiocarcinoma after partial hepatectomy. J. Clin. Oncol.2013;31:1188-1195.https://doi.org/10.1200/JCO.2012.41.5984.
5.Wang, S.J., Lemieux, A., Kalpathy-Cramer, J., et al. Nomogram for predicting the benefit of adjuvant chemoradiotherapy for resected gallbladder cancer. J. Clin. Oncol.2011;29:4627-4632.http://doi.org/10.1200/JCO.2010.33.8020.
6.Primrose, J.N., Fox R.P., Palmer D.H., et al. Capecitabine compared with observation in resected biliary tract cancer (BILCAP): a randomised, controlled, multicenter, phase 3 study. Lancet
Oncol.2019;20:663-674.https://doi.org/10.1016/S1470-2045(18)30915-X.
7.Rizzo, A., Ricci A.D., Brandi G. Durvalumab: an investigational anti-PD-L1 antibody for the treatment of billiary tract cancer. Expert Opin. Investig.
Drugs.2021;30:343-350.http://doi.org/10.1080/13543784.2021.1897102.
8.Ricci, A.D. Rizzo, A., Brand, G. The DNA damage repair (DDR) pathway in biliary tract cancer (BTC): a new Pandora’s box? ESMO Open.2020;5:e001042.https://doi.org/10.1136/esmoopen-2020-001042.
9.Vogel, A., Bridgewater J., Edeline, J., et al. Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann. Oncol.2023;34:127-140.https://doi.org/10.1016/j.annonc.2022.10.506.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-139108
有效期至:2025/7/12
排版编辑:肿瘤资讯-REX











 苏公网安备32059002004080号
苏公网安备32059002004080号


