2024年7月5,中国临床肿瘤学会(CSCO)联合北京市希思科临床肿瘤学研究基金会共同主办“2024年中国临床肿瘤学年度进展研讨会(BOC)亟Best of ASCO® 2024 China”于广州拉开序幕。7月6日上午,《中国临床肿瘤学年度研究进展2023》重磅发布。“国际标准,中国特色”——近年来,中国淋巴瘤诊疗不断向着靶向治疗、精准医学阔步前进,新兴、优化治疗方案的提出、临床试验的开展已进入国际领先行列。中国医学科学院肿瘤医院应志涛教授介绍了2023年度淋巴瘤领域重点进展。【肿瘤资讯】现整理如下,以供学习交流(研究排名不分先后)。

研究1:基于分子分型的弥漫大B细胞淋巴瘤R-CHOP-X治疗:GUIDANCE-01 II期随机临床研究结果
通讯作者:上海交通大学附属瑞金医院 赵维莅 许彭鹏
发表期刊:Cancer Cell
该研究为GUIDANCE-01(NCT04025593)随机化II期临床试验结果,旨在报道根据基因亚型结果指导初诊中/高危弥漫大B细胞淋巴瘤(DLBCL)患者接受R-CHOP或联合靶向治疗(R-CHOP-X)的治疗效果。
研究入组128例患者,按照1:1随机分至R-CHOP或R-CHOP-X治疗组。研究主要终点结果显示,R-CHOP-X组的完全缓解率显著高于R-CHOP组(88% vs. 66%,p = 0.003),总体缓解率分别为92% vs 73%(p = 0.005)。两年无进展生存率分别为88% vs 63%(p < 0.001),两年总生存率分别为94% vs 77%(p = 0.001)。事后RNA测序验证了简化的基因亚型分型算法和先前确定的淋巴瘤微环境亚型。
该研究结果凸显了R-CHOP-X的疗效和安全性,其基于机制制定个体化治疗策略,能够双重靶向新诊DLBCL患者的基因和微环境变化。
研究2:舒格利单抗单药治疗复发难治性结外自然杀伤/T细胞淋巴瘤患者(GEMSTONE-201):单臂、多中心II期临床试验结果
通讯作者:基石药业(苏州)有限公司 杨建新
发表期刊:Journal of clinical oncology
该研究为评价抗PD-L1单克隆抗体舒格利单抗治疗复发或难治性结外自然杀伤/T细胞淋巴瘤(R/R ENKTL)疗效与安全性的III期临床研究。受试者每3周静脉注射一次舒格利单抗(1200 mg),最长治疗24个月或直至进展、死亡或退出研究。主要终点为独立放射学评估委员会评估的客观缓解率(ORR);关键次要终点包括由研究者评估的ORR、完全缓解率、缓解持续时间和安全性。
截至数据截断日期(2022年2月23日),共有80例患者入组,随访时间中位数为18.7个月。基线时,有54名患者(67.5%)为IV期疾病,39例患者(48.8%)接受过≥2线系统治疗。独立放射学评估委员会评估的ORR为44.9%(95% CI:33.6-56.6);28例患者(35.9%)达到CR,7名患者(9.0%)达到PR,12个月缓解持续率为82.5%(95% CI:62.0-92.6)。研究者评估的ORR为45.6%(95% CI:34.3-57.2),24例患者(30.4%)达到完全缓解。大多数治疗相关不良事件为1-2级,有32例患者(40.0%)报告了≥3级事件。
研究结果表明,舒格利单抗对R/R ENKTL具备强效、持久的抗肿瘤活性。该治疗方案耐受性良好,符合预期安全性。
研究3:高选择性JAK1抑制剂戈利昔替尼治疗复发难治性外周T细胞淋巴瘤的I期剂量递增与扩展研究
通讯作者: 北京大学肿瘤医院 朱军
发表期刊:Annals of Oncology
该研究为一项国际多中心临床试验,旨在评估高选择性JAK1抑制剂戈利昔替尼治疗复发难治性外周T细胞淋巴瘤的安全性与抗肿瘤活性,次要目标为明确推荐2期剂量(RP2D)与药物代谢动力学(PK)。
51例患者入组并接受了戈利昔替尼治疗(150mg qd或250mg qd)。戈利昔替尼在测试的两个剂量下均可耐受,但观察到250mg剂量下严重不良事件和剂量调整的发生率较高。最常见的≥3级治疗相关不良事件为中性粒细胞减少症(27.5%)和血小板减少症(11.8%)。整体而言,客观反应率为39.2%,完全缓解率为21.6%。在中位随访时间为14.7和15.9个月时,中位反应持续时间(DoR)和无进展生存期分别为8.0和3.3个月。
基于上述数据,确定150mg qd为RP2D。戈利昔替尼作为口服药物显示出良好的PK特性。生物标志物分析表明JAK/STAT通路异常与戈利昔替尼的临床活性可能存在关联。
研究4:依托泊苷、地塞米松和培门冬酶联合夹心放疗方案治疗早期NK/T细胞淋巴瘤:一项随机III期研究
通讯作者:上海交通大学附属瑞金医院 赵维莅
发表期刊:INNOVATION
既往研究结果提示,甲氨蝶呤、依托泊苷、地塞米松和培门冬酶(MESA)联合夹层放疗对早期结外鼻型自然杀伤/T细胞淋巴瘤(鼻型NKTCL)有效。此项研究为一项多中心、随机、III期试验,旨在探讨减弱剂量、非静脉给药的依托泊苷、地塞米松和培门冬酶(ESA)联合夹层放疗的疗效和安全性。研究共招募了来自中国27个诊疗中心的14-70岁初诊早期鼻型NKTCL患者。患者随机分配(1:1)接受ESA(d1:肌注培门冬酶2500 IU/m2,d2-4:口服依托泊苷200mg、地塞米松40mg)或MESA(d1:静脉注射甲氨蝶呤1g/m2,第2-4天口服依托泊苷200mg、地塞米松40mg,d5:肌内注培门冬酶2500 IU/m2)治疗方案(4个周期),联合夹层放疗。主要终点为总体反应率(ORR)。非劣效性界值为-10.0%。
共有256例患者进行了随机分组(2016.3.16至2020.7.17),其中248例(ESA组125例,MESA组123例)完成意向性治疗分配(mITT)。ESA联合夹层放疗的ORR为88.8%(95%CI:81.9-93.7),MESA联合夹层放疗为86.2%(95% CI:78.8-91.7),绝对率差为2.6%(95% CI:-5.6-10.9),符合非劣效标准。ESA组中42例(33.6%)患者发生≥3级不良事件,而MESA组为81例(65.9%)。
研究结果提示,ESA联合夹层放疗是一种有效、低毒性、非静脉给药的门诊设计方案,在初诊早期鼻型NKTCL中可作为一线治疗选择。
研究5: 信迪利单抗、安罗替尼和培门冬酶联合放疗的三明治疗法作为I-II期结外NK/T细胞淋巴瘤患者的一线治疗II期研究
通讯作者:中山大学肿瘤防治中心 李志铭
发表期刊:American Journal of Hematology
对局部非淋巴/自然杀伤性T细胞淋巴瘤(ENKTL)的新型高效低毒联合治疗方案仍是一个临床治疗的未满足需求。该II期临床试验(NCT03936452)旨在探究信迪利单抗、安罗替尼和培门冬酶联合放疗的三明治疗法作为一线治疗,对初诊I-II期局部结外自然杀伤/T细胞淋巴瘤(ENKTL)患者的疗效和安全性。研究主要终点是6治疗周期后的完全缓解率(CRR)。次要终点为无进展生存期(PFS)、总生存期(OS)、2周期后的CRR、6周期后的总反应率(ORR)、反应持续时间(DOR)和安全性。
2019年5月至2021年7月,共纳入58例患者。其2周期后CRR为55.1%(27/49),6周期后87.8%(43/49);6周期后ORR为87.8%(43/49;95% CI:75.2-95.4)。中位随访时间为22.5月(95% CI:20.4-24.6),中位PFS、OS和DOR未达到。2年PFS、OS和DOR率分别为87.6%(95% CI:78.8-97.4)、97.9%(95% CI:94.0-100)和91.1%(95% CI:83.2-99.8)。治疗相关3-4级不良事件发生率为41.4%(24/58),其中高血压(15.5%)、高三酰甘油血症(8.6%)、口腔黏膜炎(6.9%)和贫血(5.2%)常见。无与治疗相关的死亡事件发生。
研究结果证实,一线信迪利单抗、安罗替尼和培门冬酶联合放疗的治疗方案在初治早期ENKTL患者中疗效显著,且安全性良好。
研究6: 基于当前治疗手段的结外NK/T细胞淋巴瘤的治愈证据:CLCG数据库分析
通讯作者:国家癌症中心/中国医学科学院肿瘤医院 亓姝楠
发表期刊:Haematologica
关于是否有部分结外鼻型NK/T细胞淋巴瘤(ENKTCL)患者可以被认为“治愈”这一问题,目前尚无共识。该研究回顾性分析了中国淋巴瘤协作组多中心数据库中2008年至2016年接受非蒽环类化疗或放疗的1955例ENKTCL患者的临床数据,旨在评估当前治疗手段下ENKTCL的“统计学治愈”情况。
研究采用非混合治愈模型,并考虑背景死亡率,以探索估计治愈比例、中位生存时间和治愈时间点。相对生存曲线在整体队列及大多数亚组达到平台期,表明“治愈”概念是可靠的。总体治愈比例为71.9%;未治愈患者的中位生存时间为1.1年。治愈时间为4.5年,超过此时间点后,ENKTCL患者的死亡率与一般人群相当。治愈概率与B症状、分期、活动状态、乳酸脱氢酶、原发肿瘤浸润以及原发上呼吸消化道部位相关。老年患者(>60岁)与年轻患者的治愈比例相似。根据风险分层组,5年总生存率与治愈比例相关。
研究结果提示,接受当前治疗策略的ENKTCL患者可能存在统计学上的治愈。尽管受风险因素影响,总体上治愈的可能性是乐观的。
研究7: 替雷利珠单抗、吉西他滨和奥沙利铂治疗复发或难治性经典型霍奇金淋巴瘤:一项多中心II期研究
通讯作者:江苏省人民医院 范磊
发表期刊:Haematologica
该研究为前瞻性多中心II期临床试验,旨在探讨替雷利珠单抗与吉西他滨、奥沙利铂(T-GemOx)联合治疗复发/难治性cHL的疗效和安全性。受试者接受6-8疗程的吉西他滨(d1 1 g/m²)、奥沙利铂(d1 100 mg/m²),并联合替雷利珠单抗(d2 200 mg),每21天一次,随后进行替雷利珠单抗维持治疗(每2月一次,持续2年)。主要结果指标是最佳完全缓解率。
截至2022年8月,共30例患者连续入组并接受了诱导治疗。最佳总体反应率和完全缓解率分别为100%(95%CI: 88.4%-100%)和96.7%(95% CI: 82.8%-99.9%)。T-GemOx启动后的中位随访时间为15.8个月。未自体干细胞移植患者的12月无进展生存率为96%(95% CI: 74.8%-99.4%)。治疗期间共记录122起不良事件,其中93.4%为1/2级。3/4级不良事件以血小板减少症(10%)和贫血(6.7%)最常见。
总体而言,T-GemOx作为复发/难治性cHL的拯救治疗显示出良好的抗肿瘤活性和可管理的毒副作用。研究需要更长时间的随访来确定替雷利珠单抗维持治疗与移植相比是否具备治愈效果。
研究8: 维泊妥珠单抗用于初治DLBCL:III期POLARIX研究亚洲亚组人群分析
通讯作者:北京大学肿瘤医院 朱军
发表期刊:Blood
该研究为POLARIX 3期临床试验,旨在探究维泊妥珠单抗联合利妥昔单抗、环磷酰胺、阿霉素和泼尼松(Pola-R-CHP)方案对初诊DLBCL患者的疗效与安全性。患者按照1:1比例随机分为Pola-R-CHP和R-CHOP治疗组,接受6个疗程的Pola-R-CHP或R-CHOP,外加2个疗程的利妥昔单抗单药治疗。为在中国注册POLARIX临床试验研究者,评估了亚洲亚组群体的PFS一致性(定义为全球人群预期PFS风险降低50%以上)。
281例患者纳入分析,包括全球意向性治疗分配(ITT)人群中来自亚洲的160例患者及ITT中国延伸队列中的121例患者。其中,141例患者随机分配到Pola-R-CHP组,140例分配到R-CHOP组。截止2021年6月28日(中位随访24.2个月),PFS与全球人群的一致性定义相符,且Pola-R-CHP组的PFS优于R-CHOP组(风险比0.64;95%CI:0.40-1.03)。2年PFS分别为Pola-R-CHP组74.2%(95% CI:65.7-82.7),R-CHOP组66.5%(95% CI:57.3-75.6)。Pola-R-CHP组与R-CHOP组在安全性上相当,其中3-4级不良事件发生率为72.9% vs 66.2%,严重不良事件为32.9% vs 32.4%,5级不良事件为1.4% vs 0.7%,导致研究治疗中断的不良事件为5.0% vs 7.2%,以及任何级别的周围神经病变44.3% vs 50.4%。
上述研究表明,在POLARIX研究中,Pola-R-CHP组与R-CHOP组在亚洲和全球人群中展现出一致的疗效和安全性。
研究9: 低危弥漫大B细胞淋巴瘤PET-CT调整的治疗:3期非劣随机对照试验研究结果
通讯作者:上海交通大学附属瑞金医院 赵维莅
发表期刊:Cancer Communications
该研究是一项开放标签、随机、III期、非劣效试验,比较了对于IPI为0-1的非肿块型低风险DLBCL患者,在PET-CT为阴性的情况下(Deauville评分为1-3),使用4周期 vs 6周期R-CHOP化疗的疗效。对于入组患者,在接受四个周期R-CHOP后PET-CT确认完全缓解(CR)的患者被随机分配(1:1)到四周期利妥昔单抗(4R-CHOP+4R)或两周期R-CHOP加两周期利妥昔单抗(6R-CHOP+2R)治疗组。主要终点是2年无进展生存率(PFS)。
共纳入287例患者(年龄14-75岁),中位随访时间为47.3个月。4R-CHOP+4R组和6R-CHOP+2R组的2年PFS率分别为95%(95%CI:92%-99%)和94%(95% CI:91%-98%)。两组之间2年PFS的绝对差异为1%(95% CI:-5%-7%),支持4R-CHOP+4R方案的非劣效。在4R-CHOP+4R组中,3-4级中性粒细胞减少症发生率(16.7% vs 76.9%),且发热性中性粒细胞减少症的风险减少(0.0% vs 8.4%),感染风险降低(2.1% vs 14.0%)。
研究结果提示,对于中期PET-CT确认CR的低风险、非肿块型DLBCL患者,将标准的6个周期化疗减少到4个周期,可减少不良事件的发生,具有可比较的临床疗效。
研究10:奥布替尼治疗复发或难治性边缘区淋巴瘤:一项开放标签、多中心、II期研究
通讯作者:北京大学肿瘤医院 朱军
发表期刊:American Journal of Hematology
该研究为多中心、单臂II期临床试验——复发/难治性MZL患者接受奥布替尼治疗(150mg,qd),以评估疗效与安全性。主要终点是由独立审查委员会(IRC)根据Lugano 2014分类评估的总体反应率(ORR)。次要评估指标为其他疗效、安全性和药代动力学特征。
111例患者入组,其中90例患者以粘膜相关淋巴组织(MALT,46.7%)和结节性MZL(35.6%)为主。大多数患者处于晚期疾病阶段,其中IV期占75.6%。在中位随访24.3个月后,IRC评估的ORR为58.9%(95% CI:48.0-69.2),完全缓解率和部分缓解率分别为11.1%、47.8%。IRC评估的反应持续中位时间为34.3个月,未达到IRC评估的中位无进展生存期(PFS),12个月PFS率为82.8%(95% CI:72.6-89.5)。12个月OS率为91.0%(95% CI:82.8-95.4)。常见的治疗相关不良事件(TRAEs)包括贫血(27.9%)、中性粒细胞计数减少(23.4%)、白细胞计数减少(18.0%)、血小板计数减少(17.1%)、血尿(16.2%)、皮疹(14.4%)和上呼吸道感染(10.8%)。34名患者(30.6%)经历了≥3级TRAEs。18名患者(16.2%)出现严重的TRAEs,以肺炎(5.4%)最为常见。由于TRAEs,7名患者(6.3%)停止了奥布替尼治疗。
研究结果提示,奥布替尼在中国复发/难治性MZL患者中表现出高反应率和持久的疾病缓解,药物耐受性可接受。
研究11: PI3Kδ抑制剂林普利塞治疗复发或难治性滤泡性淋巴瘤的II期临床研究
通讯作者:中国医学科学院血液病医院 邱录贵
发表期刊:Clinical Cancer Research
该研究为探索新型口服活性PI3Kδ抑制剂林普利塞对复发/难治性滤泡性淋巴瘤(FL)患者的疗效与安全性的II期临床研究。患者在接受二线或更高级别系统治疗后疾病进展的情况下被纳入研究,治疗方案为林普利塞80mg(口服,28天为一周期),直至疾病进展或无法耐受的毒性发生。研究主要终点为客观缓解率(ORR),次要结果包括缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)、疾病控制率和药物安全性概况。
研究共入组114例患者,最终84例患者被纳入完整分析组(FAS)。FAS患者的ORR为79.8% (95%CI:69.6-87.8),其中13例患者(15.5%)完全缓解,54名患者(64.3%)部分缓解。中位DOR为12.3个月(95% CI:9.3-15.9)。中位PFS为13.4个月(95% CI:11.1-16.7)。12个月OS率为91.4%(95% CI:82.7-95.8)。就安全性而言,发生率最高(>3%)的 ≥3治疗相关的不良事件包括感染性肺炎(19.0%)、中性粒细胞减少(15.5%)、淋巴细胞减少(4.8%)、白细胞减少(4.8%)、脂肪酶增高(3.6%)、血小板减少(3.6%)、高三酰甘油血症(3.6%)和间质性肺病(3.6%)。
整体而言,林普利塞在治疗复发/难治性FL中表现出显著疗效,不良反应可控。
总结
回顾2023年度,中国淋巴瘤诊疗取得了令人瞩目的临床研究成果。在国际舞台上,中国临床科学家以数据立论,分享了创新的临床治疗方案与治疗经验,推动了我国淋巴瘤靶向治疗的发展与创新型药物的临床推广。路漫漫其修远兮,上下求索。中国淋巴瘤诊疗的发展之路仍在继续,我们期待着更新的数据报道、更优的治疗方案,惠及更多淋巴瘤患者,助力实现健康中国愿景!
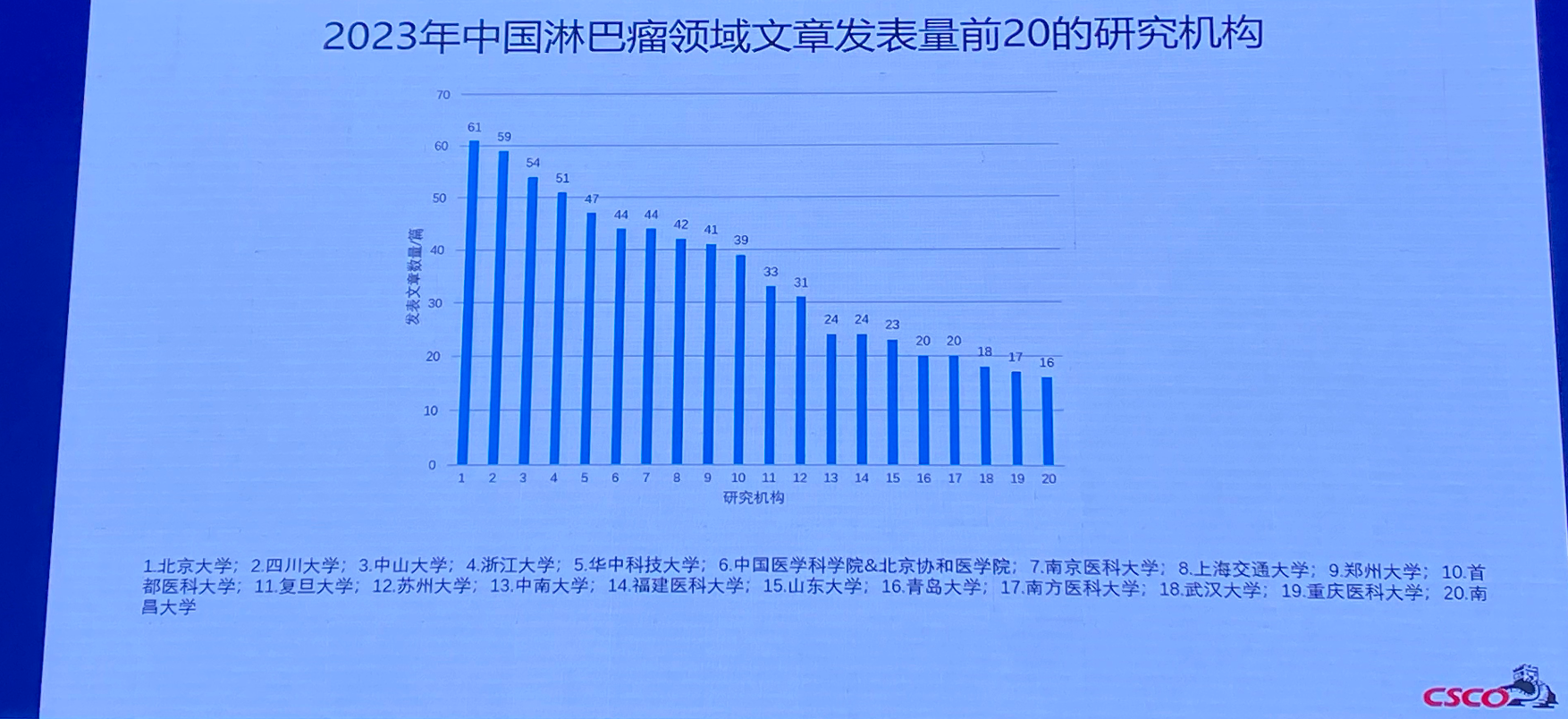
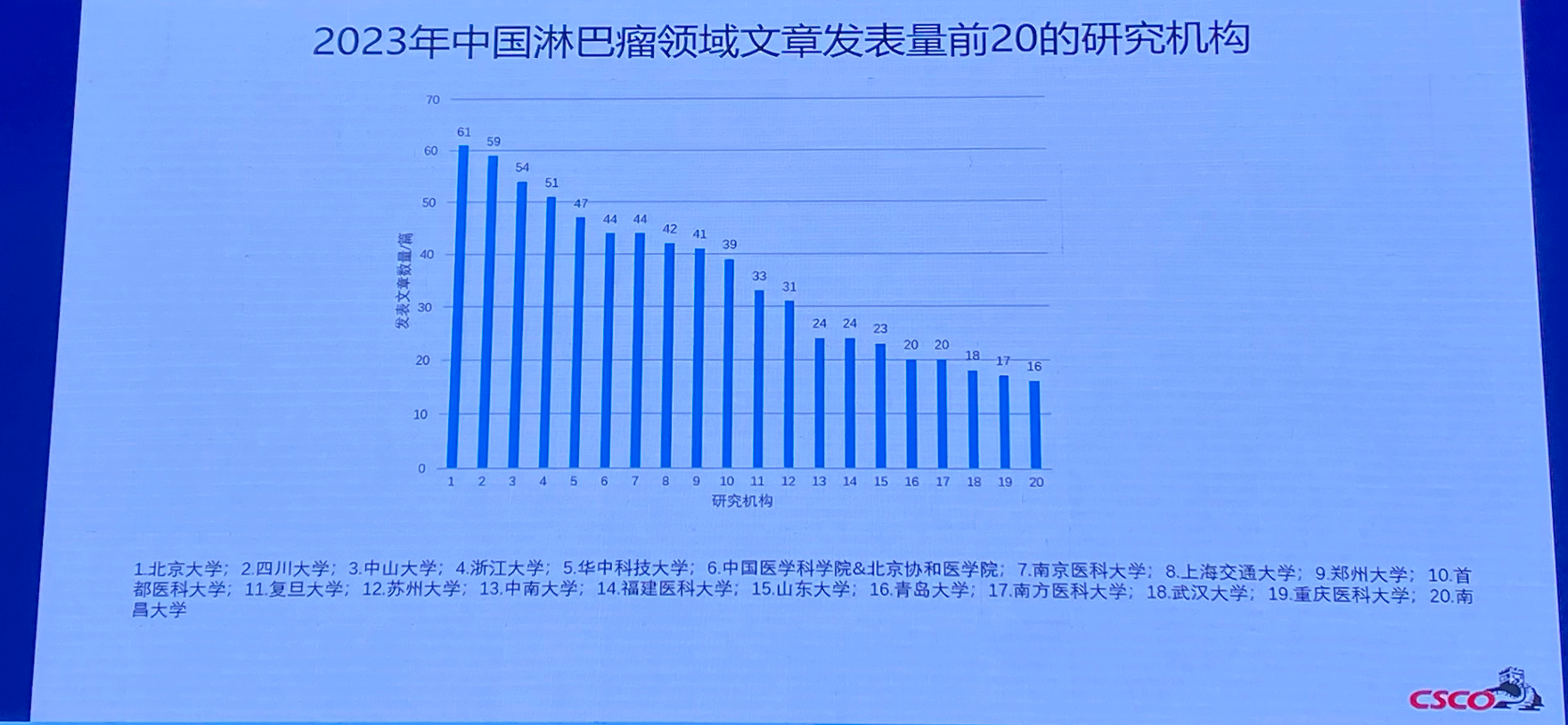
排版编辑:Amiee











 苏公网安备32059002004080号
苏公网安备32059002004080号


