本期精选5篇在2024年5月份发表的结直肠癌领域文献,部分研究邀请到郑州大学第一附属医院宗红教授进行深入解读。
专家介绍
主任医师、教授、医学博士、肿瘤科一病区主任
中国老年学和老年医学学会精准医疗分会常务委员
中国医师协会肿瘤医师分会乳腺癌学组委员
中国研究型医院学会乳腺癌专业委员会常务委员
中国抗癌协会肿瘤麻醉与镇痛专业委员会委员
河南省预防医学会肿瘤控制与预防专委会主任委员
河南省研究型医院学会分子肿瘤专委会主任委员
河南省消化医学会大肠癌精准治疗专委会主任委员
河南省医学会肿瘤医学分会会副主任委员
河南省抗癌协会大肠癌专业委员会副主任委员
西妥昔单抗联合FOLFOXIRI对比西妥昔单抗联合FOLFOX作为RAS/BRAF野生型患者初始不可切除结直肠癌肝转移的转化治疗方案(TRICE研究):一项随机对照试验[1]
目前,对于强化化疗联合抗EGFR治疗能否为存在初始不可切除的结直肠癌肝转移(CRLM)的RAS/BRAF野生型结直肠癌(CRC)患者队列带来更好的临床疗效仍不明确。为此,该研究在存在初始不可切除CRLM的CRC患者中比较评估了西妥昔单抗+FOLFOXIRI(三药组) vs 西妥昔单抗+FOLFOX (双药组)作为的转化治疗方案(即从不可切除到可切除)的有效性和安全性。
这项开放标签的随机临床试验于2018年4月至2022年12月在中国的7家医疗中心进行,总计招募了146名伴初始不可切除CRLM的RAS/BRAF野生型CRC患者。采用分层随机化方法将患者(1:1)分配到西妥昔单抗+ FOLFOXIRI治疗组(n = 72)或西妥昔单抗+ FOLFOX治疗组(n = 74)。分层因素为肿瘤部位(左半vs右半)和可切除性(技术上不可切除vs ≥5个转移)。主要终点为客观缓解率(ORR)。次要终点包括中位肿瘤缓解深度(DpR)、早期肿瘤退缩(ETS)、R0切除率、无进展生存期(PFS)、总生存期(分析时尚未成熟)和安全性。由放射科医生进行盲态的肿瘤影像学评估。主要疗效指标分析是在意向治疗人群中进行的,而安全性分析则是在至少完成一线化疗的患者中进行。
共有14例患者(9.6%)失访(双药组9例,三药组5例)。校正分层因素后发现两组的ORR是相似的,三药组和双药组的ORR分别为84.7%和79.7%(比值比[OR] 0.70;95%置信区间[CI] [0.30, 1.67],卡方检验p值=0.42)。此外,三药组和双药组的ETS发生率无显著性差异(80.6% (58/72) vs 77.0% (57/74),OR 0.82, 95% CI [0.37, 1.83],卡方检验p值=0.63)(图1)。
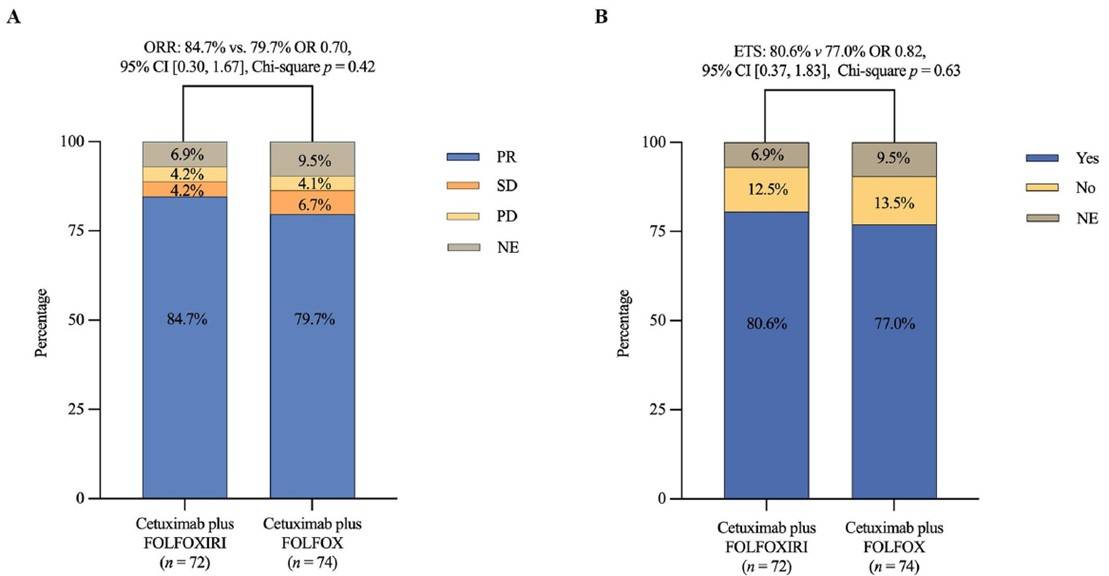
图1:两个治疗组的肿瘤缓解情况:(A) ORR;(B) ETS
虽然三药治疗组的中位DpR更高(59.6%,四分位数间距[IQR] [50.0, 69.7] vs 55.0%,IQR [42.8, 63.8],Mann-Whitney 检验p值=0.039),但无论是否采用射频消融/立体定向体放疗,R0/R1切除率都相当,三联疗法组患者的切除率为54.2%(39/72),而双联疗法组患者的切除率为52.7%(39/74)。患者的中位随访时间为26.2个月(IQR [12.8, 40.5]),三药组和双药组的中位PFS分别为11.8个月 vs 13.4个月(风险比[HR] 0.74, 95% CI [0.50, 1.11],Log-rank检验p值=0.14)(图2)。双药组中47.2%(35/74)的患者和三药组中55.9%(38/68)的患者发生了≥3级不良事件。三药治疗与更高的≥3级中性粒细胞减少(44.1% vs 27.0%,p=0.03)和腹泻(5.9% vs 0%,p=0.03)的发生率相关。该研究的主要局限性包括主观手术决策对肿瘤可切除性的固有偏倚,以及缺乏对ORR和切除率的集中评价。
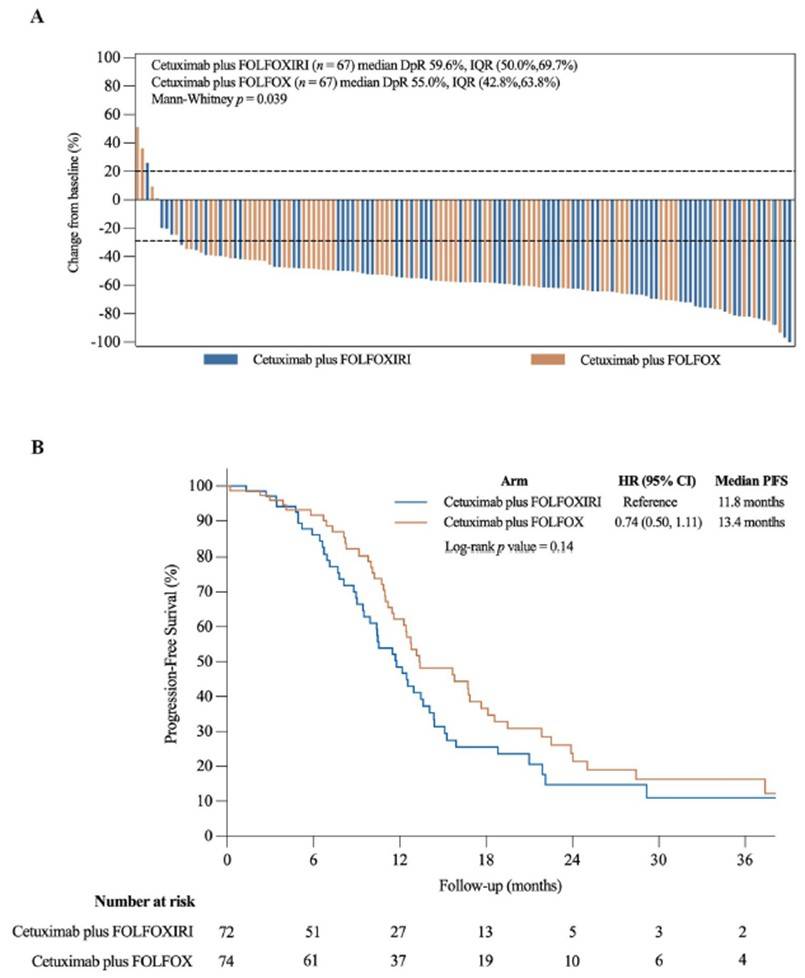
图2:(A)瀑布图描绘了至少进行过1次疗效评价的患者的肿瘤缓解深度;(B) ITT人群的无进展生存期
与西妥昔单抗联合FOLFOX相比,西妥昔单抗联合FOLFOXIRI治疗并没有显著改善ORR。尽管三药组的DpR的增加了,但这一改善并没有转化为R0切除率或PFS的提升。此外,三药组还与治疗相关毒性的增加有关。(ClinicalTrials.gov注册号:NCT03493048)
宗红教授解读:TRICE研究是首项针对比较三药化疗和两药化疗联合西妥昔单抗用于转化治疗的研究。再次证实了在RAS/BRAF野生型mCRC患者的转化治疗中,西妥昔单抗联合不同强度化疗方案均能取得一致较高的ORR、DpR和ETS,同时提示对于mCRC转化治疗两药联合西妥昔单抗已达天花板效应,对于部分患者而言两药联合西妥昔单抗或已足够。
但不能仅凭此研究而完全否定三药化疗联合西妥昔单抗在转化治疗中应用价值,西妥昔单抗联合 FOLFOXIRI 在本研究中产生了更好的 DpR,可能有助于手术成功切除,保留更多的肝实质,为二次切除提供更有利的条件,同时有研究证明更深的肿瘤缓解DpR与更长的OS之间存在潜在相关性。因此需等待OS结果成熟后进一步明确三药组会否在OS上有获益以及通过亚组分析找到三药组获益的人群。由邓艳红教授牵头的FOCULM研究探索了中国人群改良版FOLFOXIRI方案联合西妥昔单抗用于RAS/BRAF野生型CRLM的疗效,取得了70.1%的NED、95.5%的ORR,在PFS和OS方面,西妥昔单抗联合三药化疗组对比三药化疗也显示出改善趋势。[6]因此,三药化疗联合西妥昔单抗仍然有一定的价值,尤其是对于单个肿瘤直径较大,转移肿瘤数目较多、原发肿瘤部位位于右半结肠等以最大程度缩瘤为目标的患者。
DEEPER研究提示三药联合西妥昔单抗相较于三药联合贝伐珠单抗ORR相当,但在RAS/BRAF野生左半mCRC患者中三药联合西妥昔单抗取得了更优的OS(53.6m vs. 40.2m,HR 0.54 [95%CI,0.32~0.91])[7]、PFS(14.5m vs 11.9m P=0.0032)、DpR(59.2% vs 47.5% P=0.0017)[8],而在既往的三药联合贝伐珠单抗对比两药联合贝伐珠单抗的研究中看到,三药化疗联合贝伐珠单抗相较于两药化疗联合贝伐珠单抗的优势,指南保留了三药联合贝伐珠单抗的推荐。
也是基于此研究,2024年CSCO指南[9]更新中对于适合强烈治疗(RAS和BRAF均野生型)潜在可切除转移性结肠癌的患者删除了“FOLFOXIRI+西妥昔单抗”的推荐,而对于此类患者两药联合西妥昔单抗仍是唯一左半转化治疗的I级推荐、右半选择之一。
同时该研究共纳入右半患者19例(13%),总体ORR高达89.5%,ETS为73.7%。与既往支持抗EGFR单抗用于右半患者转化治疗的结果一致 [10、11]。结合此前PARADIGM研究[11]、FIRE-3研究[12]的后续生物标志物分析结果,相信未来可以在右半肠癌中探索更多可以从抗EGFR单抗中获益的人群。
纳武利尤单抗联合relatlimab治疗既往经治的高微卫星不稳定/错配修复缺陷型转移性结直肠癌患者: II期CheckMate 142研究[2]
已经证明包括纳武利尤单抗在内的程序性细胞死亡蛋白-1 (PD-1)抑制剂对既往经治的高微卫星不稳定/错配修复功能缺陷(MSI-H/dMMR)的转移性结直肠癌(CRC)患者的长期生存有益。PD-1和淋巴细胞活化基因3 (LAG-3)是不同的免疫检查点,它们通常在肿瘤浸润的淋巴细胞上共同表达并有助于肿瘤介导的T细胞功能障碍。Relatlimab是一种LAG-3抑制剂,已被证明与纳武利尤单抗联合使用治疗黑色素瘤患者有效。
CheckMate 142研究展示了纳武利尤单抗联合relatlimab治疗MSI-H/dMMR转移性结直肠癌患者的结果。在该项开放标签的II期研究中,经治的MSI-H/dMMR转移性结直肠癌患者每2周静脉注射纳武利尤单抗240 mg+relatlimab 160 mg。主要终点是研究者评估的客观缓解率(ORR)。
共有50名既往经治的患者接受了纳武利尤单抗联合relatlimab治疗。该研究的中位随访时间为47.4(范围43.9-49.2)个月,研究者评估的ORR为50% (95% CI,36% - 65%),疾病控制率为70% (95% CI,55% - 82%)。研究者评估的中位至缓解时间为2.8 (范围1.3-33.1) 个月,中位缓解持续时间为42.7 (范围2.8-47.0+)个月。研究者评估的中位无进展生存期为27.5个月(95% CI,5.3-43.7),3年无进展生存率为38%,中位总生存期尚未达到(95% CI,17.2个月-NE),3年总生存率为56%(图3)。任何级别的治疗相关不良事件(TRAEs)中最常见的是腹泻(24%)、虚弱(16%)和甲状腺功能减退(12%)。14%的患者报告了3级或4级TRAEs, 8%的患者出现了因任何级别的TRAEs导致的停药。未发生与治疗相关的死亡。
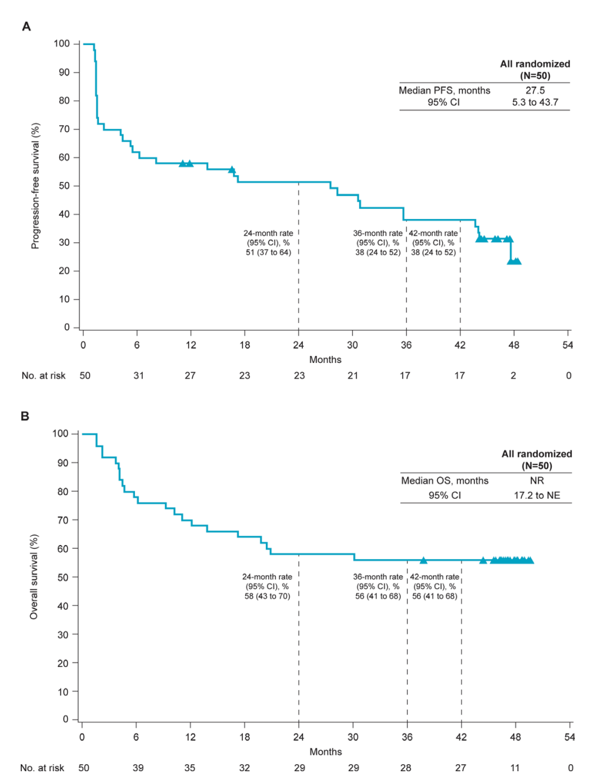
图3:Kaplan Meier生存曲线(符号代表删失)。(A)研究者评估的无进展生存期;(B)所有患者的总生存期
在既往经治的MSI-H/dMMR转移性结直肠癌患者中,纳武利尤单抗联合relatlimab治疗提供了持续的临床获益,并且耐受性良好。(ClinicalTrials.gov注册号:NCT02060188)
宗红教授解读:淋巴细胞活化基因 3 (LAG-3) 是一种抑制性免疫检查点,与主要组织相容性复合物 II 结合。LAG-3 和 PD-1 是不同的免疫检查点,通常在肿瘤浸润性 T 细胞上共表达,导致肿瘤介导的 T 细胞功能障碍。在既往未经治疗的转移性或不可切除黑色素瘤患者中,与单独使用纳武利尤单抗相比,纳武利尤单抗和 relatlimab的双重免疫检查点抑制显示出显著的无进展生存期延长,且具有可控的安全性。基于这些结果,美国食品药品监督管理局批准纳武利尤单抗加 relatlimab 的固定剂量组合用于治疗不可切除或转移性黑色素瘤,LAG3成为继PD-1/PD-L1/CTLA-4之后第四个用于临床的免疫检查抑制剂。此研究提示LAG-3与PD-1的联合在经治的MSI-H的mCRC中具有前景,同时NICHE-3研究[13]:纳武利尤单抗联合relatlimab新辅助治疗局部晚期dMMR结肠患者癌疗效具有潜力,100%的患者达到病理缓解;79%的患者达pCR。含LAG3的双抗也在积极研发中,期待LAG3的新联合方案在肠癌领域能够探索出更多更好的临床数据。
帕博利珠单抗联合mFOLFOX7或FOLFIRI用于微卫星稳定/错配修复功能正常的转移性结直肠癌:KEYNOTE-651队列B和D[3]
该项1b期KEYNOTE-651研究评估了帕博利珠单抗联合化疗在微卫星稳定或错配修复功能正常的转移性结直肠癌中的作用。纳入的微卫星稳定或错配修复功能正常的转移性结直肠癌患者分别接受帕博利珠单抗200mg(每3周)联合5-氟尿嘧啶、亚叶酸钙、奥沙利铂治疗(每2周)(既往未经治的患者;队列B);或帕博利珠单抗200mg(每3周)联合5-氟尿嘧啶、亚叶酸钙、伊立替康治疗(每2周)(既往接受过氟嘧啶联合奥沙利铂治疗的患者;队列D)。主要终点是安全性,次要终点是研究者根据RECIST v1.1评估的客观缓解率(ORR),探索性终点是生物标志物分析。
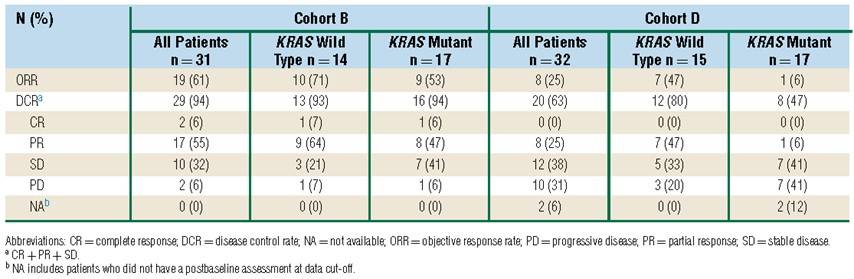
队列B和队列D分别入组31例和32例患者。两组的中位随访时间分别为30.2个月和33.5个月。队列D中有1例患者出现剂量限制性毒性(3级小肠梗阻)。在队列B中,18名患者(58%)发生了3级或4级治疗相关不良事件(AEs),其中最常见的是中性粒细胞减少和白细胞总数减少(各有5例)。在队列D中,17例患者(53%)发生了3级或4级治疗相关AEs,其中最常见的是中性粒细胞减少(7例)。未发生5级治疗相关AEs。队列B的ORR为61% (其中KRAS野生型患者为71%;KRAS突变型患者为53%),队列D的ORR为25% (其中KRAS野生型患者为47%;KRAS突变型患者为6%)(表1)。在这两个队列中,治疗缓解的患者相较于未缓解患者的PD-L1联合阳性评分和T细胞炎性基因表达谱均更高,而HER2表达更低。没有观察到肿瘤突变负荷与缓解之间的关联。
表1:不同KRAS突变状态下,队列B和队列D患者的肿瘤缓解情况
帕博利珠单抗联合5-氟尿嘧啶、亚叶酸钙、奥沙利铂/5-氟尿嘧啶、亚叶酸钙、伊立替康表现出可接受的不良反应特征。疗效数据似乎与目前的标准治疗相当(包含KRAS突变型在内)。通过生物标志物分析产生的假设有待于未来进一步探索。(ClinicalTrials.gov注册号:NCT03374254)
抗VEGFR和抗EGFR单抗的联合治疗:伊立替康和西妥昔单抗联合/不联合ramucirumab二线治疗结直肠癌的随机II期研究(ECOG-ACRIN E7208)[4]
早期的研究曾探索过抗EGFR单抗和抗VEGF单抗联合治疗晚期结直肠癌(CRC)的可能,但后来的研究表明在不区分RAS状态的人群中使用这种治疗是有毒和无效的。该项研究在晚期KRAS野生型CRC人群中探索了伊立替康-西妥昔单抗(IC)联合或不联合抗VEGFR单抗ramucirumab (ICR)作为二线治疗的结果。
共纳入102例既往接受过含氟嘧啶、奥沙利铂和贝伐珠单抗方案一线治疗的KRAS野生型肿瘤患者,患者基于ECOG PS、距上次化疗时间和使用奥沙利铂后的进展情况进行分层,分别接受IC(伊立替康180mg+西妥昔单抗500 mg/2 q2w) vs. 改良ICR (mICR)(伊立替康150mg+西妥昔单抗400 mg/m2+ramucirumab 6 mg/kg)方案治疗。研究比较的主要终点是无进展生存期(PFS) (假设检验的功效为85%,预测中位PFS提升幅度为70%,即从4.5个月提升至7.65个月)。
在102名入组患者中, IC组和mICR的可评估患者分别为44人和45人。两组的中位PFS分别为6.0个月和9.2个月(HR 0.75,p=0.07,研究设计显著性差异p值<0.128)(图4)。两组的缓解率分别为23%和36% (p=0.27),疾病控制率(DCR)分别为52%和73% (p=0.05)。两组中≥3级的毒性发生率不同。两组的总生存期均为19个月左右,无显著性差异。
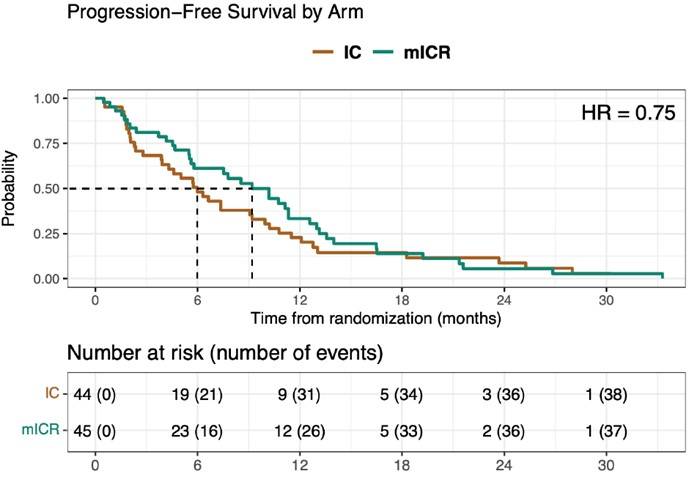
图4: 两组患者的PFS
既往无RAS基因分型的3期研究不支持抗EGFR和抗VEGF药物的联合使用。该项针对KRAS野生型CRC患者(所有入组患者既往均接受贝伐珠单抗治疗)的随机、多中心、2期研究表明,在伊立替康和西妥昔单抗方案的基础上添加ramucirumab可改善PFS和DCR。这说明该联合方案是可行和有效的。未来还需要筛选合适的患者去开展3期研究。(ClinicalTrials.gov注册号:NCT01079780)。
免疫检查点抑制剂用于POLE/POLD1校对缺陷转移性结直肠癌[5]
POLE和POLD1校对缺陷(POLE/D1pd)定义了一种罕见的转移性结直肠癌亚型——超突变转移性结直肠癌(mCRC;超过100个突变/Mb)。目前关于免疫检查点抑制剂(ICIs)在POLE/D1pd mCRC中活性和疗效的特异性数据尚不足,并且ICIs治疗该类患者与治疗错配修复功能缺陷(dMMR)/高微卫星不稳定性(MSI-H) mCRC的疗效是否有所差异也仍不清楚。
该项全球研究共纳入了27例因携带POLE/D1突变导致校对缺陷的mCRC患者,并给予抗PD-L1单药或抗PD-L1联合抗CTLA-4药物进行治疗。该研究收集了POLE/D1pd mCRC患者的临床病理学和基因组学特征、治疗缓解情况和ICIs治疗后的生存预后结果,并将其与接受ICIs治疗的包含610例dMMR/MSI-H mCRC患者的队列进行了比较。在一个包含7241例CRC患者的独立队列中开展了进一步的基因组学分析,以确定POLE和POLD1pd的分子谱和突变特征。
POLE/D1pd与年轻、男性、较少的RAS/BRAF驱动突变和右半结肠癌等因素相关。与dMMR/MSI-H mCRC患者相比,POLE/D1pd mCRC患者的客观缓解率(ORR)显著更高(89% vs 54%;P=0.01)。中位随访24.9(四分位数间距:11.3-43.0)个月后,与dMMR/MSI-H mCRC患者相比,POLE/D1pd患者比的无进展生存期(PFS)显著更长[风险比(HR) = 0.24,95% CI 0.08-0.74,P=0.01],总生存期(OS)也更优 (HR = 0.38, 95% CI 0.12-1.18,P=0.09)(图5)。在包含不同DNA修复缺陷类型的多变量分析中发现,POLE/D1pd与PFS (HR = 0.17, 95% CI 0.04-0.69,P=0.013)和OS (HR = 0.24,95% CI 0.06-0.98,P=0.047)的显著改善相关。分子谱显示POLE/D1pd肿瘤具有更高的肿瘤突变负荷(TMB)。在两种mCRC亚型患者中均观察到肿瘤缓解,其中POLE/D1pd亚型患者的缓解程度与POLE/D1pd的表达强度相关。
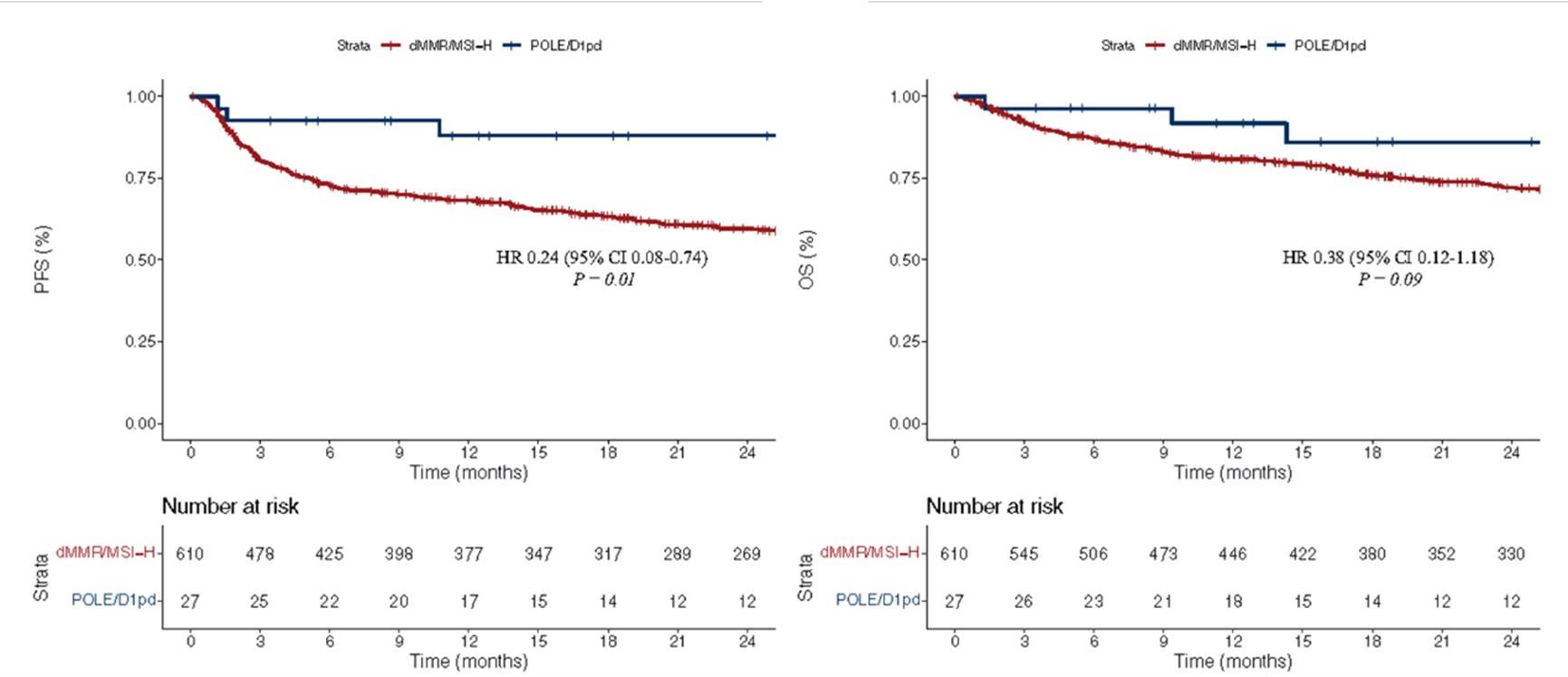
图5:POLE/D1pdmCRC患者比dMMR/MSI-H mCRC患者比较的Kaplane-Meier曲线。(A)PFS;(B)OS
与dMMR/MSI-H mCRC患者相比,POLE/D1pd mCRC患者接受ICIs治疗后在肿瘤缓解和生存获益方面表现出更优的结果。
宗红教授解读:目前公认的ICI治疗敏感的biomarker包括:错配修复功能缺陷(dMMR)/高度微卫星不稳定(MSI-H)、高肿瘤突变负荷 (TMB-H) ,此外PD-L1表达、肿瘤微环境、免疫评分和肠道菌群等也可能与ICI获益相关。然而,这些生物标志物有其自身的局限性,比如dMMR/MSI-H所占比例较低、TMB在不同瘤肿中cutoff值可能不同、有些marker临床检测不可及,尚在科研阶段;因此,探索新的预测ICI治疗敏感的标志物非常重要。POLE其编码产物 POLE 是 Pol ε 的最大亚基,POLD1 基因的编码产物是 Pol δ 催化亚基,Pol ε 和 Pol δ 通过其核酸外切酶区域的校对活性来识别和修复错配的碱基,并在核苷酸切除修复和双链断裂修复中发挥作用,POLE/POLD1(POLE/POLD1-EDM)的核酸外切酶结构域突变导致校对功能丧失,导致突变基因在细胞中积累,与超高的TMB相关,因此是免疫治疗潜在获益的Biomarker[14]。 POLE/D1pd 突变主要见于子宫内膜癌和 CRC(在所有疾病阶段分别为 5%-10% 和 2%-4%)。在这项研究中与dMMR/MSI-H mCRC患者相比,POLE/D1pd mCRC患者接受ICIs治疗后在肿瘤缓解和生存获益方面表现出更优的结果。再一次印证了POLE/POLD1突变患者免疫治疗的价值。我们中心既往也发表了一篇POLE 突变结直肠癌患者真实世界数据的回顾性研究[15],回顾性收集郑州大学附属第一医院(ZZ队列)的272例CRC患者和癌症基因组图谱数据库(TCGA队列)的499例CRC患者,在ZZ队列中体细胞POLE突变率为7.7%,包括2.6% POLE EDM(核酸外切酶结构域突变 )和5.1%POLE 非EDM,在TCGA队列中,POLE EDM肿瘤和POLE非EDM肿瘤的TMB均显著高于POLE野生型肿瘤。在ZZ队列中观察到类似的趋势,尽管没有显著差异。在ZZ队列POLE EDM组的PFS和OS显著高于POLE非EDM组和POLE WT组。我们还报告了一名携带种系 POLE 突变的 CRC 患者,他接受了卡瑞利珠单抗治疗并表现出长期的疾病稳定。因此基于一系列研究2024NCCN指南[16]及2024CSCO指南[9]均提及POLE/POLD1突变人群可获益于免疫治疗。
本期看点:
1、一项随机对照试验(TRICE),为RAS/BRAF野生型初始不可切除的CRLM患者如何选择抗EGFR单抗为基础的转化治疗方案提供了指导意见,研究结果已写入2024 CSCO指南。
2、一项II期单臂研究(CheckMate 142),在经治的MSI-H/dMMR mCRC患者中探索了纳武利尤单抗联合relatlimab方案的疗效和安全性,结果显示出一定的疗效获益和良好的耐受性。
3、来自KEYNOTE-651研究的Ib期队列分析,显示出帕博利珠单抗联合化疗治疗MSS/pMMR mCRC患者的疗效与当前标准治疗接近,安全性可控,未来还需要进一步探索生物标志物分析。
4、一项随机II期研究(ECOG-ACRIN E7208),在晚期KRAS野生型CRC人群中探索了伊立替康-西妥昔单抗联合或不联合抗VEGFR单抗ramucirumab作为二线治疗的结果。联合ramucirumab治疗的患者显示出PFS和DCR获益的增加,ORR和OS与对照组相比无显著性差异,未来仍需要筛选合适患者开展3期研究探索。
5、一项全球性研究研究,探索了ICIs治疗POLE/D1pd mCRC患者和dMMR/MSI-H mCRC患者的疗效差异。结果显示,尽管两种mCRC亚型患者均有肿瘤缓解,但POLE/D1pd mCRC患者接受ICIs治疗后相比dMMR/MSI-H mCRC患者的获益更多,此外POLE/D1pd mCRC患者的缓解程度还与POLE/D1pd的表达强度相关。
1、Wang DS, Ren C, Li SS, et al. Cetuximab plus FOLFOXIRI versus cetuximab plus FOLFOX as conversion regimen in RAS/BRAF wild-type patients with initially unresectable colorectal liver metastases (TRICE trial): A randomized controlled trial. PLoS Med. 2024;21(5):e1004389. Published 2024 May 10.
2、Overman MJ, Gelsomino F, Aglietta M, et al. Nivolumab plus relatlimab in patients with previously treated microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: the phase II CheckMate 142 study. J Immunother Cancer. 2024;12(5):e008689. Published 2024 May 31.
3、Kim R, Tehfe M, Kavan P, et al. Pembrolizumab Plus mFOLFOX7 or FOLFIRI for Microsatellite Stable/Mismatch Repair-Proficient Metastatic Colorectal Cancer: KEYNOTE-651 Cohorts B and D. Clin Colorectal Cancer. 2024;23(2):118-127.e6.
4、Hochster HS, Catalano P, Weitz M, et al. Combining anti-VEGFR and anti-EGFR antibodies: Randomized phase II study of irinotecan and cetuximab with/without ramucirumab in second-line colorectal cancer:(ECOG-ACRIN E7208). J Natl Cancer Inst. Published online May 22, 2024.
5、Ambrosini M, Rousseau B, Manca P, et al. Immune checkpoint inhibitors for POLE or POLD1 proofreading-deficient metastatic colorectal cancer. Ann Oncol. Published online May 3, 2024.
6、Hu H, Wang K, Huang MJ, et al. Modified FOLFOXIRI With or Without Cetuximab as Conversion Therapy in Patients with RAS/BRAF Wild-Type Unresectable Liver Metastases Colorectal Cancer: The FOCULM Multicenter Phase II Trial. Oncologist. 2021 Jan;26(1):e90-e98.
7、Y. Sunakawa, et al. Modified (m)-FOLFOXIRI plus cetuximab versus m-FOLFOXIRI plus bevacizumab as initial treatment for RAS and BRAF wild-type metastatic colorectal cancer: Updated survival analysis of the DEEPER trial by JACCRO. 2023 WCGIC, abstract SO-25.
8、Sunakawa Y, Shiozawa M, Watanabe T, et al. Modified (m)-FOLFOXIRI plus cetuximab treatment and predictive clinical factors for RAS/BRAF wild-type and left sided metastatic colorectal cancer (mCRC): The DEEPER trial, 2023 ESMO 555O
9、2024CSCO结直肠癌诊疗指南
10、Holch J, et al. 2017 ASCO Abstract 3586
11、Yamazaki K, Muro K, Watanabe J, et al. Efficacy of panitumumab in patients with left-sided disease, MSS/MSI-L, and RAS/BRAF WT: A biomarker study of the phase III PARADIGM trial. 2023 ASCO 3508
12、J.W.Holch, et al. Refining first-line treatment decision in RAS wildtype (RAS-WT) metastatic colorectal cancer (mCRC) by combining clinical biomarkers: Results of the randomized phase 3 trial FIRE-3 (AIO KRK0306). 2024 ASCO GI, Abs.13
13、Verschoor YL, Van Den Berg JG, Balduzzi S, et al. Neoadjuvant nivolumab plus relatlimab (anti-LAG3) in locally advanced MMR-deficient colon cancers: The NICHE-3 study. 2023 ESMO abstr LBA31
14、Yang CJ, Zhao L, Lin YL, et al. Biomarkers for immune checkpoint inhibitors in colorectal cancer: recent advances and future perspectives. Cancer Biol Med 2023. doi: 10.20892/j.issn.2095-3941.2023.0201
15、Jiang M, Jia YL, Han JM, et al. Distinct clinical pattern of colorectal cancer patients with POLE mutations: A retrospective study on real-world data. Front Genet. 2022; 13: 963964.16、NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Colon Carcinoma. Version 1.2024
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


