约20%-25%的非小细胞肺癌(NSCLC)患者初诊时为Ⅲ期[1]。根据AJCC/UICC TNM第8版分期,Ⅲ期NSCLC可进一步分为ⅢA期、ⅢB期和ⅢC期,其5年生存率随分期的升高逐渐降低,分别为36%、26%和13%[2]。Ⅲ期NSCLC患者具有高度异质性,因此这部分人群最需要多学科团队的综合治疗[3]。近年来,免疫联合化疗为Ⅲ期NSCLC提供了更多选择,同时也带来了新的问题,包括围术期治疗模式的选择、患者选择以及如何优化潜在可切除或不可切除III期NSCLC诊疗策略等。近期,发表于《Cancers》杂志(IF: 5.2)的一篇文章围绕新辅助免疫治疗时代可切除Ⅲ期NSCLC的循证医学证据等方面进行了梳理和讨论[4]。【肿瘤资讯】现邀杨懿教授特此点评,深入剖析免疫治疗在Ⅲ期NSCLC患者中的获益及面临的争议和挑战。
新辅助免疫治疗时代下Ⅲ期NSCLC的可切除性
近期,第9版TNM分期将N2分成单站N2(N2a)和多站 N2(N2b),这一分类对这些患者的治疗决策和预后具有临床意义。第8版和提议的第9版TNM III期的分期见表1。
表1 NSCLC第8版和提议的第9版TNM分期对比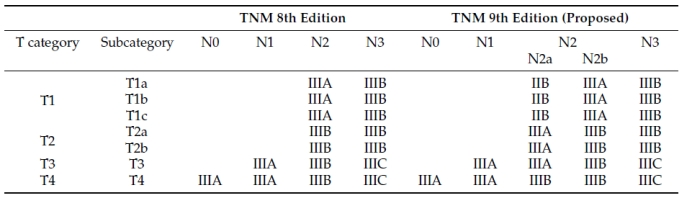
新辅助免疫联合化疗在Ⅲ期NSCLC中的循证医学证据
新辅助免疫联合化疗在可切除NSCLC中的循证医学证据迅速积累(表2和表3)。
表2Ⅲ期NSCLC新辅助免疫联合化疗试验(研究设计和结果)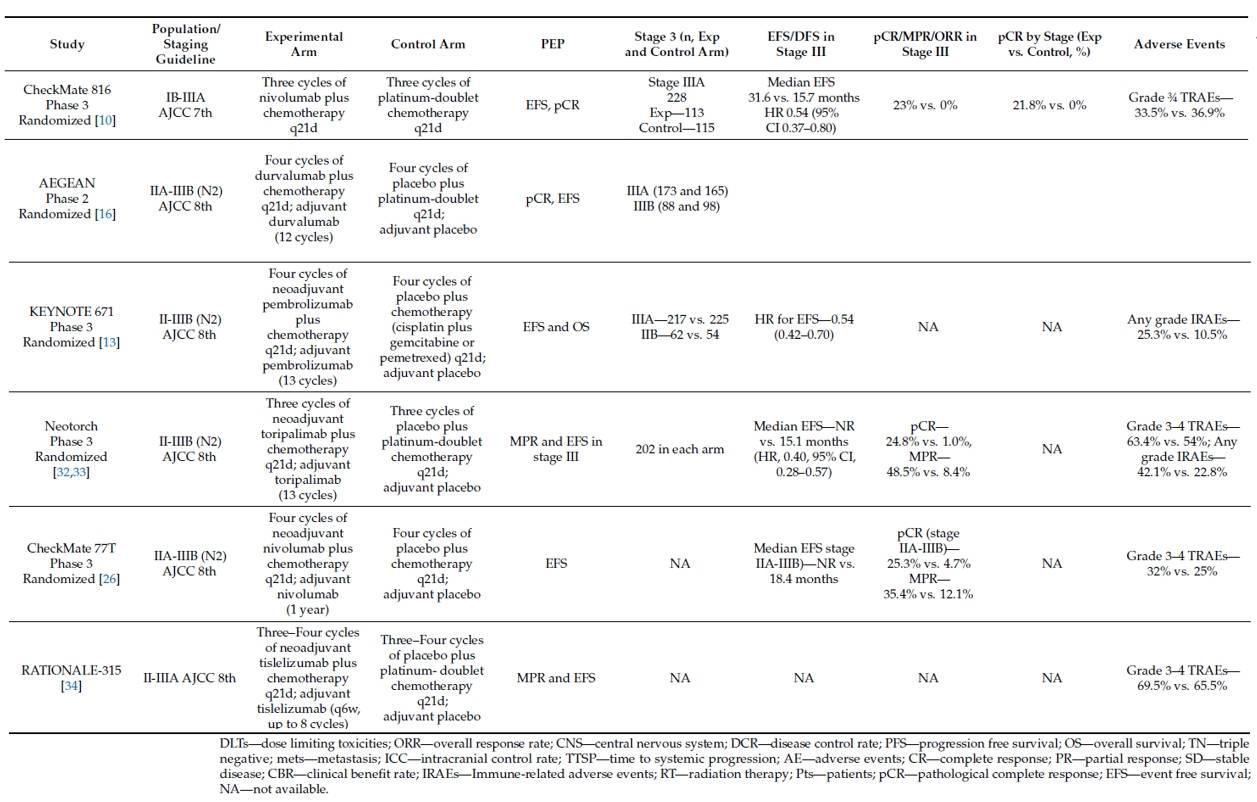
表3 Ⅲ期NSCLC新辅助免疫联合化疗的手术结果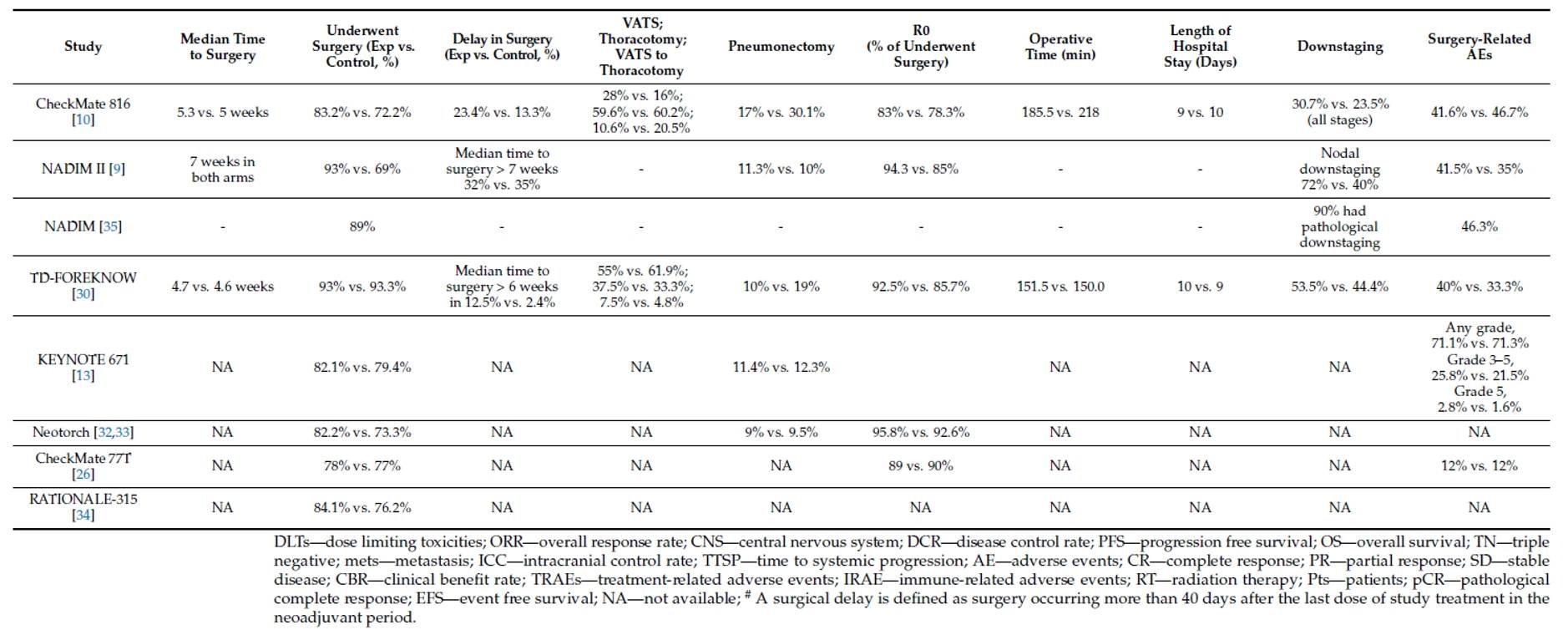
近来,“夹心饼”式免疫围术期治疗相关研究呈现出井喷式的爆发,KEYNOTE-671、RATIONALE-315、CheckMate 77T等相继公布阳性结果,为围术期免疫治疗提供了新的治疗选择。值得注意的是,尽管这些研究均纳入了III期患者,但在研究设计和基线特征方面存在一定差异。
AEGEAN研究评估了度伐利尤单抗围术期治疗可切除Ⅱ-ⅢB(N2)期NSCLC(AJCC第8版分期)的疗效和安全性。同样多项PD-1抑制剂在可切除NSCLC患者进行了“夹心饼”模式的探索。在基线特征中,Neotorch研究纳入的均为Ⅲ期NSCLC患者,其余研究Ⅲ期占比在58.4%~70.3%。从研究公布的初步结果来看,均达到了阳性结果。相较单纯化疗组,新辅助免疫联合化疗显著提高了pCR率和MPR率;且EFS同样达到了具有统计学差异和临床意义的延长,另外KEYNOTE-671研究取得了OS改善(NR vs. 52.4个月,HR=0.72)。安全性方面整体可耐受。
挑战与未来
新辅助免疫和辅助免疫治疗模式的人群选择
在新辅助免疫联合化疗模式中,目前尚无明确的、经验证的可用于指导临床筛选新辅助免疫治疗优势人群的biomarker。但从既往研究的探索性分析发现,PD-L1表达水平、合并突变可能与疗效存在一定相关性,未来有待进一步探索。
对于接受新辅助免疫治疗后的患者,术后是否继续辅助免疫治疗是临床亟待解决的挑战。多项研究结果提示pCR可能与EFS相关,但目前仍无证据证实根据达到pCR与否进行或不进行术后辅助治疗。
治疗周期
在可切除NSCLC患者中,目前新辅助免疫治疗为3-4个周期。从研究数据来看,3个周期和4个周期在可切除NSCLC患者中均取得显著的pCR/MPR和获益。因此,对于新辅助治疗的周期数仍存在争议,同时术后辅助治疗时长也有待进一步探索。
肿瘤缓解评估
考虑到免疫治疗的非常规缓解模式,PET-CT、动态胸部X线等结合传统的影像学检查或可有助于重新评估肿瘤病灶。此外,新辅助免疫治疗后的病理评估标准仍有待统一化、标准化。
挽救治疗
目前对于新辅助治疗后出现疾病进展、术中发现不可切除或因毒性无法进行根治性手术的患者,尚无指南可参考以指导其后续管理。对于局晚患者,CTRT仍是一种治疗选择;而对于转移性NSCLC患者,或许可基于PD-L1和biomarker选择治疗方案,但对于新辅助治疗期间出现明显进展的患者,往往提示其侵袭性强、预后差,后续一线免疫联合化疗是否可为这部分人群带来获益仍不明确,联合CTLA-4抑制剂或下一线单药化疗可供选择。
不可切除人群的降期和外科视角
对于接受新辅助免疫联合化疗的NSCLC患者,治疗前和治疗后N2的评估、手术时机以及对手术预后的影响值得外科医生重点关注。此外,对于因肿瘤解剖学位置的潜在可切除NSCLC患者,影像学降期是否可带来手术降期仍未可知。对于经MDT评估为不可切除的患者,基于PACIFIC的研究数据[5],根治性放化疗后免疫巩固治疗是标准治疗。
小结
基于目前证据,新辅助免疫联合化疗应该作为所有可切除NSCLC患者的标准治疗。未来需要探索更多具有良好临床实用性的生物标志物,筛选新辅助免疫联合化疗的优势人群,以及术后辅助免疫的真正获益患者。在制定治疗决策时,除有效性,还应考量安全性。
[1]Bartolomeo V, Cortiula F, Hendriks LEL, De Ruysscher D, Filippi AR. A Glimpse Into the Future for Unresectable Stage Ⅲ Non-Small Cell Lung Cancer. Int J Radiat Oncol Biol Phys. 2024 Apr 1;118(5):1455-1460. doi: 10.1016/j.ijrobp.2023.11.005. Epub 2023 Dec 27. PMID: 38159097.
[2]Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016 Jan;11(1):39-51. doi: 10.1016/j.jtho.2015.09.009. PMID: 26762738.
[3]吴一龙,钟文昭,宋勇,等. Ⅲ期非小细胞肺癌的处理:共识与争鸣[J]. 循证医学, 2022, 22(3): 129-136. DOI: 10.12019/j.issn.1671-5144.2022.03.001.
[4]Verma S, Breadner D, Mittal A, et al. An Updated Review of Management of Resectable Stage Ⅲ NSCLC in the Era of Neoadjuvant Immunotherapy. Cancers (Basel). 2024 Mar 27;16(7):1302. doi: 10.3390/cancers16071302. PMID: 38610980.
[5]Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage Ⅲ Non-Small-Cell Lung Cancer. J Clin Oncol. 2022 Jun 10;40(17):1965. PMID: 35108059.
[6]Forde PM, Spicer J, Lu S, et al. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer. N Engl J Med. 2022 May 26;386(21):1973-1985. doi: 10.1056/NEJMoa2202170. Epub 2022 Apr 11. PMID: 35403841; PMCID: PMC9844511.
[7]Felip E, Altorki N, Zhou C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357. doi: 10.1016/S0140-6736(21)02098-5. Epub 2021 Sep 20. Erratum in: Lancet. 2021 Sep 23;: PMID: 34555333.
[8]O'Brien M, Paz-Ares L, Marreaud S, et al. Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol. 2022 Oct;23(10):1274-1286. doi: 10.1016/S1470-2045(22)00518-6. Epub 2022 Sep 12. PMID: 36108662.
[9]Lu S., Wu L., Zhang W, et al. Perioperative Toripalimab + Platinum-Doublet Chemotherapy vs Chemotherapy in Resectable Stage II/III Non-Small Cell Lung Cancer (NSCLC): Interim Event-Free Survival (EFS) Analysis of the Phase III Neotorch Study. J. Clin. Oncol. 2023;41:425126. doi: 10.1200/JCO.2023.41.36_suppl.425126.
[10] picer J.D., Gao S., Liberman M., et al. LBA56 Overall Survival in the KEYNOTE-671 Study of Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer (NSCLC) Ann. Oncol. 2023;34:S1297–S1298. doi: 10.1016/j.annonc.2023.10.052.
[11] Yue D., Wang W., Liu H., et al. LBA58 Pathological Response to Neoadjuvant Tislelizumab (TIS) Plus Platinum-Doublet (PtDb) Chemotherapy (CT) in Resectable Stage II-IIIA NSCLC Patients (pts) in the Phase III (Ph3) RATIONALE-315 trial. Ann. Oncol. 2023;34:S1299. doi: 10.1016/j.annonc.2023.10.054.
[12] Cascone T., Awad M.M., Spicer J.D., et al. LBA1 CheckMate 77T: Phase III Study Comparing Neoadjuvant Nivolumab (NIVO) Plus Chemotherapy (Chemo) vs Neoadjuvant Placebo Plus Chemo Followed by Surgery and Adjuvant NIVO or Placebo for Previously Untreated, Resectable Stage II–IIIb NSCLC. Ann. Oncol. 2023;34:S1295. doi: 10.1016/j.annonc.2023.10.050.
[13] 张嘉涛,潘燚,汪斌超,等.Adaptive treatment:肺癌治疗的加加减减[J].循证医学, 2024(001):024.
[14]Sun C, Wang X, Xu Y, et al. Efficiency and safety of neoadjuvant PD-1 inhibitor (sintilimab) combined with chemotherapy in potentially resectable stage ⅢA/ⅢB non-small cell lung cancer: Neo-Pre-IC, a single-arm phase 2 trial. EClinicalMedicine. 2024 Jan 19;68:102422. doi: 10.1016/j.eclinm.2024.102422. PMID: 38304743.
[15]Sun C, Liu Y, Zhang P, et al. Interim analysis of the efficiency and safety of neoadjuvant PD-1 inhibitor (sintilimab) combined with chemotherapy (nab-paclitaxel and carboplatin) in potentially resectable stage ⅢA/ⅢB non-small cell lung cancer: a single-arm, phase 2 trial. J Cancer Res Clin Oncol. 2023 Feb;149(2):819-831. doi: 10.1007/s00432-021-03896-w. Epub 2022 Feb 22. PMID: 35192053.
[16]Li J, Lu S, Tian Y, et al. Neoadjuvant low-dose radiotherapy plus durvalumab and chemotherapy for potentially resectable stage Ⅲ NSCLC: A phase Ib dose-escalation study. Radiother Oncol. 2024 Apr 26;196:110316. doi: 10.1016/j.radonc.2024.110316. Epub ahead of print. PMID: 38679201.
[17]Bahce, I. et al. 950O Ipilimumab plus nivolumab and chemoradiotherapy followed by surgery in patients with resectable and borderline resectable lung cancer: The INCREASE trial. Annals of Oncology, Volume 33, S982
[18]Kumar A, Srinivasan D, Potter AL, et al. Induction chemoimmunotherapy with surgery versus concurrent chemoradiation followed by immunotherapy for stage Ⅲ-N2 non-small cell lung cancer. J Thorac Cardiovasc Surg. 2024 Jun;167(6):1895-1905.e2. doi: 10.1016/j.jtcvs.2023.09.029. Epub 2023 Sep 16. PMID: 37722622.
[19]Dai F, Chen C, Zhou G, et al. Subsequent surgical treatment or maintenance immunotherapy in stage Ⅲ lung cancer patients achieving a favorable response following neoadjuvant immunotherapy: A matched retrospective cohort study from the surgical perspective. Thorac Cancer. 2024 Apr;15(10):830-846. doi: 10.1111/1759-7714.15247. Epub 2024 Feb 27. PMID: 38414317.
[20] Zhou et al., 2024, Cancer Cell 42, 1–10 July 8, 2024 The Author(s). Published by Elsevier Inc. https://doi.org/10.1016/j.ccell.2024.05.024
[21]Reck, M. et al. 115TiP MDT-BRIDGE: A phase II study of neoadjuvant durvalumab (D) + chemotherapy (CT) followed by either surgery and adjuvant D or chemoradiotherapy (CRT) and consolidation D in patients (pts) with resectable or borderline resectable stage IIB–IIIB NSCLC. Immuno-Oncology and Technology, Volume 20, 100587.
本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-138006
过期日期:2024-9-26
排版编辑:肿瘤资讯-张钰晴












 苏公网安备32059002004080号
苏公网安备32059002004080号


