
由于NTRK基因融合可涉及多种肿瘤,但发生率罕见,而且不同肿瘤的标准疗法(SoC)和预后存在差异,使用“金标准”随机对照试验(RCT)对TRK抑制剂进行临床试验往往不可行。目前,TRK抑制剂的临床试验多采用单臂篮式研究设计,以便为此前无有效药物可治的NTRK基因融合患者提供快速有效的治疗新药。然而,单臂试验无法直接提供不同药物间的疗效对比证据,如何弥补这种局限性,一直是TRK抑制剂上市后的研究重点。在今年的ASCO大会上,拉罗替尼携VICTORIA研究重磅亮相[1],在高质量研究设计和统计方法的帮助下,将单臂篮式临床试验条件下的拉罗替尼与真实世界中的非TRK抑制剂治疗相比较,进一步展示拉罗替尼作为TRK抑制剂在NTRK基因融合恶性肿瘤患者中不可取代的地位,提供了与非TRK抑制剂进行比较的有效证据。基于此,我们邀请到南方医科大学陈平雁教授和北京协和医院陈永辉教授,为我们解读该研究并探索拉罗替尼在泛肿瘤治疗领域中的重要价值以及发展前景。
特邀专家
博导,博士后合作导师
南方医科大学生物统计学系 前主任(1997-2019年)
海南省真实世界数据研究院 执行院长
创建国内第一个生物统计学系(2005),国内率先开设生物统计本科专业(理科,2005)
中华预防医学会生物统计分会 前主任委员(2014-2021)
广东省生物统计学会 创始人/会长
国际生物统计学会中国分会 副理事长
发表论文逾300篇,其中SCI收录论文110余篇,发表在SMMR、SIM、NEJM、JAMA、JCO、JAMA-IN、JAMA-SUR、ERJ、Critical Care,EClinicalMedicine、JASN、Radiology、Chest、Sleep、Hearts、JACC Cardiovasc Interv等期刊。
主编《SPSS统计软件应用教程》系列研究生规划教材影响广泛。
医学硕士、现任中国医学科学院北京协和医院核医学科副主任医师、副教授、硕士生导师
中华医学会核医学分会68Ga显像与精准诊疗工作委员会委员
中华医学会核医学分会治疗学组委员
北京内分泌代谢病学会甲状腺专委会常委
北京医学会核医学分会核素治疗学组委员
自2003年起在北京协和医院核医学科从事临床、教学及科研工作
专业擅长甲状腺疾病如131I治疗甲亢、分化型甲状腺癌,神经内分泌肿瘤及晚期前列腺癌诊疗一体化
参加过多项临床研究课题、因 “北京地区血友病综合诊治和管理协作体系的建立及相关应用”项目获2010年中华医学科技叁等奖
2024 ASCO 研究速递

研究名称:VICTORIA研究——拉罗替尼与非TRK抑制剂治疗NTRK基因融合恶性肿瘤患者的真实世界数据比较
研究概述:研究纳入NTRK基因融合阳性的非小细胞肺癌(NSCLC)、结直肠癌(CRC)、软组织肉瘤、甲状腺癌或唾液腺癌的成年患者。研究采用精确匹配的方法,比较了在3项临床试验(NCT02122913、NCT02576431、NCT02637687)中接受拉罗替尼治疗的NTRK基因融合恶性肿瘤患者(试验组)与在真实世界(RW)环境中接受非TRK抑制剂治疗的患者(外部对照组[C1] )的疗效结果(研究设计见图1)。
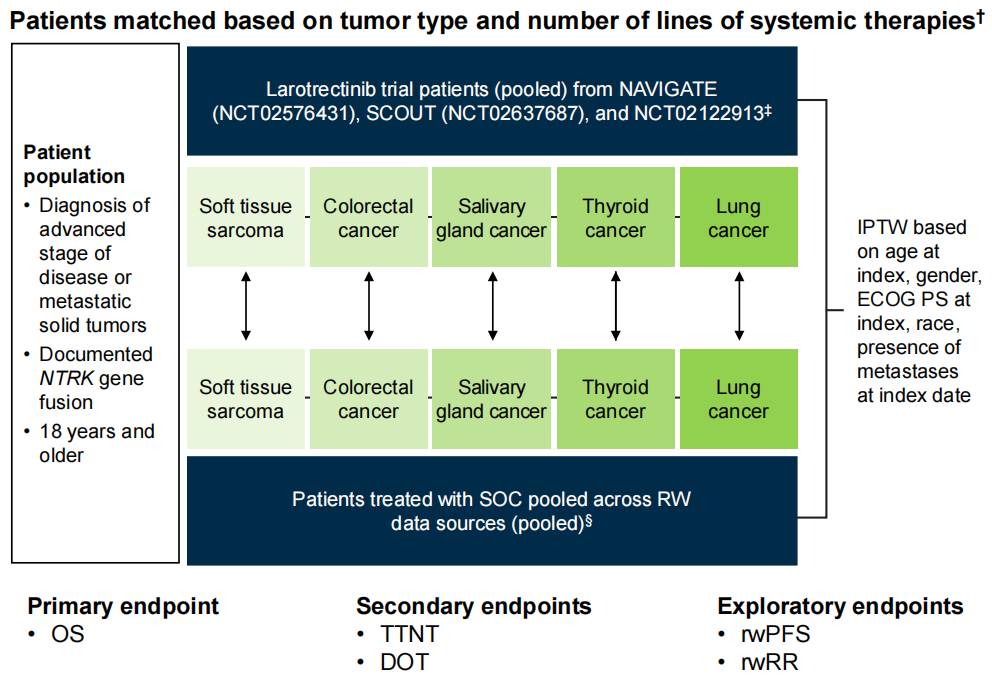 图1 研究设计
图1 研究设计
研究纳入164例精确匹配后的NTRK基因融合恶性肿瘤患者,拉罗替尼组和外部对照组各82例。根据肿瘤类型和治疗线将接受拉罗替尼治疗的患者与对照组的患者进行精确匹配,并确定对照组患者的指示治疗线。使用倾向性评分(加权)模型平衡两组患者的关键基线特征,最终倾向性评分模型纳入5个变量,包括性别、种族、年龄、ECOG PS和指示日期时是否转移。经过加权匹配后,两组患者的基线特征达到平衡。
对照组的治疗情况如下:化疗(49%)、非TRK抑制剂小分子靶向治疗(27%)、化疗+非TRK抑制剂非小分子靶向治疗(11%)或免疫检查点抑制剂治疗(10%)(两组患者基线特征见表1)。
表1 入组患者关键基线特征数据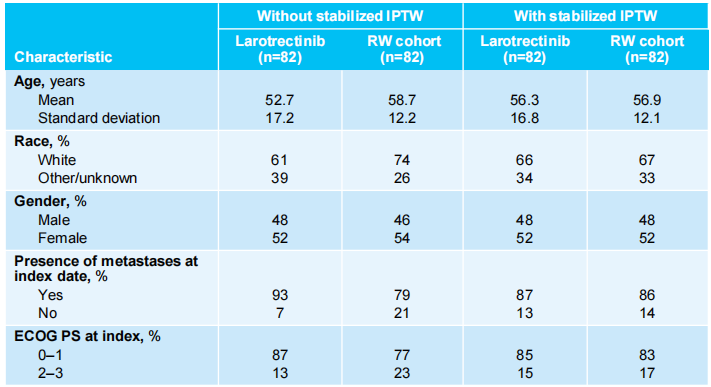
关键结果:
在加权分析中,试验组与对照组相比,OS更长(中位数未达到vs 37.2个月;HR 0.44 [95% CI 0.23–0.83]),经充分的敏感性分析,结果稳健。
在加权分析中,试验组治疗持续时间(DOT)中位数30.8 vs 3.4个月,HR 0.23 [95% CI 0.15–0.33];至下一次治疗的时间(TNT)中位数未达到vs 10.6个月,HR 0.22 [95% CI 0.13–0.38],均比对照组更长。
在加权分析中,试验组与对照组相比,无论通过放射科医生(中位数36.8 vs 5.2个月;HR 0.29 [95% CI 0.18–0.46])还是肿瘤科医生评估(中位数36.8 vs 5.9个月;HR 0.33 [95% CI 0.20–0.53]),无进展生存期(PFS)都更长。
未加权分析的结果与加权分析在DOT、TTNT和PFS方面一致。
试验组的缓解率(RR)(73.8% [95% CI 62.7–83.0])比对照组更高(53.8% [95% CI 37.2–69.9])。
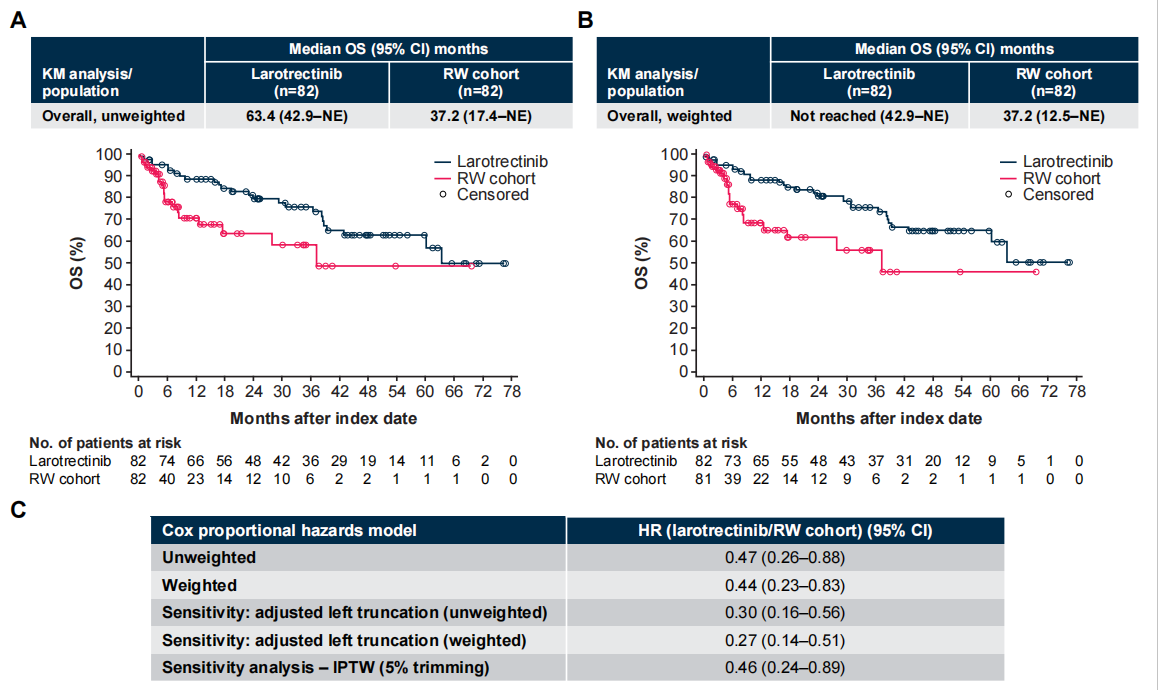 图 2 未加权(A)和加权后(B)的OS以及风险比(C)
图 2 未加权(A)和加权后(B)的OS以及风险比(C)
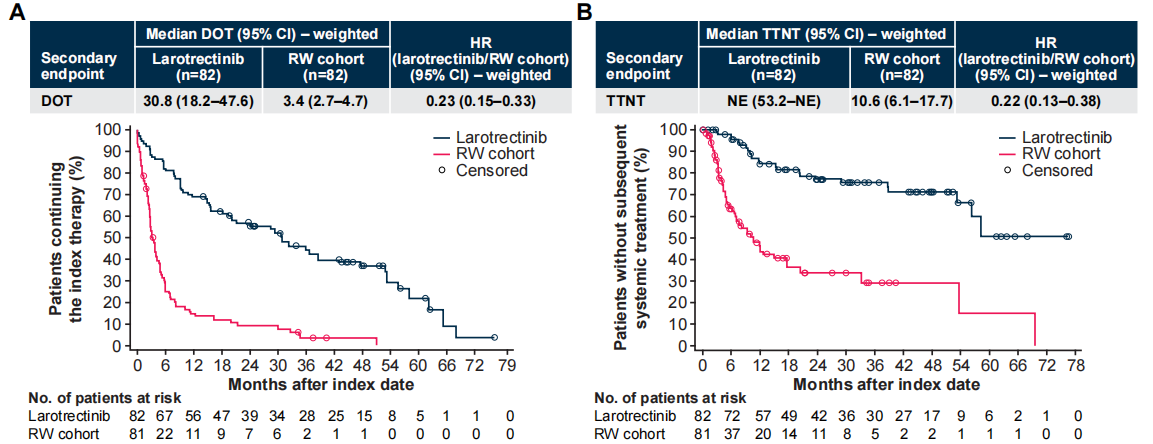 图3 加权后的DOT(A)和TTNT(B)
图3 加权后的DOT(A)和TTNT(B)
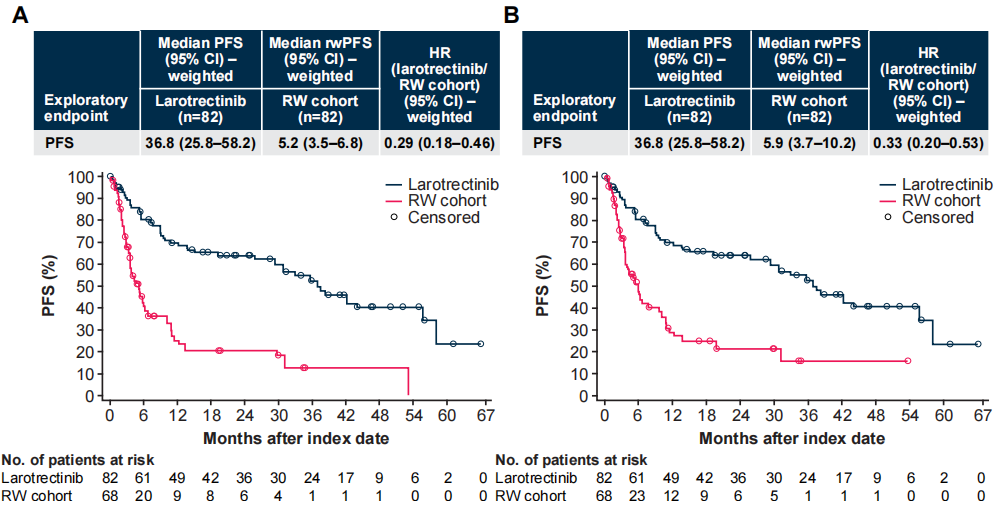 图4 加权后的PFS和rwPFS,放射科医生评估(A)与肿瘤科医生评估(B)
图4 加权后的PFS和rwPFS,放射科医生评估(A)与肿瘤科医生评估(B)
ASCO大咖点
陈平雁教授:高质量研究设计和统计方法为罕见靶点单臂试验药物的疗效比较带来可能
新药临床研发中,RCT被广泛认为是评估和比较干预效果的金标准,但在某些情况下可行性较差,如具有重大伦理风险,或所研究疾病是危及生命、复发难治、无药可治的疾病,再或者是患者群体很小的罕见疾病等。尤其是针对罕见突变的泛瘤种靶向药物,如TRK抑制剂拉罗替尼,上市注册时采用单臂篮式研究是一种较优的设计,这种设计选择合适的外部对照甚为关键。
采用外部对照的研究需要谨慎考虑混杂和偏倚的控制。倾向性评分匹配和逆概率加权(IPTW)等是常用的偏倚控制方法。通常来说,采用这些方法进行校正,可使得两组间基线特征分布一致,确保可比性。近年来,这些方法也受到了越来越多临床专家的关注。
我们看一下JCO杂志2020年的一篇文献,这是一项比较拉罗替尼和标准治疗(SoC)对NTRK基因融合恶性肿瘤患者生存期影响的研究[2],采用倾向性评分匹配的匹配调整间接比较(MAIC)方法,将3项拉罗替尼单臂临床试验(NCT02122913、NCT02637687和NCT02576431)的数据与Flatiron Health/ Foundation Medicine数据库中SoC的真实世界数据构建的外部对照进行了比较。
这项研究最终纳入了85例接受拉罗替尼治疗和28例接受SoC的患者,匹配调整后的分析结果显示,拉罗替尼可以降低78%的死亡风险(HR 0.22,p=0.001),两组的mOS分别为39.7个月和10.2个月。与SoC相比,拉罗替尼治疗TRK融合恶性肿瘤可以显著延长患者的OS。更重要的是,随着随访时间的延长,拉罗替尼治疗的优势也在进一步扩大,如下图所示。
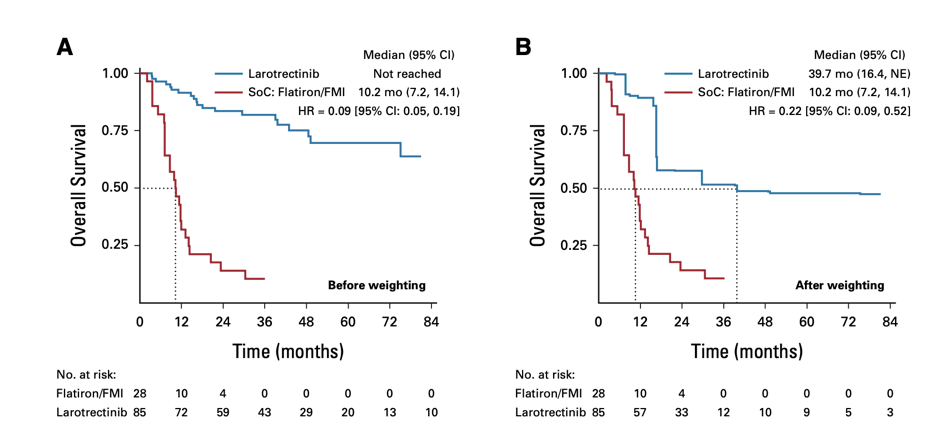
图5 未加权(A)和加权(B)的OS结果
本届ASCO公布的VICTORIA研究也采用了类似这篇JCO文献的真实世界数据作为外部对照的研究策略和分析方法,而且样本量更大,拉罗替尼组和基于真实世界数据的非TRK抑制剂外部对照组匹配后各有82例患者。从结果来看,拉罗替尼与非TRK抑制剂相比展示出非常明显的优势。由此可见,临床研究中,对于患者群非常有限、涉及肿瘤类型广泛、每个瘤种的对照治疗各异等所面临的挑战,如果有高质量的真实世界数据,可用作外部对照,通过采用恰当的统计分析方法,如倾向性评分匹配或者逆概率加权等,可以为单臂试验为关键研究支持新药获批上市提供可行路径和有力支持,有助于帮助临床决策,优化治疗实践。
陈永辉教授:有靶打靶,充分发挥拉罗替尼的精准治疗优势
作为少见突变,NTRK基因融合在近年来受到了越来越多的关注。NTRK基因融合可见于各种成人和儿童实体瘤,TRK融合癌患者既往没有相关靶点的靶向治疗,而接受标准治疗方法的NTRK基因融合肿瘤患者的OS并没有得到有效的延长[3]。雪上加霜的是,NTRK基因融合肿瘤患者往往预后不佳,生存期较NTRK野生型肿瘤患者更短[4-5]。TRK抑制剂的出现正在改变这一现状。拉罗替尼是一种TRK抑制剂,已于2022年4月在我国正式获批上市,用于治疗NTRK基因融合阳性的局部晚期或转移性实体瘤的成人和儿童患者,开启了肿瘤精准诊疗新时代。
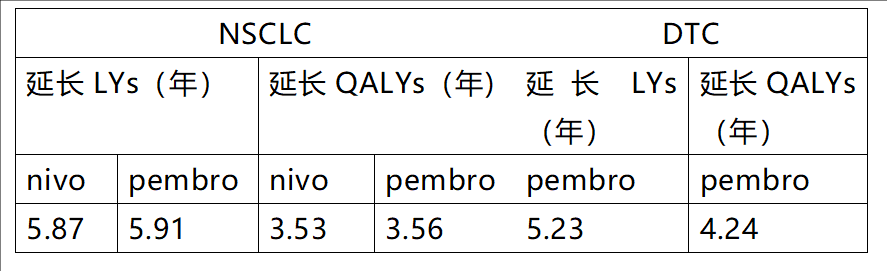
除了前述与SoC相比的显著优势,拉罗替尼在与免疫检查点抑制剂的对比中,也显示出令人满意的结果。今年6月最新发布的研究显示[6],在NSCLC患者中,与纳武利尤单抗(nivo)和帕博利珠单抗(pembro)相比,拉罗替尼分别增加了5.87和5.91预期寿命(LYs)、3.53和3.56质量调整寿命年(QALYs)。在分化型甲状腺癌(DTC)患者中,与帕博利珠单抗相比,拉罗替尼也分别增加了5.23 LYs和4.24 QALYs(表2)。这一结果提示拉罗替尼不但改善患者的生存时间,患者的生存质量也有所提高。
表2 拉罗替尼较免疫检查点抑制剂
随着更多长期生存数据的积累和更多患者的加入,未来的研究将提供更加坚实和详细的分析,以验证NTRK抑制剂的疗效和安全性。此外,由于不同瘤种之间可能存在生物学差异,特定单瘤种的研究数据可能会为临床诊疗带来更多参考信息,并有助于优化患者的治疗策略。
结语
受制于罕见靶点的研究难度,高质量外部对照研究可有效利用现有临床试验数据、真实世界数据甚至已发表研究数据等为临床实践提供关键的证据支持。对临床试验数据的再利用不仅有利于药物开发、优化实践,提供更多的疗效安全性对比证据,也能激发新的研究思路,产生多维度积极效应。面对NTRK基因融合的恶性肿瘤患者,拉罗替尼已经证实了其在泛瘤种治疗中的疗效与安全性,期待未来的持续发力,探索属于TRK抑制剂的广阔未来。
[1]Marcia S. Brose,2024 ASCO abstract 3105
[2]Carsten Bokemeyer, et al. Survival Outcomes of Patients With Tropomyosin Receptor Kinase Fusion-Positive Cancer Receiving Larotrectinib Versus Standard of Care: A Matching-Adjusted Indirect Comparison Using Real-World Data. JCO Precis Oncol 7:e2200436
[3]George D. Demetri, et al. Characteristics and outcomes of patients with NTRK fusion-positive (NTRK+) metastatic / locally advanced solid tumours receiving non- TRK inhibitor standard of care, and prognostic value of NTRK fusions in clinical practice. ESMO 2021. 100P
[4]Lyudmila Bazhenova, et al. TRK Fusion Cancer: Patient Characteristics and Survival Analysis in the Real‐World Setting. Targeted Oncology. https://doi.org/10.1007/s11523-021-00815-4
[5] Irene Santi, et al. Prognostic value of the NTRK fusion biomarker in the Netherlands. ESMO 2021. 105P
[6]J Manag Care Spec Pharm. 2024;30(6):581-87
审核号:MA-LAR-CN-0245-1











 苏公网安备32059002004080号
苏公网安备32059002004080号


