乳腺癌是威胁女性健康的最主要的恶性肿瘤。在中国,约60%的乳腺癌患者为激素受体阳性、人表皮生长因子受体2阴性(HR+/HER2-)[1],其中,约 40%的HR+/HER2-晚期乳腺癌患者存在PIK3CA突变[2]。PIK3CA突变可导致PI3K信号通路异常激活,刺激肿瘤增殖、转移和侵袭,并且与乳腺癌治疗耐药密切相关,从而使临床治疗更具挑战性。Inavolisib是中国首个且目前唯一高选择性PI3Kα抑制剂,此前在第46届美国圣安东尼奥乳腺癌研讨会(SABCS)中公布的Ⅲ期临床试验INAVO120研究取得了阳性结果[3]。2024年美国临床肿瘤学会(ASCO)年会中,INAVO120研究更新了无进展生存期(PFS2)数据[4],为PIK3CA突变HR+/HER2-晚期乳腺癌患者带来了治疗新选择。
2023 SABCS:PFS超双倍获益,INAVO120研究首次分析结果亮眼
INAVO120研究(NCT04191499)是一项全球、多中心、双盲、随机对照的Ⅲ期临床研究,旨在评估Inavolisib联合哌柏西利和氟维司群 vs 安慰剂联合哌柏西利和氟维司群治疗在PIK3CA突变HR+/HER2-局部晚期或转移性乳腺癌患者中的疗效和安全性。
研究共入组了325例经组织或ctDNA检测确定为PIK3CA突变,在辅助内分泌治疗期间或治疗完成后12个月内发生疾病进展,且既往未接受过针对局晚/转移性疾病治疗的HR+/HER2-患者,并按1:1被随机分配至试验组进行Inavolisib(9mg po qd)+哌柏西利(125mg po qd, D1-D21)+氟维司群(500mg im C1D1/15,Q4W)治疗或对照组进行安慰剂(po qd)+哌柏西利(125mg po qd, D1-D21)+氟维司群(500mg im C1D1/15,Q4W)治疗,直至进展或者毒性不耐受或缺乏临床获益。研究的主要终点是研究者评估的PFS,次要终点包括总生存期(OS)、客观缓解率(ORR)和临床获益率(CBR)等。(图1)
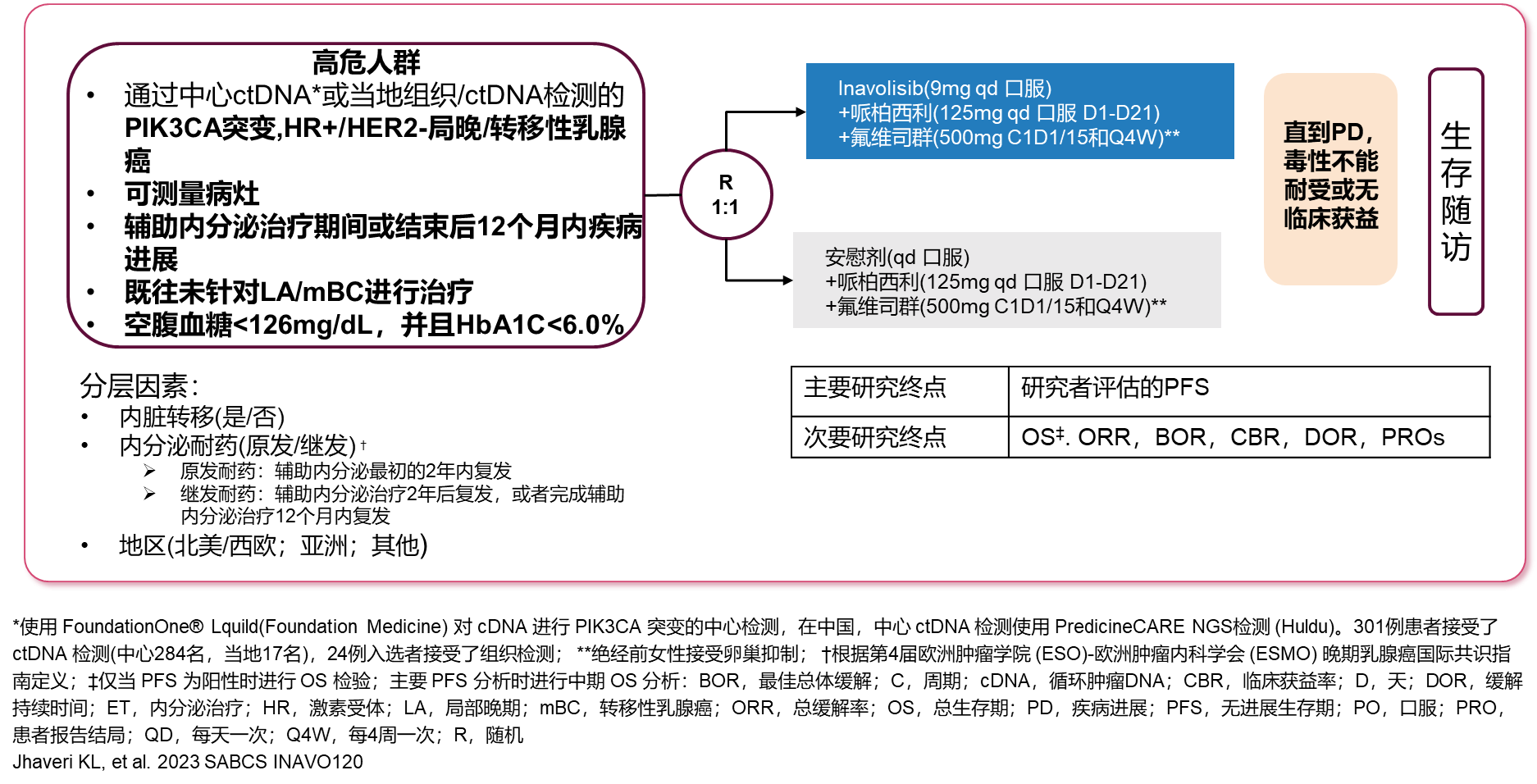
图1 研究设计
试验组的中位治疗时长9.2个月后,42%的患者仍然在接受Inavolisib治疗;而对照组在中位治疗5.6个月后,30%的患者仍然在接受安慰剂治疗[3]。中位随访21.3个月时,两组的中位PFS分别15.0个月 vs 7.3个月(分层HR= 0.43,95%CI 0.32-0.59;p<0.0001)。试验组显著延长患者PFS达7.7个月,实现超双倍获益,降低疾病进展或死亡风险达57%[3]。且各亚组获益一致——无论是在不同区域如亚洲、北美/西欧、其他,还是在绝经前/后、肝转移是/否、原发内分泌耐药/继发内分泌耐药等关键性亚组中,接受Inavolisib+哌柏西利+氟维司群治疗的患者均观察到与总人群一致的获益[3]。
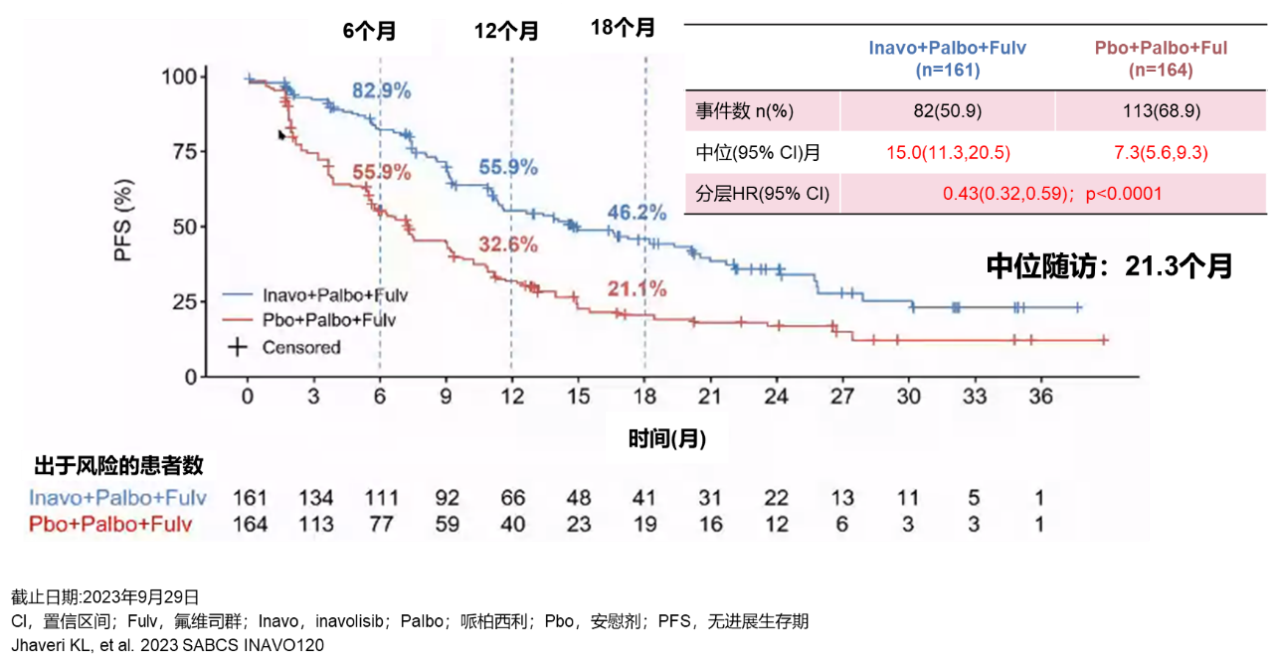
图2 主要研究终点PFS(研究者评估,中位随访21.3个月)
虽然试验组的中位OS尚未达到NE(范围:27.3,NE),但已可见到明显的OS获益趋势。ORR和CBR也观察到明显优势,试验组的ORR达58.4%,较对照组提高了33.4%(58.4% vs. 25.0%);CBR达75.2%,较对照组提高了28.2%(75.2% vs. 47.0% )[3]。
安全性方面,临床最常见的任意级别不良反应(AE)为中性粒细胞减少、高血糖、口腔炎/黏膜炎症、皮疹和腹泻。Inavolisib联合哌柏西利和氟维司群的安全性特征可管理,安全性特征与单个药物一致,且在每个药物的最大耐受剂量(MTD)上未发现新的安全性信号[3]。
基于INAVO120研究的积极结果,美国食品药品监督管理局(FDA)授予Inavolisib三联疗法突破性疗法认定(BTD),受理Inavolisib的上市申请,并授予其优先评审资格。Inavolisib亦被纳入中国国家药品监督管理局药品审评中心(CDE)优先审评通道,这将大大加快其审评进程,缩短评审时限,为药品的加速上市起到关键作用。
2024 ASCO:Inavolisib三联疗法带来持续获益
本次ASCO会议中,INAVO120研究更新了额外的疗效数据,并详细分析了安全性数据及患者报告结果(PRO)数据。结果显示[4],中位随访21.3个月时,两组的中位PFS2(从随机分组到下一步治疗结束的时间)分别为24.0个月 vs 15.1个月(分层HR=0.54,95%CI:0.38-0.77)(图3),充分证实了Inavolisib联合治疗对后续治疗的持久影响,PFS2提示了患者的远期生存获益,为临床治疗决策提供有价值的参考。两组分别有40.4%(65/161)和50.0%(82/164)接受后续治疗,其中试验组中61.5%(40/65)的患者接受化疗,对照组中73.2%(60/82)的患者接受化疗。两组至首次化疗的时间(TTFC)分别为NE vs 15.0个月(未分层HR=0.54,95%CI:0.38-0.78)(图4)。可见Inavolisib三联疗法的使用与疾病进展后的持续获益相关。该治疗方案可以延迟包括化疗在内的后续治疗需求长达8.9个月,充分显示出基于Inavolisib治疗的临床益处。
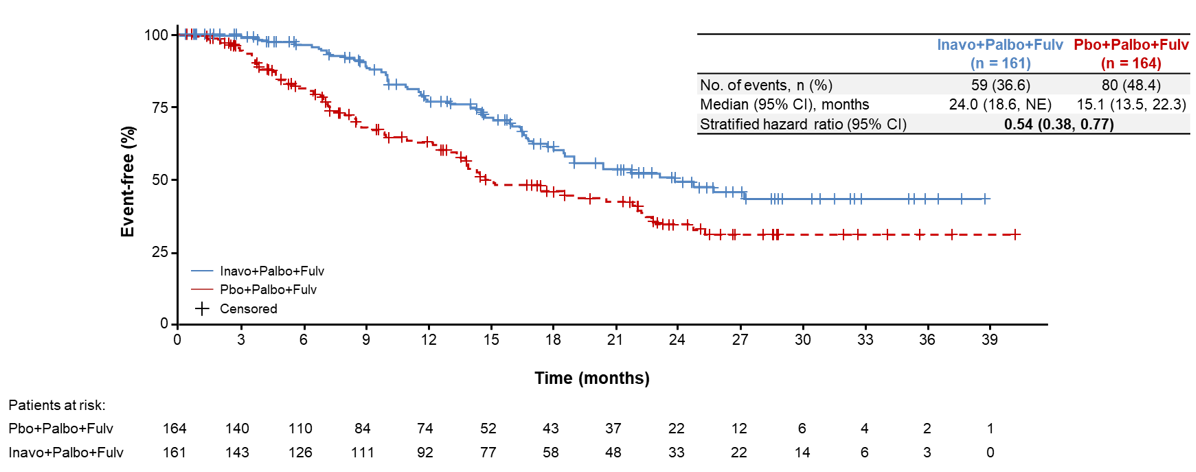
图3 PFS2结果
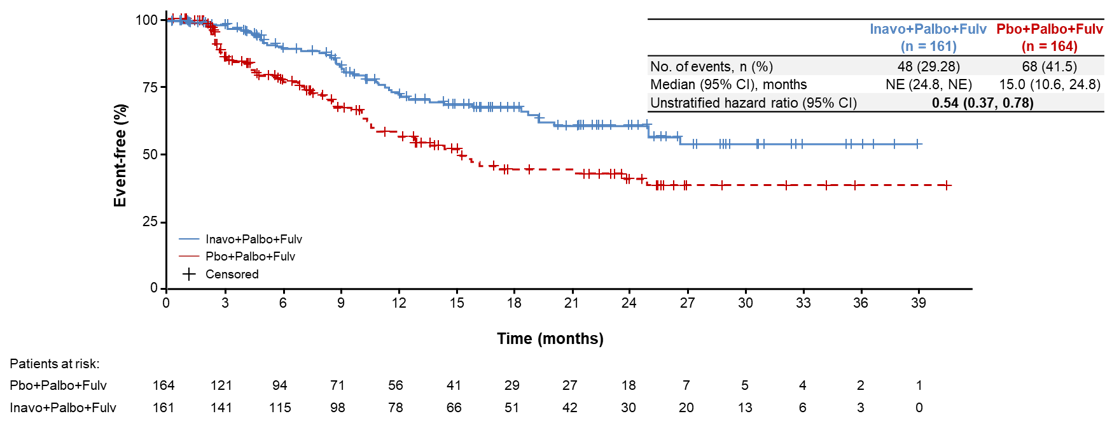
图4 TTFC结果
安全性方面,临床报告的关键不良反应(AE)包括高血糖、腹泻、皮疹、口腔炎/黏膜炎症。对照组中报告的AE均为1-2级,试验组报告了3级的高血糖、腹泻、口腔炎/黏膜炎症。试验组中,高血糖、腹泻、皮疹、口腔炎/黏膜炎症的中位发生时间分别为7、15、29和13天(图5)。严重血糖和口腔炎事件比例低:≥3级高血糖发生率5.6%,口腔炎和黏膜炎5.6%。因高血糖、口腔炎和黏膜炎而停药的患者比例均为0.6%(各1例),因任何AE而停用Inavolisib的比例仅为6.2%[4]。
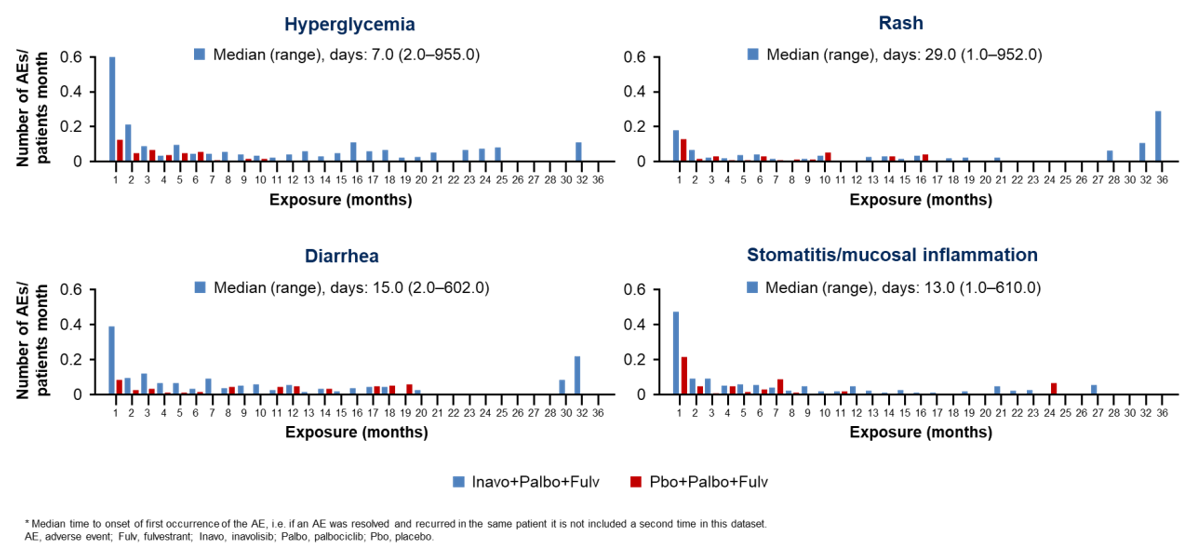
图5 关键AE的发生时间
PRO方面,简短疼痛量表(BPI-SF)评估的疼痛严重程度数据分析可见,与对照组相比,试验组患者确认达到最严重疼痛的时间更晚(30.9个月 vs 18.1个月,HR=0.74,95%CI:0.48-1.13)[4]。两组大多数患者报告的最严重的不良反应水平均为中等或更低。与对照组相比,试验组患者发生腹泻、口腔溃疡、皮疹的严重程度更高。但大多数患者对治疗相关AE的担心程度为“完全没有”或“有一点”,且两组患者在治疗期间均保持了日常功能和健康相关的生活质量,加用Inavolisib并未对患者产生不良影响。因高血糖、腹泻、皮疹和口腔炎/黏膜炎症而停用Inavolisib的患者数量极少,进一步证实Inavolisib具有可控的安全性和良好的耐受性。
未来可期:Inavolisib三联方案重塑复发内分泌耐药PIK3CA突变HR+乳腺癌治疗格局
PIK3CA突变是HR+/HER2-晚期乳腺癌中最常见的突变基因。相比PIK3CA野生型患者,PIK3CA突变HR+/HER2-晚期乳腺癌患者的预后通常较差,且对传统内分泌和化疗的响应不佳。近年来,随着临床对PIK3CA突变认知的不断深入,Inavolisib等PI3Kα抑制剂在PIK3CA突变HR+/HER2-晚期乳腺癌治疗中逐渐崭露头角。尽管国外已有药物获批用于PIK3CA突变HR+/HER2-晚期乳腺癌患者的治疗,但中国尚无针对此类患者的PI3K抑制剂获批上市。PIK3CA突变HR+/HER2-晚期乳腺癌患者的临床治疗需求远未被满足。
Inavolisib是中国首个且唯一高选择性PI3Kα抑制剂,可通过三药联合三重阻断信号通路,逆转或延缓耐药,精准切中PIK3CA突变患者内分泌治疗耐药患者的临床需求,开辟了PIK3CA突变、内分泌治疗耐药的HR+/HER2-晚期乳腺癌的治疗新格局。继2023 SABCS上以超双倍获益的PFS亮相后,INAVO120研究于此次2024 ASCO上,再携PFS2的惊艳数据引起了高度关注与广泛讨论。
此外,Inavolisib三联疗法的安全性数据同样亮眼,更新的INAVO120研究数据显示,Inavolisib三联疗法安全易管理,与现有标准治疗相比未发现新的安全性事件。且Inavolisib的加用在不影响患者日常功能和生活质量、不增加治疗负担的同时,能延长患者疼痛恶化的平均时间达12.8个月。
可以说,Inavolisib三联疗法为PIK3CA突变的HR+/HER2-乳腺癌患者提供了一种新的、更有效的治疗选择,并有望成为这类患者的一线标准治疗模式。期待Inavolisib尽早上市可及,为更多国内乳腺癌患者带来精准靶向治疗获益。同时,也期待临床高度重视PIK3CA突变检测,建立标准化PIK3CA检测临床路径,致力于为每一位突变患者提供更优的精准诊疗方案。只有病理、临床实现双向奔赴,才能携手同行,共同绘就PIK3CA突变乳腺癌精准治疗时代的全新蓝图。
1] 郑莹, 等. 中国癌症杂志, 2013(08):10-18.
[2] N Vasan, et al.Ann Oncol.2019 Dec 1;30(Suppl 10):x3-x11.
[3] Jhaveri KL, et al. 2023 SABCS INAVO120
[4] Dejan Juric, et al. 2024 ASCO INAVO120
排版编辑:肿瘤资讯-Awa











 苏公网安备32059002004080号
苏公网安备32059002004080号


