人类表皮生长因子受体2(HER-2)是胃癌治疗的经典靶点,2010年,抗HER-2单克隆抗体曲妥珠单抗成功开启了胃癌的精准靶向治疗时代[1],但是此后胃癌抗HER-2靶向治疗探索一度陷入瓶颈,直到近年来靶向HER-2的抗体偶联药物(ADC)在胃癌中取得突破。厦门大学附属第一医院王文一医师分享1例HER-2(3+)晚期胃癌病例:患者女性,38岁,胃中-低分化腺癌IV期,二线治疗进展后采用我国自主研发的抗HER-2 ADC维迪西妥单抗联合PD-1单抗治疗2周期达到部分缓解(PR),无进展生存期(PFS)已达到7个月。目前患者总生存期(OS)已超过26个月。【肿瘤资讯】将病例诊疗过程整理如下,并邀请厦门大学附属第一医院李佳艺教授对病例进行点评,以飨读者。
病例介绍
专家介绍
肿瘤学硕士
基本情况
患者,女性,38岁。
主诉:因“右下腹痛3月”于2021年12月入院。
既往史:2009年、2018年两次剖腹产育2子,2014年行“阑尾切除术”。
月经史:初潮14岁,4天/30天,末次月经:2021-11-1。2012年起反复痛经,当地医院诊断:“子宫内膜异位症”。
个人史:无特殊。
家族史:无特殊。
ECOG评分:1分。
既往诊疗经过
2021年9月 因“右下腹持续性闷痛,伴肛门坠胀”于当地医院就诊。
2021年9月22日 肿瘤指标检查示:CEA、CA125正常,CA199:165.3U/ml。诊断“痛经”,予亮丙瑞林治疗未缓解。
本次诊疗经过
2021年12月27日 肿瘤指标检查示:CEA:44.88ng/ml,CA125:83.64U/ml,CA199:7719.0U/ml,CA724:115U/ml。
2021年12月27日 胃镜示:胃窦巨大溃疡,胃体胃角粘膜粗大隆起,充气不良。超声胃镜示:病变部位粘膜层次消失,回声紊乱,增厚明显,最厚2.7cm,浆膜层受累,浆膜外可见肿物,腹腔多发肿大淋巴结(图1)。
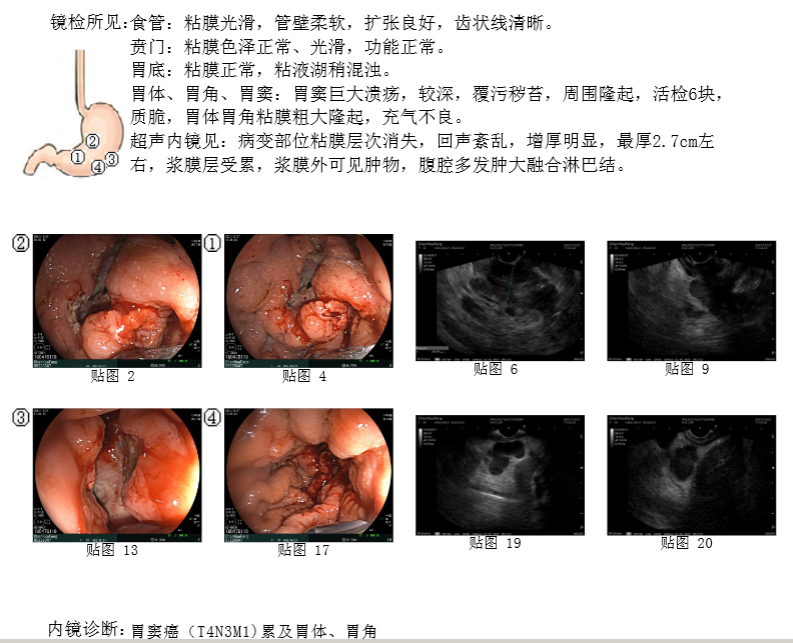
图1 2021年12月胃镜
2021年12月 病理示:(胃)中-低分化腺癌,HER-2(3+),MLH1+、PMS2+、MSH2+、MSH6+、PD-L1(22C3) CPS=3,EBER(-),MSI-L(图2)。
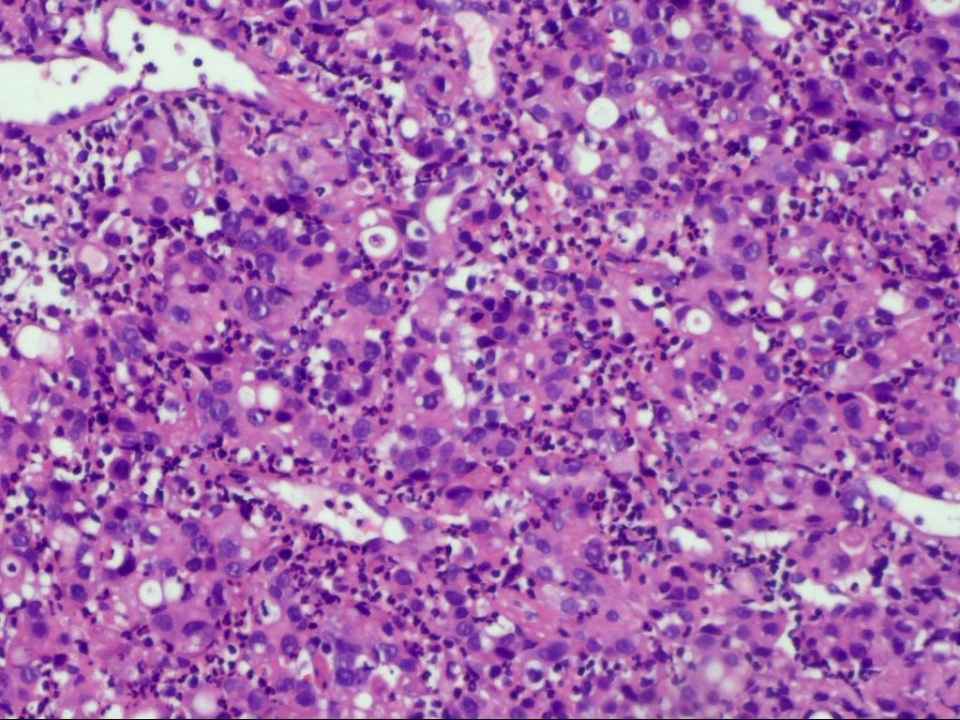
图2 2021年12月病理
2021年12月29日 PET-CT示:胃壁弥漫性不规则增厚,SUVmax=14.73,胃周、腹膜后多发肿大淋巴结,部分融合,大者4.2×3.7cm,SUVmax=9.28;左锁骨上淋巴结,大者1.5×0.9cm,SUVmax=5.33;腹膜多发转移,大者5.0×3.7cm,SUVmax=15.03;
左附件转移,3.4×3.1cm,SUVmax=12.26;右附件转移,4.9×4.3cm,SUVmax=16.32(图3)。
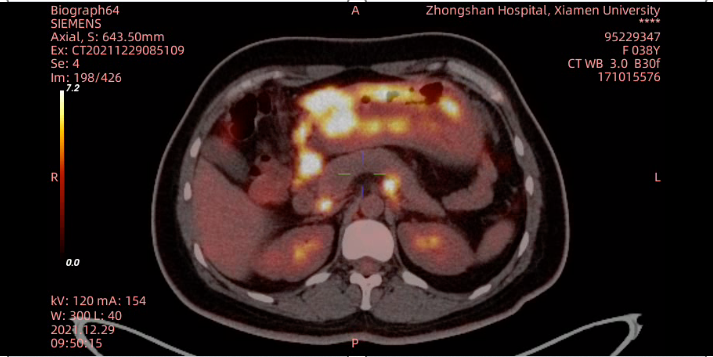
图3 2021年12月PET-CT
临床诊断:1.胃恶性肿瘤中低分化腺癌,同时性双侧卵巢转移、胃周、腹膜后、左锁骨上淋巴结转移、腹膜转移,cT4aN3M1,IV期,P1c,HER-2 3+、CPS=3、pMMR、MSI-L、EBER-;2.子宫内膜异位症;3.阑尾缺如(术后)。
胃癌卵巢转移临床分型:C-GCOM分型:IIIa型(不可切除型)。
一线治疗2022.1.5-2022.6.9
2022年1月5日至2022年6月9日 行PD-1单抗+H+XELOX治疗8周期,具体为:PD-1单抗 200mg d1、曲妥珠单抗 (首剂488mg) 366mg d1、奥沙利铂 200mg d1、卡培他滨:1.5g bid d1-14 q3w。
最佳疗效:PR。
MDT建议手术探查,争取行肿瘤减灭术,患者拒绝。
2022年3月 腹泻3级,粪常规:脓细胞 10-15/HP OB弱阳性。肠镜:全结肠及直肠充血、水肿、糜烂(图4)。病理:药物性肠炎不能除外(图5)。
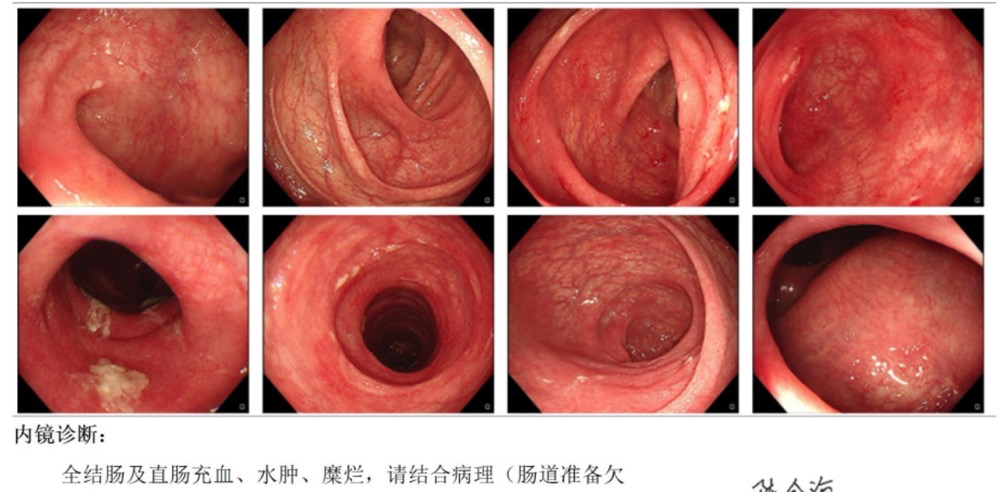
图4 2022年3月肠镜
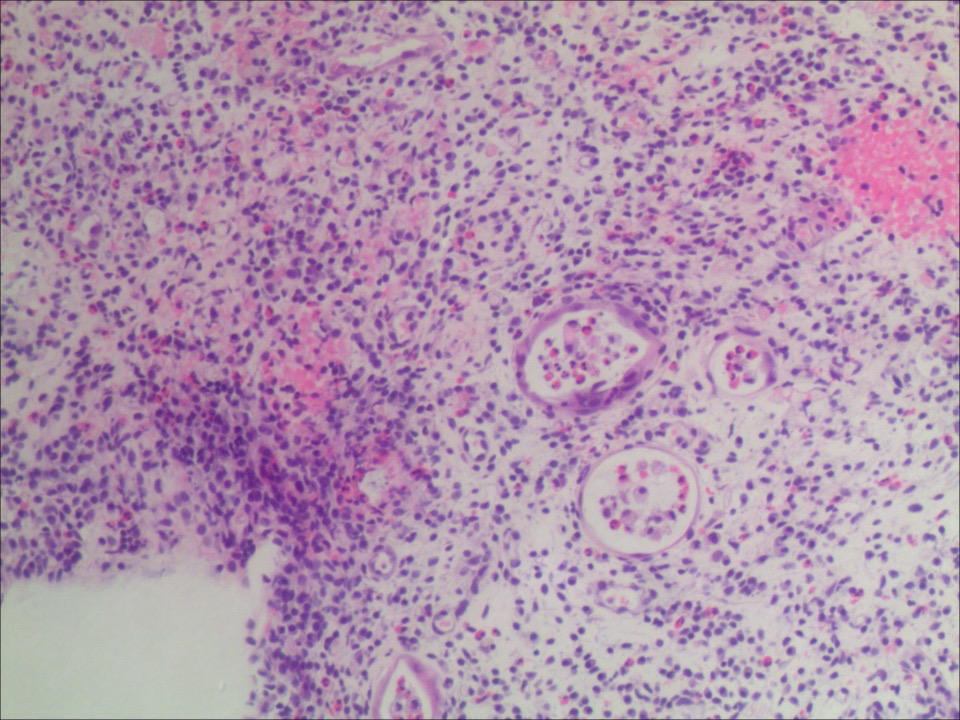
图5 2022年3月肠镜病理
2022年6月30日 PET-CT示:1.胃窦病灶、双侧附件区病灶体积较前缩小,FDG代谢减低,但仍具部分代谢活性。左锁骨上、胃周、腹膜后多发高代谢肿大淋巴结未见显示,局部残余低代谢小淋巴结,考虑治疗后病情部分缓解;2.中央骨髓代谢弥散增高,考虑化疗后骨髓增生活跃;3.双肺散在炎性灶,建议随诊(图6)。评效:PR。
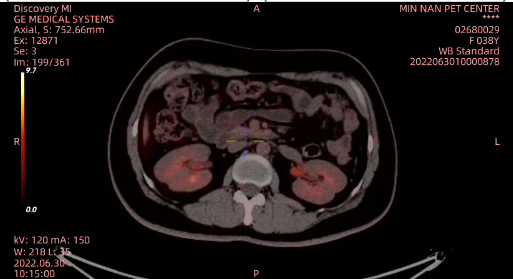
图6 2022年6月PET-CT
2022年6月30日至2022年9月1日 给予PD-1单抗+H+CAP 维持治疗4周期。
2022年9月 PET-CT示:PR(图7),MDT讨论认为转化成功,可以手术。
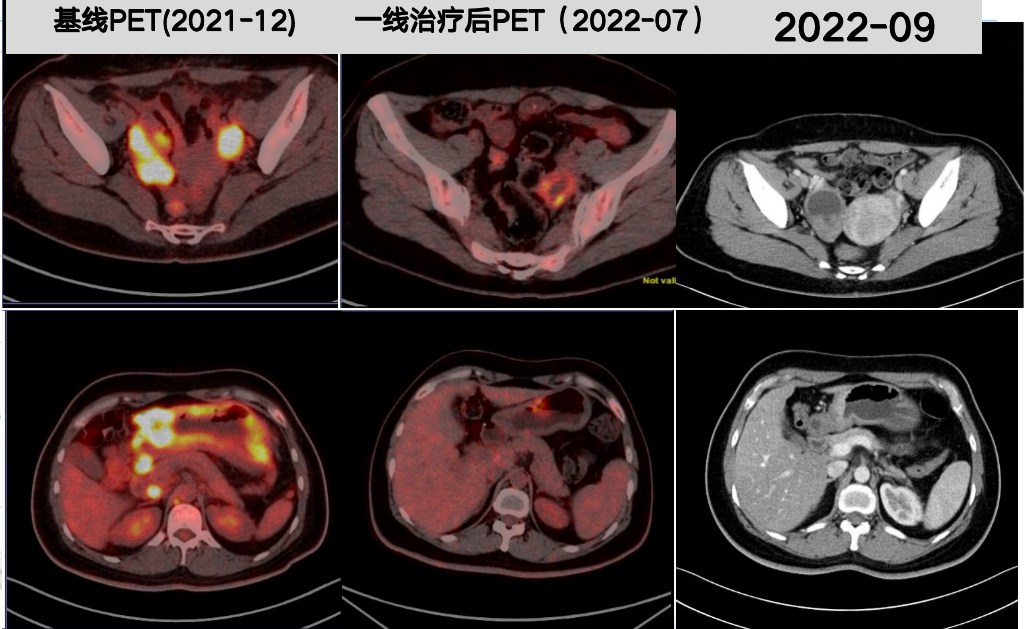
图7 2022年9月PET-CT
2022年9月21日 行腹腔镜探查术,术中所见:胃窦大弯侧肿瘤约3cm,局部累及浆膜层,呈化疗后退缩样反应,胃周淋巴结可见肿大,呈化疗后退缩样反应,右侧卵巢约10cm大囊实性肿瘤,左侧卵巢约3cm囊实性肿物,腹膜后淋巴结可见肿大呈化疗后退缩样反应,所见肝脏表面脾脏表面、腹盆腔未见明显种植结节。行根治性远端胃大部切除术+双侧卵巢输卵管切除术。术后病理示:(新辅助化疗后,远端胃切除标本)胃中-低分化腺癌及印戒细胞癌,部分区域伴黏液分泌,大小约3×1.5×1cm,癌浸润胃肌壁全层并浸透浆膜层,部分肿瘤细胞退变,间质纤维增生伴多量淋巴细胞浸润,呈化疗反应,肿瘤退缩分级(2级);间质见脉管癌栓,肌间神经束见癌累及;上切端、下切端及网膜组织均未见癌累及;周围胃粘膜呈慢性中度非萎缩性胃炎。(左侧卵巢及输卵管)卵巢见癌累及,间质脉管内见癌栓,输卵管黏膜呈慢性炎。(右侧卵巢及输卵管)卵巢见癌累及,间质脉管内见癌栓,输卵管黏膜呈慢性炎。淋巴结(7/25枚)见癌转移(18枚见化疗后反应),其中:胃小弯侧淋巴结(4/17枚),胃大弯侧淋巴结(1/1枚),幽门上淋巴结(0枚),幽门下淋巴结(2/7枚);其中3枚转移灶>2mm。免疫组化结果:CK8(+),SYN(-),CEA(+),Her2(3+),P53(80%强+),MLH1(+),PMS2(+),MSH2(+),MSH6(+),Ki67(60%+),EBER(-)(图8)。术后分期:ypT4aN3aM1,TRG2级。
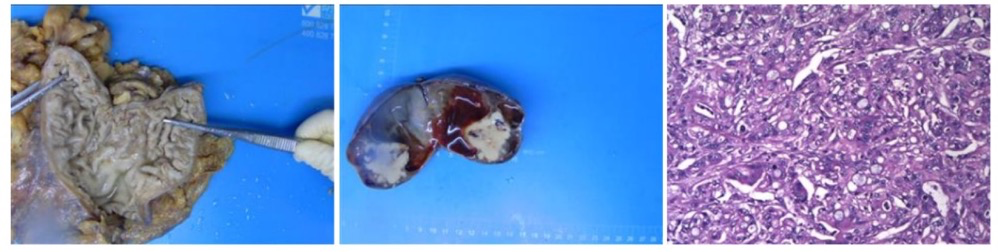
图8 2022年9月术后病理
2022年10月28日至2023年4月7日 给予PD-1单抗+H+CAP术后辅助治疗。监测肿瘤标志物,定期增强CT检查。
2022年11月、2023年2月 术后增强CT复查示:胃吻合口及双附件区未见复发;左锁骨上及腹膜后淋巴结(非靶病灶)(图9)。评效:非完全缓解(nonCR)/非疾病进展(nonPD)。
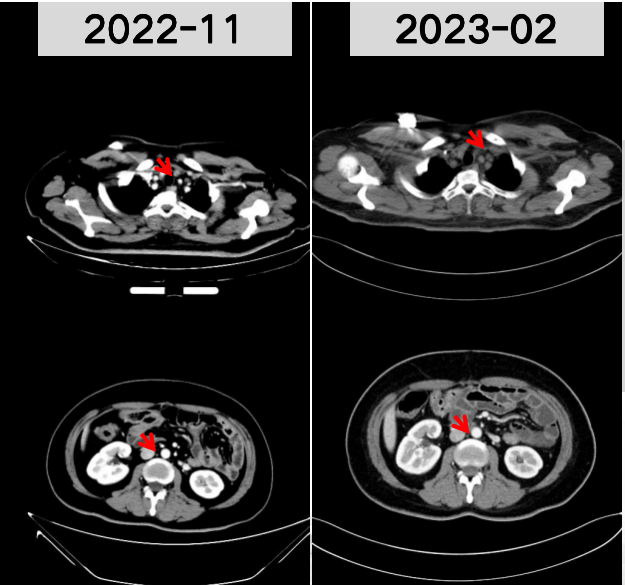
图9 2022年11月和2023年2月术后增强CT
2023年4月26日 PET-CT示:腹膜后、左锁骨上淋巴结转移,腹壁及双侧附件区、腹膜转移(图10)。评效:疾病进展(PD)。
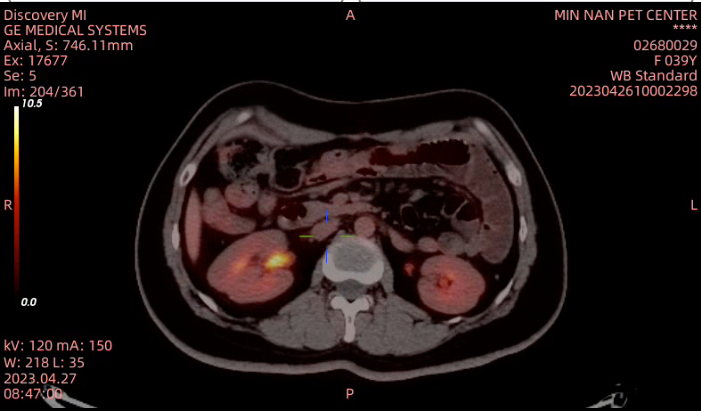
图10 2023年4月PET-CT
2023年4月28病理:(前腹壁穿刺标本)浸润性中-低分化腺癌。结合病史考虑胃癌转移来源(图11)。
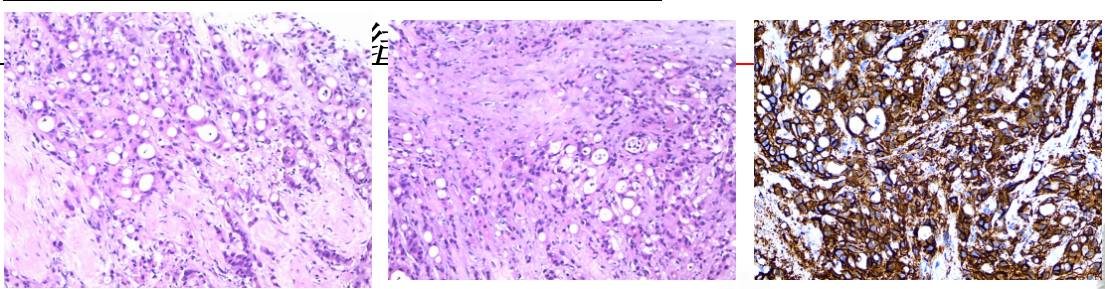
图11 2023年4月病理
二线治疗
2023年5月18日至2023年7月20日 入组DS-8201a单药头对头对比HER-2阳性晚期胃癌标准二线治疗方案的Ⅲ期临床试验(DESTINY-GASTRIC04),具体方案为:DS8201a 394.24 mg q3w。治疗2周期评效:PR。治疗4周期评效:PD(图12)。
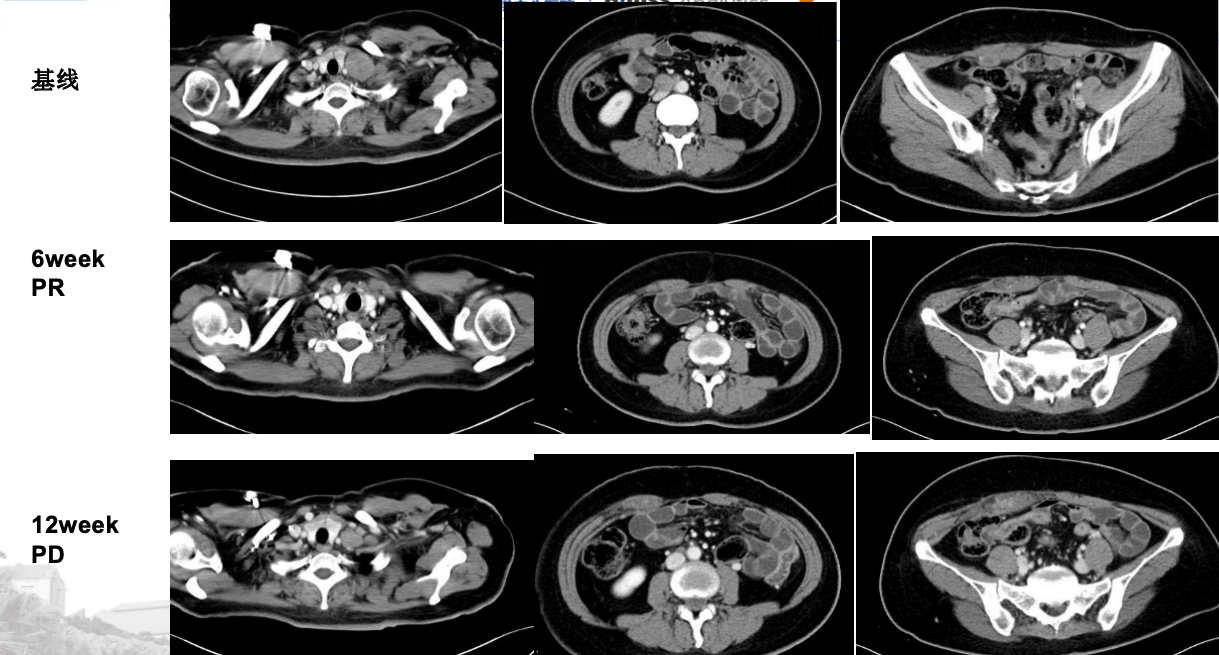
图12 2023年6月和7月增强CT
三线治疗
2023年8月14日至2024年2月20日 行PD-1单抗+维迪西妥单抗治疗。具体:维迪西妥单抗 150mg q2w+PD-1 200mg q4w。
2023年10月10日全腹部增强CT示:与2023-8-9 CT比较:1.残胃充盈不佳,吻合口壁略增厚较前相仿,食管下段贲门区稍增厚同前,腹膜后肿大淋巴结较前未见,右侧腹膜及右腹直肌深方多发转移灶较前缩小,请结合临床、增强MR检查;2.左附件区囊样灶,较前相仿,请结合MR增强检;3.盆腔少量积液较前略减少,余同前,随诊(图13)。评效:PR。
2024年1月9日 全腹部增强CT示:与2023-10-10 CT比较:1.残胃吻合口壁未见明显增厚,食管下段贲门部稍增厚同前,右侧腹膜及右腹直肌深方多发转移灶较前相仿,请结合临床及增强MR检查随诊;2.原盆腔少量积液已较前吸收好转,余同前,随诊(图13)。评效:持续PR。
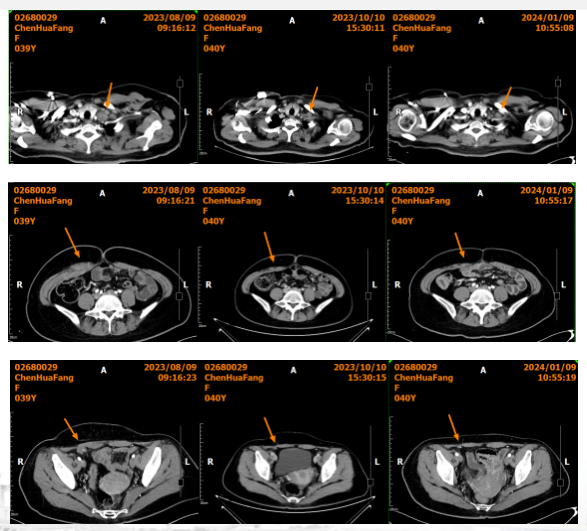
图13 2023年10月和2024年1月全腹增强CT
2024年3月 PET-CT示:与2023-04本院PET-CT对比:1.腹膜后、盆腔、双侧髂血管旁多发肿大淋巴结大部消失,局部残留低摄取小淋巴结,盆腔、前腹壁、腹膜病灶较前缩小,局部腹膜残留稍高摄取结节,考虑治疗后病情明显缓解,建议定期复查;2.双肺散在炎性灶(图14)。评效:持续PR。
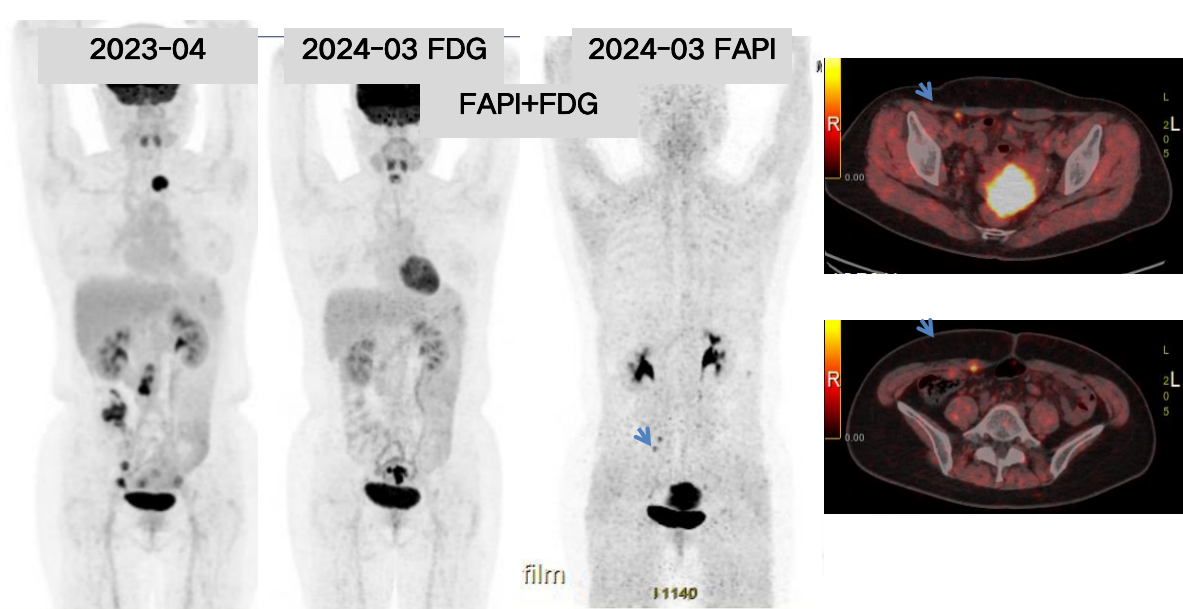
图14 2024年3月PET-CT
诊疗经过见图15。
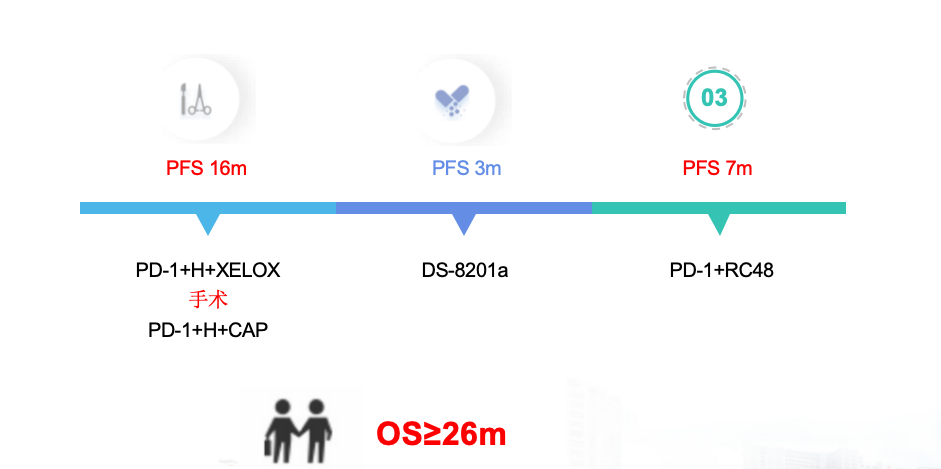
图15 诊疗经过
病例总结:
该患者中年女性,胃中-低分化腺癌IV期,HER-2(3+)。一线采用PD-1单抗+曲妥珠单抗+化疗达到PR,获得根治性手术机会,行根治性远端胃大部切除术+双侧卵巢输卵管切除术,术后给予PD-1单抗+曲妥珠单抗+化疗辅助治疗,评效nonCR/nonPD。术后7个月进展,入组DS-8201a临床试验,治疗2周期达到PR,4周期后PD。三线采用维迪西妥单抗+PD-1单抗治疗2周期达到PR,PFS已达到7个月。目前患者OS已超过26个月。
病例点评
专家介绍
厦门大学附属第一医院肿瘤内科主任医师,硕士生导师
中国临床肿瘤学会(CSCO)免疫治疗专家委员会委员
第二届中国研究型医院学会肿瘤专业委员会常务委员
北京癌症防治中心食管癌专业委员会青委副主任委员
中国女医师协会临床肿瘤专业委员会委员
中华医学会肠内肠外营养分会NUSOC协作组委员
福建省抗癌协会肿瘤康复专业委员会委员
福建省抗癌协会肿瘤营养与支持治疗专业委员会委员
厦门市医师协会肿瘤医师分会消化肿瘤MDT学组组长
既往两项大型多中心研究数据显示,我国胃癌患者HER-2阳性率为12%~13%[2]。
2010年,ToGA研究[2]首次证明曲妥珠单抗联合化疗较单纯化疗显著延长HER-2阳性晚期胃癌患者的生存期,奠定了曲妥珠单抗联合化疗的标准一线治疗地位。2021年,KEYNOTE-811研究[3]证实,对于HER-2阳性晚期胃癌患者,在曲妥珠单抗联合化疗基础上联合PD-1单抗一线治疗可以显著提高客观缓解率(ORR)和中位PFS,丰富了临床治疗选择。与此同时,靶向HER-2的ADC药物异军突起,为HER-2阳性晚期胃癌全程管理提供了新的有力武器。
ADC是一类通过连接子将细胞毒性药物连接到单克隆抗体的靶向生物制剂,将单克隆抗体作为载体将小分子细胞毒性药物以靶向的方式高效地运输至目标肿瘤细胞中。维迪西妥单抗是我国首个自主研发的ADC类药物,由全新HER-2单克隆抗体、组织蛋白酶可裂解连接子和MMAE组成,具有高亲和力、强大杀伤力和良好的安全性[4]。在维迪西妥单抗治疗≥2线标准治疗失败的HER-2 IHC 3+及HER-2 IHC 2+晚期胃癌患者的关键研究C008[5]中,ORR达到24.8%,疾病控制率(DCR)为42.4%,中位PFS为4.1个月,中位OS达到7.9个月。安全性方面,主要不良反应为血液学毒性,未发现间质性肺炎、心脏毒性等严重不良反应,无治疗相关死亡。基于C008研究结果,维迪西妥单抗于2021年6月在国内获批用于至少接受过2种系统化疗的HER-2过表达局部晚期或转移性胃癌患者[5]。2023版中国临床肿瘤学会(CSCO)胃癌诊疗指南将维迪西妥单抗作为HER-2阳性(IHC3+或2+)晚期胃癌三线及以上治疗I级推荐[6]。
本例患者为HER-2(IHC 3+)中-低分化胃腺癌合并全身多发转移,一线PD-1单抗+曲妥珠单抗+化疗治疗后转化为可切除,术后原方案辅助治疗,PFS达到16个月。二线治疗使用ADC 药物DS-8201a单药治疗达到PR,但是很快进展,PFS仅为3个月。三线采用维迪西妥单抗联合PD-1单抗治疗,2周期达到PR,PFS已经达到7个月。近期发表的一项探索性I期临床研究结果提示,维迪西妥单抗联合特瑞普利单抗治疗二线及以上胃癌患者的ORR达43%,持续缓解时间(DOR)为5.1个月,DCR为75%,中位PFS 为6.2个月,中位OS为 16.8个月,且安全性良好[7]。相信随着研究证据的不断积累,ADC联合免疫治疗将应用于HER-2过表达晚期胃癌患者的前线治疗,给患者带来更多生存获益。
[1] 中国抗癌协会胃癌专业委员会, 中国抗癌协会肿瘤内镜学专业委员会. 胃癌胃镜活检标本HER-2检测中国专家共识(2023版)[J]. 中国肿瘤临床, 2023, 50(19): 973-982.
[2] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER-2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
[3] Janjigian YY, Kawazoe A, Yañez P, et al. The KEYNOTE-811 trial of dual PD-1 and HER-2 blockade in HER-2-positive gastric cancer. Nature. 2021 ;600(7890):727-730.
[4] 中国抗癌协会肿瘤药物临床研究专业委员会, 国家抗肿瘤药物临床应用监测专家委员会, 国家肿瘤质控中心乳腺癌专家委员会, 等. 抗体药物偶联物治疗恶性肿瘤临床应用中国专家共识(2023版)[J]. 中华肿瘤杂志, 2023, 45(9):741-762.
[5] Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER-2 therapeutic antibody RC48 in patients with HER-2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond). 2021;41(11):1173-1182.
[6] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胃癌诊疗指南[M]. 北京:人民卫生出版社,2023.
[7] Yakun Wang, Jifang Gong, Airong Wang, et al. Disitamab vedotin (RC48) plus toripalimab for HER2-expressing advanced gastric or gastroesophageal junction and other solid tumours: a multicentre, open label, dose escalation and expansion phase 1 trial. EClinicalMedicine. 2024;68:102415.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


