骨髓增生异常/骨髓增殖性肿瘤伴环形铁粒幼细胞及血小板增多(MDS/MPN-RS-T)是MDS/MPN的一种罕见亚型,占MDS不到1%,其临床特征包括骨髓环形铁粒幼细胞(RS)≥15%和持续血小板增多,中位生存期约为75个月。鉴于MDS/MPN-RS-T中SF3B1的高频率突变及其与骨髓RS之间的相关性,2022年世界卫生组织(WHO)诊断分型标准将RS<15%且SF3B1突变阳性的患者重新归类为MDS/MPN伴SF3B1突变和血小板增多(MDS/MPN-SF3B1-T)。尽管既往的研究表明,年龄>80岁、血红蛋白(Hb)<100g/L、异常核型和ASXL1和/或SETBP1突变等是MDS/MPN-RS-T患者生存的不良预后因素,但相关的预后积分系统均未得到进一步验证,此外,患者纳入上述队列的原则均基于2008年或2016年WHO诊断分型标准。
基于此,中国医学科学院血液病医院(中国医学科学院血液学研究所)肖志坚/徐泽锋教授团队开展了一项研究,根据2022年WHO诊断分型标准,该研究共纳入2006年6月至2023年8月于该院就诊的180例MDS/MPN-SF3B1-T的患者,其中122例患者就诊时有二代测序数据,该研究基于所有患者(训练队列1,n=180)和有二代测序数据的患者(训练队列2,n=122)分别建立了临床预后模型和临床-分子预后模型,并以cBioPortal平台上纳入分子遗传学的国际预后积分系统(IPSS-M)队列中的43例MDS/MPN-RS-T患者作为外部验证队列。近日,该研究结果已发表于Leukemia杂志。

根据2022年WHO分类的MDS/MPN-SF3B1-T临床特征和分子图谱
MDS/MPN-SF3B1-T患者确诊时的中位年龄为65岁(57~70岁),中位Hb、中位血小板计数(PLT)和中位骨髓RS分别为74 g/L(63~88 g/L)、552×109/L(487~718×109/L)和38%(24~57%)。
在本研究中,有169例患者的细胞遗传学数据可供评估。共有135例(79.9%)患者的核型正常,5例(3.0%)患者具有复杂核型。在134例(89.3%)患者中检测到SF3B1突变。SF3B1的特定突变包括K700E(61.2%)、K666N/R/E/M/Q/T(18.7%)、H625C/G/H/L(9.0%)和H662Q/Y(8.2%)(图1A)。
在接受NGS检测的122例患者中,MDS/MPN-SF3B1-T的常见突变基因包括 SF3B1(93.4%)、JAK2(32.8%)、TET2(29.5%)、DNMT3A(21.3%)、ASXL1(17.2%)、TP53(8.2%)、MPL(6.6%)、SETBP1(6.6%)和 SRSF2(4.9%)(图1B)。
对MDS/MPN-SF3B1-T中不同基因突变的相关性分析表明,任何两个基因突变的相关系数均低于0.3(P>0.05),表明相关性较弱。46例(37.7%)患者同时携带SF3B1和MPN驱动基因突变,其中2例患者同时携带SF3B1、JAK2和MPL突变。
与Mayo-Moffitt队列中诊断为MDS/MPN-RS-T的患者(n=158)相比,本研究队列中符合2022 WHO定义的MDS/MPN-SF3B1-T的患者(训练队列1,n=180)的中位年龄更小(65岁 vs. 71岁),中位Hb更低(74g/L vs. 95g/L),TET2突变的比例更高(29. 5% vs. 7.0%,P=0.003)。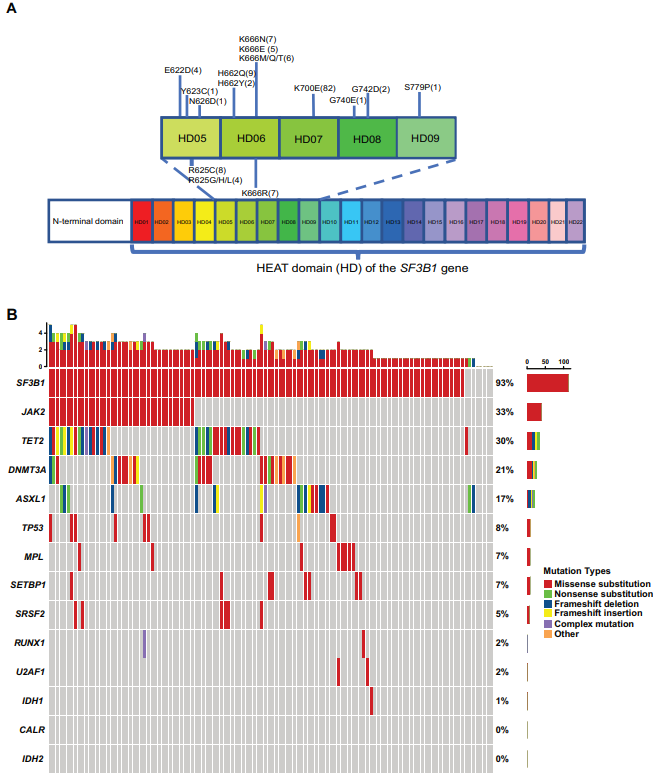
图1. 按BM RS百分比分类的180例MDS/MPN-SF3B1-T患者的临床和实验室特征
骨髓RS<15%和骨髓RS≥15%的MDS/MPN-SF3B1-T患者比较
研究人员将180例MDS/MPN-SF3B1-T患者分为两组:骨髓RS<15%的患者(n=24)和骨髓RS≥15%的患者(n=156)。通过NGS或Sanger测序,在24例骨髓RS<15%的患者中至少检测到一个SF3B1基因突变。骨髓RS<15%的患者中男性比例更高(83.3% vs.54.5%,P=0.008),中位乳酸脱氢酶水平更高(300.5 U/L vs. 204.2 U/L,P=0.002)。
两组患者在诊断年龄、血细胞计数、核型分层或分子图谱方面无明显差异。1例骨髓RS<15%的患者和15例骨髓RS≥15%的患者失去随访。骨髓RS<15%患者的中位OS(n=23;41个月)明显低于骨髓RS≥15%患者(n=141;76个月)(P<0.001)(图2)。然而,骨髓RS 5~15%的患者(n=12;41个月)与骨髓RS<5%的患者(n=11;38个月)相比,中位OS没有差异(P=0.905)。
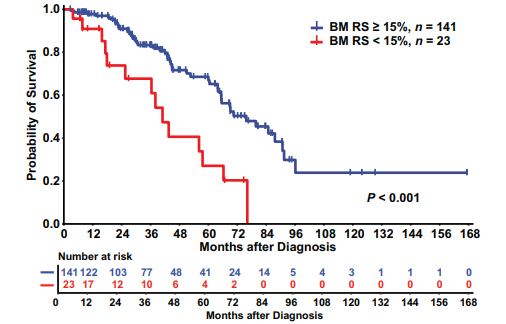
图2. MDS/MPN-SF3B1-T患者中骨髓RS≥15%的患者与骨髓RS<15%的患者生存率比较
MDS/MPN-SF3B1-T患者的OS预后因素
所有MDS/MPN-SF3B1-T患者的中位OS为69个月。确诊后发生白血病转化和血栓事件的患者分别为11例(8.7%)和4例(4.0%)。
OS的单变量分析显示,年龄≥65岁(P<0.001)、Hb<80g/L(P=0.090)、PLT≥800×109/L(P=0.087)、骨髓RS<15%(P<0.001)、IPSS-R细胞遗传学类别中级/差/极差(P=0.005)、SETBP1突变(P=0.061)和SRSF2突变(P<0.001)与患者生存率低有关。
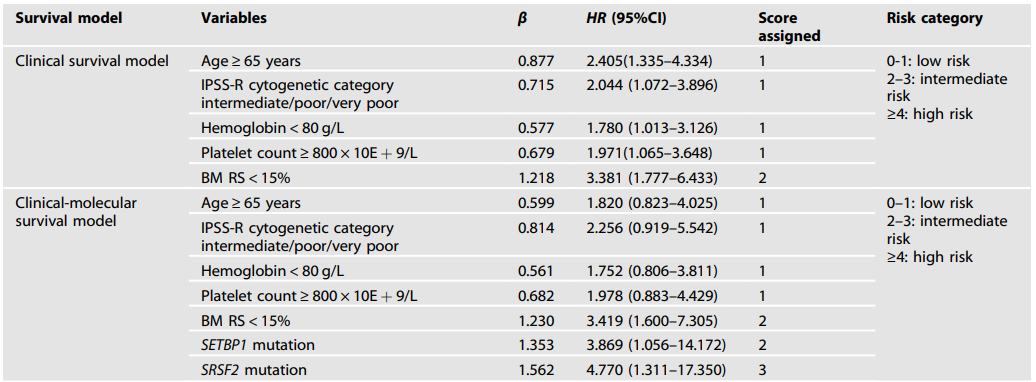
在训练队列1(n=180)中,将年龄≥65岁、Hb<80g/L、PLT≥800×109/L、骨髓RS<15%、IPSS-R细胞遗传学类别中级/差/极差均纳入多变量分析。基于这5个变量,研究人员建立了一个临床生存模型,其中年龄≥65岁、Hb<80g/L、PLT≥800×109/L、骨髓RS<15%、IPSS-R细胞遗传学类别中级/差/极差分别占1分、1分、1分、2分和1分(表2)。
表2. 临床生存模型和临床分子生存模型中的变量分配
然后,将患者分为三个风险级别:低危(0~1分,n=66,中位OS:96个月)、中危(2~3分,n=73,中位OS:64个月)和高危(≥4分,n=15,中位OS:36个月),其中低危与中危的生存率有显著差异(低危 vs. 中危,P<0.001;低危与高危,P<0.001;中危 vs. 高危,P=0.001;图3A)。
在训练队列2(n=122)中,年龄≥65岁、Hb<80 g/L、PLT≥800×109/L、骨髓RS<15%、IPSS-R细胞遗传学类别中级/差/极差、SRSF2突变和SETBP1突变根据前面的单变量分析结果被纳入随后的多变量分析。研究人员建立了另一个包括上述7个变量的临床-分子生存模型(表 2),并将训练队列2中的患者分为三个风险级别:低危(0~1分,n=45,中位OS未达到)、中危(2~3分,n=47,中位OS:65个月)和高危(≥4分,n=18,中位OS:30个月),其中低危与中危的生存率有显著差异(低危 vs. 中危,P=0.011;低危 vs. 高危,P<0.001;中危 vs.高危,P<0.001)(图3B)。
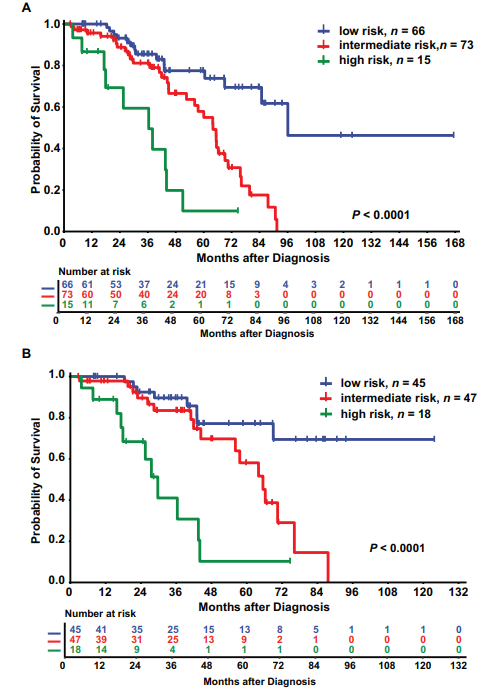
图3. 训练队列1和2的OS估计值
为了比较临床生存模型和临床-分子生存模型的鉴别力,研究人员还将临床生存模型应用于训练队列2,发现临床生存模型也可以将训练队列2中的患者分为三个风险级别,其生存率有显著差异。在训练队列2 中,用C指数衡量,临床-分子生存模型的判别能力优于临床生存模型(C指数,0.722 vs. 0.695)。
将临床生存模型和临床分子生存模型应用于验证队列。验证队列中有41例患者的OS数据。虽然验证队列中被归类为高危的患者很少,但根据临床生存模型(P=0.027)和临床-分子生存模型(P=0.013),不同风险类别的生存率存在显著差异。在验证队列中,临床-分子生存模型的表现也优于临床生存模型(C指数,0.688 vs. 0.677)。
总结
总之,与骨髓RS≥15%的MDS/MPN-SF3B1-T患者相比,骨髓RS<15%且SF3B1突变的患者生存率更低。此外,本研究还为根据2022年WHO分类为MDS/MPN-SF3B1-T患者建立了生存模型,这将有助于临床医生对MDS/MPN-SF3B1-T患者进行风险分级,实现个体化治疗。
Li F, Qin T, Li B, et al. Predicting survival in patients with myelodysplastic/myeloproliferative neoplasms with SF3B1 mutation and thrombocytosis[J]. Leukemia, 2024: 1-8.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


