近年来,伴随着多发性骨髓瘤(MM)的生存期延长,第二原发恶性肿瘤(SPMs)的发生风险也受到越来越多关注,如急性髓系白血病(AML)和骨髓增生异常综合征(MDS)。相比之下,MM患者继发B细胞急性淋巴细胞白血病(B-ALL)则非常罕见。BMJ Case Report就报告了一例IgG κ型MM患者在复发治疗期间出现血细胞减少,最终诊断为继发B-ALL,希望能引起大家对这一现象的重视。


病例介绍:不明原因的全血细胞减少:MM维持治疗中的警示信号
患者,男,60岁出头。既往有糖尿病和高血压病史。最初因肾功能不全、肱骨溶骨性损害就诊,伴单克隆免疫球蛋白血症(M蛋白3.41g/dl),骨髓活检示单型浆细胞占50%,诊断为IgG κ型MM。FISH检查提示5号染色体三体和11q22扩增,染色体核型分析显示3、5、9、11、15、19、21号染色体复杂高二倍体。
诱导治疗予以硼替佐米+来那度胺+地塞米松(VRD)方案11个周期,总体疗效为微小反应(MR)。之后序贯卡非佐米+泊马度胺+地塞米松(KPD)3个周期,达到部分缓解(PR)。诊断1年后行自体造血干细胞移植,预处理方案为大剂量美法仑,移植后达到非常好的部分缓解(VGPR)。
随后开始来那度胺10mg/d单药维持治疗。期间因流感病毒肺炎入院,伴急性全血细胞减少,来那度胺暂停。2个月后以同样剂量重新开始,移植后约2年因M蛋白再次升高,来那度胺剂量增加至25mg/d,加用地塞米松。4个月后评估疾病进展,方案调整为硼替佐米+地塞米松,3个月后加用泊马度胺。患者共接受该方案10个周期,期间因全血细胞减少再次中断治疗。
诊疗经过:从形态学线索到诊断证据:血液肿瘤筛查的艺术
(一)全血细胞减少的评估
末次就诊时,患者体检未见明显阳性体征。血常规示:WBC 3.37×109/L,HGB 113g/L,PLT 45×109/L。κ轻链降至12.7mg/L,κ/λ比值2.89。M蛋白较治疗前降至0.31g/dL。患者全血细胞减少并未随治疗间断而好转,遂行外周血涂片和骨髓检查。
外周血涂片见异常淋巴样细胞,具有不规则核、核仁明显、胞质深染等形态学特点,考虑可能为浆细胞或其他淋巴细胞增殖性疾病。流式细胞术仅检出极少量单克隆成熟B细胞和浆细胞,但有1%的幼稚B细胞群体(CD19+/CD34+)。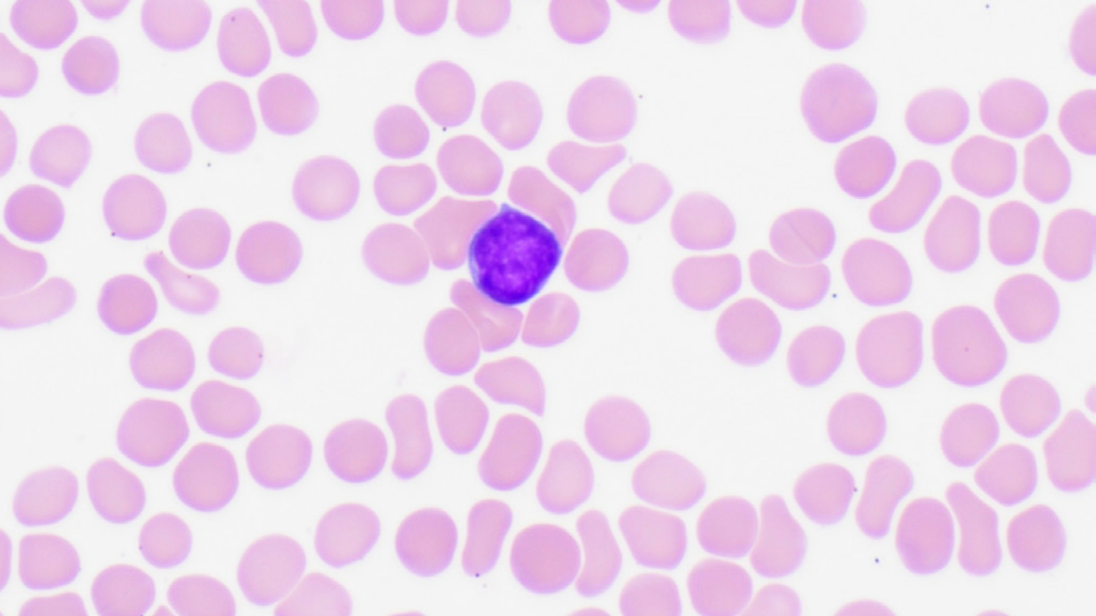
图1:外周血涂片
骨髓活检示骨髓增生极度活跃(95%),几乎完全被弥漫分布的幼稚细胞所占据,计数显示原始细胞比例高达75%。流式细胞术未见浆细胞,但检出一群原始细胞(占68%),免疫表型为CD10+,CD19+,CD20+,CD22+,CD34+,CD79a+,TdT+,且髓系标志阴性,符合B-ALL表型。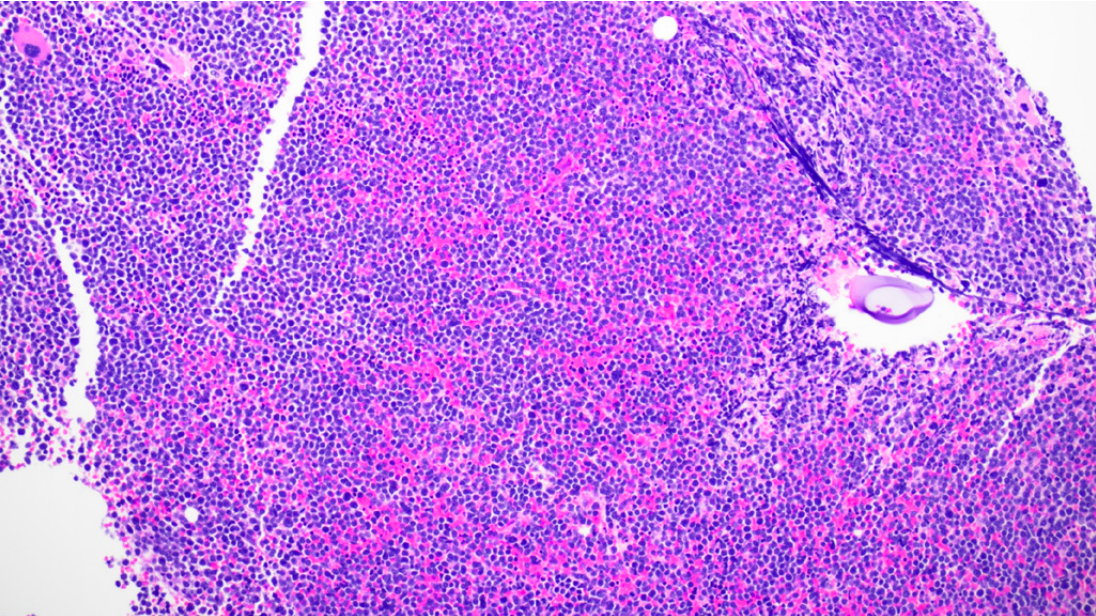
图2:骨髓活检
骨髓细胞遗传学检查示近三倍体核型,涉及多条染色体数目异常和结构异常。其中1、6、10、11、12、18、21号染色体增加,2-5、7-9、13、15、17、19、20号染色体减少,8p和18p缺失。FISH未见BCR-ABL1融合基因,MYC、MLL和IGH重排阴性,但CDKN2A纯合缺失。SNP阵列提示可能存在低二倍体克隆,即3-5、7、13、15-17、20号染色体均为双拷贝,且这些染色体均有嵌合性拷贝中性杂合性缺失的证据。
(二)B-ALL的诊断与治疗
基于以上检查结果,患者被诊断为继发B-ALL。立即予以改良的“Hyper-CVAD”(环磷酰胺+长春新碱+多柔比星+地塞米松)方案联合利妥昔单抗进行诱导治疗。患者同时接受了预防性鞘内注射阿糖胞苷和甲氨蝶呤。
第1个疗程后复查骨髓,示骨髓增生低下(5-10%),散在可见表达CD34和TdT的细胞(3-5%)。微小残留病(MRD)流式细胞术检出异常未成熟B细胞占0.72%。染色体核型正常。
随后患者第2个疗程接受了Hyper-CVAD B方案(高剂量甲氨蝶呤和阿糖胞苷)。骨髓形态学未见残留白血病,免疫组化未见浆细胞增多。但MRD流式细胞术仍检出0.12%的异常未成熟B细胞,提示残留病。
鉴于MRD阳性,遂给予贝林妥欧单抗治疗。首个疗程并发1级细胞因子释放综合征和3级免疫效应细胞相关神经毒性综合征,经糖皮质激素治疗后好转。患者目前仍在继续贝林妥欧单抗治疗,同时定期鞘内化疗预防中枢神经系统复发。如果达到MRD阴性,将考虑异基因造血干细胞移植。
寻根溯源:多重因素交织,续发白血病成谜?
尽管继发B-ALL在MM患者中罕见,但对于原因不明的全血细胞减少,临床医生应考虑筛查继发血液肿瘤的可能。本病例中,外周血涂片异常淋巴样细胞即为B-ALL存在的首个线索,进一步骨髓活检明确诊断。
MM患者发生继发血液肿瘤的风险增加,尤其是AML和MDS。在MM的治疗中,烷化剂如口服美法仑和大剂量美法仑预处理对继发髓系肿瘤有重要作用。一项对比研究提示,MM患者在接受自体造血干细胞移植10年后,血液学SPMs的累积发病率为2.1%,明显高于未行移植的对照组(0.8%)。
而在移植后使用来那度胺维持治疗,被认为是SPMs的独立危险因素。一项纳入三个随机对照研究的荟萃分析显示,与安慰剂相比,接受来那度胺维持治疗的MM患者,继发实体瘤和血液肿瘤的风险分别增加1.71倍和2.03倍(P=0.015)。即便在初始诱导治疗中,联合来那度胺(尤其是与口服美法仑)也可增加血液学SPMs的风险。尽管如此,国际骨髓瘤工作组仍建议在维持治疗中使用来那度胺,因其生存获益明显。
本病例患者在移植前还接受了泊马度胺和卡非佐米,尽管改善了移植前疾病状态,但也增加了免疫调节剂的暴露,可能进一步提高了SPMs风险。目前泊马度胺相关SPMs的研究数据相对缺乏,对于接受了多种免疫调节剂、多线治疗的MM患者,继发血液肿瘤的风险值得关注。
MM继发B-ALL非常罕见。在CALGB 100104研究中,共460例接受自体移植的MM患者随机分配来那度胺或安慰剂维持治疗,中位随访34个月时,仅在来那度胺组检出1例继发B-ALL。但随访延长至91个月,来那度胺组共出现6例,安慰剂组出现2例,提示继发B-ALL可能需要较长随访时间。本例患者在移植后39个月诊断B-ALL,累积接受免疫调节剂时间约39个月。
既往个案报道也有类似病例,多发生于接受自体移植和来那度胺维持2年以上的患者,常表现为无症状全血细胞减少。这些病例尚无共同的细胞遗传学和分子生物学特征。本例B-ALL具有复杂的近三倍体核型,可能源自一个低二倍体克隆,预示不良预后。
由于MM继发B-ALL病例稀少,目前主要参照原发B-ALL的治疗方案,异基因造血干细胞移植的成功病例极少。MM患者一旦发生继发血液肿瘤预后很差。一项47例MM继发治疗相关AML/MDS的研究显示,中位总生存期仅6.3个月。瑞典一项大型队列研究则提示,MM继发AML/MDS患者的中位生存期更短,仅2.4个月。相比原发AML/MDS,继发者预后更差。由于病例稀少,MM继发B-ALL与原发B-ALL的预后差异尚不清楚。
未来还需进一步研究MM继发B-ALL的发病特点、预后因素和有效治疗策略。免疫调节剂在MM继发血液肿瘤中的作用机制也有待阐明。随着MM生存期的延长,继发恶性肿瘤应受到临床医生的高度关注。
小结:多发性骨髓瘤生存期延长,警惕继发恶性肿瘤风险
B-ALL是MM患者罕见的继发恶性肿瘤,长期使用免疫调节剂可能增加风险。对于原因不明的全血细胞减少,应警惕继发血液肿瘤的可能,并及时评估。外周血和骨髓形态学检查往往提供重要线索。复杂细胞遗传学异常提示预后不良。尽管缺乏标准治疗方案,目前主要参照原发B-ALL方案,异基因造血干细胞移植或可延长生存。总之,随着MM患者生存期的延长,继发恶性肿瘤的风险需要引起足够的重视,相关机制和临床特点有待进一步研究。
一位86岁女性患者同时患有多发性骨髓瘤和原发性血小板增多症,最初诊断为多发性骨髓瘤时,患者的血小板计数正常,随着抗肿瘤治疗骨髓功能恢复,原发性血小板增多症的表现逐渐显现。治疗组面临如何权衡两种疾病治疗的迫切性、避免并发症以及相互影响等多重挑战。以下哪种说法是正确的?
以下正确的说法是?
A. 多发性骨髓瘤治疗不会影响原发性血小板增多症的病程
B. 原发性血小板增多症会显著降低抗多发性骨髓瘤治疗的疗效
C. 泼尼松联合环磷酰胺可以同时治疗这两种疾病
D. 诊断两种疾病的先后次序决定了哪种疾病应该优先治疗
上期《寻根溯源丨延误诊断4年的警示,破译淋巴细胞增多之“谜”》答案为A
Puliafito B, Oveisi D, Fanous C, El-Masry M. Secondary B-cell acute lymphoblastic leukaemia in a patient with multiple myeloma. BMJ Case Rep. 2022;15(6):e249637. Published 2022 Jun 22. doi:10.1136/bcr-2022-249637
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


