卵巢癌作为全球女性中的第八大常见癌症及致死原因,其患者群体正趋向年轻化1。而年轻患者面临的生育问题也可能对治疗选择及肿瘤学结果产生影响。那么,年轻与年长患者之间的生存结果是否存在差异?为了解答这一问题,近期,Journal of Cancer Research and Therapeutics期刊发布了一项重要的回顾性研究2。该研究深入分析了上皮性卵巢癌(EOC)患者年龄与生存结局之间的相关性,为我们理解不同年龄段EOC患者的治疗和预后提供了宝贵的数据和见解。
研究背景
在年轻成人中,EOC在病理发生、生物学因素、体征和症状方面与老年患者存在显著差异。目前,大多数探讨年轻EOC患者肿瘤学结果的研究集中在西方国家,而来自亚洲的数据则相对缺乏。值得注意的是,亚洲人群的种族背景和组织学亚型分布与西方国家存在差异,这些差异可能对患者的预后产生显著影响。鉴于此,本研究着眼于泰国人群,旨在揭示年轻年龄与EOC患者肿瘤学结果之间的潜在联系,为亚洲EOC患者的治疗提供依据。
研究方法
对2005年01月01日至2017年12月31日在 Songklanagarind 医院诊断为 EOC 并接受治疗的患者的病历进行分析。入选标准为:(i) 组织学证实的 EOC 和 (ii) 在本院接受治疗的患者。排除标准为:(i) 共存交界性上皮性卵巢肿瘤,(ii) 并存恶性肿瘤,(iii) 数据不完整。
分析年轻组(≤40岁)和年长组(>40岁)患者的疾病特异性生存率(DSS)和无进展生存期(PFS),并进行生存相关因素分析。DSS 定义为从初次治疗至因疾病死亡的时间;PFS 为初次治疗至复发或死亡时间。
研究结果
研究共纳入763例EOC患者,其中年轻组(≤40岁)患者153例,年长组(>40岁)患者610例。年轻组和年长组患者的中位年龄分别为34岁(范围30-38岁)和52岁(范围47-61岁)。整体人群的中位随访期为42个月(范围1-195个月)。按年龄分层的临床病理学特征和治疗相关因素总结见表1。
表1 患者的临床病理特征
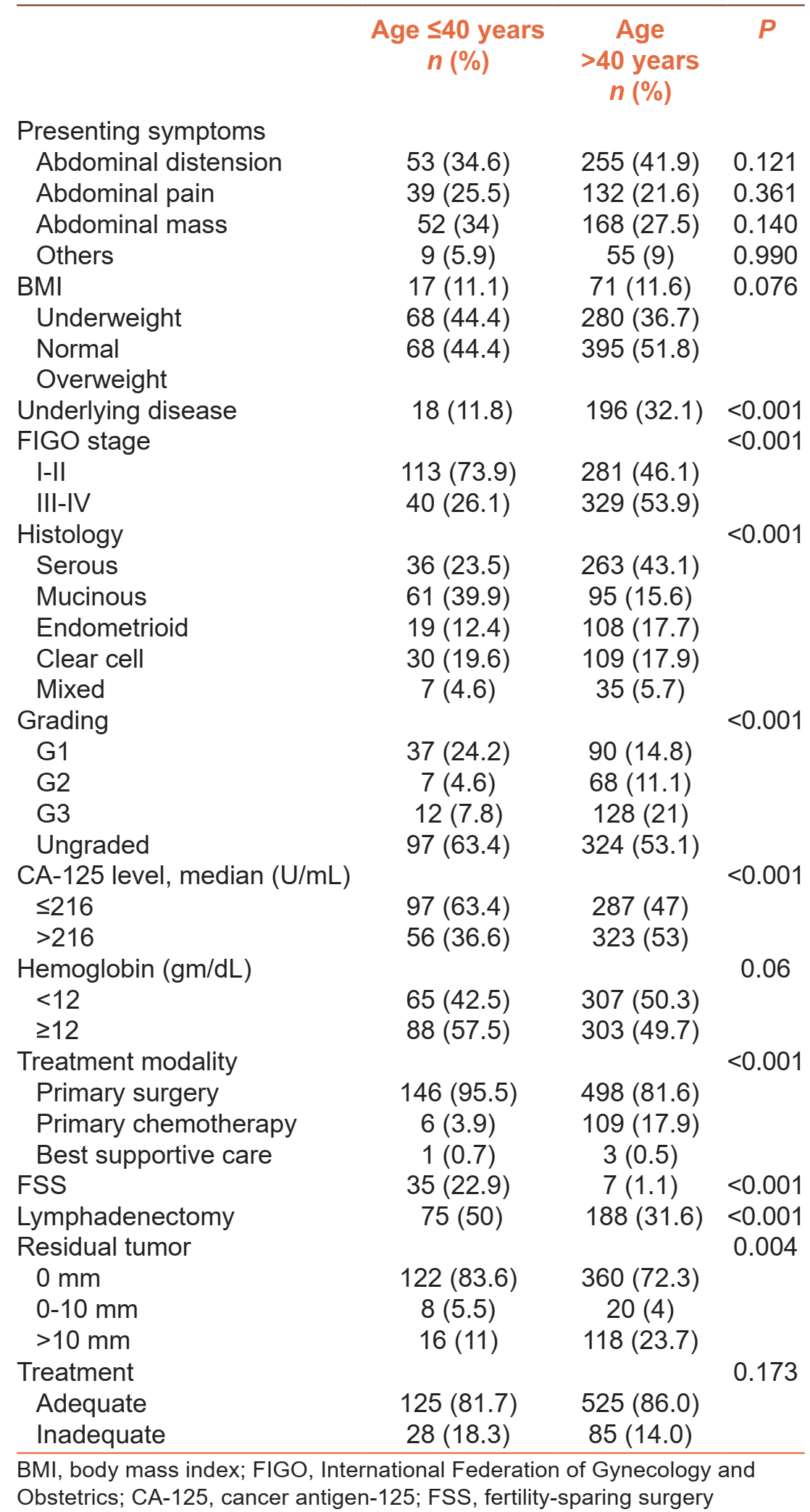
年轻组患者 vs 年长组患者的病理特征
年轻组患者被诊断为早期疾病的比例显著更高(73.9% vs 46.1%,P < 0.001);
年轻组患者更有可能被诊断出粘液性组织学亚型(39.9% vs 15.6%,P < 0.001);
年轻组患者更有可能患有低级别疾病(24.4% vs 14.8%,P < 0.001)
年轻组患者的CA-125水平低于年长组患者(P < 0.001)。
年轻组患者 vs 年长组患者的手术特征
年轻组患者接受初次手术的可能性更高(95.5% vs 81.6%,P < 0.001)。具体而言,≤40岁患者较>40岁的患者更有可能接受保留生育能力的手术(22.9% vs 1.1%)。
年轻组和年长组分别有50%和31.6%的患者接受了淋巴结清扫术,此外,年轻组患者更有可能接受最佳减瘤手术(89.1% vs 76.3%,P = 0.004)。
年轻组患者 vs 年长组患者的生存特征
年轻组患者的5年和10年DSS 率分别为59.1%和42.2%(未达到中位DSS),老年组分别为54%和35%(中位DSS为84.7个月)。两组之间的中位 DSS 没有统计学显著差异(HR=0.78;95% CI:0.58~1.06;P = 0.099)。
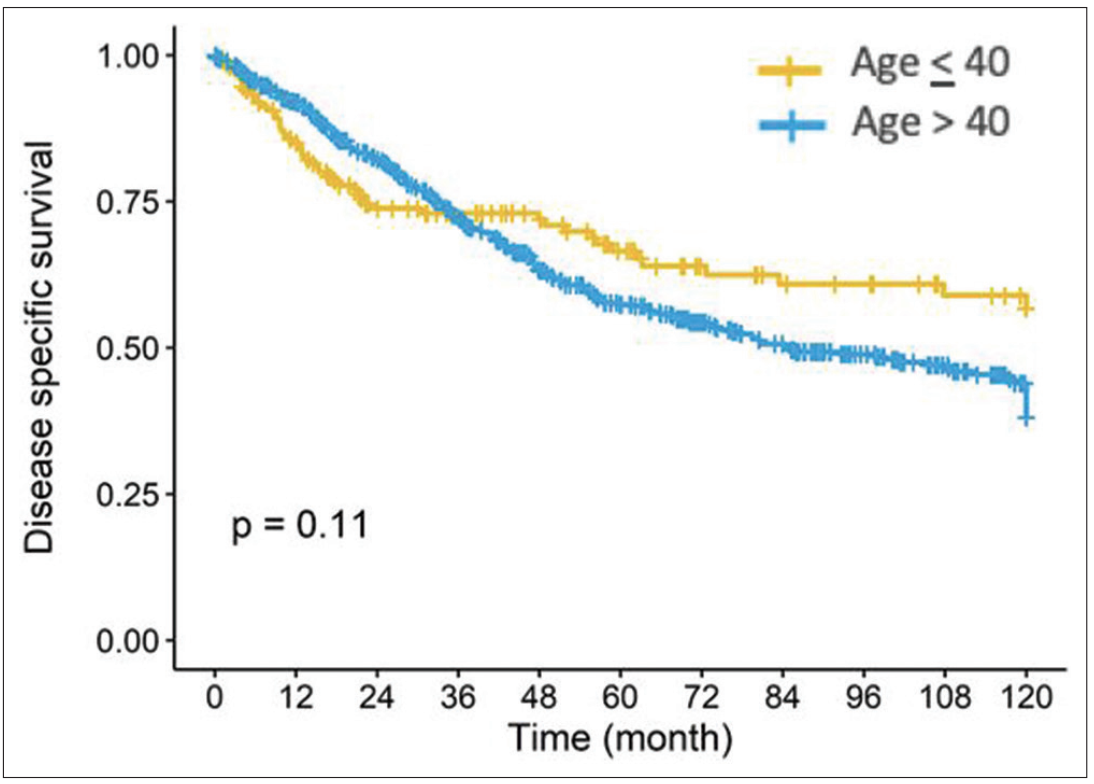
图1 年龄≤40岁和>40岁患者的DSS
年轻组患者的5年和10年 PFS 率分别为45.1%和31.1%,年长组患者分别为35%和25%。两组患者的中位 PFS 分别为120个月和41.6个月,存在显著差异 (HR=0.65;95%CI:0.5~0.85;P < 0.001)。
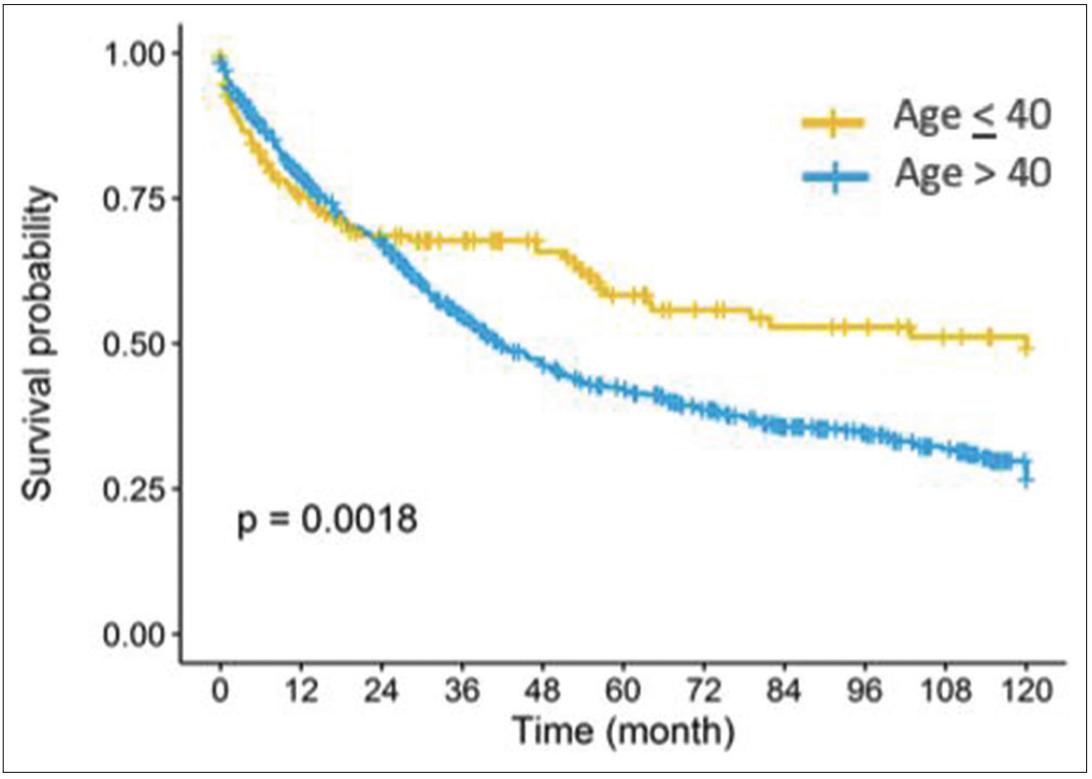
图2 ≤40岁和>40岁患者的12年PFS
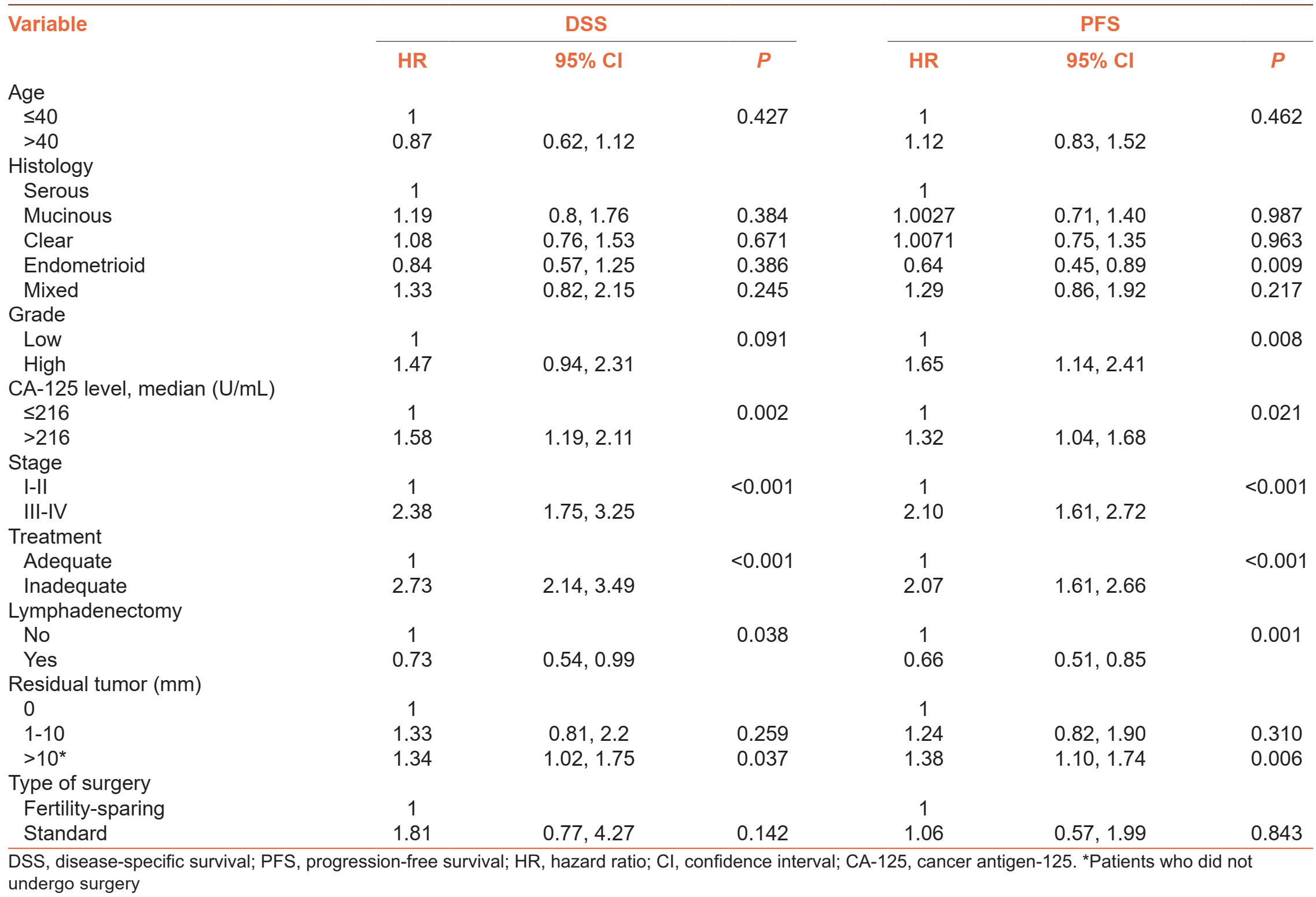
生存预后因素分析
多变量分析结果显示,较低的CA-125水平(<216 mIU/mL)、早期(I-II期)疾病、最佳减瘤手术和淋巴结清扫与更好的PFS和DSS相关,而内膜样亚型和低级别肿瘤对PFS有积极影响,但对DSS没有影响。年龄较小不是PFS和DSS的独立预后因素。此外,保留生育能力手术与较差的生存结局无关(DSS,P = 0.142;PFS,P = 0.843)。
表2 生存预后因素的多变量分析
“至年龄时间”对生存期的影响
在DSS和PFS曲线中,分别在3年和2年处观察到交叉现象,这表明"至年龄时间"可能对生存期产生影响(图1,2)。为了进一步检验年龄的预后意义,研究采用年龄-时间交互作用的多变量分析方法,结果显示,≤40岁与更好的3年后 DSS和2年后的PFS具有相关性。然而,在这个时间点之前,≤40岁却是DSS和PFS的不良预后独立因素;也就是说,年龄较轻增加了诊断后3年内的死亡风险,同时也增加了2年内疾病进展风险。
表3 “至年龄时间”对生存期的影响

年轻组早期死亡相关因素分析
在153例年轻患者中,37例 (24%) 在诊断后3年内死亡。分析了所有年龄≤40岁患者中预测早期死亡(< 3年)的临床病理学特征。单因素分析显示,血红蛋白水平、FIGO分期和治疗相关因素(方式、最佳减瘤手术、充分治疗)具有显著影响。多因素分析显示,预测年轻 EOC 患者早期死亡的危险因素为治疗不充分 (P = 0.004)、减瘤手术欠佳 (P = 0.005)、血红蛋白水平 < 12 mg/dL(P = 0.049)。
讨论与小结
在本研究中,年轻组患者的中位PFS优于年长组患者,这一结果可能与年轻患者与多种有利预后因素有关,如早期疾病阶段、较低的CA-125水平、低级别肿瘤、接受更为充分的治疗以及更多地进行最佳减瘤手术。然而,两组之间的中位DSS无显著差异,这表明,尽管年轻EOC患者在PFS上具有优势,但这并未转化为DSS的改善。这可能是由于复发疾病的预后较差,且复发后的治疗效果不佳,从而掩盖了PFS的优势。
通过年龄-时间交互作用分析,研究证实年龄和时间对生存具有交互作用。在诊断后的前3年内,年轻是死亡和疾病进展的独立不良预后因素;而在诊断后的第3年之后,年轻似乎成为了DSS和PFS的独立有利因素。这表明,在年轻患者中,预后存在一定的异质性。
从临床应用的角度来看,我们应该向年轻EOC患者传达他们相较于老年患者在生存方面的优势。然而,那些接受治疗不充分、经历次优减瘤手术或血红蛋白水平低于12 mg/dL的年轻EOC患者尤其面临早期死亡的风险,因此需要加强治疗和密切随访。需要注意的是,本研究是一项回顾性分析,未来可进行大样本分析,并关注年轻EOC患者早期死亡的原因。
1. Kongkamsuan W, Boonyapipat S. Epithelial ovarian cancer in younger age versus older age groups: Survival and clinicopathological features. Journal of Cancer Research and Therapeutics. 2024;20(1):363-368. doi:10.4103/jcrt.jcrt_677_22
2. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J Clinicians. Published online April 4, 2024. doi:10.3322/caac.21834
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审核编号:CN-134186
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


