乳腺癌居女性恶性肿瘤发病率首位,现阶段基于分子分型的综合治疗手段也在逐渐趋于精准化。作为发病率占比最高的激素受体阳性(hormone receptor positive,HR +)、 人 类 表 皮生长因子受体 -2 阴 性(human epidermal growth factor receptor 2 negative,HER2 -)乳腺癌,内分泌治疗(endocrine therapy,ET)已成为此类患者的术后辅助标准治疗方案 [1]。但是仍有约 20% 的患者在 5 年的术后辅助治疗期间出现疾病进展,转归晚期患者。随着 CDK4/6(cyclin-dependent kinase 4/6)抑制剂相关临床研究的深入,已有 4种 CDK4/6 抑制剂帕博西利(palbociclib)、瑞博西利(ribociclib)、阿贝西利(abemaciclib)及达尔西利(dalpiciclib)获批用于临床。对于 HR +晚期乳腺癌(advanced breast cancer,ABC)患者,CDK4/6 抑制剂已成为标准的晚期一线或二线治疗方案。尽管 CDK4/6 抑制剂疗效良好,但是最终仍然会面临耐药问题,绝大多数晚期乳腺癌患者在接受 CDK4/6 抑制剂治疗后会出现耐药情况,但目前其耐药机制尚不完全明确;而进展后的治疗策略也成为临床中最为关注的问题。本文就CDK4/6 抑制剂相关耐药机制和进展后治疗策略的研究进展进行综述,以期为临床用药提供参考。
 王蕾,杨思原,张季,等.CDK4/6抑制剂在HR~+晚期乳腺癌治疗中的耐药机制及进展后治疗策略[J].中南药学,2024,22(04):1030-1036.
王蕾,杨思原,张季,等.CDK4/6抑制剂在HR~+晚期乳腺癌治疗中的耐药机制及进展后治疗策略[J].中南药学,2024,22(04):1030-1036.
CDK4/6 抑制剂的耐药机制
CDK4/6 抑制剂的耐药机制大致可分为两类:细胞周期特异性机制和非细胞周期特异性机制。
细胞周期特异性机制
1 细胞周期 G1 期至 S 期转变中耐药发生相关因子
在细胞周期中,CDK4/6 抑制剂通过与 D 型细胞周期蛋白(cyclin D)结合形成复合体,促使视网膜母细胞瘤(retinoblastoma,Rb)蛋白磷酸化并释放与之结合的转录因子 E2F,E2F 通过调控转录促使细胞由 G1 期转变为 S 期。因此,Rb 作为CDK4/6 抑制剂发挥抑制肿瘤细胞生长的关键作用靶点,其缺失可能导致 CDK4/6耐药的发生。例如,在 Rb 基因缺失时,CDK4/6-cyclin D 下游失去作用靶点,细胞可能借助旁路例如 E2F 激活细胞周期推进从而导致了细胞对 CDK4/6 抑制剂耐药 [2]。由 CCNE1 基因编码细胞周期蛋白 E(cyclin E)与CDK2 形成复合体后,此时细胞周期的推动不再依赖于 CDK4/6-cyclin D。当 E2F 及 CDK2 过表达可能导致 cyclin E-CDK2 复合体过度激活并磷酸化 Rb,形成正反馈回路,从而促使 G1 期转变为 S期 [3];在临床前研究及Ⅲ期临床研究中也验证了CCNE1 表达水平与 CDK4/6 疗效的改善有关 [4]。
cyclin-CDK 复合体的形成是驱动细胞周期推进的先决条件,有研究指出,当复合体中 CDK6 基因扩增可能导致耐药的发生。有研究在对 CDK4/6 抑制剂耐药的 MCF-7 细胞中观察到了 CDK6 表达水平的增加 [5];而将 CDK6 基因进行特异性敲除药物的敏感性即恢复 [6],其原因可能与 CDK6 过表达影响 Rb 磷酸化过程有关。因此,在细胞周期相关性耐药发生的过程中,cyclin-CDK 复合体与 Rb 相关途径均扮演着重要的角色。
此外,有文献指出,cyclin-CDK 复合体、Rb相关的抑癌基因也参与调控 CDK4/6 抑制剂耐药的发生。p16 基因(由 CDKN2D 基因编码)作为肿瘤抑制因子,是 INK4 家族的一员。当 p16 过表达时,将通过抑制 CDK4 活性和降低 cyclin D1 表达而使得 CDK4/6 抑制剂应答减弱,从而导致耐药的发生 [7]。p21 作为 Cip/Kip 家族的成员,发挥着抑制周期蛋白依赖性激酶(CDK)和稳定 cyclinCDK 复合体的双重作用,P21 表达降低则可能导致 cyclin-CDK-Rb 通路信号“传递障碍”。组蛋白脱乙酰基酶(histone deacetylase,HDAC)有抑制p21 的作用,而 HDAC 抑制剂可上调 p21 的表达,并导致 cyclin-CDK-Rb 通 路 信 号 持 续 激 活, 与CDK4/6 抑制剂联用可改善耐药细胞的疗效 [8]。表观遗传修饰在肿瘤中发挥重要作用,组蛋白的乙酰化修饰可能参与了 CDK4/6 抑制剂的耐药过程。例如,HDAC 蛋白 LXCXE 序列可通过招募 Rb 蛋白从而促进组蛋白去乙酰化的发生和下游基因沉默,而乳腺癌中 HDAC5 基因缺失或下调通过增加组蛋白 H3 赖氨酸 27 乙酰化(H3K27ac),促使细胞周期相关致癌基因转录增加从而对 CDK4/6抑制剂耐药 [9]。小鼠双微同源物 2(murine double minute2,MDM2)是负调节 p53 活性的蛋白质。MDM2 可通过形成 MDM2-p53 复合物抑制 p53 发挥功能。p53 可以激活天然 CDK4 抑制剂 p21,导致细胞周期停滞 [10]。当 MDM2 过度表达时抑制了 p53 的周期阻断能力和限制效应,导致 p53 对CDK4/6 抑制剂等细胞周期药物敏感 [11]。
2 细胞周期 G2 期至 M 期转变中耐药发生相关因子
WEE1 是丝氨酸 / 苏氨酸蛋白激酶中的一员,参与细胞周期的调控,在 G2/M 期检查点发挥关键作用。WEE1 和 CDK1 协同抑制 DNA损伤的细胞进入有丝分裂期,而抑制 WEE1 可能导致损伤细胞发生连续复制迫使有丝分裂的持续发生并造成基因组不稳定,最终导致有丝分裂灾难。目前已有报道证实 WEE1 在乳腺癌中高表达,WEE1 过表达可诱导对 CDK4/6 抑制剂的耐药,而耐药细胞株对 WEE1 抑制剂 Adavosertib(AZD1775)表现出敏感性 [12]。另外 MDM2 蛋白与 Rb 蛋白直接作用,MDM2 在 DNA 损伤条件下在 G2/M 期泛素化并降解 Rb 蛋白促使细胞周期旁路激活,也可能是 CDK4/6 抑制剂耐药的原因 [13]。
细胞周期非特异性机制
1 成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFR)信号通路的上调
FGFR信号通路参与了 HR + 乳腺癌的内分泌治疗及CDK4/6 抑制剂交叉耐药。有研究对耐药前和耐药后的样本进行比较,发现 FGFR/FGF 可通过重编程和激活 MAPK 途径诱导内分泌治疗过程及CDK4/6 抑制剂耐药性的产生 [14]。FGFR1 的过表达会减弱其对 G1/S 转换调节因子(Rb 蛋白、E2F1和 cyclin D3)和促进 G2/M 转换的因子(cyclin B1、CDC2/CDK1 和 CDC25)的抑制作用,推动细胞周期进展从而介导耐药 [15]。临床前研究也证实,抑制异常 FGFR 活性能够逆转对 CDK4/6 抑制剂的耐药性 [16]。
2 PI3K/AKT/mTOR 信号通路的异常激活
PI3K/AKT/mTOR 信号通路参与肿瘤细胞的生长和转移,在大约 35% 的 HR + /HER2 -转移性乳腺癌(metastatic breast cancer,MBC)中发现了 PI3K基因的激活突变,推测 PI3K/AKT/mTOR 信号通路可能是 HR +乳腺癌治疗耐药的关键环节。研究表明 CDK4/6 抑制剂耐药细胞株中,PI3K/AKT/mTOR 通路高度活化,cyclin A、cyclin E 和 cyclin D1 蛋白表达增加,CDK2 磷酸化水平增加,使得肿瘤增殖不再受 CDK4/6 抑制剂控制,从而导致耐药的发生 [17]。此外,AKT/mTOR 信号传导途径的负调节剂 PTEN 的缺失通过激活 AKT 导致肿瘤细胞对 CDK4/6 抑制剂产生抗性 [18]。还有研究发现 PTEN 的缺失诱导细胞核 CDK 抑制剂 p27Kip1 的下调,这也会使其对 CDK4/6 抑制剂产生抵抗 [19]。
3 上皮 - 间充质转化(epithelial mesenchymal transition,EMT)和信号传导蛋白 3(Smad3)抑制
CDK4/6 抑制剂通过激活 TGF-β 信号通路,TGF-β磷酸化并激活 Smad2 和 Smad3,然后与 Smad4 形成复合体,通过激活 EMT 转录因子诱导 EMT 发生使肿瘤细胞逃逸而间接耐药。同时,TGF-β 还通过PI3K/AKT/mTOR 信号通路诱导 EMT[20-21]。此外,Smad3 作为 TGF-β 信号通路的关键抑制环节,可通过抑制 cyclin E-CDK2 而使细胞周期停滞 [22]。
4 自噬激活
自噬在癌症中有双重作用,在肿瘤发生初期,自噬作为一种生存途径和质量控制机制,可防止肿瘤发生并抑制其进展。然而在肿瘤发展的后期阶段或应激条件下,自噬机制可促进肿瘤进展。在肿瘤细胞抵抗不利环境条件下,细胞周期阻滞介导自噬发生,自噬通过代谢分解降解 ROS,并介导逆转 G1 期阻滞 [23]。CDK4/6 抑制剂通过抑制 cyclin D 激活自噬,逆转 CDK4/6 抑制剂介导的细胞周期停滞 [24],从而参与 CDK4/6 抑制剂的耐药。
5 免疫逃逸
CDK4/6 抑制剂通过增加 T细胞活化和促进 T 细胞杀伤肿瘤细胞来增强抗肿瘤免疫。但有研究显示,NCOR1、MUC4 和MUC16 基因等 T 细胞活化及 T 细胞杀伤相关免疫调控关键基因在帕博西利耐药细胞中突变频率显著增高;进一步的基因组学和转录组学分析表明,由免疫相关基因突变诱导的免疫途径失控将导致 CDK4/6 抑制剂耐药的发生 [25]。进一步研究显示 CDK4/6 抑制剂可增加程序性细胞死亡配体1(PD-L1)的表达,从而诱导炎症微环境并改善肿瘤的免疫原性 [26],说明免疫疗法的加入能降低CDK4/6 抑制剂的耐药性。
CDK4/6 抑制剂的耐药后治疗策略
目前,关于针对使用 CDK4/6 抑制剂治疗进展后患者的治疗方法缺少具有针对性的大型随机临床试验的数据,现有的治疗更多是来源于对有限数量的患者的回顾分析及随机临床试验的亚组分析。因此,对于 CDK4/6 抑制剂治疗进展的后续治疗策略仍缺乏共识,但越来越多的针对性临床试验正在开展,其结果将进一步指导 CDK4/6抑制剂耐药后的治疗。目前临床考虑治疗方案可分为三类:化疗,转换为其他内分泌治疗+ CDK4/6 抑制剂,联合靶向治疗。
化疗
有研究表明,在 HR + /HER2 -的乳腺癌细胞中,CDK4/6 抑制剂与化疗药物之间没有交叉耐药性 [3]。一项多中心分析显示,既往接受帕博西利治疗但反应差的患者中,在换用化疗后其中位无进展生存期(mPFS)仍优于以往治疗反应较佳的患者 [27]。换言之,患者既往帕博西利治疗的不敏感提示其从其他 ET 中受益的概率极低。针对在 CDK4/6 抑制剂治疗后疾病进展迅速或伴有症状的内脏疾病或内脏危象的患者,需要快速缓解症状和实现疾病控制,应强烈考虑化疗。
其他内分泌治疗+ CDK4/6 抑制剂
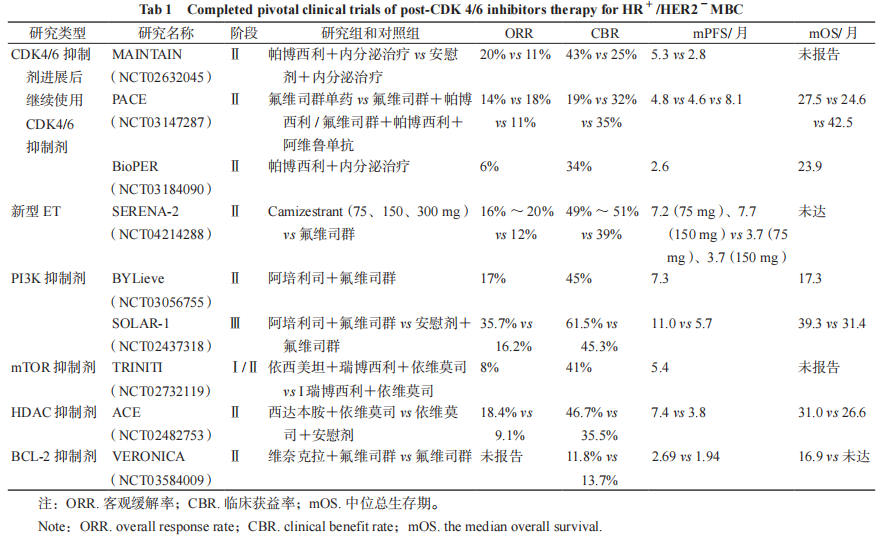
相 较 于 芳 香 酶 抑 制 剂(aromatase inhibitor,AI),氟维司群(fulvestrant)作为选择性雌激素受体降解剂(selective estrogen receptor downregulation regulator,SERD),对携带 ESR1 突变的肿瘤细胞有较好疗效。在帕博西利与来曲唑或氟维司群联合治疗耐药的患者中也观察到了 ESR1 突变的出现,这表明针对 ESR1 突变的治疗可能有助于克服 CDK4/6 抑制剂的耐药性 [28]。SERENA-1 试验评估了接受过氟维司群或 CDK4/6 抑制剂等治疗后使用 Camizestrant 表现出的良好疗效和剂量依赖的安全性。此外,SERENA-2 的结果也提示了对于使用过 CDK4/6 抑制剂的患者具有肯定疗效,并且转化分析表明 Camizestrant 能显著降低肿瘤循环 DNA 中的 ESR1 突变水平 [29]。对于临床实践来说,在进展后继续使用同一或另一种 CDK4/6 抑制剂是否仍然有效是一个非常重要的问题。越来越多的研究正在尝试探索使用 CDK4/6 抑制剂进展后交替使用不同 CDK4/6 抑制剂的可行性。帕博西利治疗进展后继续使用阿贝西利的多中心回顾性分析显示,mPFS 为 5.8 个月 [30]。第二阶段MAINTAIN 研究的结果显示,使用帕博西利进展后,HR + /HER2 - MBC 患者更换内分泌治疗方案并接受瑞博西利治疗,与单独内分泌治疗相比有显著的无进展生存期(PFS)获益(5.29 vs 2.76 个月)[31]。PACE 试验中 CDK4/6 抑制剂获得性耐药的 HR + /HER2 - MBC 在单独使用氟维司群和氟维司群+帕博西利的 PFS 没有差异 [32]。而 BioPER研究帕博西利治疗失败后继续帕博西利再挑战的临床获益率(CBR)为 34.4%,mPFS 为 2.6 个月,该研究生物标志物分析也提示获益可能是因为选择了没有 Rb 缺失、cyclin E1 高表达,以及 ESR1突变的患者 [33]。因此,耐药后改用其他内分泌药物联合 CDK4/6 抑制剂也是选择之一。
表 1 已完成的 HR + /HER2 - MBC CDK 4/6 抑制剂后治疗关键临床试验
联合靶向治疗
1 PI3K 抑制剂
PAM 信号通路中对 PI3K 基因的激活突变的抑制一直是乳腺癌关注的焦点。阿培利司(alpelisib)是目前唯一被批准用于治疗肿瘤中携带 PIK3CA 突变的 MBC 患者的药物。在SOLAR-1 试验中,阿培利司+氟维司群治疗延长了先前接受过内分泌治疗的 PIK3CA 突变、HR + /HER2 - MBC 患者的 PFS[34]。该试验中有少数患者(20 例)接受了 CDK4/6 抑制剂作为先前的治疗,但在这一亚组患者中,联合治疗的 mPFS 为5.5 个月,而单用氟维司群组为 1.8 个月,表明阿培利司在 CDK4/6 抑制剂耐药情况下的疗效。在使用 CDK4/6 抑制剂加 AI 进展后的 HR + /HER2 - MBC 中,BYLieve 试验显示了阿培利司+氟维司群对 PIK3CA 突变患者的疗效,121 名患者在中位数为 11.7 个月的随访期中,50.4% 患者在 6 个月内没有疾病进展,mPFS 为 7.3 个月 [35]。此外,氟维司群联合 CDK4/6 抑制剂一线治疗后进展的PIK3CA 突变患者入组 BYLieve 研究的队列 B,并接受阿培利司联合来曲唑作为二线治疗,mPFS报告为 5.7 个月,6 个月 PFS 率为 46.1%[36]。因此,对于内分泌治疗联合 CDK 4/6 抑制剂一线治疗后出现疾病进展的 PIK3CA 突变患者,内分泌治疗联合 PI3K 抑制剂治疗可以成为患者的一种选择。PI3K 抑制剂与 CDK4/6 抑制剂联合应用也显示出协同效应。目前,内分泌治疗、CDK4/6 抑制剂和PIK3 抑制剂三联组合的几项临床试验正在进行。
2 mTOR 抑制剂
依维莫司(everolimus)是口服的 mTOR 抑制剂,联合内分泌治疗可提高绝经后女性晚期乳腺癌对 AI 耐药患者的 PFS[37]。目前针对 CDK4/6 抑制剂进展后使用依维莫司与内分泌治疗联合治疗的临床研究正在进行中。一项对 133 名使用帕博西利进展的患者的研究显示,依西美坦+依维莫司是内分泌治疗的首选,其mPFS 为 4.9 个月 [38]。另一项回顾性队列研究比较了依维莫司+依西美坦治疗先前接受过 CDK4/6抑制剂的患者(17 例)和未接受过 CDK4/6 抑制剂的患者(26 例)的疗效,显示 mPFS(4.2 vs 3.6 个月)或 mOS(11.3 vs 15.6 个月)没有显著差异 [39]。该研究支持 CDK4/6 抑制剂暴露不会影响依维莫司加依西美坦的生存结局。所以在 CDK4/6 抑制剂进展后,依维莫司与谨慎选择的内分泌治疗的组合可以是一种有效的治疗选择。TRINITI-1 试验分析了在之前的 CDK4/6 抑制剂之后进展的HR + /HER2 - MBC 中瑞博西利+依西美坦+依维莫司的组合,24 周的临床获益率达到 41%,超过了预先定义的主要终点阈值(> 10%),总体人群的 mPFS 达到 5.7 个月,支持 CDK4/6 抑制剂耐药进展后治疗可考虑联合阻断 CDK4/6 通路和靶向PI3K/AKT/mTOR 信号通路 [40]。
3 其他靶向药物
FGFR 是一种新的治疗靶点,多项研究表明 FGFR 基因扩增与 CDK4/6 抑制剂+内分泌治疗的耐药性有关。这种耐药性可以被 FGFR 和 VEGFR 双重抑制剂 lucitanib 逆转 [41]。基于基线 ctDNA 中检测到的分子变化,对MONALEESA-2 试验的 PFS 进行分析,结果表明,与野生型 FGFR1 患者相比,FGFR1 扩增患者的 PFS 较短,对于 FGFR 通路改变的乳腺癌应考虑使用内分泌治疗+ CDK4/6 抑制剂+ FGFR 抑制剂组合 [41]。在一项Ⅰb 期(NCT03238196)试验中,评估先前 CDK4/6 抑制剂+内分泌治疗暴露后FGFR1-4 扩增患者使用帕博西利 / 氟维司群和厄达替尼(erdafitinib,泛 FGFR 抑制剂)治疗,结果提示有效且安全性可控 [42]。
另一类有望逆转乳腺癌内分泌耐药的药物是表观遗传调节剂组蛋白去乙酰酶抑制剂。西达本胺(tucidinostat,苯酰胺类 HDAC 亚型选择性抑制剂)获批用于乳腺癌,这主要源于一项Ⅲ期 ACE研究,在内分泌抵抗的 HR+/HER2-MBC 患者中,采用依西美坦加入西达本胺治疗,与安慰剂相比,能显著改善 PFS(7.4 vs 3.8 个月)[43];一项验证西达本胺安全性和有效性的真实世界研究,纳入既往 CDK4/6 抑制剂、mTOR 抑制剂治疗失败的患者,结果阶段性数据证实西达本胺+氟维司群 /AI治疗安全有效,mPFS 达到 6.4 个月,其生存获益数据与国外研究中换用另一种 CDK4/6 抑制剂的获益数据相当,充分展现了西达本胺在 CDK4/6 抑制剂治疗失败的中国患者后线治疗中的显著优势。
目前单一药物的免疫治疗在 HR+/HER2-ABC 的使用并不常见,但 CDK4/6 抑制剂联合免疫治疗用于 CDK4/6 抑制剂进展的患者正在研究中。临床前数据显示 CDK4/6 抑制剂与免疫检查点抑制剂联合使用时,阿贝西利在体内联合 PD-1阻断,可提高肿瘤免疫治疗效果 [26]。一项Ⅰb期(JPCE)临床试验显示,在接受内分泌治疗和化疗发生转移后 CDK4/6 抑制剂初治的 HR+/HER2- ABC 患者中,连续服用阿贝西利和帕博利珠单抗的安全性可控 [44]。在 CDK4/6 抑制剂耐药的疾病中,新的免疫治疗组合是必要并且可预见的,相关临床试验正在进行中。
目前正在临床开发的 CDK4/6 抑制剂进展后患者的其他策略包括使用 BCL-2 抑制剂,细胞周期蛋白依赖性激酶抑制剂等。维奈克拉(venetoclax)是一种口服 BCL-2 抑制剂在与他莫昔芬联合应用于 HR+/HER2- MBC 伴 BCL2 过表达患者的Ⅰb 期临床试验中显示出有希望的结果,但 VERONICA 2期临床试验显示在内分泌治疗中加入维奈克拉并不能改善 HR+/HER2-、局部晚期 / 晚期乳腺癌患者的临床获益 [45]。选择性 CDK7 抑制剂 THZ1 和 SY-1365 对帕博西利敏感和耐药细胞株均有效。CDK7抑制剂的开发已经获得了一定的进展,两款抑制剂CT7001 和 SY-1365 已经进入临床研究阶段。CDK2已被确定为克服 CDK4/6抑制剂耐药的另一个靶点。
总结和展望
CDK4/6 抑制剂的开发是 HR + 乳腺癌治疗进程的重大突破。然而,在实际诊疗过程中,对CDK4/6 抑制剂的耐药性是一个不可避免的问题。
据目前研究来看,CDK4/6 抑制剂联合内分泌治疗出现耐药的机制尚未完全研究清楚,随着基因测序技术的逐渐深入,后续研究可进一步揭示基因组、转录组等改变和疾病进展之间的相关性,提出更为精准的治疗方案。目前 CDK4/6 抑制剂进展后的治疗仍在探索阶段,包括化疗,使用不同的内分泌治疗主干和添加或不添加第三种靶向药物,继续使用 CDK4/6 抑制剂似乎也是有获益的选择,在各种选择的最佳顺序方面没有既定的指导方针。然而,由于基线治疗背景的差异与现有数据的不均一化,虽然能使更多的患者受益,但仍有部分的患者难以承受治疗叠加的严重不良反应。因此,尝试探索早期获益人群,充分筛选治疗敏感药物,依据患者的具体情况进行个性化评估,或许将为更多患者带来治疗获益。
略
本文仅供专业人士参看,文中内容仅代表中南药学立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。版权归文章作者所有,作者拥有所有法定权利。











 苏公网安备32059002004080号
苏公网安备32059002004080号


