
肝细胞癌(hepatocellular carcinoma,HCC)起病隐匿,多数没有临床症状,多达半数的HCC初诊即已处于晚期阶段,通常预后较差[1]。对于晚期HCC,绝大多数已不宜首选手术切除,而应接受以非手术局部治疗和系统治疗为主的治疗[2]。近年来,HCC的非手术治疗进展显著,尤其是免疫检查点抑制剂联合抗血管生成靶向药物,在晚期HCC治疗中显示出较高的有效率,显著延长了患者的生存期,也为序贯外科根治性手术提供了可能[1]。在诸多免疫检查点抑制剂中,国产PD-1抑制剂替雷利珠单抗因疗效突出、安全可靠、可及性高等优势备受临床医生青睐,该药已于2024年1月正式获中国国家药品监督管理局批准,用于一线治疗不可切除或转移性HCC患者。本期由海军军医大学第三附属医院杨云、娄成医生为大家分享并解读一则病例,该病例为5个周期“替雷利珠单抗+仑伐替尼”联合3次TACE成功转化治疗IIIa期HCC达影像学完全缓解(CR)和R0切除,并在术后辅助治疗中(12个周期“替雷利珠单抗+仑伐替尼”、1次TACE)长期遏制肿瘤复发的真实案例,目前患者无复发生存时间(RFS)已达32个月。
点评专家
海军军医大学第三附属医院
从事肝胆外科临床及科研工作15年,累计完成各类肝胆外科手术2000余台,在肝脏肿瘤的微创治疗、巨大肝脏肿瘤的外科切除以及晚期肝胆肿瘤的转化治疗方面积累了丰富的经验,先后主持完成国家自然科学基金以及上海市多项基金,在Hepatology、Protein and Cell、British Journal of Caner、HBSN等国际知名学术期刊发表SCI文章多篇
分享专家
娄成
海军军医大学第三附属医院
主要从事肝肿瘤的微创治疗及肝胆肿瘤靶向免疫治疗和化疗。
参编《抗癌必修课》系列丛书。
擅长深静脉穿刺,胸壁港、手臂港植入术和拆除术,超声造影引导下肝脏占位穿刺活检术,PTCD术,经皮超声引导或腹腔镜下超声引导肝肿瘤微波消融术。
上海市嘉定区医学会肿瘤专委会委员兼秘书
上海市抗癌协会癌症康复与姑息治疗专业委员会青年委员会委员
上海市生物医药行业协会精准医疗专业委员会委员
病例详情
01基本情况
患者男性,40岁。
主诉:体检发现肝占位7天。
现病史:患者7天前体检时行腹部CT检查发现肝脏占位,伴门静脉癌栓形成,无明显腹痛、腹胀,无恶心、呕吐,无畏寒、发热,无头晕、头痛,全身皮肤黏膜无黄染。为求进一步诊治,特于今日至我院就诊,以“肝占位:原发性肝癌”收入我科行进一步诊治。
既往史:既往有“慢性乙型病毒性肝炎”病史20年,未行抗病毒治疗。否认“高血压”、“糖尿病”及“心脏病”病史。
个人史及家族史:饮酒30年,平均半斤白酒/每日,未戒酒,否认吸烟史。余无特殊。
体格检查:无特殊。
02辅助检查
入院(2020-12-08)实验室检查:
▪️血常规:未见明显异常。
▪️肝肾及凝血功能:未见明显异常。
▪️肿瘤学指标:AFP:40.3ng/mL;PIVKA-II:30508mAu/mL。
▪️乙肝相关检查:HBV-DNA定量:2.91×106IU/mL。
入院前(2020-12-01)腹部CT示:右侧肝脏见一巨大占位病变,考虑为原发性肝细胞癌;且合并门静脉癌栓形成。
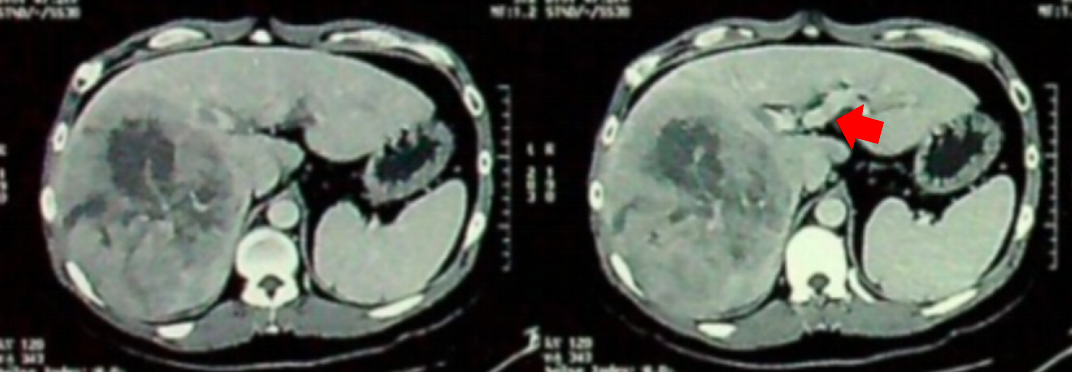 基线腹部CT影像,箭头所示为门静脉癌栓
基线腹部CT影像,箭头所示为门静脉癌栓
03临床诊断
原发性肝细胞癌(CNLC Ⅲa期,BCLC C期)
慢性乙型病毒性肝炎(Child-Pugh A级)
04治疗经过
经肝胆外科、肿瘤科、介入科、放射科等共同进行院内多学科会诊(MDT),认为患者目前诊断“CNLC Ⅲa期肝癌、慢乙肝”明确,考虑瘤体巨大、肿瘤负荷高、合并门静脉癌栓形成,直接手术难以确保安全切缘和治疗效果。经与患者及家属沟通病情及治疗策略,最终决定先采取转化治疗(在抗病毒治疗的基础上,给予局部介入治疗联合靶免系统抗肿瘤治疗),以寻求手术根治的机会,然后再予术后辅助治疗进一步改善患者预后。
1、转化治疗:“TACE+靶免”抗肿瘤方案
入院后完善相关检查,于2020-12-16行第一次TACE术,介入过程顺利,患者未诉明显不适。
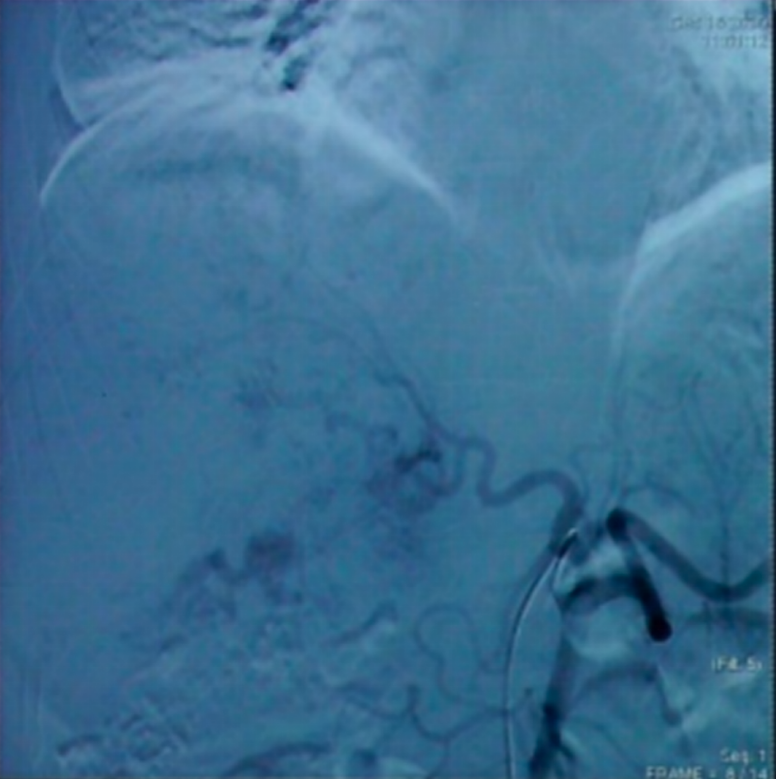 首次TACE术中造影所见
首次TACE术中造影所见
同期(首次TACE术后)予采取恩替卡韦行抗病毒治疗,并启动靶免联合系统抗肿瘤治疗,具体用药为:替雷利珠单抗 200mg ivgtt d1,q3w+仑伐替尼 8mg po qd。
按上述转化治疗方案治疗1个周期后,于2021-01-11查腹部磁共振(MRI)示:肿瘤活性下降,体积较前缩小。
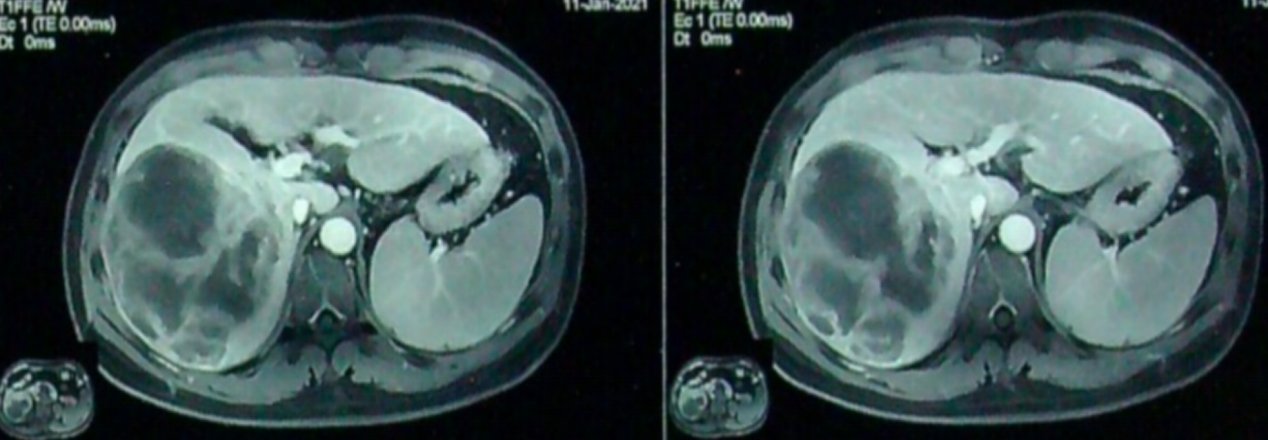 转化治疗1个周期后腹部MRI检查影像
转化治疗1个周期后腹部MRI检查影像
同时抽血行实验室检查,结果发现AFP水平(7.6ng/mL)恢复正常,PIVKA-II水平(1240mAu/mL)较前明显下降,HBV-DNA定量(4.28×102IU/mL)显著降低。说明转化治疗有效,遂决定继续当前方案治疗。
后续分别于2021-01-28、2021-03-23实施第二次、第三次TACE术,介入过程均顺利,患者未出现明显并发症。
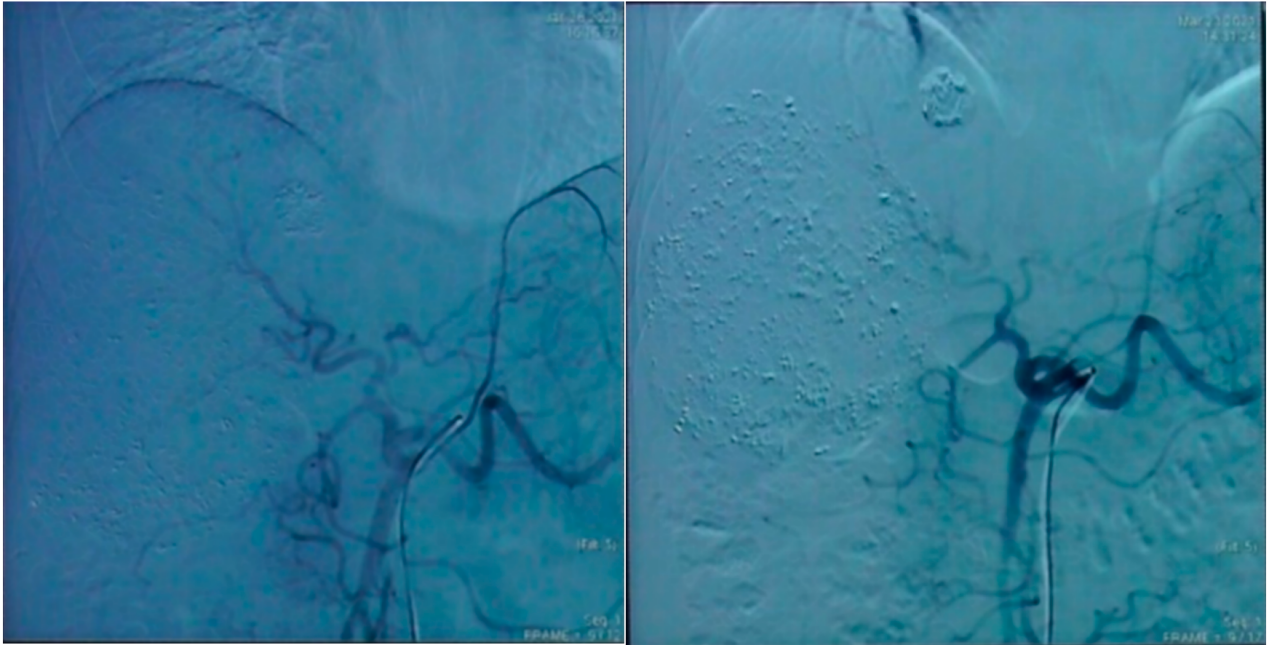 第二次(左)及第三次(右)TACE术中造影所见
第二次(左)及第三次(右)TACE术中造影所见
期间继续按原方案给予抗病毒治疗和靶免联合抗肿瘤治疗,定期复查影像学检查和实验室检查,见患者肿瘤及慢乙肝病情均呈逐渐缓解趋势。
经3次TACE及5个周期“替雷利珠单抗+仑伐替尼”治疗,于2021-04-25复查腹部增强MRI示:肿瘤体积较前明显缩小,原门静脉癌栓已消退,未见明显肿瘤活性。提示已达影像学CR。
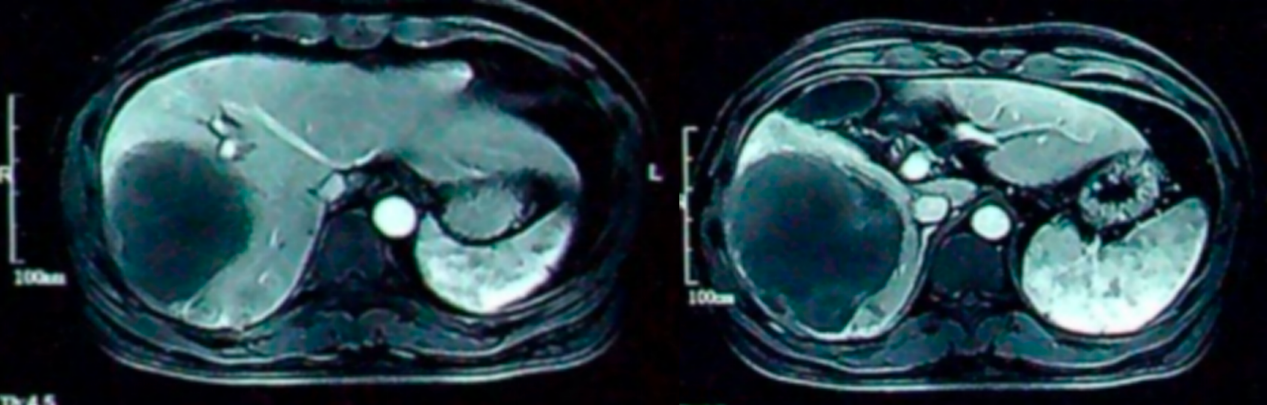 靶免治疗5个周期后腹部MRI检查影像
靶免治疗5个周期后腹部MRI检查影像
经再次MDT讨论,认为患者转化治疗较为成功,且未出现明显不良反应,目前Child-Pugh A级,HBV-DNA<500IU/mL,肝功能储备良好,已具备实施R0手术切除的条件。
2、手术、术后辅助治疗及随访
予完善相关术前准备,排除手术禁忌后,于2021-04-26在全麻下行“右半肝切除+胆囊切除术”,手术过程顺利,未出现明显手术并发症,患者恢复良好。
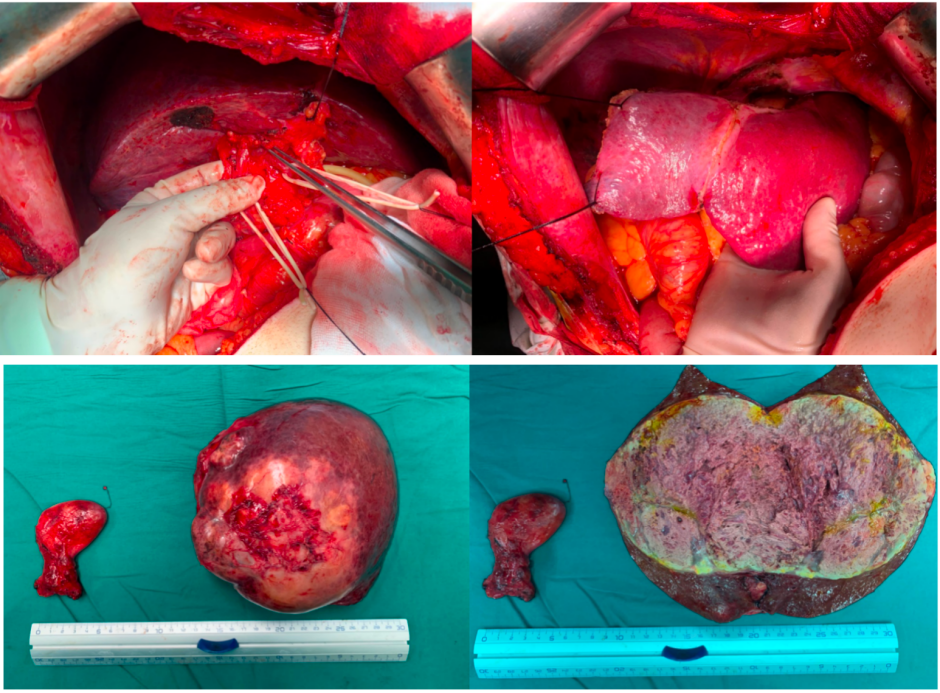 术中图像(上)及切除的肿瘤和胆囊标本(下)
术中图像(上)及切除的肿瘤和胆囊标本(下)
术后病理检查示:主瘤(长径约14.5cm×11cm)完全坏死,主瘤旁子灶(约4cm×3.5cm)仍有部分肿瘤活性,切缘阴性,胆囊及送检淋巴结未见肿瘤细胞。提示实现了R0切除。
 病理检查报告单截图
病理检查报告单截图
术后继续按原方案维持“替雷利珠单抗+仑伐替尼”靶免联合治疗,并于2021-06-15实施一次术后预防性TACE治疗。
治疗期间患者PIVKA-II水平呈断崖式下降,然后维持在较低水平。
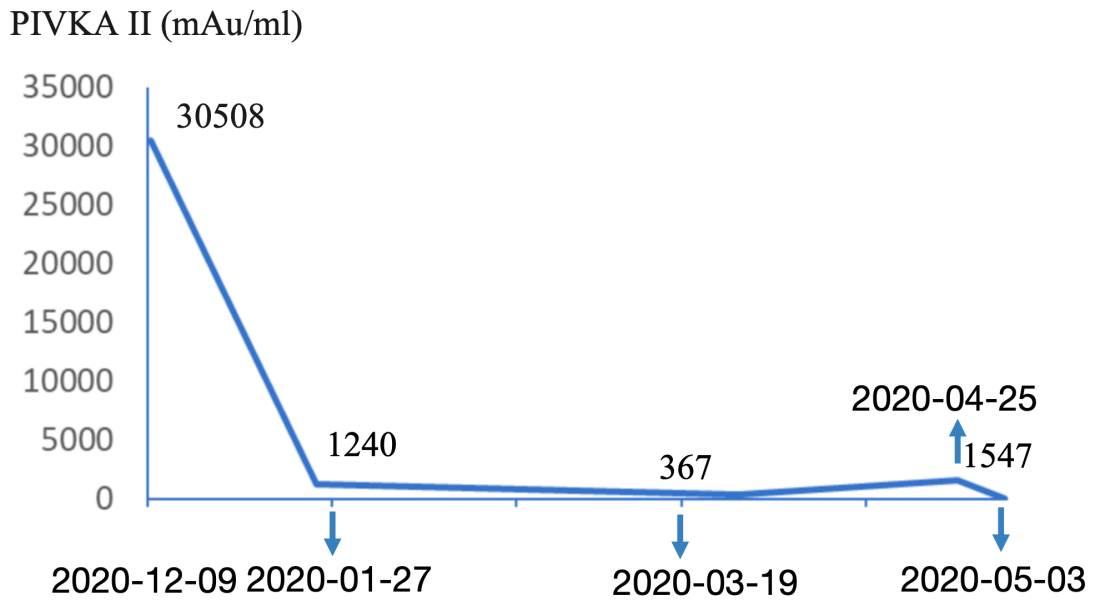
患者PIVKA-II变化趋势图
2022-01-13复查腹部MRI示:未见明显肿瘤复发或转移迹象。
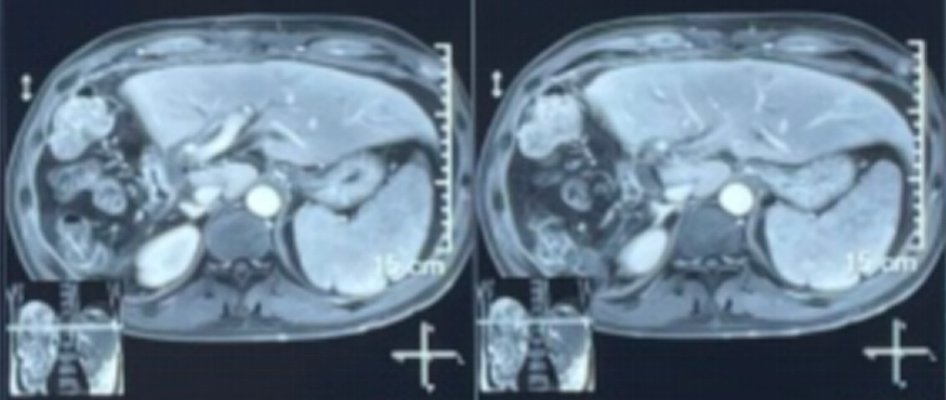 术后8个多月腹部MRI检查影像
术后8个多月腹部MRI检查影像
同时进行实验室检查,见HBV-DNA(<500IU/ml)、AFP(3.5ng/mL)及PIVKA-II(21mAu/mL)均在正常范围内。但患者出现持续性的低蛋白血症,以及转氨酶持续低水平升高,考虑是药物影响,结合患者复查未见明显肿瘤复发迹象,患者术后持续用药已超过8个月(“替雷利珠单抗+仑伐替尼”术后辅助治疗12个周期),遂停药。
2023-09患者复查肝功能示:肝脏各转氨酶指标已降至正常。
随访期间定期复查影像学检查及化验肿瘤学指标,见患者始终处于无瘤生存状态。
最近一次影像学复查(2023-12-27腹部MRI及胸部CT)示:未见明确肿瘤复发及转移征象。
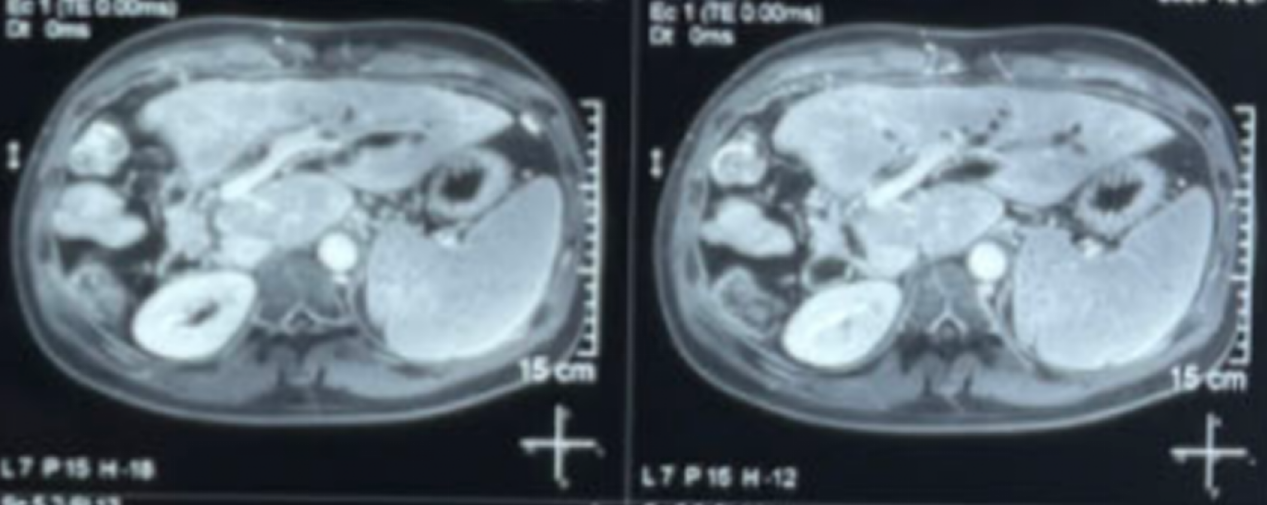 术后32个月腹部MRI检查影像
术后32个月腹部MRI检查影像
疗效评估:5个周期“替雷利珠单抗+仑伐替尼”联合3次TACE成功转化治疗IIIa期HCC达影像学CR和R0切除,并在术后辅助治疗中(12个周期“替雷利珠单抗+仑伐替尼”、1次TACE)长期遏制肿瘤复发,目前(截至2023-12-27)RFS已达32个月。
不良反应:转化治疗期间患者未出现任何明显的药物相关不良反应,术后辅助治疗8个月后因持续性的低蛋白血症及转氨酶持续低水平升高而停药。
病例总结
转化治疗是将不可切除的HCC转化为可切除HCC,是中晚期HCC患者获得根治性切除和长期生存的途径之一[3]。其中,针对肿瘤的转化治疗包括靶向药物、免疫治疗等系统抗肿瘤治疗和TACE等局部治疗,而两者联合有望获得更高的肿瘤缓解和更高的转化切除率[3]。基于此,对于本例CNLC IIIa期HCC患者,经MDT讨论和与患者及家属沟通,我们采取了在抗病毒治疗的基础上,给予“靶向药物+免疫治疗”系统治疗联合TACE局部治疗的综合性转化治疗方案。另外,转化切除只是中晚期HCC治疗的阶段性目标,实现长期生存才是最终的目标[2]。考虑到本例患者合并高危复发风险(肿瘤长径>5cm、微血管或大血管侵犯等)[4],在转化成功实现R0切除后,为了降低术后复发风险,使患者实现长期无瘤生存,我们及时沿用原靶免方案以及一次TACE术进行了术后辅助治疗。
近年来,国产PD-1抑制剂替雷利珠单抗在不可切除中晚期HCC治疗中的表现非常突出,许多相关临床研究数据都令人振奋不已。比如,RATIONALE-301研究显示,替雷利珠单抗单药治疗组患者的中位总生存期(mOS)长达15.9个月,客观缓解率(ORR)为14.3%,其中CR率是索拉非尼组的10倍(2.9% VS 0.3%);替雷利珠单抗组中位缓解持续时间(DoR)高达36.1个月,实现持续缓解[5]。再比如,BGB-A317-211研究表明:替雷利珠单抗联合靶向药物治疗治疗不可切除HCC患者,ORR达38.7%,疾病控制率约90.3%,中位无进展生存期(mPFS)达9.6个月;且两药联合≥3级TRAEs发生率仅为28.1%[6]。以上这些数据不仅突出了替雷利珠单抗在不可切除HCC治疗中能够快速缩瘤、持久抗癌的强大疗效,而且彰显了该药长期使用的良好安全性。此外,作为国产自研药物,替雷利珠单抗还具有价格便宜、可及性高的优势,因而备受临床医生和广大患者推崇。
基于以上证据和相关指南、共识推荐,对于该案例中的IIIa期HCC患者,我们通过5个周期“替雷利珠单抗+仑伐替尼”联合3次TACE成功转化治疗实现了影像学CR和R0切除。为降低术后复发风险,我们继续采取原靶免联合抗肿瘤方案(术后维持12个周期)及一次TACE术为患者实施了术后辅助治疗,有效遏制了肿瘤复发转移,目前RFS已长达32个月。另外,转化治疗期间患者未出现任何明显的药物相关不良反应,而术后辅助治疗期间患者出现了持续性的低蛋白血症及转氨酶持续低水平升高,结合患者复查未见明显肿瘤复发迹象,考虑用药时间已经长达8个月以上,遂予以停药。总体来看,替雷利珠单抗联合靶向药物治疗晚期HCC的安全性可控,患者耐受性良好。期待后续见证该患者更远期的生存获益,同时也希望替雷利珠单抗能够助力更多不可切除的中晚期HCC患者实现深度缓解、R0切除和长期无瘤生存。
[1]中华预防医学会肝胆胰疾病预防与控制专业委员会,中国抗癌协会肝癌专业委员会,北京医学会外科学分会肝脏学组,等.基于免疫联合靶向方案的晚期肝细胞癌转化治疗中国专家共识(2021版)[J].中华肝胆外科杂志, 2021, 27(4):241-251.
[2]中国抗癌协会肝癌专业委员会转化治疗协作组, 樊嘉. 肝癌转化治疗中国专家共识(2021版)[J]. 中华消化外科杂志, 2021, 20(6):600-616.
[3]中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30(4):367-388.
[4]肝癌术后辅助治疗中国专家共识协作组, 中国医师协会外科医师分会, 中国抗癌协会肝癌专业委员会, 等. 肝癌术后辅助治疗中国专家共识(2023版)[J]. 中华消化外科杂志, 2023, 22(4):437-448.
[5]Masatoshi Kudo, et al. Final analysis of RATIONALE-301: Randomized, phase III study of tislelizumab versus sorafenib as first-line treatment for unresectable hepatocellular carcinoma. 2022 ESMO.LBA36.
[6]Minshan Chen, et al. Efficacy and safety of tislelizumab (TIS) plus lenvatinib (LEN) as first-line treatment in patients (pts) with unresectable hepatocellular carcinoma (uHCC): a single-arm, multicenter, phase II trial. 2022 ESMO IO Abstract 165P.
排版编辑:肿瘤资讯-小瑜











 苏公网安备32059002004080号
苏公网安备32059002004080号


