
KRAS基因是mCRC患者中最常见的突变致癌基因。KRAS突变会引发KRAS蛋白的异常激活,持续传导下游信号通路,导致细胞异常增殖,从而促进肿瘤的发生和发展。目前研究已证实携带KRAS突变往往与CRC患者预后不良相关。介于RAS相关信号转导通路中复杂的反馈代偿机制、旁路激活以及肿瘤对药物敏感性等因素,针对RAS靶点的精准治疗策略仍是在mCRC领域具有挑战的难点。
KRAS G12C抑制剂的问世,为KRAS G12C突变mCRC的临床实践提供了新的治疗策略。Ⅰb期CodeBreak 101、Ⅲ期CodeBreak 300研究[1-2]等证明了KRAS G12C抑制剂Sotorasib(索托拉西布)联合抗EGFR单抗的疗效,且2024年初美国食品药品监督管理局(FDA)已受理KRAS G12C抑制剂-Adagrasib(阿达格拉西布)联合抗EGFR单抗-西妥昔单抗用于经治RAS G12C突变mCRC的新药申请,有望改写KRAS G12C抑制剂联合抗EGFR单抗治疗KRAS G12C突变mCRC的治疗格局。本期C对话特别邀请到国内肠癌治疗领域专家,来自北京协和医院的赵林教授携手来自山东大学齐鲁医院的郝静教授和北京协和医院的贾宁教授,对话来自西班牙瓦尔德西布伦大学医院Elena Elez教授,深度探讨KRAS突变mCRC的治疗现状、挑战及临床开发前景。
北京协和医院肿瘤内科副主任
北京肿瘤防治研究会消化肿瘤专家委员会主任委员
北京抗癌协会食管癌专业委员会副主任委员
北京肿瘤病理精准诊断研究会副会长
国家肿瘤专业医疗质量指控中心副主任委员
中国抗癌协会多原发和不明原发肿瘤专委会常委委员
北京医学会肿瘤学分会委员
CSCO结直肠癌专家委员会委员
CSCO食管癌癌专家委员会委员
CSCO抗肿瘤药物安全委员会委员
国家远程医疗与互联网医学中心胃肠肿瘤专家委员会副主任委员
Medical Oncology consultant at Vall d’Hebron University Hospital
Senior investigator at Vall d’Hebron Institute of Oncology
PI and sub-investigator in many clinical trials with molecular therapy primarily directed to the signalling pathway of the mapkinases in mCRC
山东大学齐鲁医院肿瘤内科主任医师
丹麦奥胡斯大学临床实验肿瘤学系访问学者
加拿大安大略省癌症研究院访问学者
中国抗癌协会神经内分泌肿瘤专委会常委
中国医疗保健国际交流促进会神经内分泌肿瘤分会副主任委员
山东省医师协会神经内分泌肿瘤专委会主任委员
山东生物医学工程少见肿瘤转化医学专委会主任委员
山东省研究型医院协会胃肠肿瘤MDT专委会副主任委员
山东省研究型医院协会肺癌转化医学专委会副主任委员
山东抗癌协会女医师分会副主任委员
山东省罕见疾病防治协会少见肿瘤分会副主任委员
山东省公共卫生协会消化道肿瘤防治委员会副主任委员
山东省抗癌协会肺癌专业委员会常委
北京协和医院肿瘤内科副主任医师
美国华盛顿大学访问学者
北京协和医院头颈部肿瘤协作组核心专家
北京抗癌协会头颈分子肿瘤诊治专委会常委
中国研究型医院学会精准医学与肿瘤MDT专委会委员

KRAS G12C突变mCRC临床展望:KRAS G12C抑制剂单药OR联合抗EGFR单抗?
由于RAS通路复杂的反馈机制,针对KRAS G12C突变mCRC,KRAS G12C抑制剂+抗EGFR单抗的联合方案即将成为“王牌组合”。
基于Ⅱ期CodeBreak 100研究[3]和Ⅰ/Ⅱ期KRYSTAL-1研究[4]的肿瘤缓解结果,KRAS G12C抑制剂索托拉西布和阿达格拉西布分别于2021年和2022年相继被美国食品药品监督管理局(FDA)加速批准KRAS G12C突变经治NSCLC适应症,一举打破KRAS家族不可成药魔咒。mCRC中近40%携带RAS癌基因突变包括KRAS、NRAS或HRAS等,其中最常见的就是KRAS突变[5]。而KRAS G12热点错义突变占全部KRAS突变超60%,包括G12D(40%)、G12V(35%)、G12C(11%)等[6],由此成为mCRC中最常见的靶点突变。
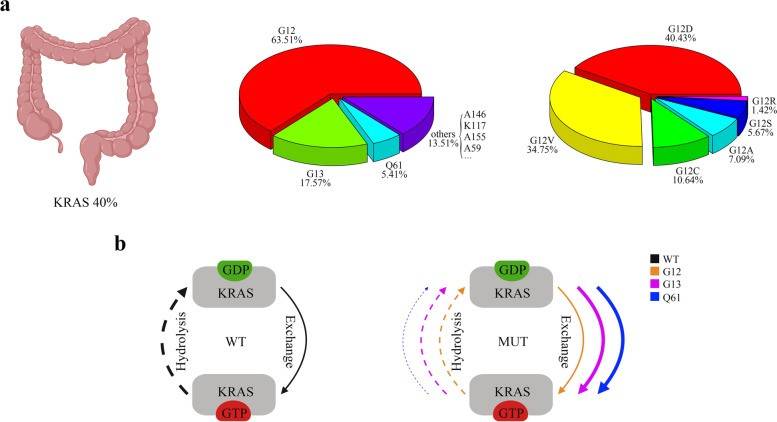
图1. CRC中KRAS突变的频率和分布以及突变KRAS蛋白的生化特征[6]
前期数据显示,KRAS G12C抑制剂单药在KRAS G12C突变化疗难治性mCRC患者中抗肿瘤活性有限,提示耐药性的存在,相关优化开发策略以实现最大程度的获益成为开展相关临床研究的重要方向。其后研究表明,联合治疗如与抗EGFR单抗联合使用可以提高其潜在活性并克服潜在的耐药机制。CodeBreak 300研究[2],全球首个证明KRAS G12C抑制剂联合抗EGFR单抗可使KRAS G12C突变mCRC患者生存获益的Ⅲ期研究,相关研究结果重磅发布于《新英格兰医学杂志》(New England Journal of Medicine),开启了KRAS G12C抑制剂联合抗EGFR单抗治疗KRAS G12C突变mCRC的序幕。Codebreak 300研究纳入既往未接受过KRAS G12C抑制剂治疗的KRAS G12C突变化疗难治性mCRC患者。研究结果非常令人振奋,两种剂量的索托拉西布联合帕尼单抗相较于标准治疗(SOC)显著改善患者的生存获益。
960mg/240mg索托拉西布联合抗EGFR单抗vs标准治疗(SOC)的中位PFS分别5.6个月和3.9个月vs 2.2个月。相比SOC,960 mg联合治疗降低疾病进展或死亡风险51%(HR=0.49, P=0.006);240mg联合治疗降低疾病进展或死亡风险42%(HR=0.58,P=0.03)。
960mg/240mg索托拉西布联合抗EGFR单抗vs标准治疗(SOC)的客观缓解率(ORR)分别为26.4%和5.7% vs 0%。
同样是KRAS G12C抑制剂联合抗EGFR单抗方案,Ⅰ/Ⅱ期KRYSTAL-1研究[4]也验证了该组合对于KRAS G12C突变CRC患者的疗效。研究纳入KRAS G12C 突变晚期实体瘤患者以评估阿达格拉西布的临床疗效,CRC队列包括阿达格拉西布单药组和阿达格拉西布联合西妥昔单抗组,结果显示,阿达格拉西布联合西妥昔单抗的ORR高达46%,中位PFS为6.9个月;而阿达格拉西布单药时的ORR为19%,中位PFS为5.6个月。
目前美国食品药品监督管理局(FDA)已受理KRAS G12C抑制剂-阿达格拉西布联合抗EGFR单抗-西妥昔单抗用于KRAS G12C突变的经治mCRC的新药申请并进入优先审评,KRAS G12C突变mCRC的治疗格局即将迎来实质性临床改变。
一项基于KRYSTAL-1研究的肿瘤生物标志物和基因组变化的分析[7]亦验证了该联合策略的科学性,该分析结果曾报道于2023年欧洲肿瘤内科学会(ESMO)大会:
基于KRYSTAL-1研究人群分析显示,无论EGFR表达水平如何,抗EGFR单抗+KRAS G12C抑制剂联合方案的ORR显著高于KRAS G12C抑制剂单药治疗。
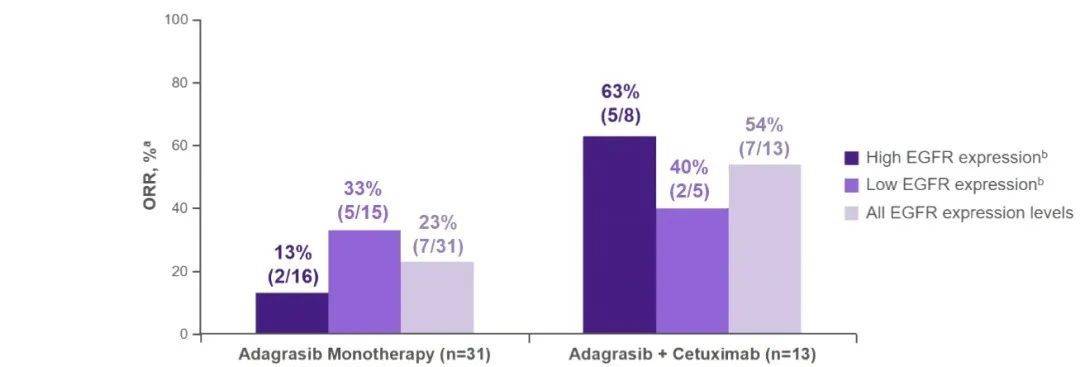
图2. KRYSTAL-1研究基于基线EGFR表达的ORR
同样,根据突变等位基因频率清除(MAFC)分析的ORR显示,第4周期第1天(C4D1)时,联合治疗组80%患者的MAFC≥90%,而单药组仅54%。在MAFC≥90%的患者中,联合治疗组的ORR为67%,单药组仅47%。
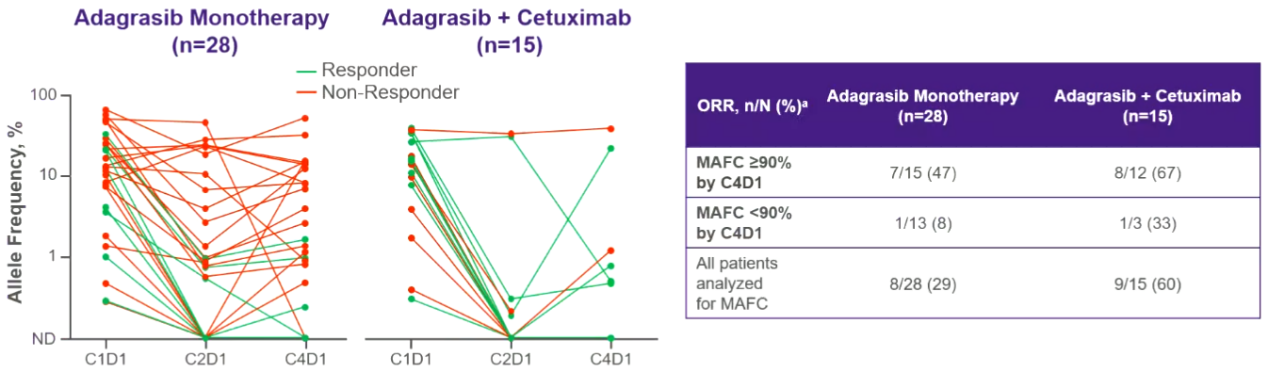
图3. KRYSTAL-1研究C4D1时根据MAFC分析的ORR
基于KRAS G12C抑制剂+抗EGFR单抗组合的惊艳结果,该治疗方案能否推进至一线/二线治疗备受瞩目。目前旨在评估阿达格拉西布+西妥昔单抗对比化疗二线治疗KRAS G12C突变mCRC的疗效和安全性的Ⅲ期KRYSTAL-10研究已完成入组,让我们共同期待相关研究结果的公布。
KRAS突变mCRC临床开发方向:耐药性解决策略和泛KRAS抑制剂的开发
抑制KRAS突变引发的继发突变是否影响患者整体生存是临床关键顾虑。而基于CRC中KRAS等位基因的多样性,泛KRAS抑制剂的临床开发备受期待。
由于KRAS通路错综复杂,其突变会激活下游或旁路信号通路如BRAF-MEK-ERK通路和PI3K-AKT-mTOR通路等。因此若一线或二线治疗中应用KRAS G12C抑制剂阻断KRAS突变极易引起旁路激活导致耐药,可能导致患者后线治疗的生存获益缩短,成为专家们的顾虑。以肺癌领域的II期SCARLET研究为例,SCARLET研究[8]探索了索托拉西布联合铂双药化疗治疗KRAS G12C突变的非鳞状非小细胞肺癌的疗效,该方案5.7个月的中位PFS相比历史标准化疗约6个月的中位PFS并不算理想。对此,专家们表示,目前针对KRAS G12C抑制剂推向一线/二线治疗应用的研究正在进行中,期待看到相关方案是否能带来整体生存获益。但对于当下的mCRC治疗,仍是建议尽早识别致癌基因,根据不同的基因型选择可及的靶向治疗方案对患者有利。目前针对KRAS突变的转移性CRC的临床实践中一线治疗时以传统化疗联合贝伐珠单抗治疗为主,但未来KRAS G12C抑制剂的成功开发,mCRC的一线治疗有可能迎来格局式的改变。除了KRAS突变的精准靶向治疗,针对耐药性的逆转和个体化治疗的研究也将会是mCRC的热点。
同样,KRAS G12C抑制剂的成功激励着针对KRAS这一经典突变基因更多的精准治疗探索。如前所述,在所有KRAS突变中,KRAS G12C和G13D最为普遍,仅是同一个密码子上氨基酸突变种类不同,即KRAS G12D是KRAS 12号密码子突变引入天冬氨酸,而不是半胱氨酸,直接表现为流行病学上的差异。KRAS G12C是NSCLC患者中最常见的KRAS突变,而KRAS G12D是CRC和胰腺癌中最常见的突变。并且由于CRC中KRAS等位基因的多样性,携带不同KRAS突变的患者具有不同预后。
中国学者进一步研究发现,我国CRC患者中约37.6%为KRAS突变,其中近32.2%的患者为KRAS G12D突变亚型,通常发生在65岁以下的患者,KRAS突变是结肠癌患者的独立预后因素[9],具有比较广阔的临床前景。且研究显示,并非所有的KRAS等位基因都会导致对抗EGFR单抗的耐药性[9]。携带KRAS G13D突变CRC患者能从一线化疗加上西妥昔单抗中受益,尽管与KRAS野生型患者相比,密码子13的突变与较差的预后相关。
目前针对KRAS G12D、G12V、G13C等其他KRAS突变亚型的药物也已陆续开展,大部分药物尚在临床前阶段,针对G12D突变的KRAS靶向治疗成为备受瞩目的治疗方向,但目前多处于临床前阶段[10],但MIRATI公司研发的MRTX1133已进入临床阶段且公布了其治疗机制,安斯泰来也在布局针对ASP-3082的临床Ⅰ期研究也在患者招募中。此外,研究发现[11],在KRAS突变肺癌中,野生型HRAS和NRAS具有抑制突变KRAS活性的作用。也就是说,KRAS突变是诱发癌症的“敌军”;而HRAS和NRAS则可抑制KRAS,且能杀伤肿瘤是“友军”。因此,如果想要杀伤肿瘤,我们需要抑制KRAS,但要避免抑制HRAS和NRAS,否则会带来毒性。例如,美国纪念斯隆-凯特琳癌症中心的Piro Lito团队研究发现一种泛KRAS(pan-KRAS)抑制剂可能为开发更多靶向KRAS的治疗方法绘制了新的蓝图[12]。研究发现,这种KRAS抑制剂可使KRAS癌蛋白失活,并且可优先且高亲和力地结合KRAS的非活性状态,保留NRAS和HRAS,通过阻断核苷酸交换以阻止野生型KRAS和广泛的KRAS突变体的激活,抑制KRAS突变癌细胞的下游信号转导和增殖。一系列研究提示,针对泛RAS抑制剂的探索具有广泛的治疗意义,值得在KRAS驱动的癌症患者中进行进一步临床研究。
小结:KRAS G12C抑制剂仅是开始,靶向KRAS的精准之路前景广阔
在mCRC的临床实践中,联合应用KRAS G12C抑制剂和抗EGFR单抗即将改变KRAS G12C突变mCRC后线治疗实践。然而,就整体KRAS突变mCRC患者的精准靶向治疗而言,KRAS G12C抑制剂的突破只是迈出的第一步。随着KRAS G12C抑制剂的成功应用,相关研究也仍需探索解决耐药性的策略和泛KRAS抑制剂的发展,以克服患者后续治疗的挑战。靶向KRAS的精准治疗探索之路正在全面蓄力,展现出前所未有的广阔前景。
[1] Kuboki Y, Fakih M, Strickler J, et al. Sotorasib with panitumumab in chemotherapy-refractory KRASG12C-mutated colorectal cancer: a phase 1b trial. Nat Med. 2024;30(1):265-270. doi:10.1038/s41591-023-02717-6
[2] Fakih MG, Salvatore L, Esaki T, et al. Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. N Engl J Med. 2023;389(23):2125-2139. doi:10.1056/NEJMoa2308795
[3] Fakih MG, et al. Sotorasib for previously treated colorectal cancers with KRASG12C mutation (CodeBreaK100): a prespecified analysis of a single-arm, phase 2 trial. Lancet Oncol. 2022;23(1):115-124.
[4] Ou SI, Jänne PA, Leal TA, et al. First-in-Human Phase I/IB Dose-Finding Study of Adagrasib (MRTX849) in Patients With Advanced KRASG12C Solid Tumors (KRYSTAL-1). J Clin Oncol. 2022;40(23):2530-2538. doi:10.1200/JCO.21.02752
[5] Patelli G, Tosi F, Amatu A, et al. Strategies to tackle RAS-mutated metastatic colorectal cancer. ESMO Open. 2021;6(3):100156. doi:10.1016/j.esmoop.2021.100156
[6] Zhu G, Pei L, Xia H, Tang Q, Bi F. Role of oncogenic KRAS in the prognosis, diagnosis and treatment of colorectal cancer. Mol Cancer. 2021;20(1):143. Published 2021 Nov 6. doi:10.1186/s12943-021-01441-4
[7] M.S. Pelster, R. Yaeger, S.J. Klempner, et al. Adagrasib with or without cetuximab in patients with KRASG12C-mutated colorectal cancer (CRC): Analysis of tumor biomarkers and genomic alterations.Annals of Oncology (2023) 34 (suppl_2): S410-S457. doi:10.1016/annonc/annonc1323
[8] Yuan Y, Liu Y, Wu Y, et al. Clinical characteristics and prognostic value of the KRAS mutation in Chinese colorectal cancer patients. Int J Biol Markers. 2021;36(2):33-39. doi:10.1177/17246008211017152
[9] Shinya Sakata, Hiroaki Akamatsu, Koichi Azuma,et al.The primary endpoint analysis of SCARLET study: A single-arm, phase II study of sotorasib plus carboplatin-pemetrexed in patients with advanced non-squamous, non-small cell lung cancer with KRAS G12C mutation (WJOG14821L).Journal of Clinical Oncology Volume 41, Number 16_suppl. doi:org/10.1200/JCO.2023.41.16_suppl.9006
[10] Feng J, Hu Z, Xia X, et al. Feedback activation of EGFR/wild-type RAS signaling axis limits KRASG12D inhibitor efficacy in KRASG12D-mutated colorectal cancer. Oncogene. 2023;42(20):1620-1633. doi:10.1038/s41388-023-02676-9
[11] Feng J, Hu Z, Xia X, et al. Feedback activation of EGFR/wild-type RAS signaling axis limits KRASG12D inhibitor efficacy in KRASG12D-mutated colorectal cancer. Oncogene. 2023;42(20):1620-1633. doi:10.1038/s41388-023-02676-9Kim D, Herdeis L, Rudolph D, et al. Pan-KRAS inhibitor disables oncogenic signalling and tumour growth. Nature. 2023;619(7968):160-166. doi:10.1038/s41586-023-06123-3
往期回顾:
C对话 | 第一期:王照元教授与陈功教授三问三答,海峡两岸专家解析肠癌外科难点疑点
C对话 | 第二期:王照元教授答陈功教授,释局晚直肠癌术前治疗模式
C对话 | 第三期:转移瘤不可切除的mCRC,原发灶是否应该切除?——陈功教授答王照元教授
C对话 | 第四期:梁逸歆教授答王晰程教授,析少见突变结直肠癌临床治疗难题
C对话 | 第五期:王晰程教授答梁逸歆教授,解肠癌治疗热点问题
C对话 | 第六期:陈功教授对话谢燿宇教授,深入交流两岸肠癌诊疗之同与异
C对话 | 第七期:中外观点碰撞,解读BRAF突变肠癌最佳治疗
C对话 | 第八期:云端再会首,RAS/BRAF野生型肠癌抗EGFR治疗策略名家观点相辉映
C对话 | 第九期:中外专家“面对面”,畅谈肠癌生物标志物检测与治疗
C对话 | 第十期:基于数据,归于经验——中英名家对话,探讨MSI-H/dMMR肠癌免疫治疗具体策略
C对话 | 第十一期:中外专家双视角,深度剖析结直肠癌CSCO与NCCN指南更新之表里
C对话 | 第十二期:中西对话OPTICAL,“精准”聚焦结肠癌新辅助
C对话 | 第十三期:中西对话IMPROVE,从“间歇给药”到CRC“免疫治疗全景观”
C对话 | 第十四期:中西对话CRC策略优化关键词:“三药or两药”、“漏斗效应”、“最佳决策”
C对话丨第十五期:中西话肠癌前沿:“耐药标志物”、“原发灶与转移灶免疫微环境”
C对话丨第十六期:中西对话,洞悉KRAS突变转移性结直肠癌的临床现状与未来方向
C对话 | 第十七期:ESMO热点回顾,中西专家研讨肠癌四大关键议题,洞悉新趋势与突破
C对话 | 第十八期:中西对话mCRC热点突变靶向治疗新格局探索(上):BRAF突变mCRC临床实践难点与方向
排版编辑:肿瘤资讯-Hannah











 苏公网安备32059002004080号
苏公网安备32059002004080号


