
神经营养酪氨酸受体激酶(NTRK)基因融合在儿童肿瘤中的发生率显著高于成人[1],且存在于多个瘤种中,尤以婴儿型纤维肉瘤(IFS)、先天性中胚层肾瘤(CMN)、累及乳腺或唾液腺的分泌性癌、儿童甲状腺乳头状癌、儿童神经胶质瘤和软组织肉瘤较常见[2-3],是主要的肿瘤驱动基因之一。
罹患NTRK基因融合肿瘤的患儿,尚存在巨大的未被满足的临床需求。拉罗替尼作为一款高选择性口服TRK抑制剂,基于其稳健且持久的总体缓解率(ORR),被批准用于各种瘤种的NTRK基因融合肿瘤成人和儿童患者。在2023年国际儿童肿瘤学会(SIOP)上,拉罗替尼以84%的ORR(IRC评估)在儿童NTRK基因融合肿瘤中展现出优异的疗效和良好的安全性[4];而在局部晚期或转移性IFS患儿中,拉罗替尼具有相比化疗更长的持续治疗时间,进一步证实了拉罗替尼在IFS患儿整体治疗策略中的重要作用[5]。
2024年,欧洲肿瘤内科学会肉瘤和罕见癌症大会(ESMO Sarcoma and Rare Cancers Congress)在瑞士卢加诺如期举办,拉罗替尼再次在儿童实体瘤的一线治疗中展现出强劲实力[6]。本期,我们特邀中山大学肿瘤防治中心张翼鷟教授为我们进行研究解读,畅谈真知灼见。
中山大学肿瘤防治中心儿童肿瘤科主任
华南肿瘤学国家重点实验室 PI
中山大学肿瘤防治中心学术委员会 委员
国家卫健委儿童血液病恶性肿瘤专家委员会 副主任委员
国家卫健委儿童血液病恶性肿瘤专家委员会 恶性实体肿瘤内科专业委员会主任委员
中国抗癌协会血液病转化研究专业委员会 候任主委
中国抗癌协会儿童肿瘤专委会 常委
中国研究型医院协会儿童肿瘤专业委员会 常委
CSCO 中国抗淋巴瘤联盟 常委
CSCO中国抗淋巴瘤联盟 儿童及青少年学组 常务副组长
中国抗癌协会血液肿瘤专业委员会常委 (第三、第四届)
研究速递:拉罗替尼一线治疗儿童NTRK基因融合肿瘤的有效性和安全性分析[4]
研究方法
本研究纳入两项临床试验(NAVIGATE和 SCOUT)中,未接受过任何系统性抗癌治疗(包括化疗、放疗或靶向治疗)的非原发性中枢神经系统(CNS)儿童NTRK基因融合肿瘤患者,主要终点为经过独立审查委员会(IRC)评估(RECIST v1.1)的客观缓解率(ORR)。值得注意的是,在事后分析时,SCOUT 研究中没有疾病进展(PD)的患儿被允许停止拉罗替尼治疗(即处于“等待观察”状态),并随访观察停止治疗≥28天患儿的情况。
研究结果
截至2022年7月,共有37例局部晚期或转移性 NTRK 基因融合肿瘤患儿被纳入分析,中位年龄为2.1岁(范围0~17岁),共包括5种肿瘤类型,分别为:婴儿纤维肉瘤(n=18;49%)、软组织肉瘤(n=14;38%)、先天性中胚层肾瘤(n=2;5%)、甲状腺癌(n=2;5%)和乳腺癌(n=1;3%)。通过下一代测序(NGS)、荧光原位杂交技术(FISH)和逆转录PCR(RT-PCR)这3种检测手段,分别在24例(65%)、7例(19%)和6例(16%)患者中识别出NTRK基因融合。此外,共检测出9种独特的基因融合伴侣,其中 ETV6::NTRK3 最常见(n=19;51%;图 1)。
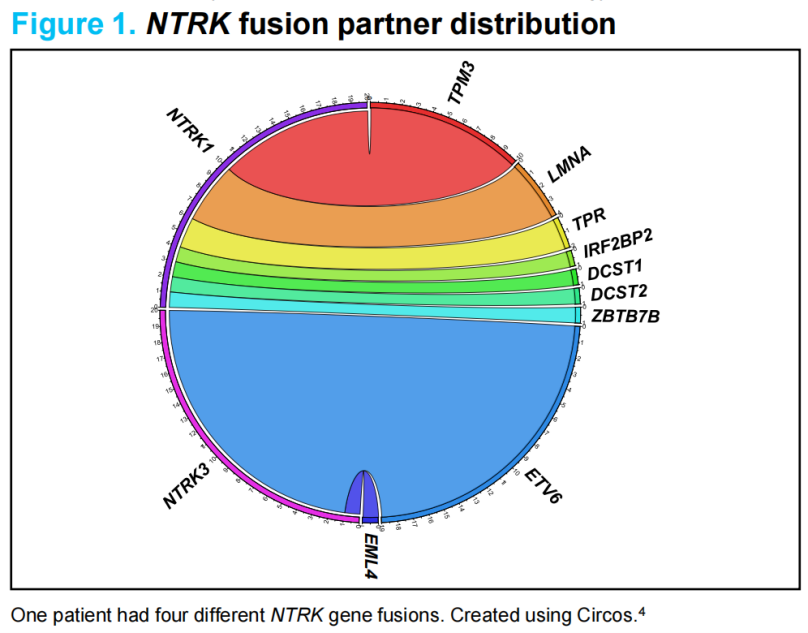
图1 NTRK基因融合伴侣分布图
研究结果显示,ORR为89%(95% CI:75~97),其中7例(19%)为部分缓解(PR),26例(70%)为完全缓解(CR),包括5例pCR;另有3例(8%)疾病稳定(SD)、1例(3%)不可评估(图2)。
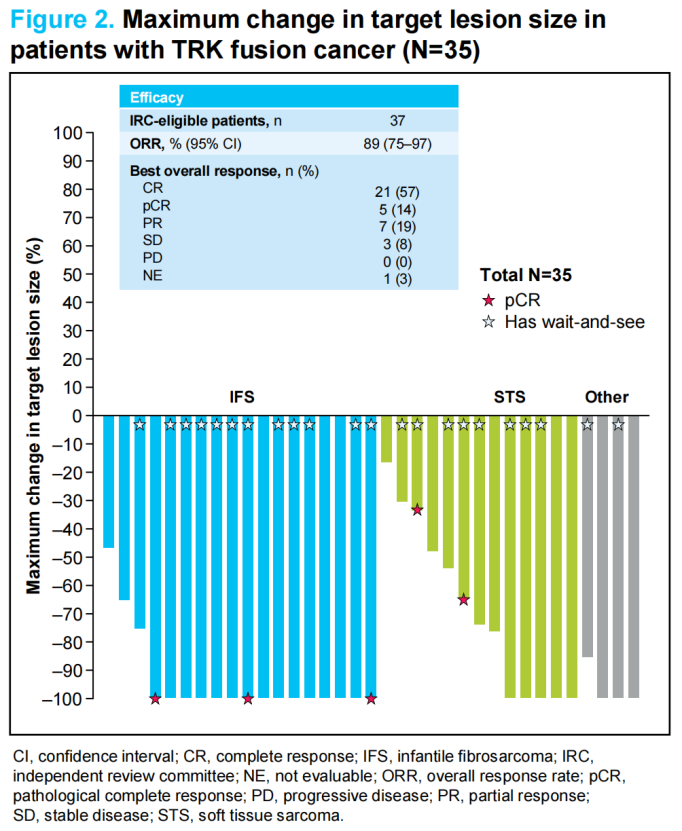
图2 患者肿瘤缩小情况
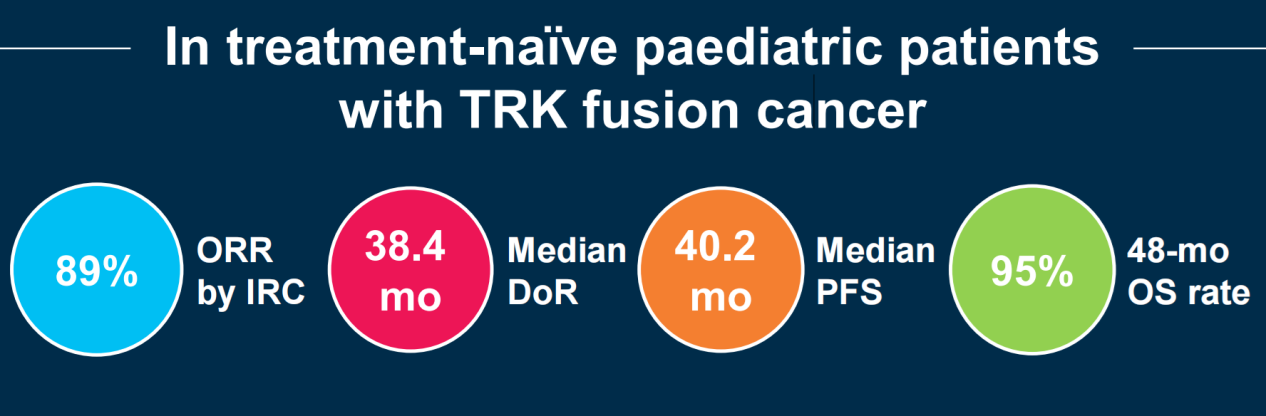
所有患者的中位至缓解时间为1.8个月(范围 0.9~5.4),治疗持续时间为1~64+个月(中位31.2个月)。在中位随访时间分别为28.6、30.3和37.8个月时,缓解持续时间(DoR)、无进展生存期(PFS)和总生存期(OS)分别为38.4个月 [95% CI:23.4~不可估计(NE)]、40.2个月(95% CI:25.5~NE)和未达到;48个月OS率为95%(95% CI:87~100;图3)。
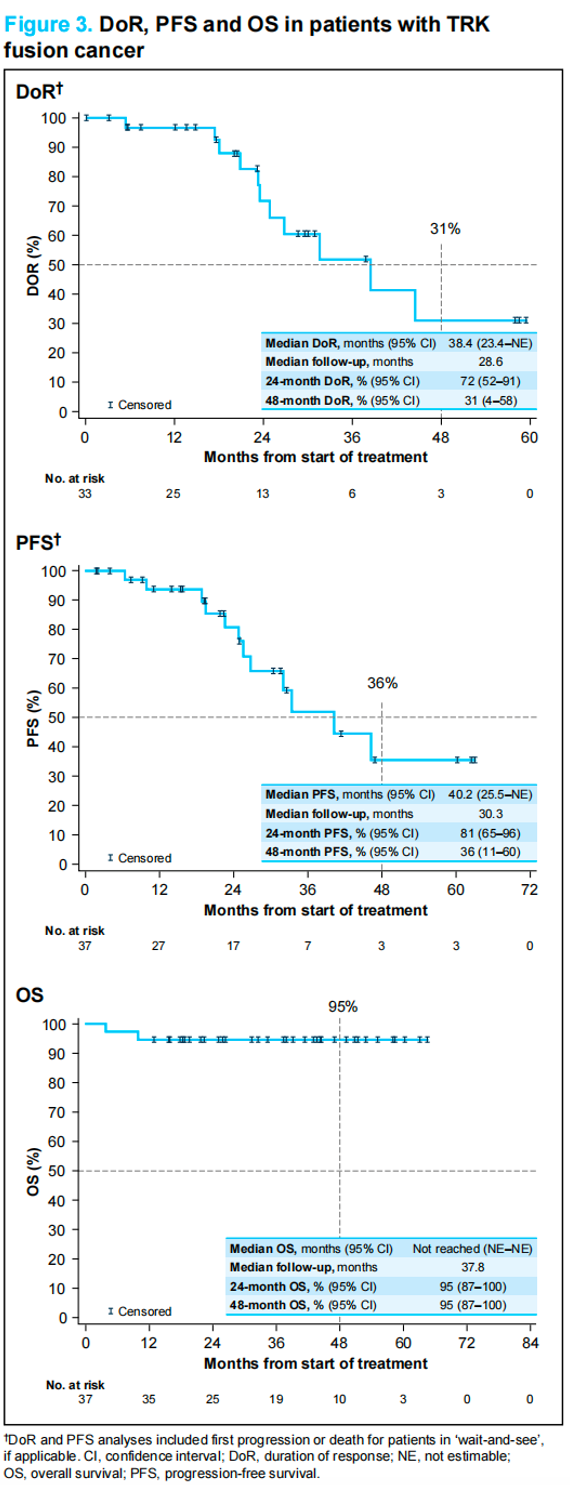
图3 患者DoR、PFS和OS情况
截至数据截止时,22例(59%)患儿进入了“等待观察”状态且全部存活(即没有疾病进展并停止拉罗替尼治疗),“等待观察”的时间从 0 个月到 44 +个月不等。其中,9例患儿在停止拉罗替尼之前接受了手术治疗,11例患者未接受手术,2例患儿手术情况不明。此外,有 5 例(23%)患儿已恢复治疗,并有4例在拉罗替尼治疗后获得再次缓解(包括3例CR、1例PR),剩下1例患儿获得SD。
安全性方面,33例(89%)患者发生治疗相关不良事件(TRAE),主要为1级或2级(图4)。15例(41%)患者报告了3级和4级TRAE,最常见的是中性粒细胞计数降低(8%)。2例患者因TRAE停止治疗。无TRAE导致的死亡。 1例患者死于治疗后出现的不良事件(呼吸衰竭)。
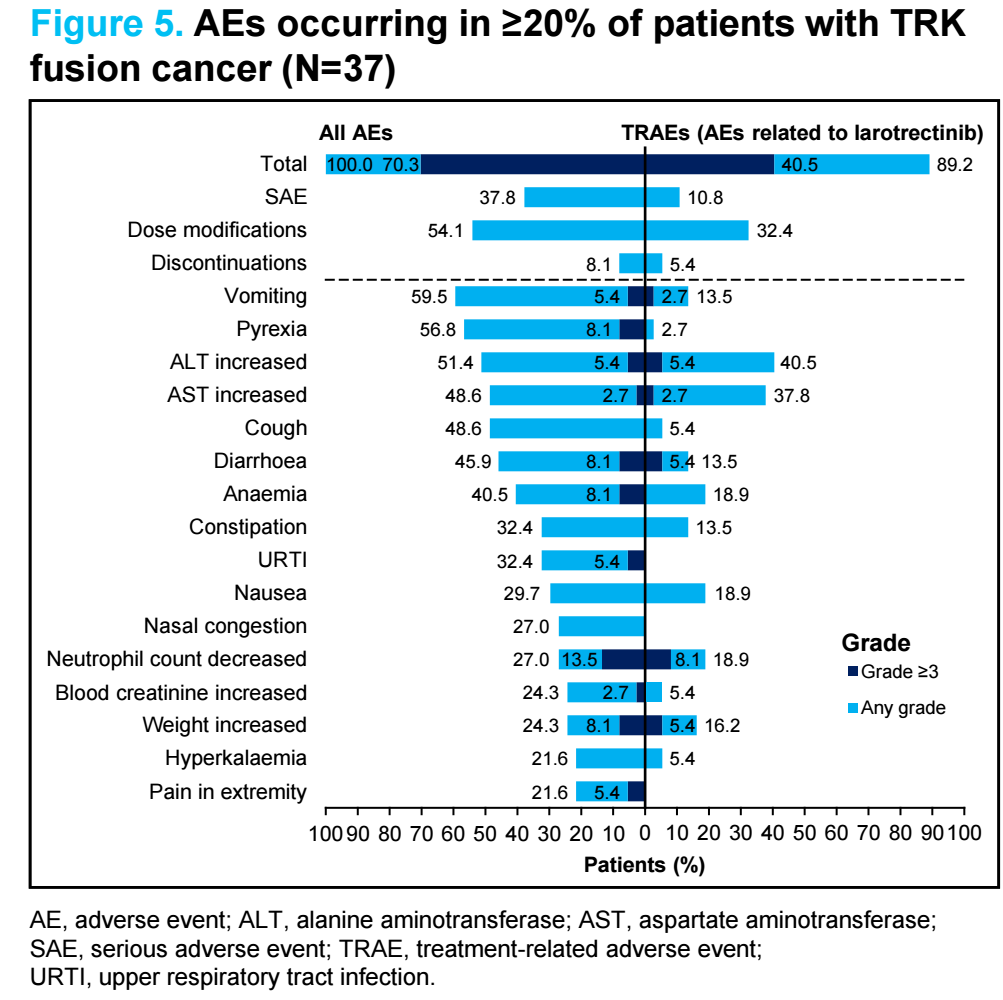
图4 患者不良事件发生情况
研究结论
拉罗替尼在治疗既往未接受全身治疗的NTRK基因融合儿童肿瘤中表现出快速且持久的缓解、延长的生存期和良好的安全性,这将进一步支持拉罗替尼在儿童NTRK基因融合肿瘤中的一线治疗地位。此外,未来或可更广泛地采用NGS,以识别可能受益于靶向治疗的患者。
专家解读:拉罗替尼一线治疗实力强劲,国内外指南/共识奠定治疗地位
未尽之需亟待突破,儿童NTRK基因融合肿瘤治疗仍存在未被满足需求
多项研究显示,NTRK基因融合肿瘤患者往往预后不佳[7-8],而在发生率相对更高的儿童患者中,标准治疗疗效的不尽人意和未尽之需,成为困扰患儿重获新生的桎梏。调查显示[9],儿童医院恶性实体瘤患儿接受手术治疗的比例是接受非手术治疗的1.5倍,其中有19.32%的患儿接受了1次以上的手术,有45.87%为四级手术,对患儿的预后和生活质量影响较大;此外,高达11天的平均住院时长也为患儿家属带来沉重的疾病负担。
放疗和化疗是NTRK抑制剂问世前的主要非手术治疗方法,但对于儿童来说,放化疗的耳毒性和血液毒性等不良反应对近期和远期健康均会产生深远影响。例如,顺铂化疗产生耳毒性的危险因素之一就是年龄<5岁[10],更有23.7%的儿童实体瘤患者在经过顺铂化疗后发生听力丢失[11]。此外,粒细胞减少性发热(FN)也是儿童肿瘤患者急诊就医住院的首要不良事件,其中接受铂类为基础的化疗后发生FN的比例高达60%,约28%接受顺铂化疗的儿童患者出现高镁血症[12]。因此,传统的标准治疗可能会影响患儿长期健康,研究显示中位随访17年后,依旧有75%儿童肿瘤存活者的健康受不良事件影响[13]。
一线治疗实力强劲,拉罗替尼获国内外多部指南和共识强力推荐
基于目前已有报道的有效性数据,大部分患儿在治疗后1~2个周期就能达到PR或CR,中位持续缓解时间38.4个月,起效迅速且缓解时间持久[14]。尤其对于IFS患儿,一项回顾性研究显示,非加权(p=0.0023)和加权(p=0.0058)分析均提示,相比传统标准治疗[长春新碱+放线菌素-D(VA方案)或长春新碱+放线菌素-D+环磷酰胺(VAC方案)],拉罗替尼治疗IFS后可分别降低79%(HR 0.21,95% CI:0.07~0.63)和85%(HR 0.15,95% CI:0.05~0.42)的治疗失败风险,且到后续治疗时间、到致残手术时间和到完全手术切除时间均相对更久,并减少了截肢风险和功能损毁[5]。此外,拉罗替尼在儿童甲状腺癌、NTRK重排梭形细胞肿瘤等多种儿童肿瘤中均表现出良好的抗肿瘤活性和安全性[15-17]。
在今年的欧洲肿瘤内科学会肉瘤和罕见癌症大会上[4],拉罗替尼再次证明了其在儿童NTRK基因融合肿瘤一线治疗中安全可靠且疗效优异。高达89%的ORR更是意味着近9成的患儿将获得持续的疾病缓解,中位持续缓解时间也达到了38.4个月。在远期生存方面,40.2个月的中位PFS和尚未达到中位的OS意味着患儿的预后生存相对更持久,其中高达95%的48个月OS率意味着大多数患儿目前存活超过4年。值得注意的是,本研究中有59%的患儿曾暂停拉罗替尼治疗,其中4例再次进行拉罗替尼治疗的患儿也获得了再次缓解。相较于放化疗无法耐受的不良反应和手术带来的创伤风险,拉罗替尼主要为1/2级的TRAE也为患儿治疗安全性提供了保障。
目前,拉罗替尼已被多个国家和地区纳入指南和共识[18-23],并一致推荐为IFS、NTRK重排的梭形细胞肿瘤、原发性中枢神经系统肿瘤、甲状腺癌儿童患者的等儿童NTRK基因融合肿瘤的优选方案[24]。可以预见,未来随着国内外用药经验的不断积累,拉罗替尼将不断夯实循证根基,为儿童NTRK基因融合肿瘤患者带来焕然新生。
[1] Gatalica Z, Xiu J, Swensen J, et al. Molecular characterization of cancers with NTRK gene fusions[J]. Mod Pathol, 2019, 32(1):147-153.
[2] Paulson VA, Rudzinski ER, Hawkins DS. Thyroid cancer in the pediatric population[J]. Genes, 2019, 10(9):723.
[3] Zhao XN, Kotch C, Fox E, et al. NTRK fusions identified in pediatric tumors: the frequency, fusion partners, and clinical outcome[J]. JCO Precis Oncol, 2021, 1:PO.20.00250.
[4] Federman N, et al. Poster presentation at SIOP 2023: Abstract 339.
[5] Orbach D, et al. Oral presentation at SIOP 2023: Abstract 193.
[6] Daniel Orbach, et al. Efficacy and safety of larotrectinib (laro) as first-line treatment for paediatric (paed) patients (pts) with TRK fusion cancer. 2024 ESMO Sarcoma and Rare Cancers Congress.
[7] Irene Santi, et al. Prognostic value of the NTRK fusion biomarker in the Netherlands. ESMO 2021. 105P.
[8] George D. Demetri, et al. Characteristics and outcomes of patients with NTRK fusion-positive (NTRK+) metastatic / locally advanced solid tumours receiving non-TRK inhibitor standard of care, and prognostic value of NTRK fusions in clinical practice. ESMO 2021. 100P.
[9] Huining Zhou, et al. Analysis of the Spectrum and Characteristics of Pediatric Cancer Based on Hospital Information Systems in China. Cancer Management and Research 2021;13:1205-1214.
[10] 曲奎尧, 唐锁勤等. 铂类药物在儿童实体瘤化疗中的应用. 世界临床药物. 2015; 36(5): 305-309.
[11] Meng Wei, Xiaojun Yuan. Cisplatin-induced Ototoxicity in Children With Solid Tumor. J Pediatr Hematol Oncol.2019 Mar;41(2)e97-e100.
[12] Castelán-Martínez OD, et al. Cancer Chemother Pharmacol. 2020 Nov;86(5):673-679.
[13] Katja I Braam, et al. Design of the Quality of Life in Motion (QLIM) study: a randomized controlled trial to evaluate the effectiveness and cost-effectiveness of a combined physical exercise and psychosocial training program to improve physical fitness in children with cancer. BMC Cancer.2010 Nov 11;10:624.
[14] Mascarenhas L, van Tilburg CM, Doz F, et al. Efficacy and safety of larotrectinib in pediatric patients with tropomyosin receptor kinase (TRK) fusion-positive cancer: an expanded dataset[J]. J Clin Oncol, 2022, 40(16_Suppl):10030.
[15] Waguespack S, Drilon A, Farago AF, et al. Treatment of advanced TRK fusion thyroid cancer with larotrectinib[J]. Eur Thyroid J, 2019,8(suppl 1):1-127.
[16] DuBois SG, Laetsch TW, Federman N, et al. The use of neoadjuvant larotrectinib in the management of children with locally advanced TRK fusion sarcomas[J]. Cancer, 2018, 124(21):4241-4247.
[17] Geoerger B, Van Tilburg C, Dubois S, et al. Larotrectinib efficacy and safety in pediatric patients with trk fusion cancer[J]. Pediatr Blood Cancer, 2019, 66(S4):S65-S66.
[18] 日本临床肿瘤学会等关于NTRK融合晚期成人/儿童实体瘤患者TRK抑制剂诊断和治疗临床建议.
[19] 儿童和选定成人肿瘤中NTRK基因融合的检测:新加坡专家共识.
[20] JSCO-ESMO-ASCO-JSMO-TOS:微卫星不稳定或NTRK融合实体瘤患者泛瘤种治疗的国际专家共识.
[21] 拉罗替尼治疗NTRK基因融合实体瘤的比利时专家共识.
[22] 儿童肿瘤协作组国际共识与争议:聚焦TRK抑制剂时代IFS的治疗.
[23] TRK融合儿童肿瘤检测和治疗的加拿大专家共识.
[24] 中国抗癌协会小儿肿瘤专业委员会, 中国研究型医院学会儿童肿瘤专业委员会. 拉罗替尼治疗TRK融合儿童肿瘤中国专家共识.
仅供医疗卫生专业人士参考
医学审批号:MA-LAR-CN-0189-1
排版编辑:肿瘤资讯-SY












 苏公网安备32059002004080号
苏公网安备32059002004080号


