无治疗缓解(TFR)已成为慢性髓性白血病(CML)患者管理的重要临床终点,对于维持深度分子学反应(DMR,即基线分子负荷降低4或4.5个对数)的患者,可为其停止酪氨酸激酶抑制剂(TKI)治疗提供机会。法国STIM研究等早期研究分析了伊马替尼和二代TKI,表明部分患者(40% ~ 50%)可在停止治疗后维持DMR,且大多数复发发生在最初6个月内。国际推荐中分析并概述了TFR成功的先决条件:最佳候选者是接受了5年以上治疗,并且至少有3年稳定MR4 (BCR::ABL1 IS 0.01%)或2年持续MR4.5 (BCR::ABL1 IS 0.0032%)的首次慢性期(CP)患者。成功实现TFR的关键预后因素包括治疗持续时间、DMR持续时间、风险评分和转录物类型,但TFR的最佳患者选择仍存在挑战,而最近的研究为提高TFR率(原文描述为improve TFR eligibility, 个人理解为提高适合TFR的患者群,翻译为TFR率)的策略提供 见解。有证据提示,早期切换干预以达到最佳反应、联合治疗、未达到DMR情况下的主动切换、剂量优化和诱导-维持方案可提高分子学反应,从而提高TFR率。《British Journal of Haematology》近日发表的一篇综述中,作者报告和讨论了所有可能提高TFR率的治疗策略,并特别强调了未来的可能方案。现整理主要内容供参考,水平有限敬请谅解。

TFR的预后因素
指南已经提出了TFR的预后因素,建议多来自伊马替尼的试验。表1列出了关于TKI停药的主要试验。在各种临床试验中,TFR成功的两个高度相关的预后因素包括停药前的治疗持续时间和DMR持续时间,两者已成为预测患者TFR成功的关键因素。在多中心EURO-SKI研究中,较长的中位治疗持续时间(估计伊马替尼治疗超过5年)和较长的DMR持续时间(超过3.1年)与6个月时维持主要分子学反应(MMR)的概率增加相关。此外,EURO-SKI和STIM2研究中与伊马替尼停药后3年维持MMR相关的预后因素分析,确定了4个预后因素和2个预后模型。在EURO-SKI研究中,在36个月时,纳入分析的510例患者中有41%保持MMR,显著的预后因素包括较长的TKI治疗持续时间、TKI期间的DMR持续时间、转录物类型和诊断时外周血中的原始细胞较少。两个模型在STIM2研究纳入的184例患者中进行了验证。
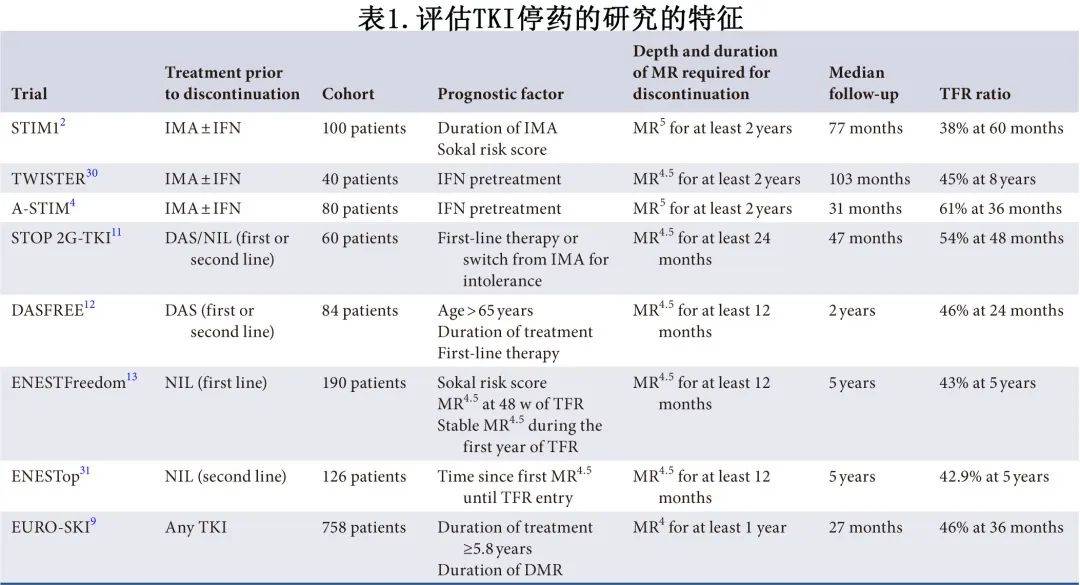
当然,在某些情况下也可以考虑Sokal风险分层和之前的干扰素(IFN)暴露作为成功TFR的因素。通过单变量分析,法国STIM1研究确定了几个潜在的停药后分子学无复发生存(MRFS)的预测因素,包括年龄、性别、Sokal和EUTOS风险评分、既往IFN治疗、伊马替尼治疗持续时间以及至不可检测的分子学反应时间及其持续时间。然而,在多因素分析中,只有Sokal评分分层和伊马替尼治疗时间是独立和显著的预后因素。在According to STIM研究(a -STIM)中,既往IFN治疗再次确定为延长无治疗生存期的潜在积极预后因素。然而,鉴于未来尝试TFR的大多数患者将接受一线TKI单药治疗,因此既往IFN暴露的预后作用可能存在争议。
在首个二代TKI停药研究(法国STOP研究)中,纳入因不耐受伊马替尼而接受达沙替尼或尼洛替尼一线治疗或二线治疗的患者,其复发率显著低于因既往反应不佳或耐药而接受这些药物的患者,但未发现年龄、性别、Sokal评分、既往IFN治疗、TKI治疗时间和MR4.5持续时间等基线临床参数与分子学复发率存在显著相关性。DASFREE研究纳入84例接受一线或二线达沙替尼治疗的CP-CML患者,结果显示2年TFR率为46%;达沙替尼治疗时间、一线治疗和年龄>65岁与疗效显著相关。事实上,在ENESTfreedom研究中,获得稳定MR4.5的同质CP-CML患者队列停止尼洛替尼一线治疗,最终5年分析显示,Sokal风险评分低、TFR第48周时的BCR::ABL1 IS 水平低以及停药后1年内维持稳定MR4.5与较高的TFR率相关。
转录物类型与停药后结局之间存在关联。意大利研究小组发现,在包含173例可评估患者的队列中,与携带e13a2转录物的患者(n=67)相比,携带e14a2转录物的患者(n=106)表现出较高的持续DMR和成功TFR率。值得注意的是,携带e14a2转录物的患者中有61%在12个月时达到TFR,而有e13a2转录物的患者中只有22%。然而,西班牙研究小组分析了2020例患者,发现e14a2转录物对前6个月的分子学缓解有积极影响,但未观察到与TFR率相关。性别倾向最初是由法国研究小组报告的一个可能的易感因素,但没有其他研究证明易感性或性别相关的差异。
实时定量聚合酶链反应(RQ-PCR)的3个月反应可预测后续结局:有报道称,达到MMR的患者在长期随访中可持续DMR。这一亚组患者(主要是在使用第二代TKI作为一线治疗后观察到的患者)适合在治疗3~4年后尝试TFR。该方法旨在减少脱靶效应,并提高患者生活质量(QoL)。通过分析115例随访≥12个月的患者开始TKI治疗后的特异性BCR::ABL1减半时间,评估了早期分子学反应(EMR,即3个月时BCR::ABL1 IS ≤10%)的预测作用。55%的患者在治疗12个月后获得持续TFR, BCR::ABL1减半时间是持续TFR的最强预测因子(减半时间<9.35天的患者中为80%,而≥21.85天的患者为4%)。此外,e14a2转录物和治疗持续时间也是持续TFR的独立预测因素。
越来越多的证据强调免疫系统在长期反应控制中的作用,例如法国研究和EURO-SKI研究报告,停药时的NK细胞计数增加。澳大利亚研究小组在参与CML8和CML10临床研究的患者中检查了效应性和抑制性免疫应答,发现活化性NK受体表达增加且Treg和单核细胞髓源性抑制细胞水平降低的患者可获得成功TFR。此外,在多中心2期DADI研究(在至少1年DMR后接受二线达沙替尼治疗的患者中评估TFR)中,作者报告了高NK细胞计数与低δγ+ T细胞和CD4 + 调节性T细胞计数之间的显著相关性,并且停药持续时间较长。
近年来,人们不断努力提高RQ-PCR检测的灵敏度。数字微滴PCR (digital microplet PCR, ddPCR)的应用提高了灵敏度和特异度,在符合TFR标准的患者亚组中显示出良好前景,通过ddPCR检测DMR可增加停药后的成功率,但停药后复发风险增加的ddPCR阈值仍存在争议。Pagani等利用BCR::ABL1 DNA PCR的荧光激活细胞分选技术,深入研究了TFR期间残留CML细胞谱系的复杂动力学。该研究对随访时间超过12个月的20例TFR患者组成的队列进行检查,发现仅在淋巴区存在可测量残留病变(MRD)。值得注意的是,MRD主要在淋巴细胞中检出,而未在粒细胞中检出,且B细胞中MRD的发生率高于T细胞(中位数10 -4.9 对10 -5.7 ,p=0.014)。这些研究强调了BCR:: abl1阳性淋巴细胞中存在多能祖细胞。最近,学者通过分类白细胞亚群进一步完善了其分析,通过排除潜在的混杂因素二提高了预测的准确性。他们采用白细胞部分分离,结合不同细胞系的PCR患者特异性DNA分析,通过前瞻性比较分析复发和维持缓解患者,可检测到粒细胞和T细胞的MRD;而在单核细胞、B细胞和NK细胞中无此现象。根据BCR::ABL1检测对粒细胞阳性、粒细胞阴性/T细胞阳性和粒细胞阴性/T细胞阴性患者进行分组,得出离散性的60个月复发率(分别为100%、67%和25%),准确率高达77%。
已有研究在停止治疗的CML患者中研究了杀伤免疫球蛋白样受体(KIR)对预后的影响。在法国STIM研究的240例患者中评估了KIR2DL5B基因型的影响,在接受伊马替尼一线治疗的CML患者中,KIR2DL5B阳性与不良预后相关。EURO-SKI研究探索了T细胞抑制性受体(CTLA-4)配体CD86对浆细胞样树突状细胞(pDC)的作用:TFR患者的CD86 + pDC浓度低于DMR但仍在治疗的患者。>95 CD86 + pDC×10 5 个淋巴细胞的临界值可提示停药后复发风险较高,无复发生存率(RFS)为30%;而CD86 + pDC×10 5 的临界值为<95时,患者的RFS率为70%。
哪些患者适合TFR:来自临床试验和真实世界评估的见解
多项研究旨在确定适合TFR的最佳候选者,但这些研究在尝试TFR之前,对达到必要的分子学反应深度的要求存在显著差异(表1)。例如,在纳入接受伊马替尼治疗的患者(不论之前是否有IFN暴露)的STIM1研究中,不可测量分子残留病(MR5)至少2年的患者符合纳入标准。A-STIM研究也采用类似的标准,甚至允许BCR::ABL1转录物偶尔呈阳性。而TWISTER研究将MR4.5设定为纳入的阈值。相反,在接受二代TKI治疗的患者中探索TFR的研究多数要求达到MR4.5的缓解深度。但EURO-SKI研究采用了不太严格的标准,纳入758例MR4缓解至少1年的慢性期CML患者,不论患者是否接受一线或二线TKI治疗。
ENESTnd研究首次估算了适合长期TFR的患者。经过5年的随访,接受尼洛替尼300mg BID治疗>3年的患者中有37.9%达到持续的MR4.5持续> 1年,有可能达到TFR。相比之下,接受伊马替尼400mg QD治疗的患者中约22%获得类似的结果,表明两个队列在TFR率方面存在显著差异。一项真实世界分析评估了在临床试验之外接受一线二代TKI治疗的患者的TFR率。根据STIM标准,“资格”定义为持续DMR(即MR4.5不可测≥2年)。397例患者(伊马替尼组320例;尼洛替尼组53例;达沙替尼24例)中位3年随访后,尼洛替尼组45%的患者和达沙替尼组29%的患者符合TFR标准,而伊马替尼组为13%。5年随访中,在128例接受二代TKI(尼洛替尼,n=81;达沙替尼,n=47)的患者符合纳入标准,尼洛替尼组的患者符合TFR资格的比例增加至53%,达沙替尼组增加至36%,表明长期治疗可提高TFR率。该发现不仅强调了治疗持续时间在确定TFR候选者方面的重要性,也强调了尽管使用更强效和选择性更强的一线TKI,但仍有约50%的患者不适合停药。
还研究了实验室技术在预测分子学复发方面的作用,通过RQ-PCR监测可预测复发。每个月每增加0.01-log (BCR::ABL1 IS ),则任何时间点的复发率增加28%(比值比1.28)。作者还提出了每月增加0.068-log [BCR::ABL1 IS ]的临界值,将患者队列分为80.7%的阴性/低斜率和19.3%的高斜率;其中72.5%的阴性斜率患者在2年内无病生存,87.9%的高斜率患者在2年内复发。然而,由于与RQ-PCR监测相关的实验室技术的变异性和患者体内结果的波动,确定TFR的最佳候选者仍有挑战。在这种情况下,多项研究已经显示使用ddPCR预测停药后复发风险的有前景结果。在50例经RQ-PCR评估为稳定MR4.5反应的CML患者中,ddPCR阴性和阳性的两组患者之间没有临床差异,甚至包括在TKI治疗的中位持续时间(ddPCR阴性组13.1年vs.阳性组10.9年,p=0.639)。与ddPCR阴性患者的RQ-PCR相比,ddPCR结果可预测3个月后的复发。
为进一步了解影响成功TFR的因素,多个工作组共同参与了一项患者数据荟萃分析,该综合分析纳入参与过5项不同TFR相关临床经验的483例患者的数据。205例患者(42%)出现分子学复发,停药后至复发的中位时间为3个月。根据ddPCR结果和治疗时间将患者分为4组时,低复发风险患者为治疗时间≥6年且BCR::ABL1 IS 水平低于各研究cut-off值的患者。
提高TFR率的策略
本节是关于提高TFR率的各种策略,包括早期转换治疗以达到最佳反应,以及作为初始联合治疗、TFR前主动转换策略以提高DMR率、剂量优化(包括个体化剂量调整和诱导-维持策略)。表2总结了相关临床试验。

早期转换为更有效的TKI
考虑到早期反应(ELN标准)对预后的影响,提高TFR率的首选策略可能包括,治疗失败或出现预警反应的患者早期转换以达到最佳反应。最近的一个例子是意大利SUSTRENIM研究,一项前瞻性、干预性和随机两臂研究,旨在评估在治疗3、6和12个月时反应不佳(ELN 2013标准)的情况下,早期从伊马替尼转换为尼洛替尼的作用,并与一线使用尼洛替尼进行对比。在前3年治疗期间达到≥MR4并维持至第4年治疗结束的所有患者均视为符合停药条件。初步数据显示,在中位随访30.4个月后,接受伊马替尼治疗的220例患者中,25.4%在治疗的前12个月内未达到最佳反应(ELN标准),因此转为尼洛替尼。在24个月随访时,332例获得分子学反应的患者中76例(23.6%)达到MR4.5,尼洛替尼组的发生率较高(48例vs 28例,p=0.015),并且尼洛替尼转换时机(无论是早期还是晚期)对DMR发生率无影响。
另一个例子为DASCERN研究,其在伊马替尼一线治疗反应不佳的患者中评估早期转为达沙替尼。总体而言,获得完全血液学反应(CHR)但在伊马替尼治疗3个月时BCR::ABL1 IS >10%的260例患者按2∶1的比例随机接受达沙替尼100mg QD (n=174)或伊马替尼400mg QD (n=86)继续治疗。在12个月随访时,达沙替尼组的MMR率高于伊马替尼组(29% vs. 13%, p=0.005),考虑到治疗交叉,达沙替尼组2年的累积MMR率为64%,伊马替尼组为41%。虽然研究结果支持在反应不佳的情况下早期转换为达沙替尼可能带来临床获益,但考虑到与两种药物的既定安全性特征相一致的不良事件,提示需要仔细考虑患者特征和早期转换为更强效TKI的真实风险/获益比。然而在一线治疗中,减少剂量的达沙替尼(50mg QD)已显示出与标准剂量100mg QD相当的疗效,且胸腔积液的发生率降低,提示需要进一步阐明降低达沙替尼剂量在改善既往TKI反应、同时减轻不良反应方面的潜在获益。
一线联合治疗策略
提高符合长期TFR标准的患者数量的另一种可能策略,可能包括给予不同的初始治疗。IFN可增强CML分子学反应,包括在停止TKI治疗后或联合TKI,以提高DMR率;对于后者,多个研究团队尝试将聚乙二醇干扰素(Peg-IFN)联合TKI作为一线治疗。例如三期法国PETALs研究随机200例CML患者1:1接受尼洛替尼300mg BID(A臂),或尼洛替尼300mg BID联合Peg-IFN 30mg/星期共30天,其次尼洛替尼300mg BID+ Peg-IFN 30mg/周共2周,然后升级到45 mg /周共2年,最后尼洛替尼单药(B臂)。早期数据表明,尽管联合方案的累积MR4.5率稍高(54.6% vs 44%,p=0.05),但两组在停药后无MMR丢失生存(MMR loss-free survival)无统计学差异(p=0.445)。
以IFN作为免疫监测增强剂,德国多中心III期TIGER研究将692例初诊患者随机分组,分别接受尼洛替尼300mg BID单药治疗(n=353)或联合Peg-IFN 30~50 μg/周治疗(n=339);研究设计还包括维持期(联合治疗组,在确认MMR后>24个月给予Peg-IFN)和TFR期(两组均有,至少36个月的治疗后,在MR4>12个月后)。在中期分析中,联合治疗组在12个月和18个月时的MMR率高于尼洛替尼单药组(12个月时81% vs 76%,p=0.035;18个月时88% vs 83%,p=0.021)。停药后24个月随访时,两组均有22%的患者达到TFR,联合治疗组与尼洛替尼单药组在12个月时的MMR率分别为69%和60% (p=0.12) ,24个月为57%和48%。尽管与法国研究相似,尼洛替尼联合IFN与治疗期间较高的分子学反应率相关,但未显著改善停药期的长期TFR率。
澳大利亚工作组在2期ASCEND-CML研究中测试了另一种方案,也是将asciminib作为一线治疗的首批研究之一,asciminib是一种新型的特异性靶向ABL Myristoyl Pocket (STAMP)抑制剂。共纳入98例患者,接受asciminib 40mg BID治疗,并根据ELN 2020标准进行治疗目标评估。治疗失败(3个月或6个月时BCR::ABL1 IS >10%,12个月或18个月时BCR::ABL1 IS >1%)患者继续服用ciminib,并根据医师偏好加用第二种TKI(伊马替尼、尼洛替尼或达沙替尼);在6个月、12个月或18个月时反应不佳的患者将asciminib剂量加倍至80mg BID。中位随访11个月后,一项临时期中分析报告了93.7%的EMR率,47%的患者达到MMR,考虑到既往二代TKI一线治疗的结果,这一百分比非常高。最常见的不良事件为血细胞减少和脂肪酶升高(不伴胰腺炎)。鉴于上述前提,这些结果似乎令人鼓舞,因为长期结局改善,无治疗生存期有所延长。
2期研究进一步探索了asciminib与现有TKI联用的协同效应,其主要终点是12个月时达到MR4。共纳入144例CP-CML患者,给予尼洛替尼300mg BID、达沙替尼100mg QD、伊马替尼400mg QD。治疗12周并获得CHR后,根据I期研究的药代动力学数据,在以下队列中给予asciminib:尼洛替尼300mg BID + asciminib 20mg BID (n=30)或asciminib 40mg QD (n=32);达沙替尼100mg QD + asciminib 80mg QD (n=32);伊马替尼400mg QD+ asciminib 60mg QD(n=31)。12个月时MR4率为37.7%。尽管DMR率较高,但37.6%的患者发生3~4级不良事件,17%的患者因毒性需要停药。还需进行更长时间的随访,以评估达到DMR和TFR后的asciminib维持治疗。
3期ASC4FIRST研究纳入新诊断CP-CML患者,正在评估asciminib 80mg QD作为一线治疗对比医师选择的TKI的安全性和疗效,主要终点为第48周的MMR;其仍处于患者招募阶段,值得期待结果,以确定asciminib作为一线治疗方案的潜力。ASC4FIRST研究有望加深对asciminib在改善DMR和TFR率方面所起作用的理解。
无DMR时的主动转换策略
目前已在探索通过主动转换策略来提高DMR率,从而增加符合TFR标准的患者数量。ENESTop研究是该策略的开创性案例之一,在这项研究中,伊马替尼治疗至少4年后未达到持续性DMR的患者转换为尼洛替尼进行巩固治疗,尼洛替尼巩固治疗1年后126例患者尝试TFR。48周时,57.9%的患者停药,最后5年随访时42.9%的患者仍维持TFR。总体而言,巩固治疗阶段77.9% (n=127)的患者和TFR阶段78.6% (n=99)的患者报告任何级别不良事件,分别包括6.1%和3.2%的心血管事件。从伊马替尼主动转换到尼洛替尼可使患者达到并维持持续DMR。ENESTPath研究也纳入伊马替尼治疗24个月后达到完全细胞遗传学缓解(CCyR)但未达到DMR的患者。在620例纳入研究的患者中,381例仅进行生存分析,而238例接受尼洛替尼300mg BID治疗,获得持续DMR至少12个月的患者1:1随机分配到TFR期(1组)或进一步接受尼洛替尼巩固期(2组)。两组在TFR 12个月时的DMR率无统计学差异(31.9% vs 37.5%,p=0.383);但尼洛替尼治疗2年后的累积MR4率为64.3%,对于伊马替尼治疗可能无法达到相同反应水平的患者,有超过30%得以挽救。TFR前87.7%的患者发生不良事件,包括9.7%的心血管事件;TFR期63.2%的患者发生不良事件,包括1例卒中、外周动脉狭窄和心肌梗死。
2020年ELN建议也提到,在无法达到DMR的情况下主动转换到二代TKI的可能性,建议用于低危或中危的年轻患者或希望怀孕的女性。但未来asciminib的安全性数据可能会改变该局限性,特别是为了提高分子学反应,最近的3期ASC4MORE研究将84例伊马替尼治疗后未达到DMR的CML-CP患者随机分组:伊马替尼400mg QD+asciminib 40mg QD、伊马替尼400mg QD+asciminib 60mg QD、继续伊马替尼400mg QD、转换为尼洛替尼300mg QD,每组共21例患者;初始报告中,48周时的MR4.5率分别为19%、28.6%、0%和4.8%。asciminib+伊马替尼组的严重不良事件和中断治疗的发生率高于继续接受伊马替尼治疗,但低于尼洛替尼组。考虑到加用asciminib的高DMR率,似乎具有良好的耐受性和前景。
剂量优化策略
多项研究已经评估TFR前剂量优化策略的可行性。2期DESTINY研究是降阶梯治疗后TFR的首次尝试,148例接受伊马替尼治疗、16例接受尼洛替尼治疗和10例接受达沙替尼治疗的患者纳入MMR队列(n=49)或MR4队列(n=125),中位治疗时间为6.9年;TKI的标准剂量减半12个月并停药24个月。MMR组和MR4组的RFS分别为36%和72%,似乎比EURO-SKI研究的结果更佳,其中使用标准TKI剂量的一半达到并维持MR4后停药的患者的RFS为50%。基于临床试验IRIS和CML-IV研究纳入的患者队列的数学模型,是支持在达到稳定缓解后TKI降阶梯的理论基础。其通过应用一个机制模型,将TKI反应框架为一个动态过程,由肿瘤生长、白血病干细胞(LSC)的激活/失活和TKI对增殖而非静止LSC的细胞毒性作用之间的相互作用引起,证明TKI如何通过靶向活跃复制的LSC快速降低BCR::ABL1水平;随后,随着静息状态的LSC变得不那么活跃,其水平可能降低得更慢。该研究提供了强有力的证据,表明缓解期残余LSC的长期耗竭不受剂量降低的影响,病提出了一种确定患者特异性最佳剂量和监测的策略。
意大利DANTE研究正在评估尼洛替尼降阶梯治疗对TFR的影响,113例CML-CP患者初始接受尼洛替尼300mg BID治疗≥3年。巩固治疗期间,107例患者转为尼洛替尼300mg QD,40例持续DMR患者尝试TFR。中位随访12.7个月,40例TFR患者中27例维持MMR或更佳;约68%的患者在尼洛替尼停药后1年仍无病,从而证实TFR前的尼洛替尼降阶梯是可行的剂量优化策略。
真实世界经验也报告了降阶梯治疗后TFR率的改善。意大利一项回顾性研究纳入248例在接受减量TKI治疗后尝试TFR的患者,51.3%的患者减量主要是由于毒性,20.8%是由于显著的合并症,27.8%的患者是由于医师选择减量。随访24.9个月,69.4%的患者仍处于TFR状态;既往无TKI耐药史的患者TFR结局显著较好。此外,与之前的研究一致,持续DMR超过6.8年的患者和携带e14a2 BCR::ABL1转录物变异的患者显示出TFR延长的趋势。同样,一项纳入246例CML患者的研究中,患者在达到MMR后因不可耐受的不良反应而减少TKI剂量,其中92.9%的患者在中位随访27.3个月期间维持缓解。值得注意的是,76例患者停止治疗,其中74%的患者在停止治疗后2年仍保持缓解。法国观察性研究TOPASE纳入120例真实世界接受ponatinib治疗的CML患者,其中8.3%的患者从既往TKI转换以改善缓解。CML-CP患者中,15mg组、30mg组和45mg组分别占35.6%、44.2%和20.2%;3个月时平均剂量分别为16.8、26.9、35.8 mg。总体而言,最初无反应的患者中有60%在4.8个月内达到MMR,提示较小剂量的ponatinib可作为加深反应的有效选择,从而可达到TFR。
诱导维持策略
研究者还探索了使用二代或三代TKI进行诱导阶段,然后使用毒性较低的伊马替尼治疗。单臂2期研究IMPACT-I纳入10例CML患者,患者接受一线二代TKI(达沙替尼6例;尼洛替尼4例)治疗至少12个月且获得持续MMR至少6个月,然后转为伊马替尼治疗。转换方案后,所有患者在41个月随访时均表现出持续的分子学缓解,89%的患者在最近一次随访时达到DMR,且毒性特征较好。
一项研究纳入CML特异性KCL-22细胞培养,评估了伊马替尼和ponatinib的药物轮换方案。最初,KCL-22细胞的生长因药物轮换而降低,但细胞最终适应该方案,表现出对伊马替尼的短暂敏感性,尽管在几个治疗周期后持续时间很短。尽管如此,使用ponatinib 等耐药倾向较低的TKI开始治疗,然后使用更敏感、副作用更少的TKI进行后续治疗仍存在获益。目前,法国正在进行的2期研究TIPI (NCT0407044)正在评估,在新诊断CML患者中进行为期6个月的ponatinib 30mg QD诱导期,以及在达到稳定的MR4.5后进行伊马替尼400mg QD维持期。该研究结果值得期待,可能有助于进一步理解该策略及其潜在获益。
提高TFR的新药和未来方法
白血病干细胞
大量证据表明,处于TFR的患者仍可保留残留的CML 白血病干细胞(LSC)(即使达到DMR),表明TFR可能不一定需要完全根除CML LSC。值得注意的是,残留的LSC可能对TKI耐药,并且可以持续存在,而不会导致CML复发。近年来对CML中LSC活性调控机制的研究取得重大进展。LSC表达与正常造血干细胞(HSC)不同的特异性标志物,包括CD33、CD36、CD26、CD93、CD25、CD123和白细胞介素-1受体辅助蛋白(ILRAP)。BCR::ABL1可增强多种促进细胞存活和抑制凋亡的下游信号通路,如JAK/STAT、Ras/MAPK和PI3K/AKT,这些信号通路有助于CML细胞的增殖和存活。此外,代谢谱研究表明,与分化的BCR::ABL1阳性细胞相比,CML LSC的生存更多依赖于氧化磷酸化(OxPHOS)。TKI治疗似乎首先减少糖酵解、谷氨酰胺分解、三羧酸循环和氧化磷酸化;这些通路可在长时间治疗后恢复,可能是由于LSC的代谢重编程状态。已经确定了多个有趣的通路,可作为体外和体内靶向LSC策略的潜在靶点(图1)。
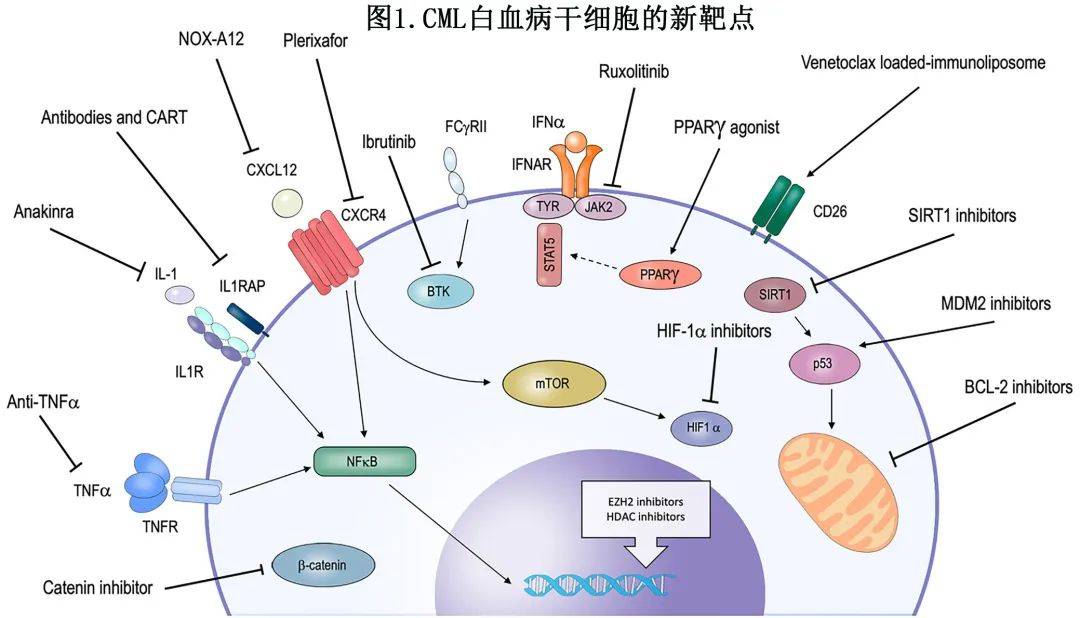
其他策略包括:靶向LSC表面标志物(CD26和ILRAP1的作用)、靶向骨髓微环境(CXCR4/CXCL12、TNFα和IL-1通路的作用)、靶向抗白血病效应物、靶向LSC中的凋亡调节因子(BCL2和p53的作用)、靶向LSC中的其他可操作靶点(FcγRIIb、JAK2和PPARγ)、靶向CML LSC的表观遗传学。多处于早期开发阶段,不做赘述。
总结
在真实世界证据和临床试验中,均有一部分患者达到稳定DMR,并可成功实现一代和二代TKI停药,而临床预后因素对TFR的成功与否有重要影响。转换为更强效、更有选择性的TKI已显示出扩大停药候选人群的潜力。虽然IFN联合TKI治疗提高了DMR率,但其对TFR的影响仍然有限。Asciminib作为一线治疗时,早期分子学缓解有所改善;进一步分析将阐明其增强TFR的潜力。主动转换策略可有效挽救达到CCyR但未达到DMR的患者,可能带来更高的TFR率。TFR的降阶梯剂量优化策略是一个有前景的方向。靶向LSC的新方法正在研究中,预期结局会改善,并且有可能扩大适合TFR的人群。
Costa A, et al.How to improve treatment-free remission eligibility in chronic myeloid leukaemia?Br J Haematol . 2023 Dec 26. doi: 10.1111/bjh.19269.











 苏公网安备32059002004080号
苏公网安备32059002004080号


