近年来,抗体偶联药物(ADC)已经取得了突破性进展,成为抗肿瘤药物中发展最迅速的领域之一,但是尚存在诸多未满足的需求。近日,中山大学肿瘤防治中心徐瑞华教授团队于国际权威期刊Cancer Communications发表综述,系统概述了ADC药物的发展现状和未来方向。【肿瘤资讯】整理如下,以飨读者。
专家简介
医学博士,中山大学肿瘤防治中心主任、医院院长、研究所所长,华南恶性肿瘤防治全国重点实验室主任,教授,博士生导师。
中国医学科学院学部委员
中国临床肿瘤学会理事长
中国抗癌协会副理事长
中国抗癌协会靶向治疗专委会首届主任委员
中国抗癌协会化疗专委会候任主任委员
中国临床肿瘤学会肠癌专委会主任委员
《Cancer Communications》主编
研究生教材《肿瘤学》主编
本科生教材《临床肿瘤学》主编
以通讯或第一作者在国际顶级期刊JAMA、Nature Medicine、Nature Materials、Cancer Cell、Lancet Oncology等发表SCI论文200余篇,入选科睿唯安(Clarivate Analytics)全球高被引科学家,连续入选中国高被引学者榜单。以第一完成人获国家科技进步二等奖2项、全国创新争先奖1项、省部级一等奖6项、何梁何利基金科学与技术进步奖、吴阶平医药创新奖、谈家桢临床医学奖及CSCO年度成就奖。入选国家百千万人才工程、全国先进工作者、国务院特殊津贴专家、南粤百杰人才培养工程、国家卫生计生突出贡献中青年专家等人才项目。
背景
生物制药创新技术促进ADC药物发展,开启了抗肿瘤治疗新时代。ADC药物由一个抗体,一个载荷(高效毒性药物分子)和连接子构成。ADC可通过特异性识别抗原,释放载荷杀灭靶细胞。部分ADC小分子可穿透细胞膜,进一步杀伤周围肿瘤细胞,称为旁观者杀伤效应。某些ADC还具有抗体免疫效应,如补体依赖细胞毒作用(CDC),抗体依赖细胞介导细胞毒作用(ADCC)和抗体依赖细胞吞噬作用(ADCP)。
ADC药物和靶向及化疗药物存在以下差异。第一,传统抗体通过抑制信号通路或促进肿瘤生长的生理过程起作用。ADC在抗体结合肿瘤细胞靶抗原后,细胞毒载荷通过直接抑制肿瘤细胞有丝分裂或破坏DNA结构起到抗肿瘤效应。因此ADC具有更强的杀伤效率和较低的系统毒性。第二,对于靶向治疗耐药的患者,通过相同靶点起作用的ADC药物依旧有效。最后,ADC可以攻击新的治疗靶点如TROP2。
目前(截至2023年3月)已经有15款ADC获批。体内效应和代谢过程,靶点选择,药物结构,识别部位和连接子类型等的任何变化都可以导致药物疗效、毒性、药代动力学和精准释放的显著不同。因此,抗体设计,连接子技术,载荷,连接过程,不同生物技术平台成为开发ADC的主要障碍。
ADC的获批和临床应用
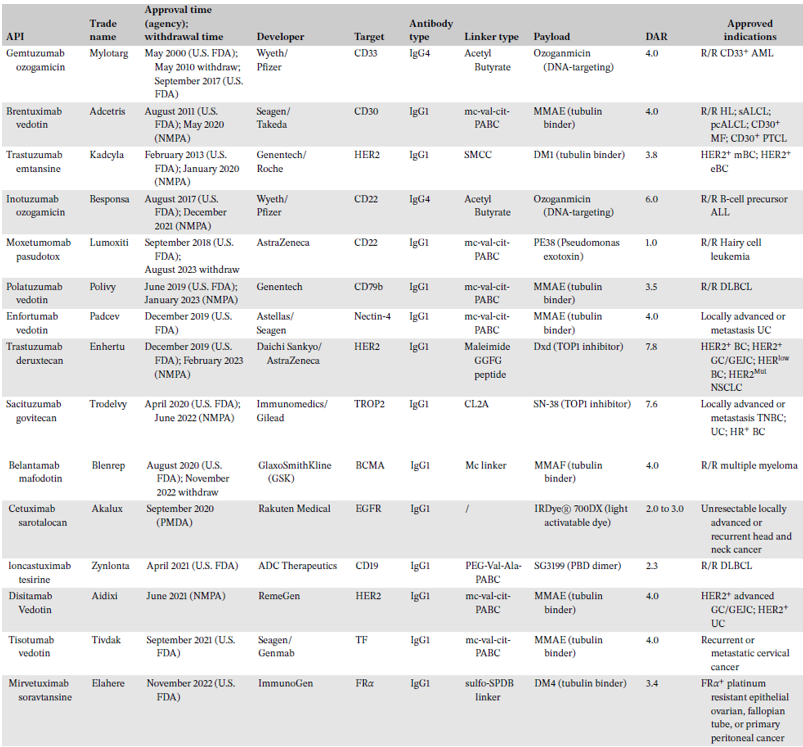
自2000年美国食品药品监督管理局(FDA)批准首个ADC以来,目前已经有15款ADC获批,其中13款上市(表1)。Belantamab mafodotin因Ⅲ期试验失败退市,Moxetumomab pasudotox因销售不佳退市。Mylotarg因不良反应移除主要市场,剂量分割后在2017年重新获批。
ADC的关键组分具有极大多样性。CD33是首个靶点,HER2是最常见靶点(表1)。主要IgG亚型是IgG1,但有2款是IgG4。IgG1抗体具有更长的血浆半衰期,更高的Fcγ受体(FcγR)结合效率,更强的ADCC和CDC效应,不易于组成多聚体。IgG4具有较弱的免疫活性效应,不需要抗体介导细胞毒作用时更为合适。2个ADC药物使用不可裂解连接子以降低脱靶毒性,大多数获批ADC(13/15)使用可裂解连接子以获得更好的旁观者杀伤效应。60%的ADC使用微管结合载荷,20%使用针对DNA载荷。使用拓扑异构酶(Top)Ⅰ抑制剂的载荷具有更高药物抗体比(DAR),更为高效。
表1 截止2023年3月获批的ADC药物
ADC研发现状
除了15款获批ADC外,目前世界范围内有189个ADC正在积极进行临床评估。在2016年前每年仅0~3款ADC进入临床试验,之后ADC开发井喷(图1A)。中国首个ADC于2014年进入临床试验,之后开始剧烈增长。
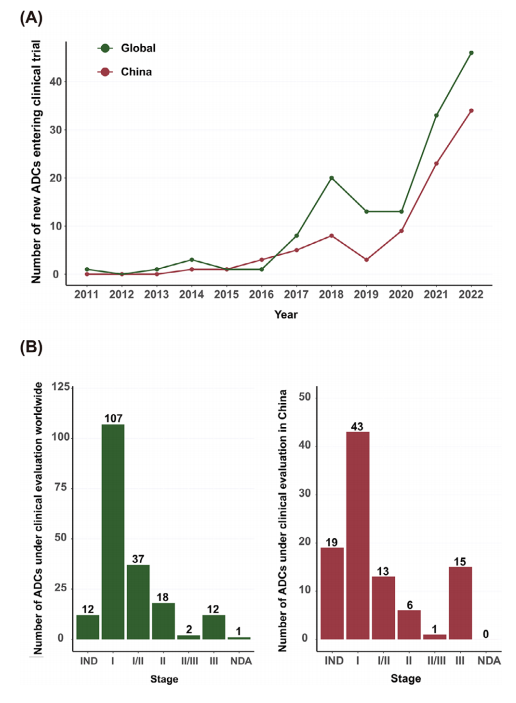
图1 ADC开发概况(A)2011~2022进入临床试验的新型ADC;(B)不同阶段临床评估的ADC数量(左:世界;右:中国)
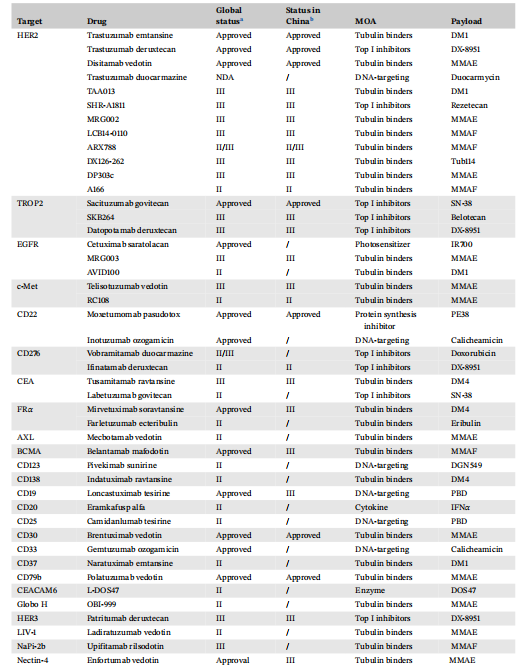
大多数新型ADC处于早期阶段,33款新型ADC进入中后期临床研究(图1B,表2)。HER2-ADC,TROP2-ADC和EGFR-ADC是最常见类型。中国除了HER2-ADC disitamab vedotin外,TROP2-ADC SKB264和EGFR-ADC MRG003都进入Ⅲ期临床研究。Claudin 18.2也是有潜力靶点(图2A)。首个Claudin 18.2-ADC CMG901在胃癌患者中显示出良好疗效。前10种靶点ADC药物占所有ADC药物的48%(图2B),中国则为63%。
表2 中后期临床研究阶段ADC靶点

微管结合物是新型ADC最常用载荷,分别占世界和中国ADC的45%和49%(图2C)。Top Ⅰ抑制剂较DNA药物更多(图2C)。
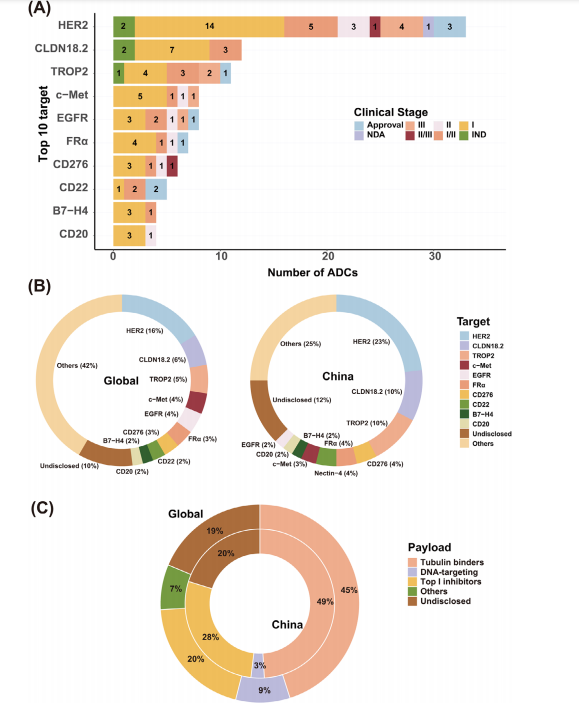
图2 目前临床评估的ADC管线靶点和作用机制多样性(A)前10个靶点;(B)ADC靶点多样性;(C)ADC载荷多样性
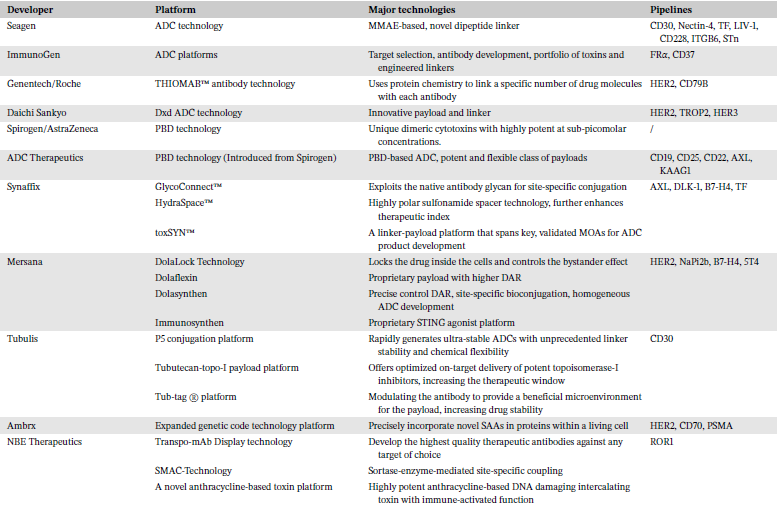
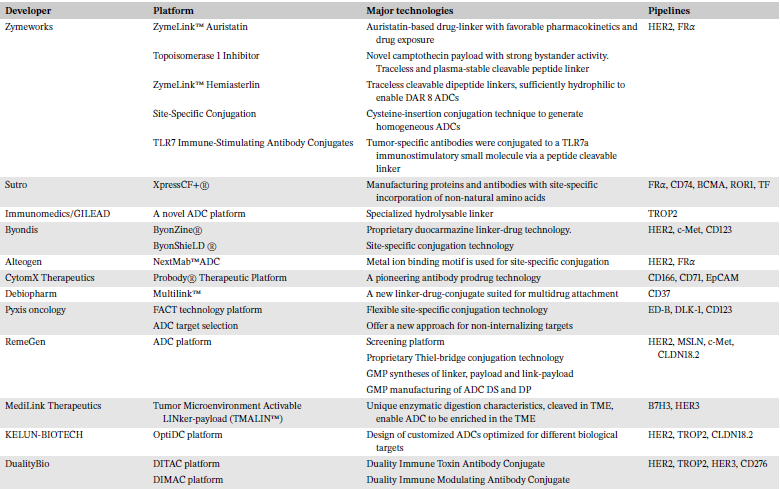
根据靶点、抗体、连接子、偶联方法和载荷的多样性,以及不同组分的结合方式,建立了不同的ADC平台以快速探索和验证新型ADC(表3)。这些平台具有不同特性,基于各自核心技术开发不同的ADC产品。
表3 ADC开发和技术平台
ADC的未来发展
目前基于药物结构和最佳临床应用模式进行了诸多探索(图3)。
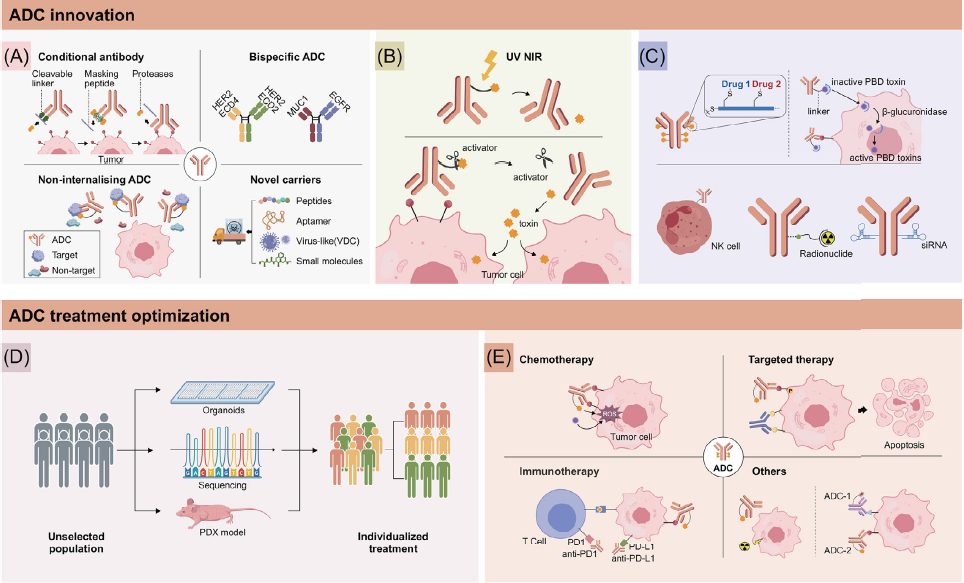
图3 ADC结构创新和治疗优化策略
选择靶抗原
目前获批ADC药物的靶抗原都是肿瘤细胞过表达的特异性蛋白。近来,新型ADC靶点研发也在更新。一个可行方法是使用肿瘤突变蛋白,因为和野生型蛋白相比,其具有更高的泛素化修饰水平,易于内吞和降解。靶向携带癌基因突变蛋白的ADC可最大化治疗特异性。ADC靶点开发还逐渐从传统肿瘤抗原扩展至微环境和肿瘤干细胞抗原。生物信息学和计算机辅助药物筛选技术极大加速了抗原选择发展。研究者试图整合多组学测序数据预测和开发新型ADC抗原。
抗体设计/新型递送工具
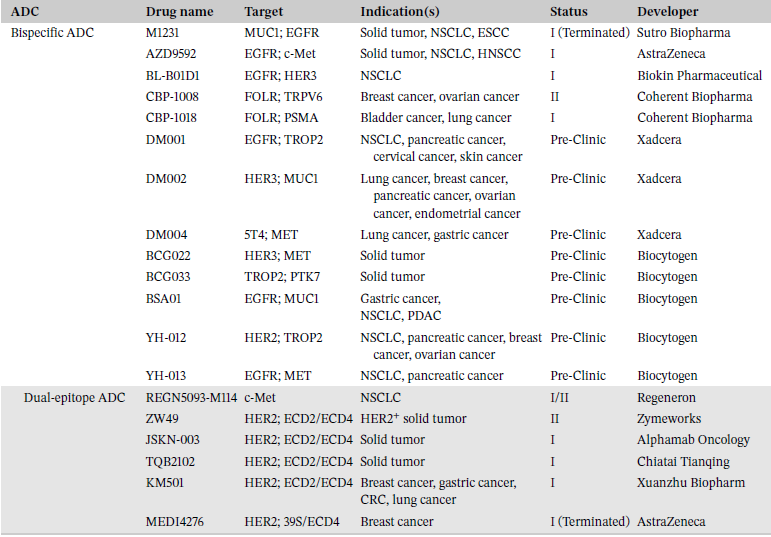
目前多个技术平台致力于优化ADC抗体。未来方向包括选择抗体血清型,增加抗体人源化,调整和优化抗体结构等。部分设计思路包括条件性抗体ADC,双特异性ADC(表4),非内吞ADC,使用其他类型分子替代抗体,如移除单克隆抗体(mAb)递送结构,将载荷偶联至更低分子量多肽片段或另一种分子递送工具上。多种新药如肽偶联药物(PDCs),小分子偶联药物(SMDCs),适配体偶联药物(ApDCs)和纳米颗粒偶联药物(NDCs)都在开发中。
表4 双特异性ADC管线
连接子
连接子保证ADC递送控制。光反应性可裂解连接子已经出现,使用近红外(NIR)光锁定策略。在NIR光照射后,ADC在照射肿瘤区域位点特异性有效释放载荷。新型紫外(UV)光控ADC也有报道。研究者也在开发新型智能ADC,使用“点击释放”策略,在未来研究中极具价值。
偶联方法进展
大多数ADC偶联于典型氨基酸残基,缺乏特异性,并导致DAR和药物分布异质性。位点特异性偶联技术包括抗体的工程化半胱氨酸结合,非自然氨基酸结合,糖基化结合和C端结合,使得抗体和小分子固定于位点并定量结合,具有更高的同源性、更好的稳定性和活性。Dantari的T-HDC技术使用多聚体分子将载荷“包裹”,载荷释放系统可携带更多载荷。
优化载荷
载荷的发展趋势逐渐由细胞毒药物向其他非细胞毒机制药物发展,包括Top2抑制剂,RNA多聚酶抑制剂,Bcl-xL抑制剂和免疫刺激剂。另一个创新设计是前药-ADC,只能在进入肿瘤细胞后活化和释放。一个潜在策略是双载荷ADC,可以携带2个协同载荷达到更佳疗效。
更多样的载荷正在研究,如抗体-自然杀伤(NK)细胞偶联药物,放射性核素偶联药物,抗体-小干扰RNA(siRNA)偶联药物,以及偶联激素,抗生素等。
临床前研究优化药物递送方案
除了开发新型药物,如何改善现有药物疗效也值得探索。一个策略是使用分割/分期剂量方案,维持抗肿瘤剂量强度并降低峰浓度,有助于降低最大毒性,延长药物作用时间。一种核素偶联药物使得疾病“可视可治疗”。此外,可使用患者来源移植物模型或类器官进行药物敏感性分析指导治疗。联合临床前研究和临床实践可达到更佳的药物使用。
使用预测标志物筛选合适人群
ADC主要依赖于抗体定位于治疗靶点,因此选择合适人群时,应首先考虑靶点表达。另一个考虑因素是载荷,载荷机制导致不同的ADC敏感性。ADC预测标志物是未来值得探索的方向。例如可根据ADC机制或药物代谢效应研究广谱标志物,也可以整合多组学测序数据分析,构建人群特异性ADC药物反应预测特征,或在靶人群中将治疗反应分层。此外循环肿瘤DNA(ctDNA)和液体活检进展也有助于寻找更广泛靶点。生物标志物指导精准人群分层和治疗是未来方向。
探索合理联合方案
ADC联合化疗、靶向治疗、免疫治疗等的联合研究正在进行。首先,联合化疗来自于传统化疗“1+1”概念。其次,作为新兴靶向化疗,ADC疗效很大依赖于靶向程度。因此增加ADC靶点抗原的联合方法可增强ADC治疗效应。此外,ADC联合放射性核素和化疗药物可能起到放疗和化疗的作用。
目前针对HER2的ADC药物联合正在进行,但是恩美曲妥珠单抗联合帕妥珠单抗的疗效不令人满意。而HER2-ADC联合酪氨酸激酶抑制剂(TKI)可达到EGFR通路的持续抑制和良好治疗指数,可能是由于TKI具有改变细胞表面HER2分子丰度的能力。也有研究报道抗血管生成药物和ADC的联合。
ADC联合免疫治疗的研究也在进行,如Enfortumab vedotin联合帕博利珠单抗治疗尿路上皮癌显示出良好疗效。ADC和免疫治疗联合使用时需要考虑ADC和免疫药物对于患者免疫系统的综合作用。基于ADCs和免疫治疗药物的多样性和联合治疗的可能机制,ADC联合免疫治疗具有广大研究空间。
目前有一些新的联合角度值得探索。双载荷ADC的设计开发具有联合效应,可直接定位于靶点,有助于降低非靶毒性。ADC联合放疗的初步数据显示有效。ADC新辅助治疗和2种ADC的联合也是未来探索方向。
小结
作为创新疗法,ADC具有显著潜力和临床价值,但也存在挑战、困难和严峻竞争。目前正在探索新抗体形式,新递送系统,非内吞抗原靶点,新型细胞毒载荷和位点特异性偶联方法。但是,还有很多问题需要解决:对于作用机制更好的理解,发现治疗反应的有效生物标志物,增强药物穿透力,改善疗效的同时降低毒性,探索给药最佳模式,克服耐药等。ADC药物显示多种可能性,我们已经进入“万物皆可偶联”时代。ADC将变革抗肿瘤治疗的格局。
Ruan DY, et al. Development of antibody-drug conjugates in cancer: Overview and prospects. Cancer Commun (Lond). 2024;44(1):3-22.
排版编辑:肿瘤资讯-胡一帆











 苏公网安备32059002004080号
苏公网安备32059002004080号


