前列腺导管内癌(Intraductal carcinoma of the prostate,IDC-P)是前列腺癌的一种独特且具有高侵袭性的病理亚型,通常与不良的病理特征相关,例如晚期、高级别和相对较大的肿瘤体积[1]。在一项纳入38个前列腺癌队列的系统评价中,IDC-P的患病率从低危患者的2.1%分别增加到中危患者、高危患者和转移性疾病患者的23.1%、36.7%和56.0%[2],提示IDC-P的存在与肿瘤的进展显著相关,IDC-P的检出与不同疾病阶段的前列腺癌患者的不良临床结局均密切相关。
IDC-P对去势治疗和以多西他赛为基础的化疗反应均较差[3],不仅如此,外照射放疗对IDC-P效果也不佳[4]。因此,目前尚无针对IDC-P的有效疗法。在基因分子层面对IDC-P认识的匮乏是造成这种困境的重要原因之一。
崭露头角
一、IDC-P基因组分析初探索
为了探索潜在的针对IDC-P的治疗策略且对IDC-P能够有更深一步的认识,四川大学华西医院泌尿外科曾浩教授团队着眼于基因层面,开展了多项针对携带IDC-P的前列腺癌患者基因突变的特性相关研究。
其中一项研究于2022年发表在《BJU International》,该研究通过对161例IDC-P携带者和84例非IDC-P携带者的前列腺癌患者进行了血浆cfDNA测序。旨在比较这两组患者的基因组变化,以及了解基因突变与患者生存结果之间的关系[5]。
结果显示,在IDC-P携带者和非IDC-P携带者中分别有29.8%(48/161) 和21.4%(18/84)存在DNA修复通路(DNA damage repair,DDR)相关基因突变(P=0.210)。IDC-P携带者与非IDC-P携带者,检测到致病性胚系DNA修复途径相关基因突变的频率分别为(11.8% [19/161] vs 2.4% [2/84],P=0.024)。在IDC-P携带者和非IDC-P携带者中特异性鉴定出胚系BRCA2突变和体系CDK12突变频率分别为 (BRCA2:8.7% [14/161] vs 0%,CDK12:6.8% [11/161] vs 1.2%[1/84])。与非IDC-P携带者相比,IDC-P携带者具有明显的雄激素受体(AR)通路相关基因突变,其显著特征表现为NCOR2突变的频率增加(21.1% [34/161] vs 6.0% [5/84],P=0.004)。对于IDC-P携带者,TP53突变与更短的无去势抵抗生存期相关(10.9个月vs 28.9个月,P=0.026);对于IDC-P携带者,在接受阿比特龙治疗的患者中,BRCA2突变与PSA快速进展相关(9.1个月vs 11.9个月,P= 0.036)。这一结果提示,需要建议携带IDC-P成分的晚期前列腺癌患者进行基因检测。
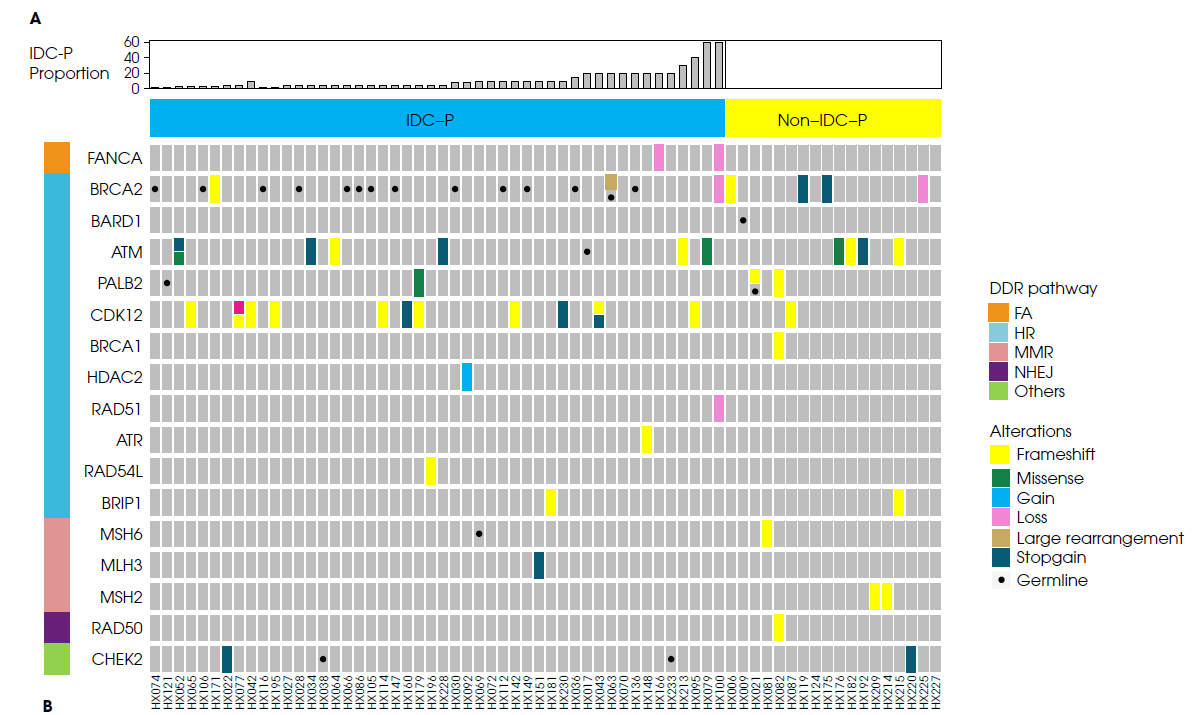
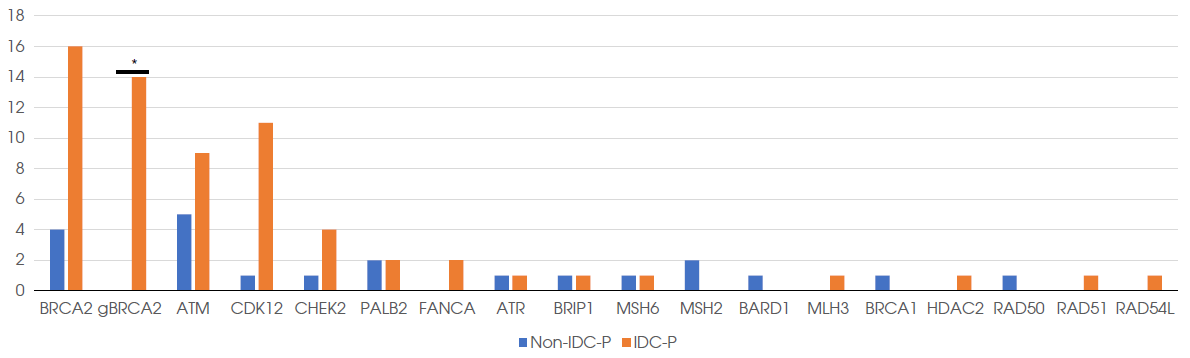
图1:携带和不携带IDC-P的PCa患者的DNA修复通路基因突变
IDC-P患者具有较高的基因组不稳定性。同源重组缺陷(HRD)是不稳定基因组的重要组成部分。近年来,大量研究证实HRD作为PARP抑制剂(PARPi)重要的疗效预测标志物,在患者管理中发挥越来越重要的作用。HRD score检测绕开了复杂的寻因过程,直接显示HRR功能丧失的后果,与通路的哪个部分出错无关。因此,与HRR相关基因突变相比,HRD score可能是识别PARPi敏感患者更可靠的生物标志物。然而,HRD score 在前列腺癌中的分布尚未被详细报道。
四川大学华西医院泌尿外科曾浩教授团队着眼于该临床问题,使用二代测序(NGS)测定HRD score与IDC-P的相关性,以及HRD score在高危局限性(M0)和新发转移性(M1)前列腺癌患者中的预后价值,并于2022年发表在《BMC medicine》 [6]。
本研究纳入123例前列腺癌患者,其中45例为M0,78例为M1期患者。HRD score综合LOH、LST、TAI三个指标进行基因组不稳定性评分。77例(62.6%)患者呈现IDC-P亚型,46例患者(37.4%)为非IDC-P 亚型(non-IDC-P)。IDC-P与non-IDC-P两组患者的基线特征平衡良好。
基因变异图谱分析显示两组患者在DDR通路(P=0.130)、HRR通路(P=0.285)和BRCA突变率(P=1.000)无显著差异。HRD计算显示IDC-P组的HRD score显著高于non-IDC-P组(P=0.002) 。相比于non-IDC-P组,IDC-P组HRD-LOH score显著更高(P=0.001),HRD-LST score显著更高(P=0.009),HRD-TAI score临近显著性高(P=0.076)。
BRCA突变和HRR通路基因突变与较高的HRD score密切相关(BRCA-m vs.BRCA-wt,P=0.019;HRR-m vs. HRR-wt,P=0.045)。从HRR通路中剔除BRCA突变后,其他HRR通路基因突变与HRD score无相关性,提示BRCA突变是HRR通路中HRD score的主要贡献者。
如图二,在整个队列中,高HRD score(≥21)与较短的无去势抵抗生存期(CFS: 22.6 vs. 32.8个月,P=0.004)和总生存期(OS:63.4 月 vs. 未达到,P=0.005)相关。M1组中也观察到了高HRD score的不良预后意义(CFS:9.3 vs 23.7月,P=0.007;OS:33.3月vs. 未达到,P=0.005)。在M0组中,高HRD score和低HRD score患者中位生存时间在数值上存在较大差异(CFS: 28.5 vs. 35.6 months, 无转移生存: 42.7 vs. 68.4 months),可能由于样本量小,未达到统计学意义。
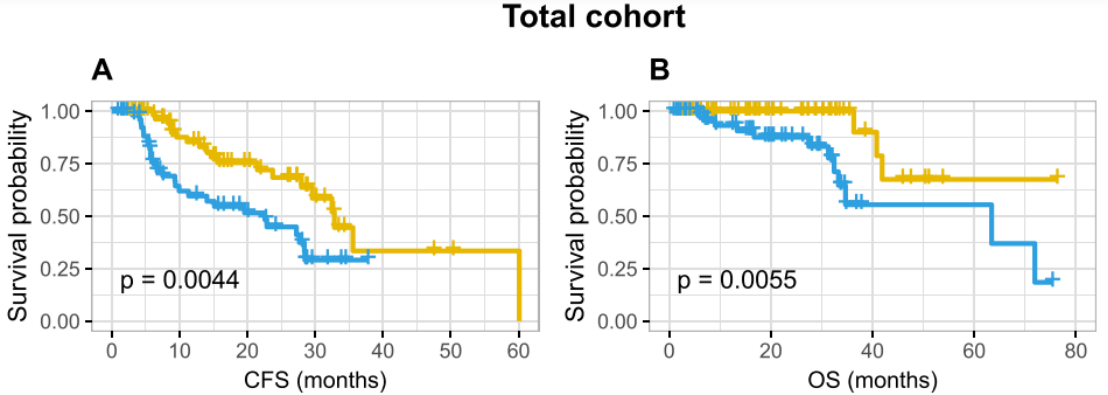
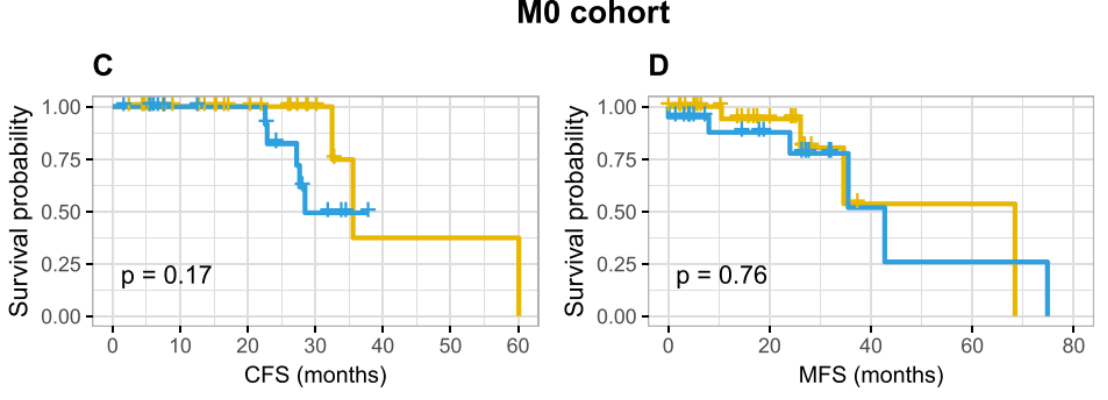
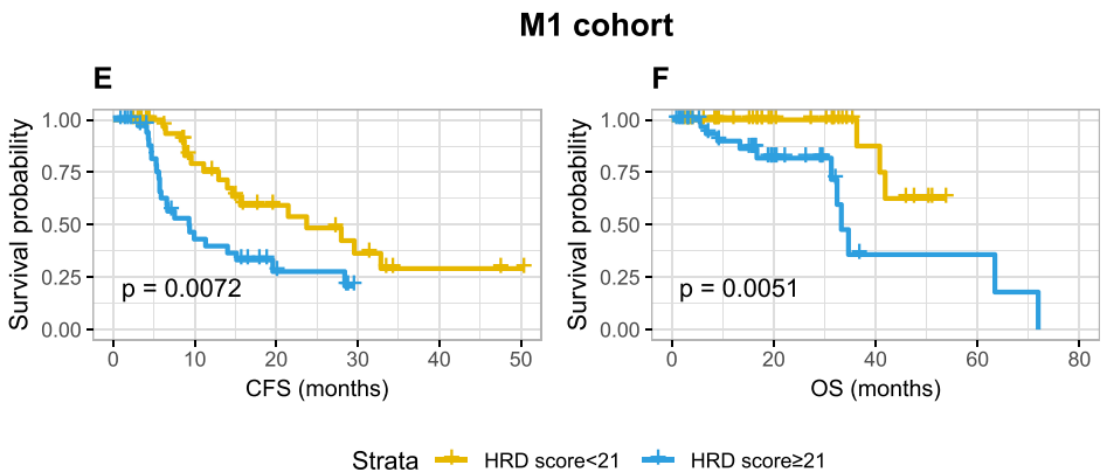
图2:HRD评分的预后价值
该研究结果提示M1、高Gleason评分和IDC-P病理与较高的HRD score相关。在侵袭性前列腺癌中,HRD score显示出良好的预后价值,因此建议高危前列腺癌患者进行HRD score测试。
拨云见日
二、IDC-P基因组分析再进一步
由于既往研究大多通过将含有IDC-P的肿瘤(实质为IDC-P与腺泡腺癌(PAC)的混合体)与PAC进行对比,而这种比较方式不够直接,一定程度上弱化了IDC-P与PAC的差异,因此四川大学华西医院泌尿外科团队通过手工刮取的方式将IDC-P、PAC及癌旁对照组织进行分离并开展了相关研究,该研究结果也于2024年1月发表在了《Cancer Research》 [8]。
该研究将22个高危前列腺癌根治手术标本中的IDC-P、PAC及癌旁对照组织进行分离,然后分别进行了全外显子,转录组及甲基化测序。
使用克隆进化分析来探索并发IDC-P和PAC之间的克隆关系,进化树结果显示,大多数并发的IDC-P和PAC(17/22, 77%)克隆接近,支持大部分IDC-P和PAC来自同一祖先。通过比较进化亲缘关系进一步揭示了不同的进化模式:在近3/4(12/17,71%)具有共同祖先的肿瘤中,IDC-P 和 PAC 表现出早期分化模式。两种肿瘤实体都具有短躯干,获得更多的各自独有驱动突变,然后独立进化(图3A); 在29%的肿瘤中(5/17),并发的IDC-P和PAC具有长躯干,表现出晚期分化模式(图3B); 在23%(5/22)的肿瘤中,并发的IDC-P和PAC部分由独立的前体启动,称为独立起源模式(图3C)。尽管两种肿瘤实体共享一个克隆,但IDC-P也来源于与PAC无关的独立克隆。这些数据为IDC-P与PAC之间存在的三种进化模式提供了依据:早期分化、晚期分化和独立起源。
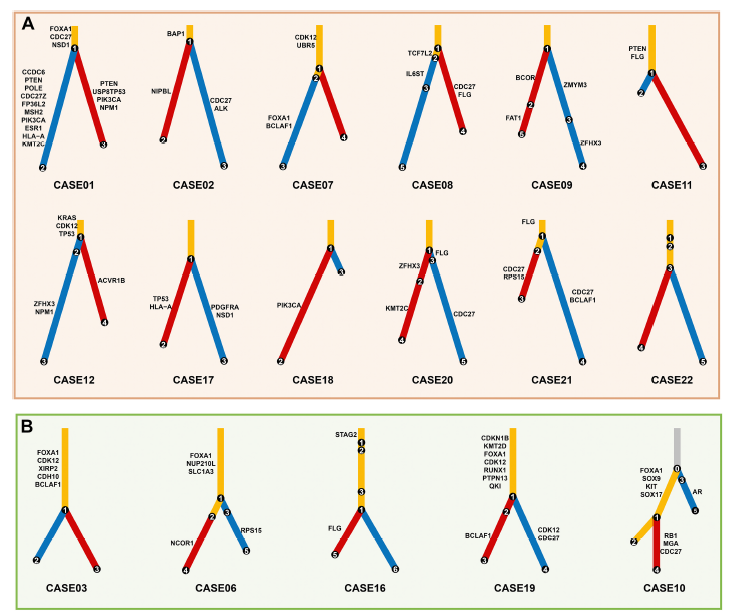
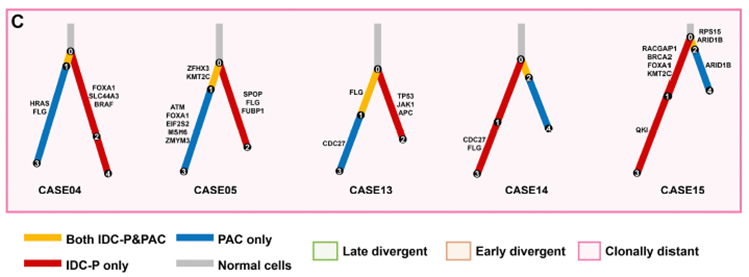
图3:IDC-P与PAC的克隆关系
*在每个进化树中,IDC-P和PAC共有的克隆集群用黄色标记,而IDC-P或PAC专有的克隆集群分别用红色或蓝色标记。6例多克隆模型患者,正常细胞以灰色标记。前列腺癌相关的驱动突变也在进化树上进行了标记
该研究随后评估了这些进化模式是否与基因组和临床病理特征相关。结果发现具有独立起源和早期分化的肿瘤,其IDC-P与PAC显示出更高的基因组和病理特征上的异质性。而具有晚期分化关系的肿瘤则在各种层面上显示出更多的相似性。
在IDC-P和PAC中,常见的驱动基因是FOXA1、CDK12、KMT2C、TP53、PIK3CA和ZFHX3(图4)。与PAC相比,IDC-P具有更多与不良预后相关的基因的过表达(图5)。
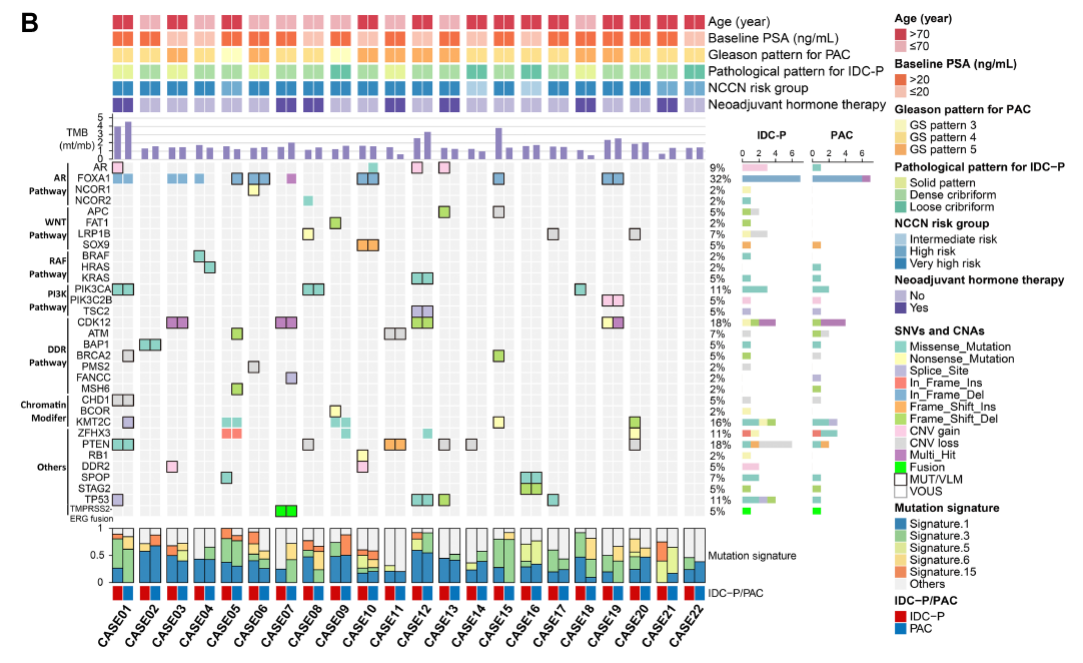
图4:IDC-P、PAC和同一RP标本的邻近正常组织的WES检测结果
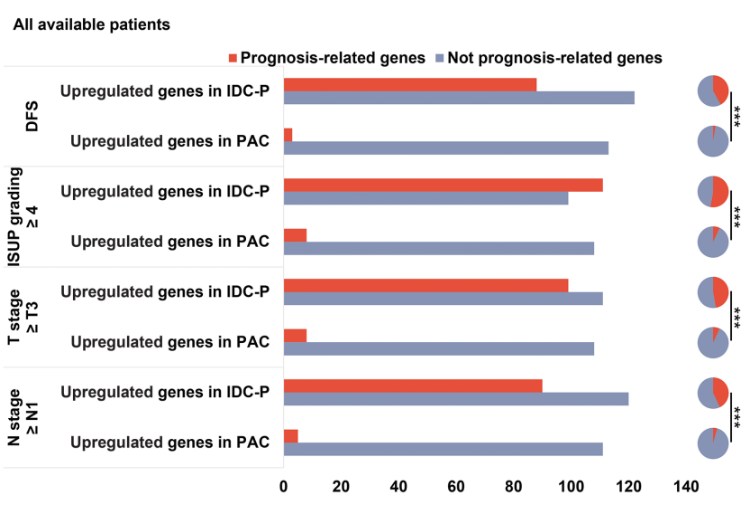
图5:IDC-P与PAC的预后评估结果
此外,该研究还发现IDC-P在转录层面上与ISUP 5级肿瘤具有更高的相似性。针对以上发现该研究也在独立人群中进行了验证,结果显示生存数据支持了上述结论:携带IDC-P的患者,尽管ISUP分级为1-4级腺癌,但其无去势抵抗生存期与ISUP分级为5级的患者一样差(HR=0.88, 95% Cl: 0.68-1.38,P=0.867)(图6)。
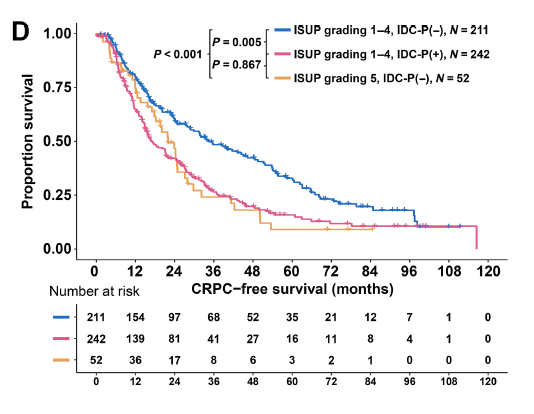
图6:Kaplan-Meier曲线显示了ISUP分级为1-4级无IDC-P、ISUP分级为1-4级有IDC-P和ISUP分级为5级无IDC-P患者的无去势抵抗生存期
在信号通路水平上,研究发现IDC-P展现出异常活化的细胞周期及雄激素受体通路:结果显示,无论进化模式或IDC-P和PAC的空间位置如何,细胞周期进展基因(E2F靶点和G2–M检查点)在PAC的IDC-P中都有富集(图7)。分子水平上可能归因于细胞周期相关的主调节因子及肿瘤内部雄激素生物合成相关基因的活化。
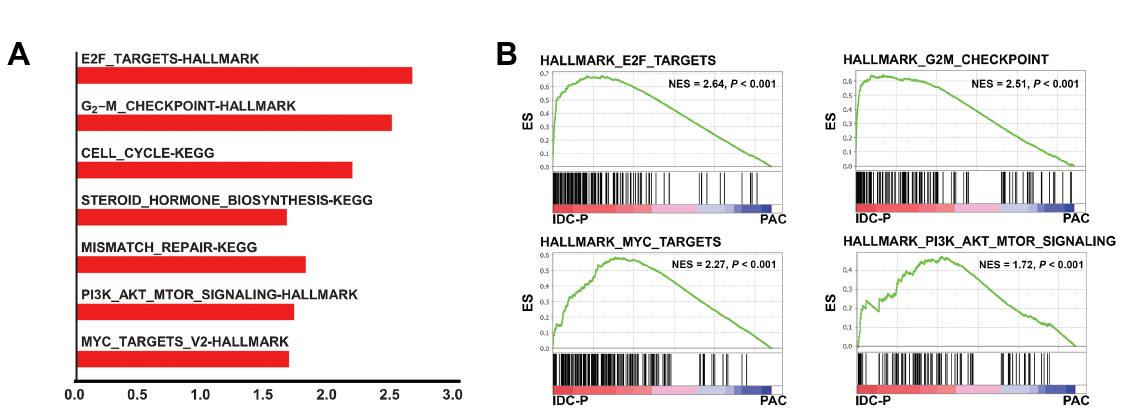
图7:基因富集分析结果
该研究发现为进一步探索IDC-P的恶性生物行为打下了坚实的分子学基础。研究结果向着解密IDC-P生物学特征的目标迈出了关键一步,对于IDC-P的更深了解将有助于针对该病理亚型的靶向药物研发。
总结
相较于非IDC-P携带者,IDC-P携带者检测到HRR突变的频率更高(29.8% vs 21.4%),IDC-P携带者中胚系BRCA2突变频率为8.7%,体系CDK12突变频率为6.8%。
在临床诊断的过程中,对于IDC-P患者进行HRR的突变检测是非常必要的,在治疗初期就需要针对该突变进行一些治疗改变或调整,如提前使用PARP抑制剂来延缓其CRPC的发生。
IDC-P与PAC之间存在三种进化关系:独立起源、早期分化和晚期分化。与PAC相比,IDC-P显示出具有更多与不良预后相关基因过表达、异常活化的细胞周期通路及雄激素受体通路等特征。
IDC-P相比PAC 具有更多与患者不良预后相关的基因的高表达,且在细胞周期信号通路以及AR信号通路上活化显著。这可能是导致携带IDC-P的晚期前列腺癌患者对内分泌治疗及化疗反应不佳的重要因素。从这些通路切入设计新的治疗策略是改善具有IDC-P成分的前列腺癌患者不良预后的新方向。
以上内容经四川大学华西医院泌尿外科曾浩教授及赵劲歌医师审核完成
• 四川大学华西医院泌尿外科书记、教授、博士生导师
• 中华医学会泌尿分会青年委员会委员兼秘书长、中华医学会泌尿分会肿瘤学组委员
• 中国医疗保健国际交流促进会泌尿健康促进分会委员兼副秘书长/青年委员会副主任委员
• CSCO前列腺癌/CSCO尿路上皮癌/CSCO肾癌专家委员会委员
博士毕业于四川大学华西临床医学院。
2019-2020年赴美国UC Davis大学博士联合培养一年。
目前以第一/共一作者身份在Journal of Urology, Cancer Research等国际知名SCI杂志发表科研论文20余篇。
现任四川省肿瘤学会(SCS)泌尿系统肿瘤专委会委员兼秘书、四川省抗癌协会泌尿男生殖系肿瘤专委会秘书。
排版编辑:Jessica
[1] VARMA M, DELAHUNT B, EGEVAD L, et al. Virchows Arch, 2019, 474 (5): 525-534.
[2] PORTER L H, LAWRENCE M G, ILIC D, et al. Eur Urol, 2017, 72 (4): 492-495.
[3] Chen, Z., Chen, N., Shen, P., et al.. Prostate, 75: 1247-1254.
[4] O’Brien C,True LD,Higano CS,et al.Am J Clin Pathol,2010,133:654.661.
[5]ZHAO J G, SUN G X, ZHU S, et al. BJU Int, 2022, 129(3): 345-355.
[6]Zhu S, Zhao J, Nie L, et al. BMC Med. 2022 Jul 22;20(1):237.
[7]Maha Hussain,et al. N Engl J Med. 2020 Dec 10;383(24):2345-2357.
[8]Zhao J, Xu N, Zhu S, et al.Cancer Res. 2024 Jan 2;84(1):154-167.
本材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批号:CN-129268 有效期至:2024-4-29











 苏公网安备32059002004080号
苏公网安备32059002004080号


