2023年12月13日,备受瞩目的《肿瘤学年鉴》(Annals of Oncology,影响因子:50.5)期刊在线发布了2023版ESMO早期乳腺癌临床实践指南——“Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up”。本期(下篇)【肿瘤资讯】整理了三阴性乳腺癌(TNBC)、特殊人群及长期随访的要点及推荐意见,供读者参阅。
点击查看指南:
2023版ESMO临床实践指南(上篇)——筛查、诊断及局部治疗的要点及推荐意见
2023版ESMO临床实践指南(中篇)——(新)辅助全身治疗的要点及推荐意见
早期TNBC的管理
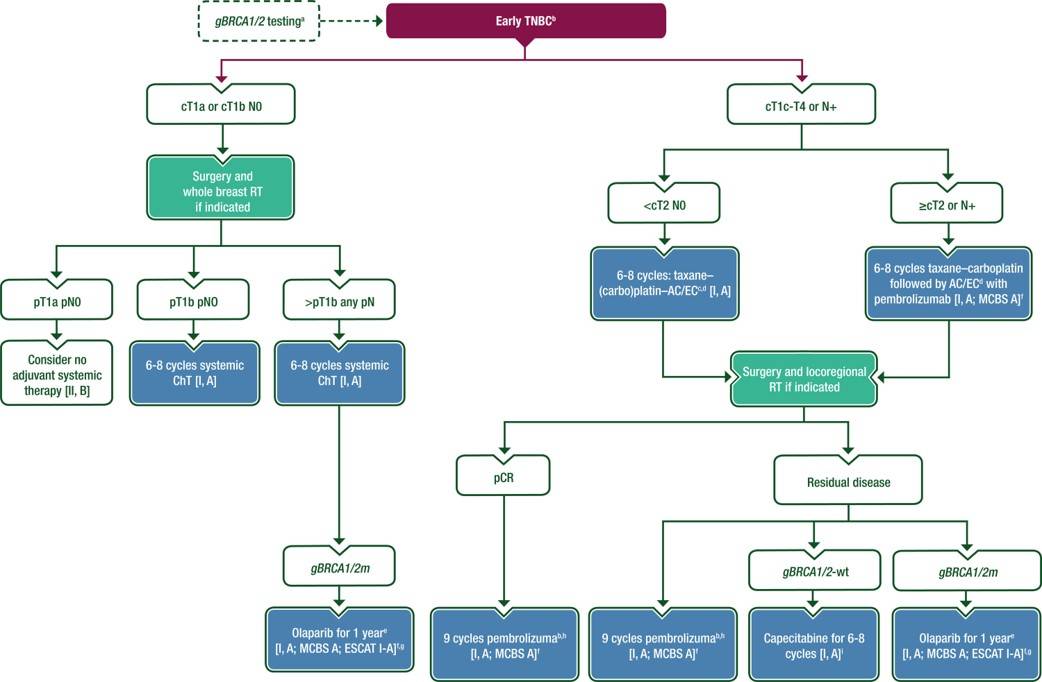
图7 早期TNBC的管理
新辅助化疗(ChT)是T1c/N0或更高级别TNBC的标准治疗。大多数pT1a pN0病变的患者不能从辅助 ChT 中获益,而辅助 ChT 在 pT1b pN0 中的疗效数据尚不清楚。具有特定组织学类型(例如腺样囊性、分泌性、髓样)的低级别TNBC患者似乎从辅助 ChT 中获益甚微,特别是在那些具有低风险临床特征的患者中,尽管由于样本量小和回顾性数据的原因,这些结果的可信度受限。
除在高风险患者的新辅助治疗背景中使用帕博利珠单抗外,新辅助治疗和辅助治疗之间 ChT 方案中的药物无差异。然而,新辅助治疗允许根据病理反应来指导后续的辅助治疗,这可以提高生存率,因此是首选策略。不含免疫检查点抑制剂 (ICIs) 的循证治疗方案为序贯治疗:先进行蒽环类药物为基础的治疗,然后是紫杉醇或紫杉醇-卡铂或相反顺序。卡铂的获益与gBRCA1/2m状态无关。标准的蒽环类药物为基础的方案是多柔比星-环磷酰胺(AC)或表柔比星-环磷酰胺(EC),在8周或12周内给药4个周期,然后在8周或12周内给予紫杉烷4个周期。首选剂量密集治疗,包括剂量密集型AC或EC和每周一次的紫杉醇。对于蒽环类药物禁忌的患者,可以使用6个周期的非蒽环类、以紫杉烷为基础的方案,如多西他赛-环磷酰胺或紫杉烷加卡铂作为替代方案。在紫杉烷基础上加用卡铂可改善病理完全缓解(pCR)率和无事件生存期 (EFS),但其对 OS 的影响尚不确定。无论是否使用铂类药物,gBRCA1/2m患者对标准蒽环类-紫杉烷为基础的 ChT 反应非常好。PARP抑制剂单药可以诱导高(>40%)的pCR率,但并不被视为新辅助治疗的标准治疗,可能最适用于初步全身治疗(PST)后仍有残留病灶患者的辅助治疗。无论gBRCA1/2m状态如何,pCR仍然是一个预后因素。
在Ⅱ-Ⅲ期 TNBC 患者中,紫杉烷-卡铂序贯 AC 或 EC 的四药 ChT 方案,联合帕博利珠单抗改善了3年pCR 率和EFS(HR=0.63,95%CI :0.48-0.82,P < 0.001)。术后继续给予帕博利珠单抗治疗,9个周期,每个周期3周。帕博利珠单抗的获益与 PD-L1 状态无关。在一项使用nab-紫杉醇-蒽环类基础药物的Ⅲ期试验中,无论 PD-L1 状态如何,新辅助阿替珠单抗也改善了 pCR 率。一项采用 nab-紫杉醇和 EC 作为 ChT 基础联合或不联合度伐利尤单抗(仅在新辅助治疗背景下给药)的随机Ⅱ期研究结果显示 pCR 率未显著改善,但显著改善了EFS 和OS。
新辅助治疗后的残留病灶
在 CREATE-X 试验中,卡培他滨辅助治疗改善了无病生存期 (DFS)(HR=0.70,95%CI: 0.53-0.92,P = 0.01)和OS(HR=0.59,95%CI: 0.39-0.90,P = 0.01);该获益仅在 TNBC 肿瘤患者中显著。最近的两项综述发现,卡培他滨辅助治疗可改善 TNBC 患者的OS,相对降低12%-30%,但对于HR阳性疾病的患者影响的证据很少。低剂量卡培他滨也可改善标准不含铂辅助 ChT 后的结局。
目前尚不清楚新辅助治疗后卡培他滨是否会增加新辅助治疗后继续接受 ICI 或奥拉帕利治疗的患者的获益[适用于 gBRCA1/2m 肿瘤和非 pCR 或≥pT2或≥pN1患者(如果接受初始手术治疗)的辅助治疗]。这些联合治疗在辅助疗法中的疗效结果尚无可用数据。对于奥拉帕利-卡培他滨组合安全性的了解也不足以支持该联合用药。
ER 和/或PR 表达为1%-9%(ER-/PR-low) 的 HER2 阴性肿瘤是一个异质性群体,其中一些在生物学行为上与TNBC相似;应根据这种具体情况调整治疗策略,因为与经典的 HR 阳性乳腺癌相比,这可能导致对 ChT 的反应更高和 ET 的疗效降低 [Ⅱ,B]。
TNBC 肿瘤应使用 ChT 联合或不联合ICI(帕博利珠单抗)治疗 [Ⅰ,A],除了一些淋巴结阴性的特殊组织学亚型,如分泌性或腺样囊性或临床风险极低 (pT1a pN0) 的肿瘤 [Ⅱ,B]。
ChT 应给药12-24周(4-8个周期),取决于疾病分期、选定方案的类型以及是否添加ICI[Ⅰ,A]。
考虑到剂量密集型ChT方案[使用粒细胞集落刺激因子(G-CSF)支持]相比非剂量密集型方案有明确的优势,应考虑使用这种方案 [Ⅰ,A]。
对于 cT1c-4 N0 或任何LN阳性TNBC,首选新辅助治疗 [Ⅰ,A]。
cT2-4 N0 或任何LN阳性(Ⅱ-Ⅲ期)TNBC应接受新辅助ChT联合帕博利珠单抗治疗,除非存在过高的ICI 相关免疫毒性的风险因素 [Ⅰ,A;ESMO-MCBS v1.1评分:A]。
在新辅助治疗阶段,应每3周给予一次帕博利珠单抗[Ⅰ,A],并在辅助治疗期持续9个3周周期,无论pCR状态如何 [Ⅰ,A;ESMO-MCBS v1.1评分:A]。
在整个治疗过程中,应密切监测接受帕博利珠单抗治疗的患者发生免疫相关不良事件的风险,并遵循ESMO CPG对免疫疗法的毒性进行管理[Ⅴ,A]。
在既往未接受新辅助 ICI 治疗的情况下,ICI不应单独作为辅助治疗 [Ⅴ,D]。
在 gBRCA1/2m 和高危TNBC(非 pCR 或病理分期Ⅱ-Ⅲ期)患者中,应给予1年的奥拉帕利辅助治疗 [Ⅰ,A;ESMO-MCBS v1.1评分:A;ESCAT:Ⅰ,A]。
可根据个体情况考虑 ICI联合奥拉帕利治疗 [Ⅴ,C]。
未接受 ICI 的残留病变患者应接受卡培他滨辅助治疗6-8个周期 [Ⅰ,A]。
不应在 gBRCAm 患者中使用奥拉帕利和卡培他滨联合治疗 [Ⅰ,E]。
可根据个体情况考虑ICI 和卡培他滨联合治疗 [Ⅴ,C]。
特殊人群
请参考《肿瘤学年鉴》在线提供的补充材料第8节,以获取关于老年患者、男性乳腺癌和其他特殊人群的更多详细信息。
DCIS的辅助治疗
手术
导管原位癌(DCIS)的乳腺手术应遵循本文档中局部治疗-手术章节中讨论的浸润性癌建议。对于原位疾病,首选边缘≥2 mm。
在 DCIS 中,通常不需要进行前哨淋巴结活检(SLNB)以评估腋窝淋巴结(ALN)。为了排除微浸润癌,如果进行了乳房切除术或对于较大 (> 5 cm) 或高风险DCIS,应考虑SLNB。单纯DCIS患者SLN阳性的可能性较低(约5%)。
RT
对于DCIS进行保乳手术(BCS)后的全乳放疗(WBRT)将局部复发的风险减半,而不影响生存率。DCIS 边缘清晰的全乳切除术是治愈性的。年轻、边缘不充分和疾病体积较大与BCS后局部复发风险较高相关,无论是否进行RT。而年轻、高级别和微浸润癌与乳房切除术后局部复发风险较高相关。在低风险 DCIS 患者中(肿瘤大小 < 10 mm,低或中等核分级,足够的手术切缘),省略 RT 可能是一种选择。可以使用大分割方案代替更长的治疗方案;在中高风险患者中,在原发性肿瘤床增加推量剂量可降低复发率。APBI 是低风险 DCIS WBRT 的替代方法,如本指南“BCS后WBRT”小节所定义的。
全身治疗
在接受 BCT 治疗 HR 阳性 DCIS 的患者中,他莫昔芬和芳香化酶抑制剂(AI)(仅绝经后患者)均可降低浸润性和非浸润性复发的风险,并减少了第二原发(对侧)乳腺癌的发生率,尽管对 OS 无影响。在 TAM-01 试验中,低剂量他莫昔芬(每日5 mg)也可降低 DCIS 后的复发风险。
老年患者的治疗应根据生物学年龄(而非实际年龄)进行调整,在虚弱患者中应考虑使用较为温和的治疗方案。对于适合标准ChT的患者,应使用标准的多药方案 [Ⅱ,B]。
在做出治疗决策前,应进行老年评估 [Ⅱ,A]。
他莫昔芬是男性乳腺癌患者的标准辅助内分泌治疗(ET)药物[Ⅳ,A]。
与患有乳腺癌的绝经前女性类似,对于高风险的男性乳腺癌患者,可以考虑添加促性腺激素释放激素激动剂(GnRHa),并且在他莫昔芬禁忌的情况下,应考虑联合使用AI-GnRHa[Ⅳ,B]。
当用作男性乳腺癌患者的辅助 ET 时,AI必须与 GnRHa 联合给药 [Ⅳ,A]。
在男性乳腺癌患者中,ChT、ET、抗HER2、ICI、CDK4/6抑制剂和 PARP 抑制剂治疗适应症和方案应遵循与女性乳腺癌患者相同的建议 [Ⅳ,A]。
DCIS 应优先采用 BCS 和 WBRT 治疗,或者在广泛或多中心 DCIS 的情况下,进行乳房切除术 [Ⅰ,A]。
在 DCIS 局部保乳治疗(BCT)后,可以使用他莫昔芬和 AI ,以预防局部复发并降低发生第二原发性乳腺癌的风险 [Ⅰ,B]。
对于DCIS的乳房切除术后,可以考虑使用他莫昔芬或AI来降低高风险患者对侧乳腺癌的风险 [Ⅱ,B]。
随访、长期影响和生存
随访注意事项
随访的目的包括:
• 检测可能治愈的局部和/或区域复发或对侧乳腺癌
• 评估和治疗治疗相关不良反应和并发症
• 促进辅助全身治疗的依从性
• 提供支持,使乳腺癌患者恢复正常生活
• 检测第二原发癌
尽管最近涉及现代影像学的随机试验没有数据支持任何特定的随访顺序或方案,但是监测应平衡患者需求、随访成本和医疗保健系统的负担。随访策略应考虑由肿瘤生物学决定的不同复发模式。
建议在治疗后前3年内每3个月进行一次定期随访[低风险早期乳腺癌(EBC)每6个月一次],从第4-5年每6个月一次,此后每年一次。访视间隔可根据复发风险和患者需求进行调整 [Ⅴ,A]。
建议每年进行双侧(BCT后)或对侧乳腺 X 射线摄影检查(乳房切除术后),必要时进行超声(US)和乳腺MRI[Ⅱ,A]。
乳腺癌幸存者应参加国家其他癌症筛查项目 [Ⅴ,B]。
对于无症状患者,不建议进行实验室检查(例如血细胞计数、常规生化、肿瘤标志物评估)或其他影像学检查 [Ⅰ,D] 。
应根据指征考虑症状导向的检查 [Ⅴ,B]。
对于接受 AI 或接受卵巢功能抑制(OFS)的患者,建议定期进行骨密度评估 [Ⅰ,A]。
对于无症状、心脏功能正常的患者,如果接受了可能具有心脏毒性的治疗,应根据临床需要进行心脏随访[Ⅲ,B]。
对于接受他莫昔芬治疗的患者,建议每年进行一次妇科检查 [Ⅴ,B];然而,不建议常规进行经阴道US[Ⅴ,D]。
生殖和性健康考虑因素
初次就诊治疗后存活者的数量逐渐增加。因此,必须认识到并随访与不同治疗方式相关的长期结局(补充表S6,可在《肿瘤学年鉴》在线获取)。
早期绝经和不孕是EBC治疗可能产生的极其重要的后果,尤其影响绝经前女性,并对生活质量产生显著影响。ET 的副作用和性功能障碍影响所有年龄段的女性,应予以解决以提高生活质量并确保治疗依从性。尽管少数患者出现暂时性闭经,但一部分患者将出现治疗相关的永久性卵巢功能障碍,且风险随年龄增长而增加。即使是卵巢功能恢复的患者,过早绝经和不孕也代表了重大问题。在治疗前解决这些可能性,并让生殖医学专家考虑生殖力保存策略,对于所有考虑未来怀孕的绝经前女性是必要的。现有资料表明,乳腺癌治疗后妊娠是安全的。
在开始辅助治疗前,应酌情与每位患者讨论并解决过早绝经、不孕和潜在的性功能障碍 [Ⅴ,A]。
应告知考虑妊娠的绝经前女性,现有证据表明,乳腺癌治疗后妊娠似乎是安全的 [Ⅲ,A]。
对于希望妊娠的女性,在 ET 18-30 个月后暂时中断辅助ET,允许3个月的洗脱期,并尝试在2年内怀孕,然后恢复ET,似乎不会影响低风险HR阳性、HER2阴性EBC患者的短期乳腺癌结局[Ⅲ,A]。
心理社会考量因素
长期生存问题需要特别关注,并涉及在乳腺癌诊断后生活中的所有影响。应鼓励患者采取健康的生活方式,定期锻炼,避免超重。疾病及其治疗的心理和其他实际后果是长期护理中极为重要的部分。患者应接受随访和管理,以解决焦虑、抑郁、对未来的不确定性、睡眠障碍、性相关障碍、慢性疲劳、神经认知功能障碍以及对他们工作能力和照顾家庭的直接影响或间接影响。在处理长期护理和随访时,应考虑影响随访策略实施的文化和环境等更广泛的维度。长期生存考量应包括治疗结束后患者所有心理社会需求。
最终,这些问题对个体患者的生活质量有重大影响,值得组织具有充足人力资源和紧密多学科随访的诊断、教育和管理的基础设施。
应鼓励患者采取健康的生活方式,定期锻炼,避免超重,并尽量减少酒精摄入[Ⅱ, A]。
应解决长期生存问题,包括心理需求以及与工作、家庭和性相关的问题[Ⅴ, A]。
Loibl S, André F, Bachelot T, Barrios CH, Bergh J, Burstein HJ, Cardoso LMJ, Carey LA, Dawood S, Del Mastro L, Denkert C, Fallenberg EM, Francis PA, Gamal-Eldin H, Gelmon K, Geyer CE, Gnant M, Guarneri V, Gupta S, Kim SB, Krug D, Martin M, Meattini I, Morrow M, Janni W, Paluch-Shimon S, Partridge A, Poortmans P, Pusztai L, Regan MM, Sparano J, Spanic T, Swain S, Tjulandin S, Toi M, Trapani D, Tutt A, Xu B, Curigliano G, Harbeck N; ESMO Guidelines Committee. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up†. Ann Oncol. 2023 Dec 8:S0923-7534(23)05104-9. doi: 10.1016/j.annonc.2023.11.016.
排版编辑:肿瘤资讯-Paine











 苏公网安备32059002004080号
苏公网安备32059002004080号


