2023年欧洲肿瘤内科学会亚洲年会(ESMO Asia)于12月1日~3日在新加坡盛大召开,多项全球及亚太地区的最新科研和研究进展重磅公布。来自湖南省肿瘤医院的一项西妥昔单抗维持治疗真实世界研究以壁报形式进行了现场展示,引发关注和讨论。本期【爱肠学院】特别邀请到主要研究者湖南省肿瘤医院杨晓琳教授,解读研究结果及临床价值。
专家介绍
湖南省肿瘤医院 消化泌尿内一科 副主任医师
湖南省抗癌协会肿瘤靶向治疗专业委员会第三届委员会 常委
湖南省抗癌协会肿瘤代谢专业委员会第一届委员会 委员
湖南省抗癌协会老年肿瘤专业委员会第二届委员会 委员
研究简介
化疗联合西妥昔单抗已被推荐作为RAS野生型转移性结直肠癌(mCRC)的标准一线治疗方案。一线诱导治疗后的维持治疗最佳模式尚不明确,本研究旨在探讨化疗联合西妥昔单抗一线诱导治疗达到疾病缓解或稳定后维持治疗的临床结局。
该项真实世界研究回顾性分析湖南省肿瘤医院2018年1月至2022年6月期间,接受6个周期两药化疗联合西妥昔单抗一线诱导治疗后达到疾病缓解或稳定(CR/PR/SD)的左半RAS/BRAF野生型mCRC患者,进行西妥昔单抗±化疗(队列A)或单纯化疗(队列B)维持治疗。采用Kaplan-Meier方法描述总生存期(OS)和无进展生存期(PFS)。
研究共纳入125例患者,队列A 72例(57.6%),队列B 53例(42.4%)。中位年龄为58岁(范围:23~76岁),86例(68.8%)为男性,最常见的转移部位是肝脏(72.0%)。中位随访32.6个月期间,队列A中达到无疾病证据(NED)状态的患者占比12.5%(9/72),队列B是3.8%(2/53)。队列A的中位OS显著长于队列B(46.4个月vs 31.1个月, p<0.0001)(图1),中位PFS同样显著延长(14.2个月 vs 11.0个月,p=0.021)(图2)。校正年龄、性别、原发肿瘤部位、转移部位以及原发肿瘤和转移灶是否切除后的Cox比例风险模型显示:相较于队列B,队列A的OS显著延长(HR 0.43,95%CI 0.25~0.73);PFS有数值上延长的趋势,没有统计学上的显著差异(HR 0.70,95%CI 0.44~1.12)。
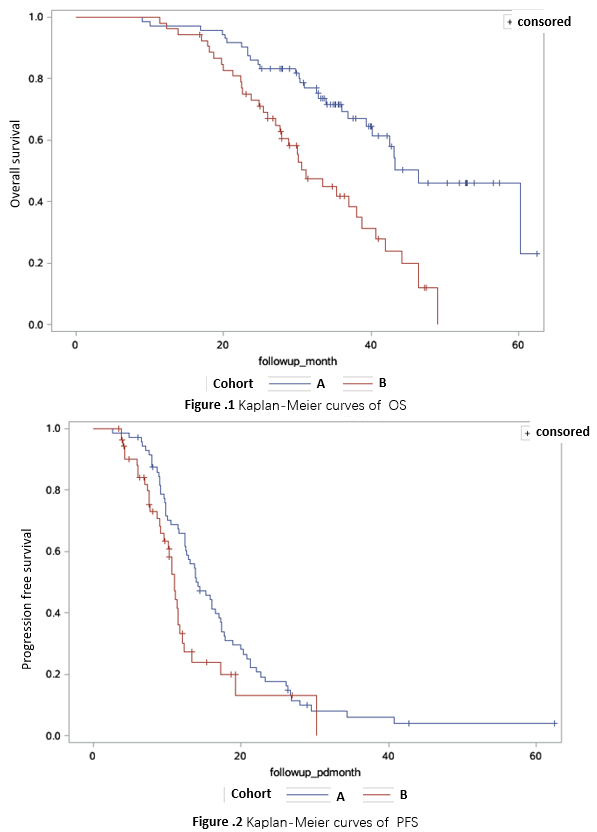
总体而言,含西妥昔单抗的维持治疗可显著改善左半RAS/BRAF野生型mCRC患者的OS,并获得有临床意义的PFS延长。
研究解读
这项在湖南省肿瘤医院开展的西妥昔单抗维持治疗回顾性真实世界临床研究,入组人群均为左半RAS/BRAF野生型mCRC患者,该类患者的一线治疗首选化疗联合西妥昔单抗,此前已在多项大型Ⅲ期研究的亚组分析[2-4]中被证实疗效确切,是国内外指南一致推荐的标准治疗。去年ASCO年会报道的PARADIGM研究[5],则是首项在RAS野生型mCRC患者中头对头比较化疗联合抗EGFR单抗或抗VEGF单抗疗效差异的随机对照III期研究,前瞻性证实了左半和全人群RAS野生型mCRC患者中,一线抗EGFR治疗相比抗VEGF的优效性,进一步确证抗EGFR单抗在RAS野生型mCRC患者的优势地位。
本中心发起的这项回顾性研究表明,西妥昔单抗一线诱导达到疾病缓解或稳定后,降低化疗的治疗强度,继续使用含西妥昔单抗的维持治疗方案,可以在维持疗效、减少不良反应的同时延缓肿瘤复发时间、提高患者生活质量,保存患者进一步接受治疗的体能。此结果与近期发表的一系列关于抗EGFR单抗维持治疗最佳策略Meta分析保持一致[6-8]。今年ASCO GI报道的一项荟萃分析[8]包含10项临床研究共计1929例RAS野生型mCRC患者,比较了抗EGFR单抗诱导治疗后的不同维持治疗策略,包括抗EGFR单抗联合两药化疗、抗EGFR单抗联合5-FU、单纯化疗、停药观察、换用贝伐珠单抗,结果显示,抗EGFR单抗联合5-FU的维持策略是最优方案。
我们注意到,在本中心开展的这项研究中队列B的获益尽管差于队列A含西妥昔单抗的维持治疗模式,但是仍然达到了30.1个月的OS,11个月的PFS,整体上优于一线单纯使用化疗治疗的患者,表明前期西妥昔单抗诱导治疗的重要性。
至于抗EGFR单抗最佳维持模式,在多项临床研究及荟萃分析中进行了比较:
抗EGFR单抗+化疗vs停药或换用贝伐珠单抗:在一项纳入了7项II期随机对照临床试验1038例RAS野生型mCRC患者数据的系统综述和meta分析[9]中,与5-FU/LV±贝伐珠单抗或停药观察相比,CT(含5-FU/LV的诱导化疗或维持)+抗EGFR单抗维持治疗可显著改善OS(HR=0.72,P<0.01)和PFS(HR=0.76,P<0.01);
抗EGFR单抗+5-FU/LV vs持续治疗: 上述这项meta分析还提示CT+抗EGFR持续治疗并不优于5-FU/LV+抗EGFR,OS(HR=0.81,P=0.17)和PFS(HR=0.81,P=0.06)。就疗效而言,抗EGFR+5-FU/LV维持治疗可能被认为是RAS野生型mCRC接受基于抗EGFR的诱导治疗后的更好选择;并且这种效应可能在左半BRAF野生型mCRC患者中进一步放大。
抗EGFR单抗单药 vs 持续治疗:ERMES III期临床研究[10]探索了RAS/BRAF野生型mCRC患者一线接受FOLFIRI+西妥昔单抗诱导治疗达到CR/PR/SD以后,接受西妥昔单抗单药维持vs持续原诱导方案治疗至PD,结果显示西妥昔单抗单药维持治疗的中位PFS与诱导方案持续治疗相比,未达到非劣效性。研究者认为,可能与超出预期患者较高的脱落率有关,同时抗EGFR单抗单药维持获益人群可能还需要进一步细分;在ERMES研究次要研究终点ETS(8周时靶病灶缩小≥20%)分析时发现[11],单药维持组患者中,有ETS和无ETS患者的中位PFS分别为10.62个月vs 8.52个月(HR=0.7,P=0.036),中位OS分别为38.88个月vs 27.43个月(HR=0.60,P=0.019),对于两组中有ETS的患者PFS无差异,但是单药维持组OS数值上优于持续治疗组。因此在FOLFIRI+西妥昔单抗诱导治疗后达到ETS的患者中可使用西妥昔单抗单药维持治疗,PFS不受影响且毒性更低、OS更长。
抗EGFR+5-FU/LV vs抗EGFR或5-FU/LV:VALENTINO研究[12]中FOLFOX4联合帕尼单抗诱导治疗后,采用帕尼单抗单药维持的PFS劣效于帕尼单抗联合5-FU/LV,提示单药抗EGFR可能还不足够。在PANAMA研究[13]中与单独使用FU/LV相比,FU/LV联合帕尼单抗维持治疗的PFS显著优于FU/LV,研究达到优效性终点,维持阶段PFS 8.8个月对比5.7个月;OS有改善趋势。两项研究表明在抗EGFR基础上联合5-FU类化疗药物是更合适的维持方案。
基于此,2022年ESMO指南[14]对于RAS野生型患者的维持治疗推荐做出更新,建议以奥沙利铂为基础化疗方案联合抗EGFR单抗一线治疗后,非进展患者可考虑氟尿嘧啶联合抗EGFR单抗维持治疗。考虑到5-FU需要置管从而可能导致患者住院周期延长,为了改善治疗便捷性和患者依从性,华中科技大学同济医学院袁响林教授发起Ⅱ期单臂前瞻性TJCC005研究[15],旨在探索减量卡培他滨联合西妥昔单抗用于RAS野生型mCRC患者维持治疗的可行性,我们医院作为分中心参与了此研究。该研究一线OS为27.4个月,PFS为12.7个月,卡培他滨的最佳维持平均剂量推荐为900mg/m2。基于此,2021年CSCO指南[16]删除了“不推荐卡培他滨与西妥昔单抗联用”。目前,多项西妥昔单抗联合卡培他滨的临床研究正在进行中。而对于一线采用FOLFIRI联合西妥昔单抗作为诱导治疗的患者,福建医科大学附属协和医院开展的一项Ⅱ期单中心前瞻性研究[17]提示,伊立替康联合西妥昔单抗6~12个周期后继续西妥昔单抗单药维持,相较于停药观察组可显著延长无治疗失败生存(FFS)时间,表明该降阶模式也是可选维持治疗方案之一。
总的来说,对于含抗EGFR单抗一线诱导治疗达到CR/PR/SD但不可手术的mCRC患者,维持治疗是可以选择的治疗策略,结合目前的证据,更多支持西妥昔单抗+5-FU的联合方案,考虑到治疗的便捷性可选择西妥昔单抗联合卡培他滨。
[1] Yang X, Qu X, Liu Z, et al. Improved Clinical Outcomes with Cetuximab Maintenance Therapy in Left-Sided RAS/BRAF Wild-Type Metastatic Colorectal Cancer:A Real-World Study of Hunan Cancer Hospital. 2023ESMO ASIA 120P
[2] Venook A, Niedzwiecki, Inncoenti F, et al. Impact of primary tumor location on overall survival and progression free survival in patients with metastatic colorectal cancer: Analysis of CALGB/SWOG 80405(Alliance). 2016ASCO Abstract 3504
[3] Stinting S, Miller-Phillips L, Fischer von Weikersthal L, et al. Per protocal analysis and final OS update of the FIRE-3(AIO KRK-0306))study comparing FOLFIRI plus cetuximab vs. FOLFIRI plus bevacizumab. 2018 ASCO Abstract 3508
[4] Qin S, Li J, Wang L, et al. Efficacy and Tolerability of First-Line Cetuximab Plus Leucovorin, Fluorouracil, and Oxaliplatin (FOLFOX-4) Versus FOLFOX-4 in PatientsWith RASWild-TypeMetastaticColorectal Cancer: The Open-Label, Randomized, Phase III TAILOR Trial. JCO 2018. 78.3183
[5] Takayuki Yoshino, Jun Watanabe, Kohei Shitara, et al. Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC): Results from the phase 3 PARADIGM trial. 2022ASCO LBA1
[6] Parisi A, Ghidini M, Giampieri R, et al. Post-induction Strategies in Metastatic Colorectal Cancer Patients Treated With First-Line Anti-EGFR-Based Treatment: A Systematic Review and Meta-Analysis[J]. Clin Colorectal Cancer. 2022, 21(3):e162-e170. doi:10.1016/j.clcc . 2021.12.005.
[7] Laércio Lopes da Silva, Pedro Nazareth Aguiar, Renata D’Alpino, et al. Maintenance therapy following an anti-EGFR-based induction regimen in metastatic colorectal cancer (mCRC)_ A network meta-analysis of clinical trials[J]. Journal of Clinical Oncology. 2022, 40(4 suppl):128. doi:10.1200/JCO.2022.40.4_suppl.128.
[8] Mastrantoni L, Beccia V, Caira G, et al. Maintenance strategies after anti–EGFR-based induction in RAS wild-type (wt) metastatic colorectal cancer (mCRC): A systematic review and Bayesian network meta-analysis[J]. Journal of Clinical Oncology. 2023, 41( 4_suppl):148. doi: 10.1200/JCO.2023.41.4_suppl.148.
[9] Parisi A, Ghidini M, Giampieri R, et al. Post-induction Strategies in Metastatic Colorectal Cancer Patients Treated With First-Line Anti-EGFR-Based Treatment: A Systematic Review and Meta-Analysis[J]. Clin Colorectal Cancer. 2022, 21(3):e162-e170. doi:10.1016/j.clcc.2021.12.005.
[10] Pinto C, Orlandi A, Normanno N, et al. LBA22 – Phase III study with FOLFIRI/cetuximab versus FOLFIRI/cetuximab followed by cetuximab (Cet) alone in first-line therapy of RAS and BRAF wild-type (wt) metastatic colorectal cancer (mCRC) patients: The ERMES study[J]. Annals of Oncology. 2022, 33 (suppl_7): S1390. doi: 10.1016/j.annonc.2022.08.018.
[11] Orlandi A, Pinto C, Calegari MA,et al. Early tumor shrinkage (ETS) as clinical factor to select maintenance with cetuximab (cet) monotherapy in patients (pts) with RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC): A secondary endpoint analysis of the ERMES study[J]. J Clin Oncol. 2023, 41 (16_suppl):3603.
[12] Pietrantonio F, Morano F, Corallo S, et al. Maintenance Therapy With Panitumumab Alone vs Panitumumab Plus Fluorouracil-Leucovorin in Patients With RAS Wild-Type Metastatic Colorectal Cancer: A Phase 2 Randomized Clinical Trial[J]. JAMA Oncol. 2019, 5(9):1268-1275. doi:10.1001/jamaoncol.2019.1467.
[13] Modest DP, Karthaus M, Fruehauf S, et al. Panitumumab Plus Fluorouracil and Folinic Acid Versus Fluorouracil and Folinic Acid Alone as Maintenance Therapy in RAS Wild-Type Metastatic Colorectal Cancer: The Randomized PANAMA Trial (AIO KRK 0212)[J]. J Clin Oncol. 2022, 40(1):72-82. doi:10.1200/JCO.21.01332.
[14] Cervantes A, Adam R, Roselló S, et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up[J]. Ann Oncol. 2023, 34(1):10-32. doi:10.1016/j.annonc.2022.10.003.
[15] Wang L, Liu Y, Yin X, et al. Effect of Reduced-Dose Capecitabine Plus Cetuximab as Maintenance Therapy for RAS Wild-Type Metastatic Colorectal Cancer: A Phase 2 Clinical Trial[J]. JAMA Netw Open. 2020, 3(7):e2011036. doi:10.1001/jamanetworkopen.2020.11036.
[16] 2021结直肠CSCO指南
[17] Jiang T, Chen H, Zheng J, et al. Cetuximab Maintenance Therapy in Patients with Unresectable Wild-Type RAS and BRAF Metastatic Colorectal Cancer: A Single-Institute Prospective Study[J]. Adv Ther. 2020, 37(6):2829-2840. doi:10.1007/s12325-020-01360-8.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


