2023年12月13日,备受瞩目的《肿瘤学年鉴》(Annals of Oncology,影响因子:50.5)期刊在线发布了2023版ESMO早期乳腺癌临床实践指南——“Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up”。本期【肿瘤资讯】整理了筛查、诊断及局部区域治疗的要点及推荐意见,供读者参阅。
• 本 ESMO 临床实践指南为早期乳腺癌 (EBC)患者的管理提供了关键建议和算法。
• 涵盖了诊断、分期、风险评估、治疗、随访、特定情况和患者视角。
• 作者团队是多学科的,由来自国际各机构的专家组成。
• 推荐意见(包括 ESMO-MCBS 和 ESCAT 评分,如适用)是基于现有证据和专家意见。
• 在诊断程序和治疗选择方面,涵盖了患者沟通和共同决策。
发病率和流行病学
全球数据表明,2020年乳腺癌新发病例230万,占所有新发癌症病例的近12%,同年死亡68.5万。由于筛查技术的改进,乳腺癌的检出率有所提高。近年来,西方国家的死亡率有所下降,尤其是在年轻的年龄组中,但乳腺癌仍是全球女性癌症相关死亡的主要原因。大多数EBC病例可通过综合治疗治愈,尽管治愈率因临床分期和亚型而异。
筛查、诊断、病理学和分子生物学
乳腺癌筛查
关于筛查的详细信息包含在《肿瘤学年鉴》在线的补充材料部分1中,也在ESMO关于遗传性乳腺癌-卵巢癌综合症的癌症风险降低和筛查的临床实践指南(CPG)中有所描述。
诊断和影像学
诊断和影像学的描述包含在《肿瘤学年鉴》在线的补充材料部分2中。
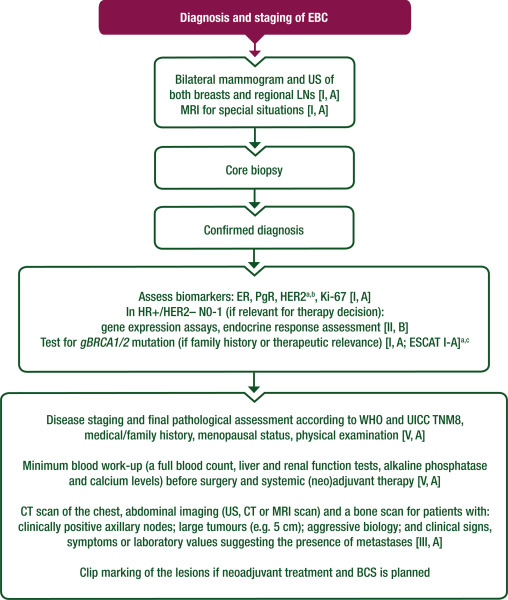
图1 EBC 的诊断检查和分期
遗传性乳腺癌
关于遗传性乳腺癌的详细信息包含在《肿瘤学年鉴》在线补充材料部分3中。
组织形态学评估、生物标志物和分子病理学
组织形态学评估、生物标志物和分子病理学在补充材料部分4和补充表格S1-S4中有描述,可在《肿瘤学年鉴》在线获取。
建议对患癌风险为平均水平的50-69岁女性进行定期(每2年一次)的乳腺X线摄影筛查[Ⅰ,A]。对于45-49岁和70-74岁女性,也可进行定期乳腺 X 射线摄影,尽管获益的证据较少[Ⅰ,B]。
对于有显著的家族遗传背景或已知携带BRCA1/2和其他高风险致病变异(PVs)的女性,应遵循ESMO癌症遗传性乳腺癌-卵巢癌综合征风险降低和筛查的临床实践指南Ⅲ, A]。
进一步的诊断工作基于临床检查和影像学,包括双侧乳腺X线摄影和超声(US)检查,以及区域淋巴结(LNs)的检查,或在有症状的情况下进行二维数字乳腺摄影[Ⅰ,A]。
在有条件和适当的情况下,可以考虑使用数字乳腺断层摄影(DBT)[联合或不联合合成乳腺摄影(synthetic mammography,SM)]和对比增强能谱乳腺X 线摄影(CESM)作为替代方法[Ⅱ,B]。
在标准影像学检查后存在不确定性或特殊临床情况下(例如与gBRCA1/2m和其他高风险PVs相关的家族性乳腺癌、小叶癌、疑似多灶性/多中心性、存在乳房植入物等)推荐进行乳腺磁共振成像(MRI)[Ⅰ,A]。
仅建议对Ⅱb期及以上疾病(特别是LN广泛受累)、初次诊断时复发风险高的患者和/或有症状的患者进行远处转移(骨、肝和肺)的评估[Ⅲ,A]。
建议在诊断时进行治疗前病理学评估,包括完整的组织形态学、免疫组化(IHC)和分子评估(如适用),应包括原发肿瘤组织学和腋窝淋巴结(ALN)组织学/细胞学(如果临床上怀疑LN受累)[Ⅰ,A]。
评估应包括组织学类型、分级和雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)生物标志物及增殖标志物如Ki-67的IHC评估[Ⅰ,A]。在HER2 IHC评分不明确(HER2 2+)的情况下应进行FISH检测[Ⅰ,A;ESMO分子靶点临床可操作性评分(ESCAT)评分:Ⅰ,A]。
肿瘤应根据常规组织学和IHC结果分为不同生物学亚型,如Luminal A型、Luminal B型、HER2阳性和三阴性[Ⅰ,A]。《肿瘤学年鉴》在线的补充材料部分4提供了关于亚型分类的详细信息。
在激素受体 (HR) 阳性、HER2阴性 EBC 且辅助化疗 (ChT) 适应症不确定的情况下(考虑所有临床和病理学因素后),可在术前进行基因表达测定和内分泌反应评估 [Ⅱ,B]。
肿瘤浸润淋巴细胞(TILs)可能增加预后和预测信息,特别是在三阴性乳腺癌(TNBC)和HER2阳性乳腺癌中,但没有明确的TILs阈值指导治疗决策[Ⅰ,B]。
不应使用程序性死亡配体1(PD-L1)表达水平来指导EBC的治疗决策[Ⅰ,E]。
应向符合各自国家标准的患者以及那些适合接受奥拉帕利辅助治疗的患者提供BRCA1/2基因的胚系检测和后续的遗传咨询。
分期和风险评估
分期和风险评估的详情见补充材料第5节以及补充表S2-S4,可在《肿瘤学年鉴》在线获取。
应根据世界卫生组织肿瘤分类和国际癌症控制联盟肿瘤-淋巴结-转移 (TNM) 分期系统第八版进行疾病分期和手术标本的最终病理学评估[Ⅴ,A]。
建议在手术和全身(新)辅助治疗前进行基本的血液检查(全血细胞计数、肝肾功能测试、碱性磷酸酶和钙水平)[Ⅴ, A]。
对于以下患者,可以考虑进行胸部计算机断层扫描(CT)、腹部影像学检查(US、CT或MRI扫描)和骨扫描:
• 临床阳性ALN;
• 大肿瘤(例如5cm);
• 侵袭性生物学特征;
• 临床症状、体征或实验室指标提示存在转移[Ⅲ, A] 。
必须评估完整的医疗和家族史,包括绝经状态(如有疑虑,应测量血清雌二醇和促卵泡激素水平)[Ⅴ, A]。
对于高风险患者以及当常规方法无法确定时,可以使用[18F-氟代脱氧葡萄糖(FDG)PET/CT扫描替代CT和骨扫描[Ⅱ, B]。
EBC管理
一般治疗原则
本指南中的建议提供了促进最佳患者护理的框架。然而,每例患者的治疗决策应考虑基于患者/疾病特征、合并症和患者偏好的个体风险-获益分析。所有治疗决策应作为与患者共同决策过程的一部分进行。如适用,首选参加临床试验。
补充材料第6节可在《肿瘤学年鉴》在线获取,提供了一般治疗原则的更多详细信息。
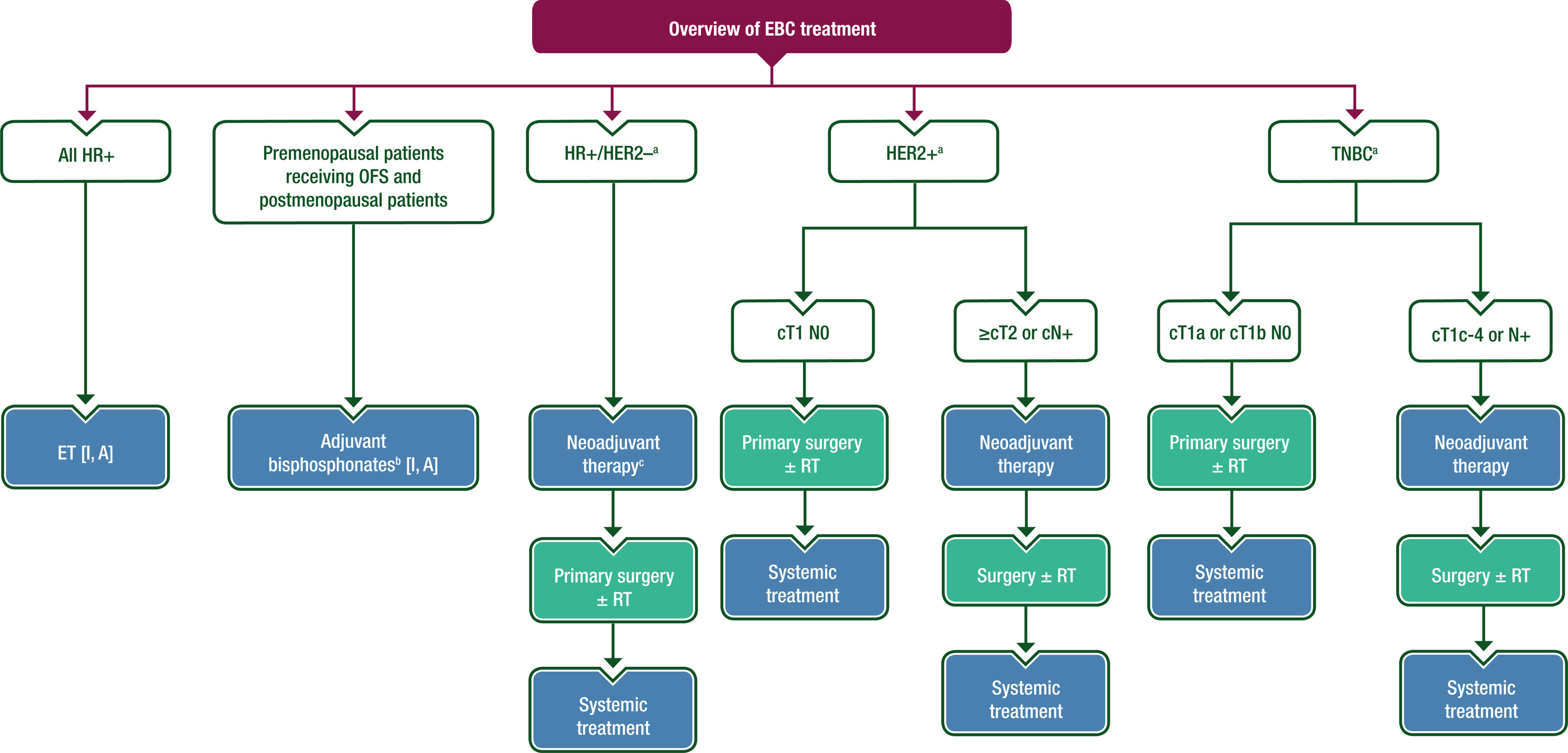
图2 EBC治疗概述
在有条件的情况下,治疗应在专业的乳腺单位/中心进行,由专门的多学科团队(MDT)执行,该团队可以将患者转诊至其他专科[Ⅲ, A]。
建议参与临床试验[Ⅴ, A]。
每位患者的治疗策略应基于个体风险-获益分析,考虑肿瘤负担(原发肿瘤的大小和位置、病灶数量和LN受累程度)和生物学特征(病理学,包括生物标志物和基因表达),以及年龄、绝经状态、一般健康状况和患者偏好[Ⅰ, A]。
应考虑年龄与其他因素的关系,不应成为治疗决策的主要决定因素 [Ⅳ,A]。
在开始任何全身治疗之前,应与年轻的绝经前患者(无论疾病分期)讨论生育力保护[Ⅴ, A]。
患者沟通和共同决策
《肿瘤学年鉴》在线提供的补充材料第7节,详细介绍了患者沟通和共同决策的内容。
应以全面且易于理解的方式重复(口头和书面)提供诊断和治疗选择的信息 [Ⅴ, A]。
建议使用可靠、以患者为中心的网站或类似信息来源[Ⅴ, A]。
患者应积极参与所有管理决策,并应公平获得全面的生殖护理选择,包括妊娠咨询、避孕和生育力保护 [Ⅴ,A]。
局部区域治疗
手术
保乳手术 (BCS)是大多数乳腺癌患者的适宜手术选择。对于接受BCS的患者,通常伴随术后放疗(RT),也称为保乳治疗(BCT),实现最佳的肿瘤学和美容效果非常重要。因此,建议乳腺外科医生应接受肿瘤整形手术方法的培训或与整形外科医生合作。应使用适当的以患者为导向的信息工具促进共同决策。
应报告边缘状态;对于浸润性癌,不要求墨染切缘无肿瘤;对于原位肿瘤,推荐边缘距离≥2mm。
使用定位标记夹标记肿瘤床有助于准确规划放疗增强区域或部分乳腺照射(如有指征)。目标应是实现每年局部复发率<0.5%,以及5年内总体局部复发率≤5%。保留乳头的乳房切除术 (NSM) 和保留皮肤的乳房切除术 (SSM) 通常被认为在肿瘤学上是安全的,同时改善了无法实现乳腺保留病例的美容效果。
应向大多数需要乳房切除术的女性提供即刻或延迟的乳房重建。不建议立即进行重建的肿瘤学原因包括炎性乳腺癌或局部区域复发风险较高的情况,以避免术后RT的延迟。无论是在乳腺癌术后放疗(PMRT)之前还是之后,自体组织为基础的重建通常比植入物为基础的重建更好地耐受术后RT。
对于乳房重建,有许多立即或延迟的手术选择。硅凝胶植入体通常是安全的,但应告知患者某些植入体发生间变性大细胞淋巴瘤的风险较小。
应根据解剖学、治疗和患者相关因素及偏好,讨论最佳的重建技术。
ALN管理的进步
初次手术或初次全身/新辅助治疗累及ALN的治疗方案见图3。
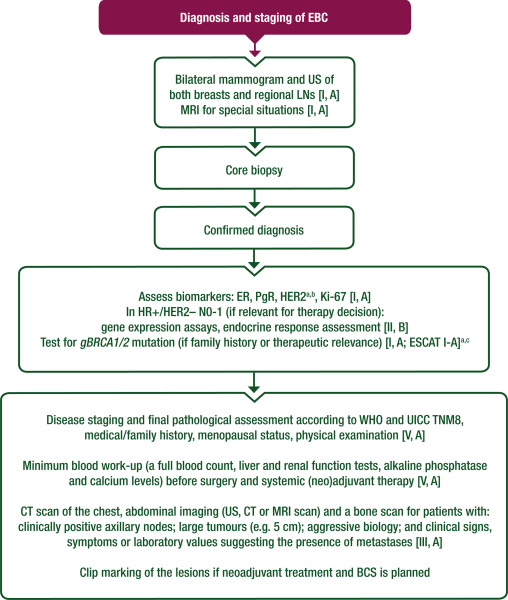
图3 EBC中ALN受累的管理
区域LN状态仍然是EBC长期结局最强的预测因素之一。前哨淋巴结活检 (SLNB) 是诊断时或新辅助 ChT 后临床阴性 ALN 的标准分期方法。与腋窝淋巴结清扫(ALND)相比,SLNB与较少的肩部僵硬、疼痛和手臂肿胀等并发症相关。通过适当的培训,SLNB可以实现高识别率(≥97%)、低假阴性率以及SLNB后有利的ALN复发率。值得注意的是,尽管假阴性率为5%-10%,但孤立ALN复发在SLNB阴性者中发生的比例小于1%。
在未经治疗的ALNs中,微转移(0.2-2.0mm)(N1mic)或孤立肿瘤细胞(N0itc+)在预后上等同于N0肿瘤,根据其他基于肿瘤和基于患者的参数指标选择局部和全身治疗方案。根据IBCSG 23-01试验,如果前哨淋巴结(SLN)有微转移,除非接受了新辅助疗法,否则不需要进一步的ALN治疗。因此,不推荐对未暴露于新辅助 ChT 的患者进行常规 IHC 或 PCR 评价SLNs。
新辅助ChT后的微转移表明非病理学完全缓解(pCR),与初治LN的微转移相比,pCR的预后更差。
对于SLN有宏转移的病例,ACOSOG Z0011试验报告了相似的结果,即使没有ALND,对于临床T1-T2 cN0浸润性乳腺癌患者,如果1-2个SLNs含有转移但无明显的包膜外扩展(接受BCS、术后切线RT包括部分腋窝和辅助系统治疗),也是如此。对于不符合这些标准的患者,以及对于有超过两个阳性SLNs的患者,ALND仍然是标准治疗。AMAROS 和 OTOASOR 研究证明,cN0疾病和 SLN 转移患者的另一种选择是腋窝RT。在 SLN 阳性的情况下,在选择 ALND 或 RT 时,多学科团队 (MDT) 需要考虑基于LN受累的全身治疗选择(例如,阿贝西利、奥拉帕利)。对于已经接受过乳房切除术,无论是否有PMRT(低风险肿瘤,T<5 cm)的指征,在阳性SLNB后是否可以省略ALND的问题仍未解决。目前,新辅助ChT后微转移和宏转移SLNs患者接受ALND的益处正在研究中。因此,在随机试验报告结果之前,对于ypN1mi以及任何宏转移疾病(ypN+),无论其他特征如何,都推荐进行ALND。目前尚无新辅助ChT后ALND中孤立肿瘤细胞(ITC)的数据。
隐匿性乳腺癌表现为区域LN转移,而乳房内没有可识别的原发病灶。它占所有新发乳腺癌病例的不到0.5%。常规诊断需要进行乳腺MRI和全身分期,最好通过FDG-PET-CT。ALND结合全乳放疗(WBRT)和区域RT是首选治疗方法。应根据亚型和分期的建议进行全身治疗,包括新辅助治疗。
初次全身/新辅助治疗后手术
在初次全身治疗(PST)之前,建议标记原发部位(使用标记夹或碳定位),以便在预期发生BCS时进行准确的手术。如果存在阳性ALN(cN1),标记阳性LN将允许在PST后cN0的患者避免进行ALND。虽然不是强制性的,但结合术前基线MRI的乳腺MRI是评估PST后残留病灶范围最准确的方法。
PST后,乳腺手术必须遵循与原发性乳腺手术相同的肿瘤学安全、低发病率和良好美容效果的原则。通过PST缩小大的单灶性原发肿瘤将使大部分患者能够接受BCS。即使在多灶性疾病或肿瘤缩小有限的情况下,患者仍然可能有资格进行BCS。PST后的手术通常应根据新的肿瘤范围而非原始肿瘤床来规划。
在临床和影像学检测为ALN阴性的患者中,PST后SLNB是首选方法。如SENTINA、ACOSOG Z1071、SN FNAC和GANEA 2试验的结果所示,在活检证实的有限初始LN受累(pN 1)并在PST后转为临床阴性(ycN 0)的患者中,可以安全地进行SLNB。在这些研究中,PST后SLN的假阴性率范围为8%-14%。 通过标记活检阳性LN以确认其是否被切除,以及使用双示踪剂并切除≥3个SLNs,可以将假阴性率降低至<5%——效果与靶向腋窝淋巴结切除(TAD)(切除标记的LN和 ≥1个SLN)相当。根据目前的证据,PST后SLN中的任何肿瘤沉积都提示ALND。此外,来自试验的现有数据不支持在初始大量LN受累[cN2-3(临床或PET-CT检测)]或炎性乳腺癌患者中常规使用SLNB,即使在PST后转换为ycN 0。
BCS 后的 WBRT
BCS 后 WBRT 导致10年任何首次复发(局部或远处)的风险和15年乳腺癌相关死亡风险分别绝对降低15.7%和3.8%。Boost RT 与无 Boost 相比可降低局部复发率(10年和20年分别相对降低41%和35%),并适用于具有局部控制不利风险因素的患者。根据ESTRO共识推荐,对于经过良好选择的低风险疾病患者,加速部分乳腺照射(APBI)报告了与WBRT相当的良好结果。适合部分乳腺照射的低风险特征包括:Luminal亚型的肿瘤(≤3cm),无淋巴血管间隙浸润,非小叶浸润性癌,肿瘤分级1-2级,低至中级别导管原位癌(DCIS)(大小≤2.5cm,手术切缘清晰≥3mm),诊断时年龄≥50岁,单中心或单病灶病变,手术切缘清晰(>2mm),淋巴结阴性(包括ITC),以及未使用PST。任何技术,包括外照射RT、近距离RT、腔内和术中电子束RT技术,只要能完全覆盖整个靶区,都是适当的。
在BCS后省略RT仍在探索中。然而,对于计划接受≥5年辅助内分泌治疗 (ET) 的高龄和/或有合并症的女性,如果她们能够接受局部复发风险增加(尤其是长期复发风险)以及 ET 的可能副作用,则可能省略RT。
PMRT
对于LN阳性的患者,PMRT(Post-Mastectomy Radiotherapy,术后放疗)导致10年首次复发绝对减少10.6%,20年时乳腺癌相关死亡率绝对减少8.1%。PMRT 被推荐用于高危疾病(包括受累的切除边缘、≥4个受累的ALNs和T3-T4肿瘤),不受淋巴结状态的影响。对于具有中等风险特征的患者(如淋巴血管浸润、年龄),包括1-3个阳性 ALN 的患者,也应该考虑PMRT。
区域RT
使用包含胸壁和所有区域 LN 的综合局部 RT 可改善结局,尤其是对于 ALN 受累患者。基于CT计划的现代局部区域RT将减少复发,主要是影响远处复发。RT 已被证明可显著降低乳腺癌死亡率(RR = 0.87,95% CI: 0.80-0.94,P = 0.0010),对非乳腺癌死亡率无显著影响(RR = 0.97,95% CI: 0.84-1.11,P = 0.63),从而导致全因死亡率显著降低(RR = 0.90,95% CI: 0.84-0.96,P = 0.0022)。
在PST的情况下,适应症和靶体积可以根据临床肿瘤分期结合肿瘤缓解进行个体化制定。欧洲放射治疗与肿瘤学学会 (ESTRO) 关于乳腺癌靶区勾画的指南精确描述了需要治疗的LN位置,指出在局晚期疾病中需要个性化处理。
ALND 后,切除部分腋窝不应RT,术后明确残留病灶的病例除外。在阳性SLNB没有进行后续ALND的情况,建议进行区域RT,其范围由其他风险因素定义(例如,最低风险:无RT;中等风险:仅1-2级RT;最高风险:包括内乳LN的1-4级全范围RT)。
RT 和乳房重建
可以在即刻乳房重建后进行。通常,自体组织重建的效果更好。
RT 剂量和分割
用于局部和/或区域辅助RT治疗的剂量常规为45-50 Gy,分为25-28次,每次1.8-2.0 Gy,典型推量剂量为10-16 Gy,每次2 Gy。中等大分割RT(例如:2.50-2.67 Gy单次剂量,15-16个治疗分次)已经显示出相当的有效性和类似的副作用。FAST-Forward试验表明,在6年的中位随访后,1周进行5次RT(总剂量26 Gy)也是安全有效的。关于超大分割局部区域RT的疗效数据,正在等待一项前瞻性研究的结果。ESTRO放射肿瘤学实践咨询委员会共识推荐在适当情况下使用更短的治疗方案。另一种超大分割方案,分次剂量为5.7-6.0 Gy,每周一次,连续5周,可以用于有日常交通困难的虚弱患者。
BCS 联合术后 RT 是大多数 EBC 患者的首选局部治疗方案[Ⅰ, A]。
如果适合/倾向于进行乳房切除术,应提供乳房重建,但原发性炎性或其他高风险肿瘤除外,这些情况下延迟全身/RT会影响治疗效果[Ⅴ, A]。
SLNB是所有cN0患者的标准腋窝手术[Ⅰ, A]。
在无PST的情况下,对于微转移扩散和有限SLN受累(1-2个受累SLNs)的cN0患者,在进行BCS后WBRT后,最终包括腋窝下部和辅助全身治疗,不需要进一步的腋窝手术[Ⅱ, A]。
通常仅在预期腋窝疾病负荷较高或影响进一步辅助全身治疗决策的情况下,推荐在受累SLNs<3个的阳性 SLNB 后进行ALND[Ⅱ,A]。
PST后的手术规划应考虑PST后的情况[IⅡ, A]。
BCS后推荐进行WBRT[Ⅰ, A]。
建议采用大分割方案:中等(即所有术后放疗指征者,每天≤3 Gy,15-16个治疗分次)和超大分割[即全乳或胸壁(无重建)RT,分 5 次连续分次照射,共26 Gy][Ⅰ, A]。
APBI是低局部复发风险的浸润性和原位乳腺癌患者的WBRT替代治疗方案[Ⅰ, A]。
对于高风险EBC,包括受累切缘、≥4个受累ALNs、T3-T4肿瘤以及存在其他风险因素的患者,推荐进行PMRT[Ⅰ, A]。
对于具有中等风险特征的患者(例如淋巴血管浸润、年龄),包括那些有1-3个阳性ALNs的患者,应考虑进行PMRT[Ⅰ, A]。
建议对累及 LN 的患者进行淋巴结RT(靶区范围取决于风险因素,包括累及 LN 的数量、N分期和对 PST 的反应)[Ⅰ, B]。
如果有指征,可以在即刻乳房重建后进行PMRT[Ⅲ, A]。
未完待续,敬请期待“不同亚型EBC(新)辅助全身治疗”章节精彩内容!
Loibl S, André F, Bachelot T, Barrios CH, Bergh J, Burstein HJ, Cardoso LMJ, Carey LA, Dawood S, Del Mastro L, Denkert C, Fallenberg EM, Francis PA, Gamal-Eldin H, Gelmon K, Geyer CE, Gnant M, Guarneri V, Gupta S, Kim SB, Krug D, Martin M, Meattini I, Morrow M, Janni W, Paluch-Shimon S, Partridge A, Poortmans P, Pusztai L, Regan MM, Sparano J, Spanic T, Swain S, Tjulandin S, Toi M, Trapani D, Tutt A, Xu B, Curigliano G, Harbeck N; ESMO Guidelines Committee. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up†. Ann Oncol. 2023 Dec 8:S0923-7534(23)05104-9. doi: 10.1016/j.annonc.2023.11.016.
排版编辑:肿瘤资讯-Paine











 苏公网安备32059002004080号
苏公网安备32059002004080号


