总生存期(OS)一直是评估肿瘤疗效的“金标准”,尤其是晚期肿瘤,OS提高是临床医生追求的最终目标。理论上来说,OS由不同线数治疗的无进展生存期(PFS)组成,PFS趋势与OS一致,但实际临床研究中PFS获益不能转换为OS获益的现象也不乏少数。以CDK4/6抑制剂为例,目前临床可选择的CDK4/6抑制剂越来越多, PFS也展现出良好的获益,但并非所有CDK4/6抑制剂都能获得总生存(OS)获益。2023美国圣安东尼奥乳腺癌研讨会(SABCS)上,MONARCH 3研究最终OS分析结果公布,而“无显著统计学差异”的结果也使得MONALEESA-2研究成为激素受体(HR)阳性和人表皮生长因子受体2(HER-2)阴性乳腺癌领域中唯一获得OS显著统计学差异的研究。为更好的促进CDK4/6抑制剂的选择和应用,【肿瘤资讯】特邀浙江大学医学院附属第一医院傅佩芬教授结合现有循证证据,客观分析不同CDK4/6抑制剂OS背后的原因。
中国临床肿瘤学会乳腺癌专家委员会常委
中国医药教育协会乳腺疾病专业委员会常委
中国医疗保健国际交流促进会乳腺疾病分会常委
中华医学会外科学分会乳腺外科学组委员
中国抗癌协会乳腺癌专业委员会委员
中国医师协会乳腺外科医师委员会委员
中国医师协会乳腺癌精准专业委员会委员
浙江省抗癌协会乳腺癌专业委员会副主任委员
浙江省中西医学会乳腺病专业委员会副主任委员
浙江省医师协会乳腺肿瘤委员会副主任委员
浙江省肿瘤诊治质控中心乳腺癌专家委员会副主任委员
PFS只是过程,OS才是终点
在晚期临床试验中,PFS和OS都是临床研究中非常重要的疗效终点指标。其中,OS的定义明确、客观稳健,是反映患者生存获益的“金标准”。鉴于OS往往需较大样本量和更长的随访时间,近年来,为加快抗肿瘤药物的研发和获批,药品监管机构针对抗肿瘤新药审批上市建立了采用替代终点的加速审评模式。
PFS因所需样本量较小、观察时间短,成为近年来备受关注的OS替代终点。但与OS的客观不同,PFS是以人为设置的评估标准为终点(实体瘤领域常用RECIST标准),相对主观,易产生评价偏倚,并且评价先于疾病变化,无法判断对患者生存的影响。PFS获益能否转化为OS具有不确定性。
达到PFS终点只是万里长征的第一步,关键是能否达到OS终点,让更多患者实现临床治愈。对于目前不可治愈的晚期乳腺癌患者来说,提高生活质量,延长总生存仍然是临床医生追求的最终目标。这一点在2021年国家药监局药品审评中心(CDE)发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》中也有强调[1]:对于肿瘤药物,提高疗效和延长患者生存时间仍然是当下追求的主要目标,通常选择OS作为临床研究的主要终点。
同路殊归,深度剖析:CDK4/6抑制剂一线治疗PFS获益显著,OS不尽相同背后的原因
CDK4/6抑制剂的出现,彻底改变了HR阳性HER-2阴性晚期乳腺癌的临床治疗模式,患者生存也获得突破性改善。PALOMA-2、MONALESSA-2、MONARCH-3和MONALESSA-7等一系列研究证实,CDK4/6抑制剂联合芳香化酶抑制剂(AI)一线治疗HR阳性HER-2阴性晚期乳腺癌患者获益显著。尽管每个研究的PFS略有差异,但与AI相比,CDK4/6抑制剂联合方案均降低疾病进展风险近50%,风险比(HR)为0.54~0.58[2]。然而除瑞波西利的MONALEESA-2、MONALEESA-7研究外,其他CDK4/6抑制剂一线治疗研究的OS均未取得显著差异性结果。
MONALEESA-2研究是首个在绝经后人群中展现出OS阳性结果的CDK4/6抑制剂III期临床试验。研究结果表明,瑞波西利联合来曲唑一线治疗HR+/HER2-晚期乳腺癌患者的中位OS相较于安慰剂组显著延长超过12个月,死亡风险降低24%(63.9个月 vs 51.4个月,HR=0.76,P = 0.008)。并且随着治疗时间的推移,瑞波西利OS获益会逐渐增加,6年时瑞波西利组的OS率高于安慰剂组12.2%[3]。
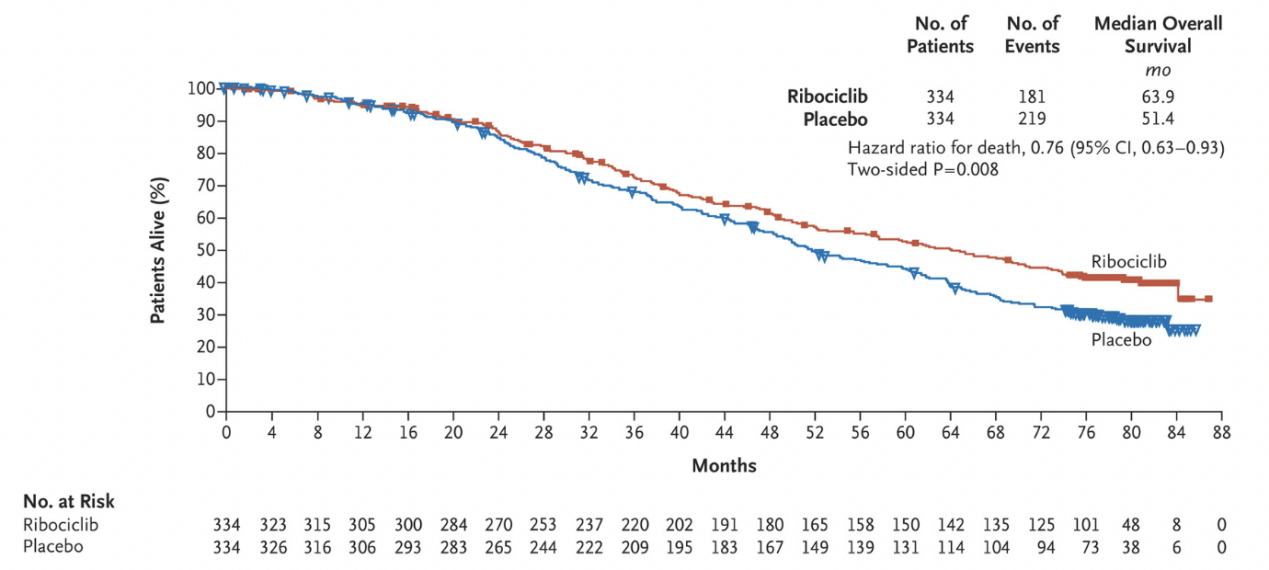 MONALEESA-2研究OS最终分析结果
MONALEESA-2研究OS最终分析结果
2022年,PALOMA-2研究公布了OS最终分析结果,在中位随访90个月后,哌柏西利组和安慰剂组中位OS分别为53.9个月和51.2个月 (HR=0.956,95%CI 0.777~1.177,P=0.3378),未能取得显著统计学差异[4]。今年SABCS大会上披露的MONARCH 3研究最终分析结果更是令人出乎意料。在长达8年的随访中,一线使用阿贝西利联合内分泌治疗HR+/HER2-晚期乳腺癌患者,中位OS超过5.5年,相比对照组OS延长13.1个月(66.8个月 vs 53.7个月),但95% 置信区间跨1,且P值未达到统计学差异阈值0.034(HR=0.804,95% CI 0.637-1.105,P=0.0664),以未达到显著统计学差异结束[5]。
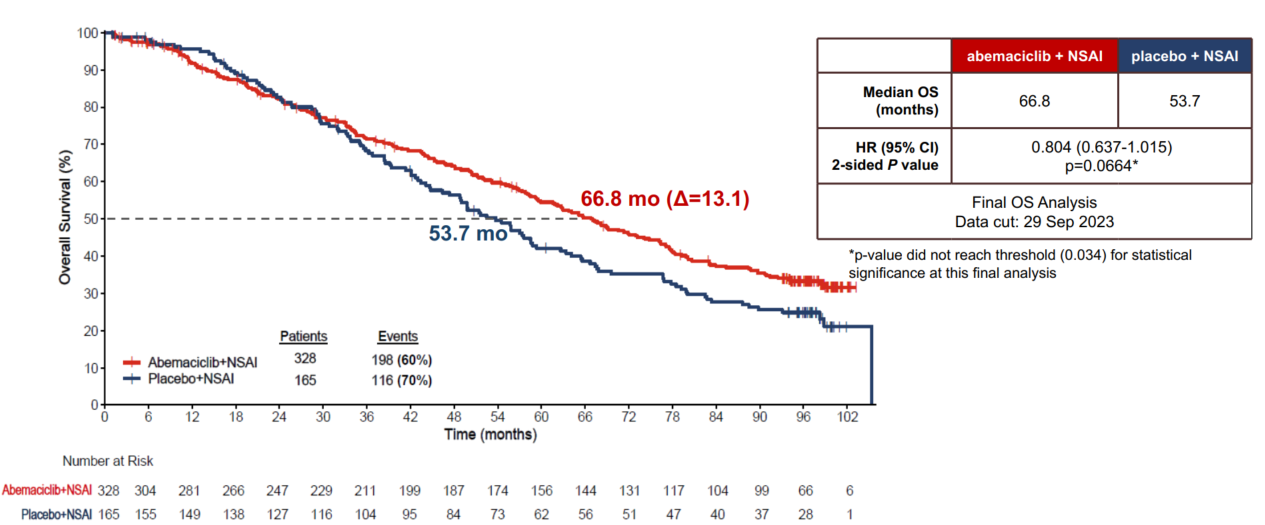 MONARCH 3 研究OS最终分析结果
MONARCH 3 研究OS最终分析结果
正是基于瑞波西利显著的OS获益,2023年NCCN指南突出瑞波西利在HR+/HER2- 晚期乳腺癌的一线治疗地位,成为NCCN指南中与芳香化酶抑制剂联合用于HR+/HER2-晚期乳腺癌一线治疗的唯一1类首选CDK4/6抑制剂[6],同时下调哌柏西利和阿贝西利与AI的推荐等级至2A。

纵观PALOMA-2、MONALEESA-2、MONARCH 3研究,三个研究均为针对绝经后 HR+/HER2-晚期乳腺癌患者的一线治疗,采用的都是CDK4/6抑制剂联合NSAI治疗模式,PFS获益一致,而 OS 却不尽相同。分析其原因可能有以下几个方面:
作用机制:CDK4/6 抑制剂虽属于同一大类,但不同药物具有不同的药代动力学,具有不同的作用机制。瑞波西利独有的二甲基酰胺结构使得其具有较高的选择性,且对CDK4具有高抑制活性,对CDK4的抑制活性是CDK6的8倍[7,8],而阿贝西利仅5.5倍,哌柏西利仅1.3倍[8],这可能是导致瑞波西利表现较优的原因。此外,瑞波西利可通过诱导肿瘤细胞衰老达到长期应答[9],同步显著影响外周先天性和适应性免疫反应[10],通过免疫激活获得长期疗效,改善患者预后,也是可能导致瑞波西利表现较优的原因之一。
样本量、事件数和统计效能:OS结果是否具有统计学差异,不仅取决于疗效,还与研究效能、事件数有关。如果研究事件数较多、效能较高,即使OS临床获益不显著,也可能观察到有统计学差异的结果。PALOMA-2研究(n=666)、MONAELEESA-2研究(n=668)虽然样本量相对较大,但在OS数据分析时,ITT人群分别发生了405例和400例死亡事件,OS成熟度在60%左右。MONARCH 3研究(n=493)最终OS分析时,ITT人群发生了315例死亡事件,OS成熟度同样达到60%以上,样本量似乎并不是导致最终OS结果差异的主要原因。另外,PALOMA-2 研究、MONARCH 3 研究在早期OS曲线均有交叉,而MONALEESA-2研究试验组和对照组生存曲线则在约2年时就开始出现分离,而且OS分析效能近90%[11],这为其后期早期获得OS统计学差异奠定了基础。此外,瑞波西利开展的其他III期研究以及亚洲人群分析中均观察到了PFS改善,且HR值较低,提示瑞波西利获益显著 [12-14]。
后线治疗:OS的改善往往建立在长期肿瘤控制的基础上,而晚期患者往往接受了多线治疗,不同阶段、不同线数的PFS累积改善才最终导致OS的提高。部分研究PFS未能最终转化为OS获益,可能是后续治疗导致的差异。但MONALESSA-2研究与MONARCH-3研究继续接受治疗的患者比例相似,依然取得了OS获益。在后续抗肿瘤治疗方案中,MONALEESA-2研究瑞波西利组和对照组分别有21.7%和34.4%的患者在进展后接受CDK4/6抑制剂治疗,高于MONARCH3研究中阿贝西利组和对照组的12%和32%,后线CDK4/6抑制剂治疗似乎并未对瑞波西利联合治疗方案的OS造成不利影响。
不良反应:药物毒副反应是影响PFS获益是否可转化为OS获益的重要因素[15],因为毒副反应会导致PFS评估本身的偏移。如果毒副反应特别大,可导致长期随访中患者因为不耐受而停药,使得PFS获益无法转化为OS获益。阿贝西利因不良反应导致永久停药的发生率较高,最高可达25.1%。哌柏西利治疗过程中因不良反应导致永久停药的发生率相最高可达12.2%,而瑞波西利相对较低,约在8.5%左右[16]。这可能是导致瑞波西利获得OS显著统计学差异的原因。
总结
CDK4/6抑制剂的出现大大改变了HR+/HER2-晚期乳腺癌治疗格局,现有CDK4/6抑制剂都取得了一致的PFS获益。值得注意的是,瑞波西利在PFS获得阳性结果的基础上,同时又获得了显著统计学差异的OS获益,为临床应用提供了更好的循证基础。当然,让乳腺癌患者实现更长生存、更好生活,CDK4/6抑制剂还有很长的路要走。期待未来CDK4/6抑制剂可以从晚期走向早期,治疗方案进一步优化,为患者带来更多获益。
1. 以临床价值为导向的抗肿瘤药物临床研发指导原则. 国家药品监督管理局药品审评中心官网
2. 国家肿瘤质控中心乳腺癌专家委员会, 中国抗癌协会肿瘤药物临床研究专业委员会. CDK4/6抑制剂治疗激素受体阳性人表皮生长因子受体2阴性晚期乳腺癌的临床应用共识. 中华肿瘤杂志, 2021, 43(4):405-413.
3. Hortobagyi GN, et al. N Engl J Med. 2022;386:942-950.
4. Finn RS, et al. J CLIN ONCOL. 2022;40(17_suppl):LBA1003.
5. Matthew P, et al. 2023 SABCS. GS01-12.
6. National Comprehensive Cancer Network. Breast Cancer (Version 1.2023). Guidelines Version 1.2023.
7. Chen P, et al. Mol Cancer Ther. 2016 Oct;15(10):2273-2281.
8. Kim S, et al. Oncotarget. 2018;9(81):35226-35240.
9. Rao P, et al. Cancer Res. 2021;81(13 suppl):2025.
10. Caroline A Peuker, et al. Eur J Cancer . 2022 Feb;162:45-55.
11. https://themedicalxchange.com/en/2022/09/21/2455_gaining-further-perspective-into-treatment-of-advanced-breast-cancer-with-cdk4-6-inhibitors/
12. Changing the Natural History of ER-Positive, HER2-Negative Breast Cancer With the Introduction of CDK4/6 Inhibition . https://ascopost.com/issues/july-25-2022/changing-the-natural-history-of-er-positive-her2-negative-breast-cancer-with-the-introduction-of-cdk46-inhibition/
13. Y. Lu, et al. ESMO Asia Virtual Congress 2020. 47MO.
14. 2022 ESMO ASIA: 21MO.
15. Tannock IF, Pond GR, Booth CM. Biased Evaluation in Cancer Drug Trials—How Use of Progression-Free Survival as the Primary End Point Can Mislead. JAMA Oncol. Published online March 10, 2022. doi:10.1001/jamaoncol.2021.8206
16. 徐兵河.中华肿瘤杂志, 2021, 43(4):431-442.
审批码KIS0015442-42964,有效期至2024-12-27,资料过期,视同作废
排版编辑:winnie











 苏公网安备32059002004080号
苏公网安备32059002004080号


