2023年SABCS最新公布了MONAECH 3研究的最终总生存期(OS)结果,虽阿贝西利组能够明显延长中位OS,但未能达到统计学差异。MONARCH 3研究的阴性结果一经公布即在乳腺癌领域激起千层浪。在临床实践中,OS获益对于CDK4/6抑制剂的用药选择是重要考量因素,而前有PALOMA-2研究折戟沉沙,后有MONARCH 3研究重蹈覆辙,唯有MOANLEESA-2研究突出重围,一时间也让领域学者对于CDK4/6抑制剂的无进展生存期(PFS)获益能否转换为OS获益产生了诸多思考。为此,【肿瘤资讯】特别邀请到中国科学院大学附属肿瘤医院(浙江省肿瘤医院)郑亚兵教授,为我们深入剖析3大CDK4/6抑制剂一线治疗绝经后HR+/HER2-晚期乳腺癌的III期临床研究,破译“OS获益”的密码。
浙江省肿瘤医院
乳腺内科副主任 主任医师 硕士生导师
中国抗癌协会乳腺癌专业委员会 委员
中国抗癌协会乳腺肿瘤整合康复专业委员会 常委
长江学术带乳腺联盟(YBCSG)副主任委员
中国医药教育协会乳腺疾病专业委员会 委员
中华医学会肿瘤学分会乳腺肿瘤青年学组 委员
浙江省医师协会乳腺肿瘤专业委员会 常委
中国医药教育协会乳腺疾病专业委员会浙江分会 常委
浙江省转化医学学会精准医学分会 副会长
浙江省抗癌协会无呕管理专家组 副组长
浙江省数理医学学会乳腺肿瘤诊疗专业委员会 常委
浙江省数理医学学会循证医学专业委员会 常委
浙江省数理医学学会乳腺肿瘤诊疗专业委员会 常委
3大CDK4/6抑制剂OS结果尘埃落定,瑞波西利是唯一优胜者
2023年SABCS大会上,MONARCH 3研究的最终OS结果[1]正式公布。披露的数据显示,在中位随访时间8.1年时,与芳香化酶抑制剂(AI)单独治疗相比,阿贝西利联合AI一线治疗绝经后的HR+/HER2-晚期乳腺癌患者仅在数值上延长了OS。意向性治疗(ITT)组的mOS分别为66.8个月和53.7个月(HR=0.804,95%CI 0.637-1.015),OS改善13.1个月;在内脏疾病亚组中,mOS分别为63.7个月和48.8个月,OS改善14.9个月,然而遗憾的是,尽管获得了OS的延长,但差异未达到统计学显著性(P=0.0664)。根据之前公布的OS结果,曲线在前两年出现交叉,这次披露的KM曲线显示,随着更长的随访时间,两条曲线的分离程度并没有逐渐扩大。

图1. MONARCH 3研究最终分析结果OS数据
无独有偶,2022 ASCO大会公布的PALOMA-2研究OS结果[2]同样显示,与AI单独治疗相比,哌柏西利联合AI一线治疗绝经后的HR+/HER2-晚期乳腺癌仅在OS数值上显示出一定程度延长,但未达到统计学差异(单侧P值=0.3378)。在中位随访90个月时,两组的中位OS分别为53.9个月和51.2个月(HR=0.956,95%CI 0.777-1.177)。
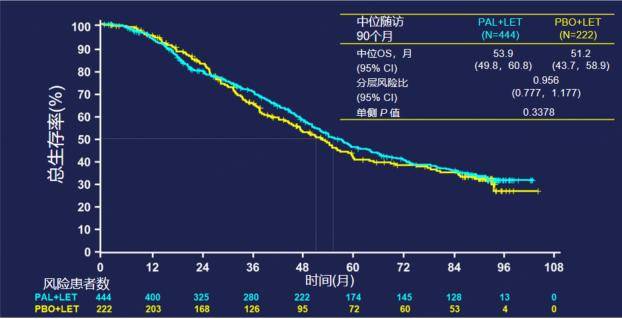
图2. PALOMA-2研究的OS更新结果
与前两者相比,2021年ESMO大会上MONALEESA-2研究的最终OS分析结果表明,瑞波西利联合AI一线治疗绝经后的HR+/HER2-晚期乳腺癌患者的mOS相较于安慰剂组显著延长12.5个月(63.9个月 vs 51.4个月),死亡风险降低24%(HR=0.76,95%CI 0.63-0.93,P=0.004)。并且随着治疗时间的推移,瑞波西利的OS获益逐渐增加,6年时瑞波西利组的OS率高于安慰剂组12.2%[3]。

图3. MONALEESA-2研究的最终OS结果
截至目前,3大CDK4/6抑制剂联合方案一线治疗绝经后HR+/HER2-晚期乳腺癌的OS结果均已公布。尽管同样是CDK4/6抑制剂联合治疗方案,取得了相似的PFS获益,但OS结果却大相径庭。即使MONARCH 3研究作为三者中最晚开展的III期临床研究,也未能从前两项临床研究中获取经验,改变OS结局。总之,目前唯有MONALEESA-2研究是首个且唯一一个在绝经后人群中展现出OS阳性结果的CDK4/6抑制剂。
深入挖掘,探究3大CDK4/6抑制剂的OS获益差别
众所周知,早期复发的乳腺癌患者预后较差,并且对一线治疗反应较差。尽管如此,MONALEESA研究[4]仍纳入了既往接受过(新)辅助内分泌治疗且无治疗间隔(TFI)≤12个月的患者,最终入组的668例患者中有18.4%为TFI≤12个月。与之相比,MONARCH 3研究[5]要求既往接受过(新)辅助内分泌治疗的患者,内分泌治疗结束后有至少12个月的TFI,即MONARCH 3研究仅纳入了内分泌敏感的HR+/HER2-乳腺癌患者。因此,MONALEESA-2研究较MONARCH 3研究纳入了更多TFI≤12个月、预后更差的患者。同时,与MONALEESA-2研究相比,PALOMA-2研究[6]也纳入了既往接受过(新)辅助内分泌治疗且TFI≤12个月的患者,两项研究的入组人群特征一致,但在一项基于PALOMA-2研究和MONALEESA-2研究的匹配调整间接比较(MAIC)分析[7]中,相比于PALOMA-2研究,MONALEESA-2研究的PFS(HR,=0.80,95% CI 0.58-1.1)具有数值的优势,而OS(HR=0.68,95% Cl 0.48-0.96,P=0.31)具有统计学的显著优势。因此,无论是相比于仅纳入内分泌敏感人群(TFI>12个月)的MONARCH 3研究,还是相比于纳入了继发性耐药人群的PALOMA-2研究,高比例的继发性耐药人群并未对MONALEESA-2研究的OS最终结果起到稀释作用,瑞波西利联合治疗方案的OS仍然实现显著获益。

图4. MONALEESA-2研究和PALOMA-2研究的MAIC分析
其次,与MONARCH 3研究纳入的内分泌敏感人群相比,MONALEESA-2研究在内分泌敏感人群的亚组分析同样有OS获益。2023 ESMO BC会议上公布了MONALEESA-2研究的亚组分析[8],其中排除了18.4%的TFI≤12个月的患者,共分析了545例内分泌敏感的患者,结果显示:瑞波西利组与安慰剂组的中位 PFS 分别为30.3个月 vs. 16.7个月(HR=0.57,95% CI 0.46-0.70;P < 0.001),中位OS 分别为69.2个月 vs. 54.3个月(HR=0.75,95% CI 0.60-0.93,P=0.005)。MONALEESA-2研究的内分泌敏感人群亚组PFS和OS分析结果与总人群获益一致,并且中位OS延长数值超过了总人群数据。
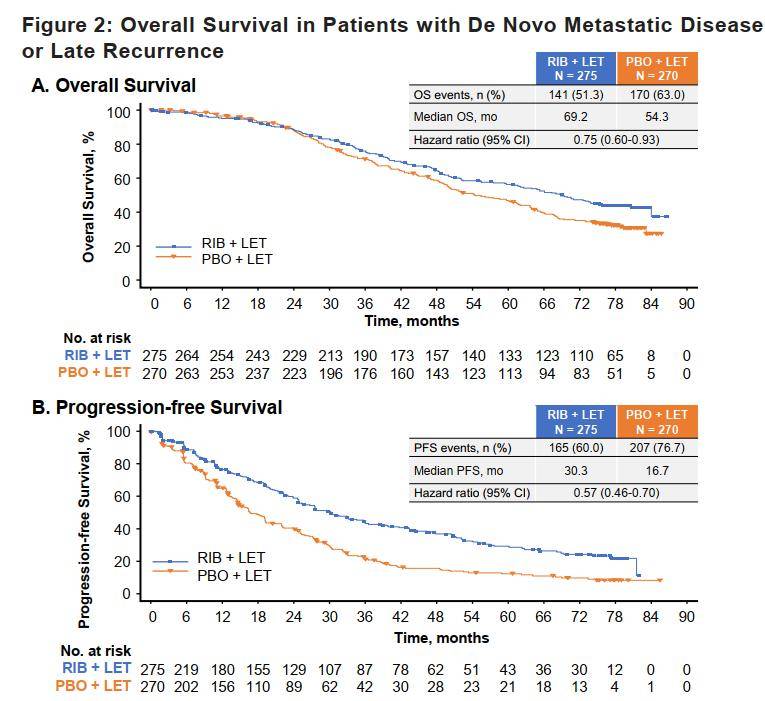
图5. MONALEESA-2试验内分泌敏感人群OS(A)和PFS(B)数据
另外,足够的样本量也是影响OS统计学效能的因素之一。在PALOMA-2研究(n=666)、MONAELEESA-2研究(n=668)和MONARCH 3研究(n=493)中,尽管MONACH 3研究的样本量最小,但一项以PFS为主要研究终点、OS为次要研究终点的试验通常会根据OS终点来确定试验规模,以减少OS受到研究样本量的限制。同时,以OS为终点的临床试验在初始的试验方案中就会预设在死亡事件数量达到多少时进行期中分析和最终分析,而数据成熟度越高,OS结果越稳健。本次MONARCH 3研究最终OS分析时,ITT人群中发生了315例死亡事件,OS成熟度达到60%以上,而MONALEESA-2研究和PALOMA-2研究的最新OS数据分析时,ITT人群分别发生了405例和400例死亡事件,OS成熟度同样在60%左右。因此,尽管MONARCH 3研究的样本量在上述3项临床研究中最小,但这并不足以影响MONARCH 3研究的最终OS结果分析。
最后,对于HR+/HER2-晚期乳腺癌患者而言,预期寿命比较长,平均会接受5-6线的治疗。因此,后线治疗也是影响OS结果因素之一。一方面,MONARCH-3研究中,阿贝西利组和对照组分别有7%和3%的患者仍在继续接受治疗,而MONALESSA-2研究中,瑞波西利组和对照组中分别有9%和5%的患者仍在继续接受治疗,两项研究继续接受治疗的患者比例相似。与MONAECH 3研究最终OS的8年随访时间相比,MONALEESS-2研究随访6.6年的OS并未受到后线治疗的稀释作用影响。另一方面,在后续的抗肿瘤治疗方案中,MONARCH3研究的阿贝西利组和对照组分别有12%和32%的患者在进展后接受了CDK4/6抑制剂治疗,而MONALEESA-2研究中,瑞波西利组和对照组分别有21.7%和34.4%的患者在进展后接受CDK4/6抑制剂治疗。MONALESSA-2研究无论是试验组还是对照组治疗进展后接受同类型的药物的患者比例均更多,但并未对瑞波西利联合治疗的方案的OS造成不利影响,OS获益依然稳固。
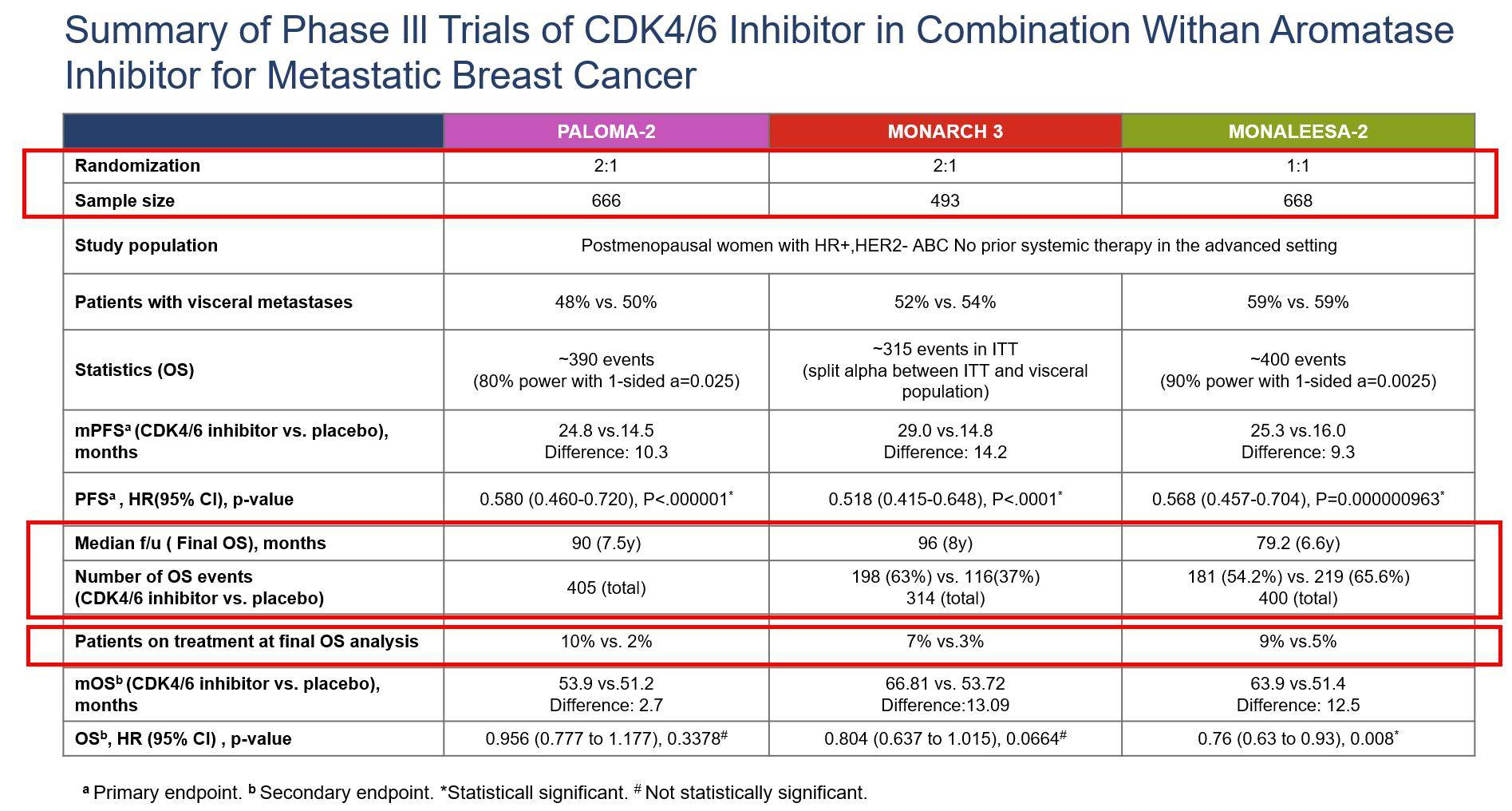
图6. 3大CDK4/6抑制剂的III期临床试验汇总
总体而言,3大CDK4/6抑制剂中,目前仅有瑞波西利取得显著的OS获益,究其原因还是基于瑞波西利的独特药物结构和作用机制。在目前已问世的多个CDK4/6抑制剂中,瑞波西利独有的二甲基酰胺结构减少对其它CDK的作用,几乎仅抑制CDK4与CDK6[9],并且对CDK4的抑制活性是CDK6的8倍[10]。瑞波西利对靶点的精准抑制和对CDK4的高抑制活性,有效避免了脱靶毒性,疗效更高,安全性更好。此外,研究发现瑞波西利可以通过诱导肿瘤向侵袭性较低的亚型转化来改变肿瘤生物学特性,增强内分泌治疗敏感性,提升患者预后[11-14]。因此,无论是在纳入了更多TFI≤12个月、预后更差的继发性耐药患者的ITT人群中,还是在内分泌敏感的同类型入组人群比较中,MONALEESA-2研究的OS均保持稳定一致的获益。
小结
3大CDK4/6抑制剂的一线治疗究竟能否为绝经后HR+/HER2-晚期乳腺癌患者带来真正的OS获益,随着MONARCH 3研究最终OS结果的公布而尘埃落定。MONALEESA-2研究无疑为CDK4/6抑制剂瑞波西利探索OS获益之路交出了一份亮眼的答卷。与此同时,值得注意的是,CDK4/6抑制剂二线治疗或后线治疗的中位PFS短于一线应用,并且CDK4/6抑制剂耐药后换用另一种CDK4/6抑制剂的治疗策略还有待商榷,因此临床实践中强调“好药先用“。此外,随着近日瑞波西利适应症正式纳入医保目录,无论是从总生存获益、生活质量改善还是药物可及性方面而言,瑞波西利均是我国绝经后HR+/HER2-晚期乳腺癌患者的优先推荐。
审批码KIS0015203-42580,有效期至2024-12-20,资料过期,视同作废
1. Matthew P, Masakazu T, Jens H, et al. 2023 SABCS. GS01-12.
2. Richard S, Hope S, Veronique C, et al. 2022 ASCO. LBA1003.
3. Hortobagyi GN, Stemmer SM, Burris HA, et al. N Engl J Med. 2022 Mar 10;386(10):942-950.
4. Janni w. et al. Breast Cancer Res Treat. 2018 Jun:169(3):469-479.
5. Goetz MP, et al. J clin Oncol. 2017 Nov 10:35(32):3638-3646
6. Finn RS, Martin M, Rugo HS, et al. N Engl J Med. 2016 Nov 17;375(20):1925-1936.
7. K. Jhaveri, et al. Matching adjusted indirect comparison of PFS & OS comparing ribociclib + letrozole vs palbociclib + letrozole as first-line treatment of HR+/HER2− ABC: Analysis based on updated PFS & final OS results of MONALEESA-2 & PALOMA-2. 2022 EBCC 3 Oral.
8. J. O'Shaughnessy, et al. 2023 ESMO BC. 196P.
9. Chen P, et al. Mol Cancer Ther. 2016 Oct;15(10):2273-2281.
10. Kim S, et al. Oncotarget. 2018;9(81):35226-35240.
11. Prat A, et al. Clin Cancer Res. 2023 Nov 8.
12. Cejalvo JM. Cancer Res. 2017;77(9):2213-2221.
13. Jørgensen CLT. Cancers. 2021;13(7):1592.
14. Aftimos P, et al. Cancer Discov. 2021;11:2796-2811.
排版编辑:肿瘤资讯-Raffle











 苏公网安备32059002004080号
苏公网安备32059002004080号


