妊娠期乳腺癌作为一种特殊的疾病类型,给患者和医生带来了许多挑战。在妊娠期间,乳腺组织的生理变化使得肿瘤不易早期发现,一旦发现时肿块通常较大或伴有淋巴结转移。同时,由于妊娠期乳腺癌在临床表现、治疗及预后方面具有其独特性,如何在治疗过程中保护胎儿是另一个关键因素。因此,确定合适的治疗方案一直存在着一些争议。【肿瘤资讯】特此邀请广东省妇幼保健院分享一例孕晚期确诊的HER2+乳腺癌伴腋窝淋巴结转移的病例。经综合治疗后,患者成功实现胎儿的顺利分娩以及病情的有效控制。此分享案例为临床医生在处理妊娠期乳腺癌问题提供了有益的临床借鉴和参考。同时,张安秦教授也对此病例进行了深入点评,为医生们提供了更全面、深入的解读和思考。
希望这次分享和点评能为临床医生在处理妊娠期乳腺癌问题上提供更多的启示和思考。
专家介绍
广东省妇幼保健院乳腺中心主任
中国妇幼保健协会乳腺保健专业专家委员会副主任委员
广东省胸部疾病学会乳腺病防治专委会主任委员
广东医学会乳腺病分会副主任委员
广东省医师协会乳腺专科医师工作委员会副主任委员
中国抗癌协会第一届肿瘤整形专业委员会委员
在国内外专业杂志发表论文20余篇
获得广东省科技进步三等奖一项
专家介绍
广东省妇幼保健院乳腺科主治医师、硕士研究生
广东省妇儿健康联盟乳腺疾病防治专科联盟秘书
广东省胸部疾病学会乳腺病防治专业委员会常任委员兼秘书长
广东省医疗行业协会乳腺病整形修复管理分委会委员
个人擅长:乳腺癌筛查、乳头溢液乳管镜检查、乳腺钙化灶活检、乳腺肿瘤微创手术、乳腺癌综合诊治。
发表SCI及核心期刊论文数篇
病史简介
患者女性,38岁,妊娠29+1w。
主诉:因“发现右乳肿物10余天,穿刺示癌3天”入院。
既往史、个人史、家族史:无特殊。
月经婚育史:末次月经2022.04.29,G2P1宫内妊娠29+1w单活胎。
乳腺专科查体:右乳外上可触及一肿块,大小约2.5x3.5cm,边界不清,活动度一般,质稍硬,压痛(-)。右侧腋窝淋巴结触及肿大淋巴结,1.5x1.0cm,边界清,活动度可,质硬,无融合。
乳腺超声:右乳腺内可见1个不规则形低回声区,大小约2.6x3.4cm(10点钟处,距乳头4.5cm),边缘模糊,内部回声不均匀;右侧腋窝见1个肿大淋巴结回声,大小约1.7x0.8cm。印象:右乳腺BI-RADS分级6级;右侧腋窝淋巴结转移可能。
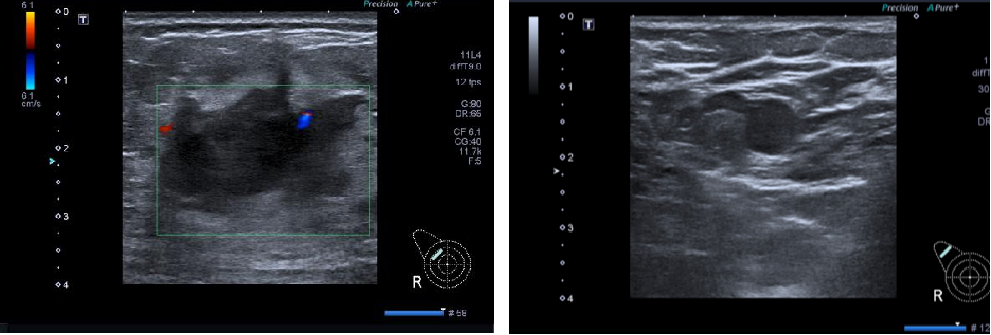
图1.乳腺超声
胸部X线、腹部超声、心脏超声:未见明显异常
血常规、肝肾功能、电解质、血脂、空腹血糖、凝血功能、感染四项、肿瘤标记物:基本正常
病理会诊:(右乳穿刺标本)少许乳腺组织呈浸润性癌改变,组织学分级Ⅱ级。免疫组化:ER(中-强, 约90%+),PR(弱, 约60%+),HER-2(3+),CK5/6(-), p53(约60%+),AR(90%+),Ki-67(约40%+)。
右腋窝淋巴结细针穿刺病理:涂片见少量核大深染异型细胞,考虑为癌细胞。
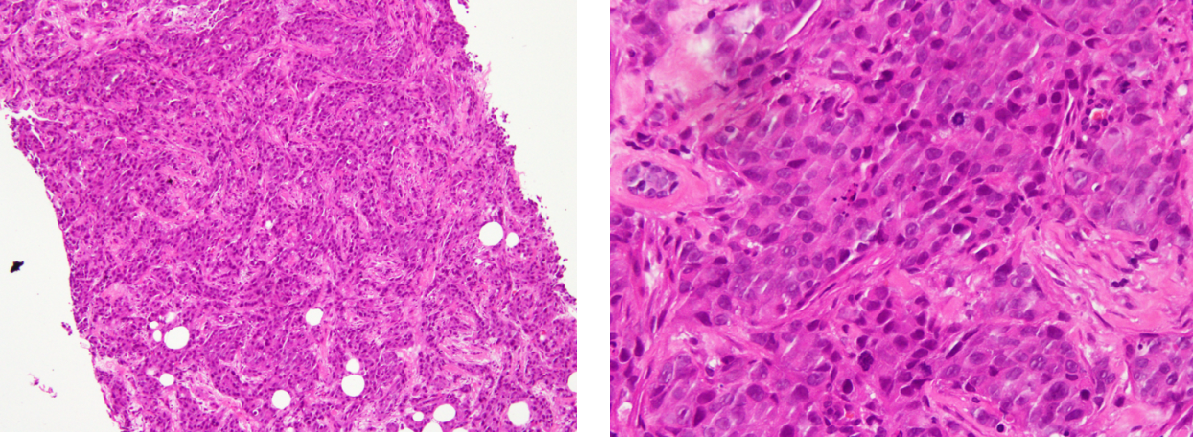
图2.肿块穿刺病理
产科超声:BPD 89mm,HC308mm,AC314mm,FL65mm,宫内妊娠,单活胎;脐动脉血流频谱正常范围。
胎儿生物物理相评分:胎儿超声四项生物物理评分总分8分(呼吸、胎动、肌张力、羊水各2分)。
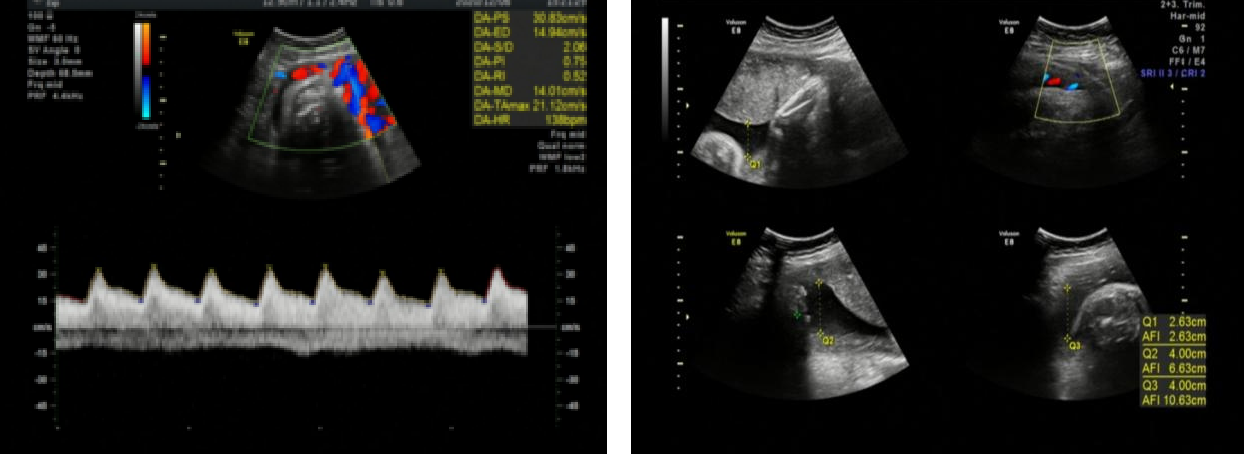
图3.产科超声
临床诊断:1.右乳浸润癌 cT2N1M0 IIB期 HER-2阳性(HR阳性)型 2.G2P1宫内妊娠29+1w单活胎
治疗方案:予右乳肿物及腋窝淋巴结各放置标记夹1枚,EC-THP新辅助化疗
产前:2022.11.24-2023.01.06 EC*3(表柔比星160mg+环磷酰胺1g)
分娩:2023.01.20妊娠37+2w行剖宫产术顺利产下一活婴
产后:2023.01.28-2023.04.30 EC*1(表柔比星150mg+环磷酰胺0.9g)-THP*4(紫杉醇脂质体300mg+曲妥珠单抗(首剂8mg/kg,后续6mg/kg)+帕妥珠单抗(首剂840mg,后续420mg)
分娩后补充检查:
2023.01.25胸腹部CT平扫+增强:右乳外上象限不规则肿块,符合乳腺Ca改变;胸3、6椎体、右侧股骨颈基底部及粗隆间骨质破坏区,不除外转移可能;双肺部及腹部未见明显异常。
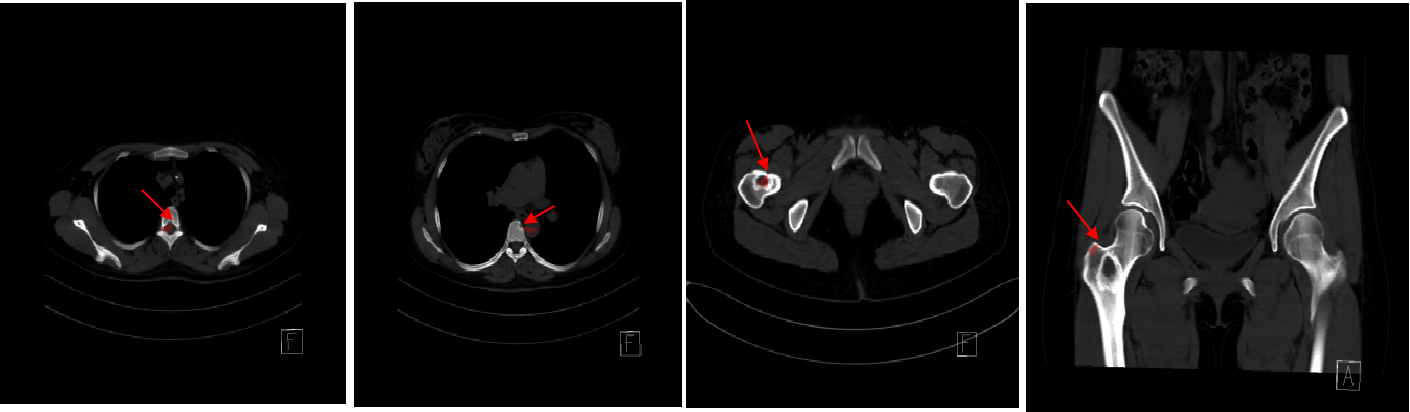
图4. 胸腹部CT平扫+增强
2023.01.25全身骨扫描:右侧股骨颈结节状放射性浓缩影,请结合相关其他检查,不除外骨转移可能;余骨未见明显异常。
2023.01.26行右股骨病灶活检病理:穿刺组织可见软骨、髓质骨及部分造血成分,未见明显异常。
新辅助治疗疗效评价:PR
乳腺B超: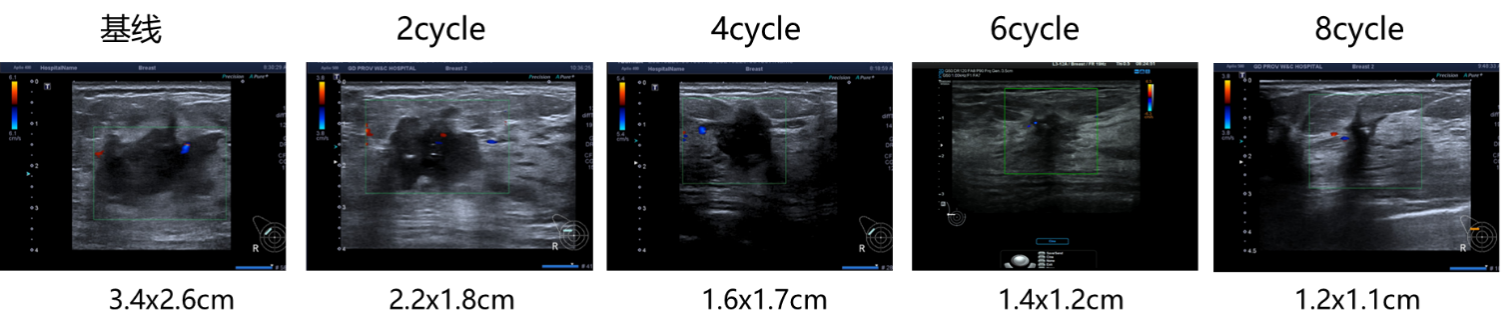
图5.乳房病灶
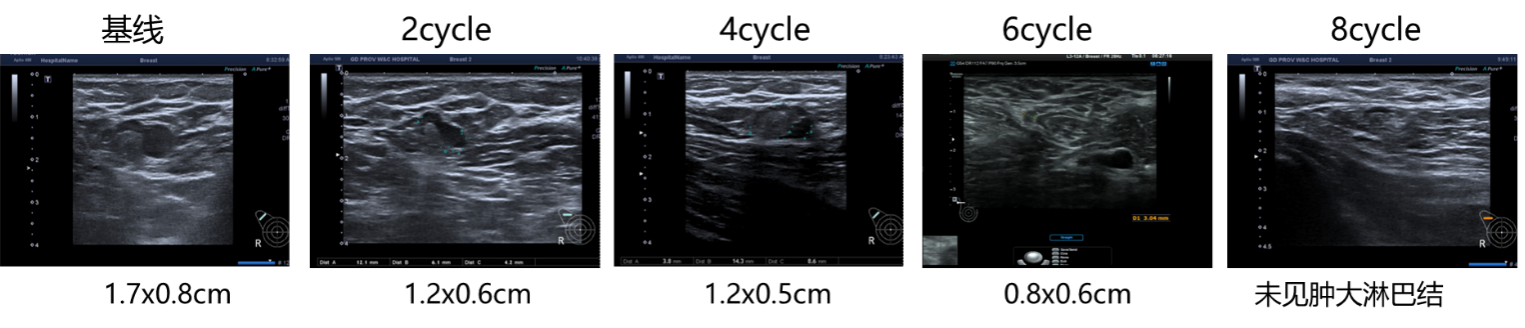
图6. 腋窝淋巴结
2023.05.17乳腺X线:
右乳外上周围腺体结构纠集,呈毛刺状,大小约1.78cm×1.02cm,局部可见标记夹,双腋下可见多个小淋巴结影,右乳BI-RADS 6级。
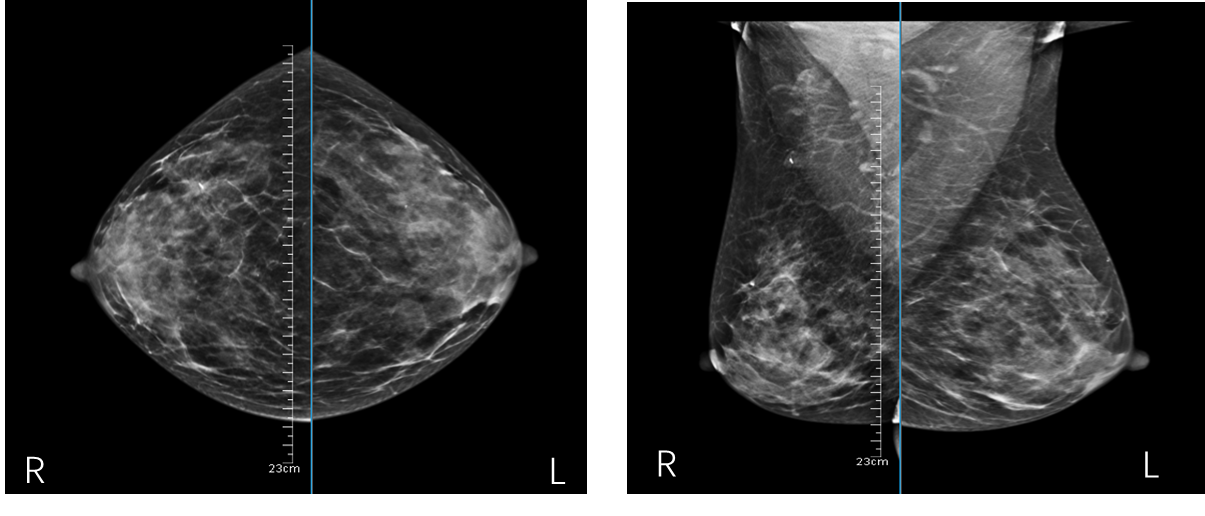
图7.新辅助化疗后乳腺X线
2023.05.18乳腺MRI平扫+增强:
右乳外上象限于10点处见多个不规则形结节状异常信号影,病灶较大者约1.5×1.0cm;双侧腋下可见多发小淋巴结,短径约0.7cm。右乳BIRADS分级6级。
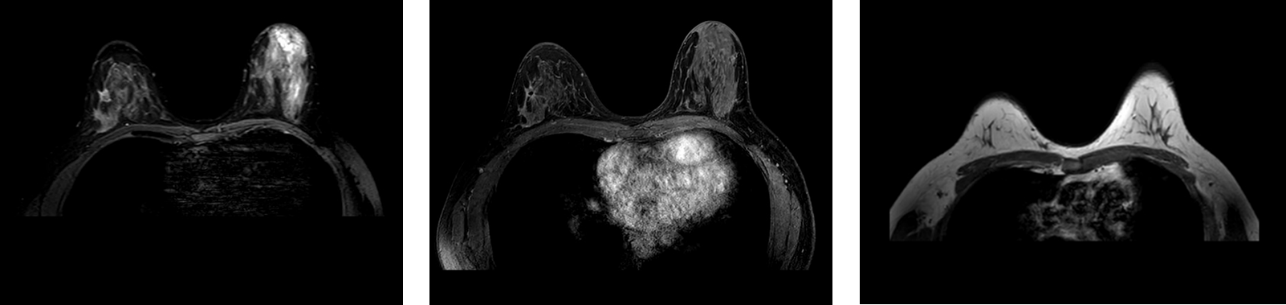
图8. 新辅助化疗后乳腺MRI
2023.05.18胸腹部CT:胸3、6椎体、右侧股骨颈基底部及粗隆间骨质异常基本同前。
手术治疗:2023.05.20全麻下行右乳癌保乳术+右侧前哨淋巴结活检术。保乳采用容积替代,用肩胛下血管前降支穿支血管组织瓣转移保乳。
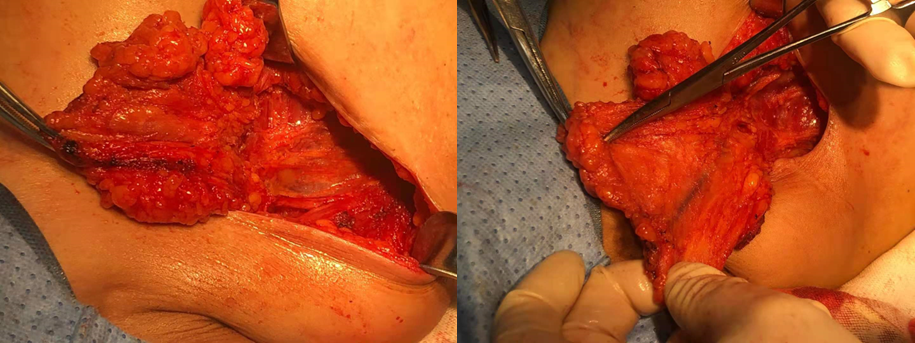
图9.右乳癌保乳术+右前哨淋巴结活检术+组织瓣转移
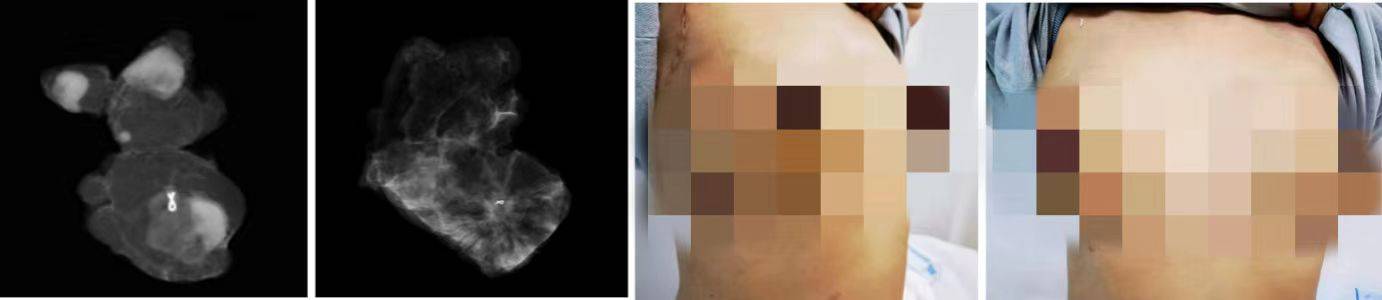
图10. 肿块影像;保乳术后观
术后病理:乳腺浸润性癌新辅助治疗后:(右乳肿块)乳腺组织,仍见少量浸润性癌,肿瘤细胞呈散在簇状或单个细胞,范围3mm,局部见高级别导管原位癌,间质纤维化伴淋巴细胞及组织细胞浸润及胆固醇结晶,化疗反应MP分级4级。免疫组化:浸润性癌ER(中等强度,约90%),PR(弱, 约5%+),HER-2(3+), Ki-67(<1%+)。(右乳前哨)淋巴结未见癌转移(0/4),其中一枚淋巴结伴治疗后改变。

图11.术后病理
术后诊断:右乳浸润性导管癌 ypT1aN0M0 IA期 HER-2阳性(HR阳性)
术后辅助治疗方案:1.放疗 2.恩美曲妥珠单抗强化治疗 3.戈舍瑞林+依西美坦内分泌治疗
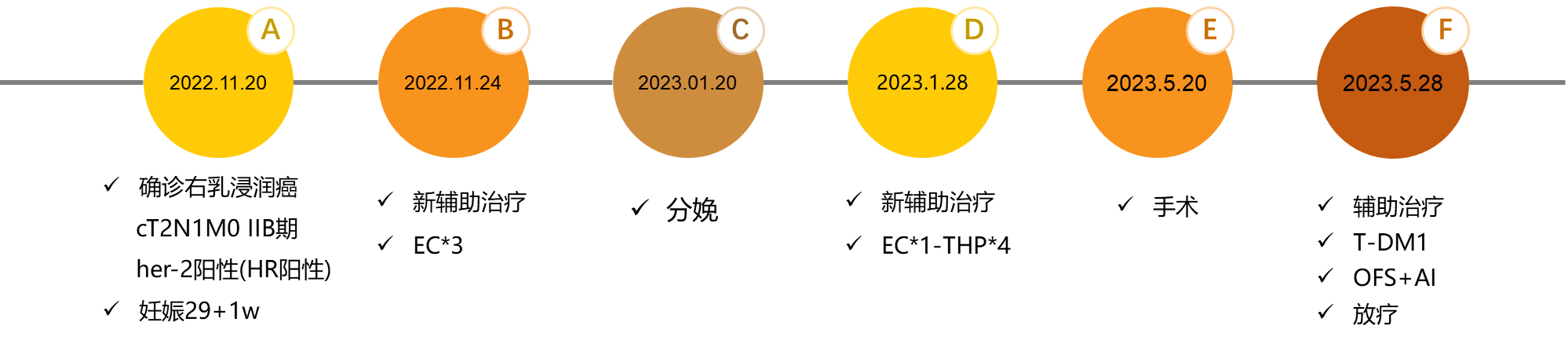
图12.治疗过程小结
妊娠相关乳腺癌的临床特征
妊娠相关乳腺癌(PABC)定义为妊娠期间或产后一年内诊断出的乳腺癌[1]。越来越多的证据支持将妊娠期乳腺癌与产后期乳腺癌视为独立且不同的乳腺癌,因为两种乳腺癌的生物学特征和预后有所不同。产后期乳腺癌与妊娠期乳腺癌相比,生存率较低且转移风险增加两倍以上[2]。临床病理特征层面,一些研究调查了妊娠和年轻非妊娠乳腺癌患者之间的差异,发现两组的组织学分级和亚型一致。在基因组水平上,常见的体细胞突变(例如,TP53、PIK3CA等)在妊娠和年龄匹配的非妊娠乳腺癌患者之间似乎也相当[3]。预后层面,2022年比利时鲁汶大学肿瘤学系一项研究总共纳入了662名妊娠和2081名非妊娠乳腺癌患者,通过Cox 比例风险回归比较了两组患者接受化疗后的DFS和OS,接受标准化疗的妊娠期乳腺癌患者与非妊娠患者的预后相似[4]。2023年4月6日《JAMA Oncology》发表的一篇数据回顾则给出了不同的结论,在怀孕或产后1年诊断乳腺癌的患者5年生存率更低,怀孕期间为(87%;95% CI,84%-89%),产后1年为(89%;95% CI,88%-90%),而远离妊娠的肿瘤患者为(93%;95% CI,92%-93%)。对于乳腺癌,与非怀孕期间确诊的癌症相比,妊娠相关癌症的1年和5年生存率都较低[5]。
妊娠相关乳腺癌治疗策略
根据2022NCCN指南,妊娠期乳腺癌最佳局部治疗和全身治疗的考虑和选择与非妊娠相关乳腺癌推荐类似[6],结合目前对T≥2cm或LN+的HER2+患者进行新辅助治疗的推荐,本例患者首选新辅助治疗。关于妊娠期乳腺癌治疗方案的选择,2022NCCN指南认为:妊娠中晚期乳腺癌可考虑术前化疗或乳腺癌手术;阿霉素、环磷酰胺、氟尿嘧啶的组合方案在妊娠期乳腺癌中经验较多;紫杉类药物在妊娠期安全数据不足;妊娠期禁用抗HER-2治疗[6]。妊娠期乳腺癌不推荐使用抗HER-2治疗的原因是胎儿肾脏上皮细胞高表达HER-2,妊娠期抗HER-2治疗最常见不良反应(33%)是羊水过少和无羊水,停药后这些不良反应通常会有所缓解,然而大部分的患者发生早产,4例新生儿死于早产并发症(主要为呼吸衰竭)[7]。

图13.2022NCCN指南妊娠期乳腺癌治疗策略
关于妊娠期乳腺癌化疗时机及药物选择,2020中国妊娠相关乳腺癌临床诊疗专家共识给出了如下推荐[8]。本例患者29+1W,符合孕晚期,可以接受化疗,药物选择上蒽环类、紫杉类、环磷酰胺均相对安全,铂类因能穿过胎盘屏障,存在胎儿生长受限、致畸的风险。

图14. 2020中国妊娠相关乳腺癌临床诊疗专家共识
关于化疗期间辅助用药,Loibl S等在2015年的JAMA Oncol也总结了相关注意事项[9]。
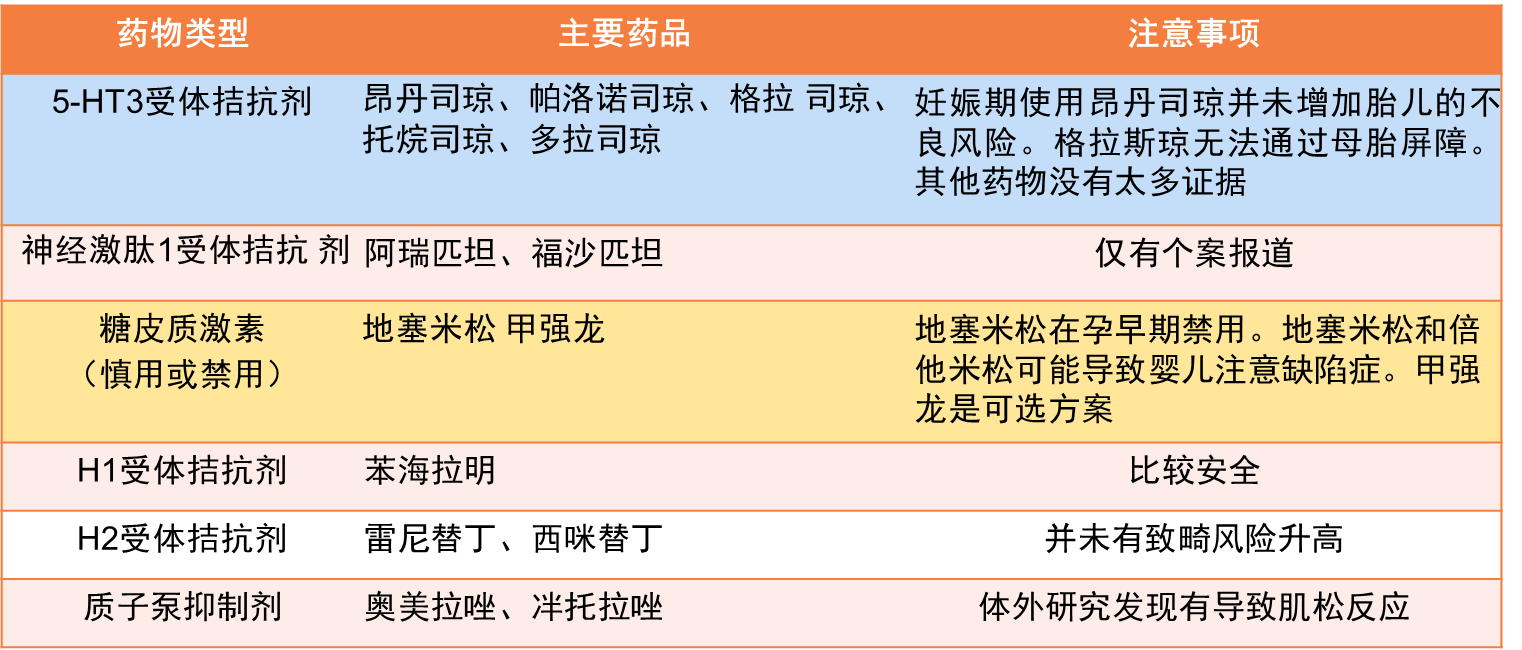
图15. 妊娠期化疗辅助用药注意事项
综上,团队为避免妊娠期间卡铂及抗HER-2治疗的使用,为患者制定了相应治疗方案,分娩前使用相对安全的EC方案,待分娩后序贯THP。
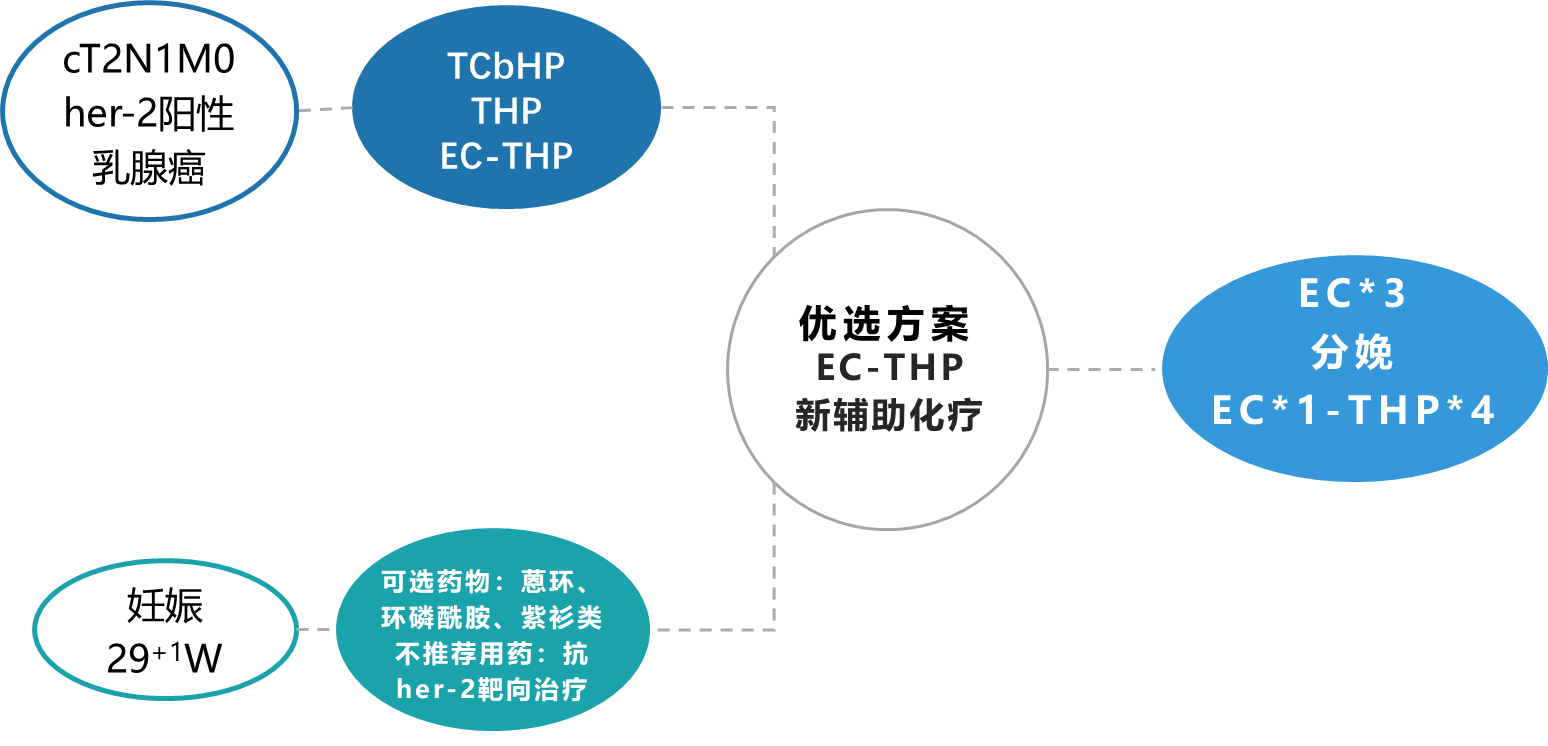
图16. 治疗方案设计思路
T-DM1在HER2阳性乳腺癌新辅助治疗non-PCR的后续辅助治疗中具有重要作用
在本例患者的术后辅助治疗中,团队除了常规放疗和内分泌治疗,还为该患者选择了恩美曲妥珠单抗强化治疗,这也是患者实现良好临床结局的原因之一。根据2023CSCO指南,新辅助抗HER2治疗无论单用H还是联合使用HP,non-PCR患者的术后辅助治疗T-DM1均为I级推荐。
此前,KATHERINE研究已确立了T-DM1在HER2阳性新辅助靶向治疗后辅助治疗中的地位,发现新辅助靶向治疗未达pCR患者辅助T-DM1治疗相较于单用曲妥珠单抗可获益[10]。而于近期圆满落幕的2023年第46届圣安东尼奥乳腺癌会议(SABCS)上,KATHERINE研究进一步公布了最终iDFS和OS更新结果,结果发现,T-DM1组的7年iDFS绝对获益13.7%,OS绝对获益4.7%,疗效与安全性均令人惊艳,为新辅助治疗后仍有残存病灶(non-pCR)的HER2阳性乳腺癌辅助治疗给予了一个铿锵有力的回答。期待乳腺癌相关领域临床医生与时俱进地学习、掌握前沿研究进展,将疗效、安全性双佳的管理方法进一步应用于临床,让我国更多乳腺癌患者获益。
*请上下滑动填写
[1] Amant F, Loibl S, Neven P, Van Calsteren K. Breast cancer in pregnancy. Lancet 2012; 379 (9815):570-579.
[2] Lancet Oncol. 2021 Jun 1;22(6):753-754.
[3] Azim HA, Jr., Brohee S, Peccatori FA et al. Biology of breast cancer during pregnancy using genomic profiling. Endocr Relat Cancer 2014; 21 (4): 545-554.
[4] Amant Frédéric,Nekljudova Valentina,Maggen Charlotte et al. Outcome of breast cancer patients treated with chemotherapy during pregnancy compared with non-pregnant controls.[J] .Eur J Cancer, 2022, 170: 54-63.
[5] Long-term Mortality in Individuals Diagnosed With Cancer During Pregnancy or Postpartum.JAMA Oncol.April 6, 2023.
[6]Breast Cancer During Pregnancy-NCCN Guidelines Version 2.2022.
[7] Flora Zagouri,et al. oncology 2013.
[8]《2020中国妊娠相关乳腺癌临床诊疗专家共识》
[9] Loibl S et al. JAMA Oncol 2015; 1: 1145-53.
[10] VON Minckwitz G, et al. NEJM, 2019, 380(7): 617-28.
排版编辑:肿瘤资讯-Awa












 苏公网安备32059002004080号
苏公网安备32059002004080号


