本期精选5篇在2023年11月份发表的结直肠癌领域文献,部分研究邀请到郑州大学第一附属医院宗红教授进行深入解读。
专家介绍
郑州大学第一附属医院 肿瘤内科
主任医师 教授 医学博士 肿瘤科一病区主任
中国老年学和老年医学学会精准医疗分会常务委员
中国医师协会肿瘤医师分会乳腺癌学组委员
中国研究型医院学会乳腺癌专业委员会常务委员
中国抗癌协会肿瘤麻醉与镇痛专业委员会委员
河南省研究型医院学会分子肿瘤专委会主任委员
河南省消化医学会大肠癌精准治疗专委会主任委员
河南省医学会肿瘤医学分会会副主任委员
河南省抗癌协会大肠癌专业委员会副主任委员
更新ESMO转移性结直肠癌生活指导原则中关于晚期结直肠癌三线治疗的治疗建议1
指南更新建议:对于接受氟尿嘧啶、奥沙利铂、伊立替康和生物制剂预治疗的患者,或在奥沙利铂和伊立替康方案失败后仍处于早期治疗线的患者,推荐使用曲氟尿苷替匹嘧啶(TAS-102)联合贝伐珠单抗[Ⅰ,A;ESMO-MCBS v1.1评分:4](如图1所示)。
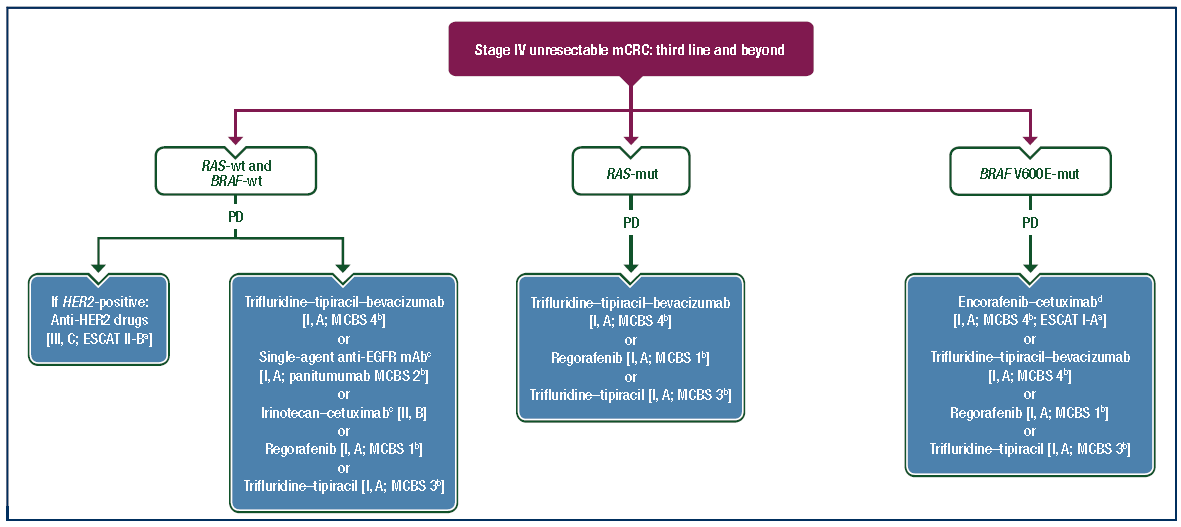
图1:IV期不可切除的mCRC:三线及以上治疗
使用TAS-102联合贝伐珠单抗作为转移性结直肠癌(mCRC)的三线治疗方案:
在III期SUNLIGHT试验中,mCRC患者接受TAS-102联合贝伐珠单抗治疗相比于接受TAS-102单药治疗改善了无进展生存期(PFS)(HR为0.44,95%置信区间(CI)为0.36-0.54,P < 0.001)和总生存期(OS)(HR 0.61,95%CI 0.49-0.77,P < 0.001)。该研究纳入的患者既往接受过不超过两种化疗方案治疗,既往治疗必须包括氟尿嘧啶、伊立替康、奥沙利铂、抗血管内皮生长因子(VEGF)单克隆抗体或抗表皮生长因子受体(EGFR)单抗,如果在治疗期间或最后一次给予新辅助或辅助治疗后6个月内疾病复发,上述治疗可以包括新辅助或辅助化疗。
在TAS-102联合贝伐珠单抗组和TAS-102组中,分别有72.4%和69.5%的患者报告了≥3级AE。两组中最常见的AE为中性粒细胞减少症、恶心和贫血。TAS-102联合贝伐珠单抗组比TAS-102组更常见的AE为高血压(10.2%vs 2.0%)、恶心(37.0%vs 27.2%)和中性粒细胞减少症(62.2%vs 51.2%),包括重度(≥3级)中性粒细胞减少症(分别为43.1%和32.1%)。该试验中导致治疗终止的AE在两组中相似,未报告治疗相关死亡。此外,TAS-102联合贝伐珠单抗组中患者的ECOG体能状态衰退出现在第9.3个月,TAS-102组中的衰退则出现在第6.3个月(HR 0.54,95%CI 0.43-0.67)。TAS-102联合贝伐珠单抗最近获得欧洲药品管理局(EMA)批准,同时ESMO-临床获益规模量表(ESMO-MCBS)v1.1评分获得了4分,这些均表明该方案的实质性临床获益。
宗红教授:基于III期SUNLIGHT临床研究[6]主要终点:TAS-102+贝伐珠单抗vs.贝伐珠单抗组的中位OS分别为10.8个月vs. 7.5个月,具有统计学意义(P<0.001),TAS-102联合贝伐珠单抗被FDA批准用于既往接受过以氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗、抗VEGF生物治疗,以及如果RAS为野生型,则接受过抗EGFR治疗的转移性结直肠癌(mCRC),TAS-102联合贝伐珠单抗已成为难治性转移性CRC三线及以上治疗的有效选择之一,近日ESMO指南更新了对于该治疗方案的推荐。纵观目前晚期肠癌后线治疗方案:瑞戈非尼、呋喹替尼、TAS-102±贝伐珠单抗、西妥昔单抗±伊立替康、雷替曲塞等各具特点,西妥昔单抗联合伊立替康[7]再挑战具有较高的ORR(21%),而其它治疗方案[8-10]在4%~6.3%之间,因此抗EGFR单抗联合伊立替康三线再挑战可快速缩小肿瘤负荷,减轻患者症状,且在RAS/BRAF野生型患者中的再挑战取得了12.5个月的OS、4.0个月的PFS,延长了患者生存时间;而TAS-102联合贝伐珠单抗无论患者的RAS突变情况、肿瘤位置和既往贝伐珠单抗治疗情况,稳定改善患者预后[6],因此是难治性转移性CRC的后线治疗选择之一。在西妥昔单抗联合伊立替康的基础上联合免疫治疗在一些小样本的研究中看到了具有前景的结果,ORR可达36.4%,OS可达17个月以上[11],但仍需III期研究进一步证实疗效,以期改变患者在后线常常面临无药可用的困境。
贝伐珠单抗可降低密码子特异性对曲氟尿苷/替吡嘧啶治疗转移性结直肠癌结局的影响2
根据分子分型导向疗法改变了mCRC的治疗模式。近来有研究认为mCRC中最常见的RAS突变KRAS G12是TAS-102疗效的阴性预测标志物。当TAS-102与贝伐珠单抗联合使用时,阴性预测性是否仍然存在尚不明确。该研究在真实世界中描述了RAS突变状态与TAS-102+贝伐珠单抗疗效之间的关系。纳入的患者来自奥地利的5个癌症中心,在各个治疗线接受过TAS-102+贝伐珠单抗治疗且具有可查询的分子检测信息的患者均有资格参加研究。通过查询病历回顾性地收集数据。生存数据比较分析采用log-rank检验。几个设定的协变量采用多变量Cox回归模型分析。
123例mCRC患者被纳入该研究中。研究结果显示,RAS野生型(WT)队列的中位OS为9.63个月(95% CI,8.055-13.775个月),RAS突变型队列的中位OS为8.78个月(95% CI,8.055-11.014个月),它们高度相似。这在校正了潜在混杂因素的多变量模型中也得到了证实[HR:1.05(95% CI,0.618-1.785;P = 0.857)]。此外,未观察到KRAS G12状态对患者预后的影响,具体而言,KRAS G12突变患者的OS为8.88个月(95%CI 7.332-12.921个月),RAS WT/无KRAS G12突变患者的OS为9.47个月(95%CI 8.088-11.375个月)[HR:0.822(95%CI 0.527-1.282;P = 0.387)](如图2所示)。

图2:(A)Kaplane Meier曲线展示了总人群中KRAS G12突变vs RAS WT/无KRAS G12突变的OS差异、(B)RAS MT人群中KRAS G12突变vs无KRAS G12突变的OS差异以及(C)KRAS外显子2突变人群中KRAS G12突变vs无KRAS G12突变的OS差异。
该项真实世界研究表明FTD/TPI+贝伐珠单抗的有效性与RAS突变状态无关,因此贝伐珠单抗可能会减轻FTD/TPI单药治疗KRAS G12突变患者潜在的疗效限制。
宗红教授:在这项研究中KRAS G12突变患者的OS为8.88个月,RAS WT或非KRAS G12突变患者的OS为9.47个月,与SUNLINGHT研究KRAS G12研究结果一致,再次表明无论是否存在RAS或KRAS G12突变均不影响TAS-102联合贝伐珠单抗的疗效,为KRAS G12突变mCRC患者提供了一种治疗选择。也是基于SUNLIGHT研究结果的亚组分析,多项指南推荐TAS-102联合贝伐珠单抗用于RAS突变型晚期肠癌三线及以上的治疗。G12突变约占所有KRAS突变的65%,G12D和G12V是最常见的G12突变,G12C突变发生比例较低[18]。目前KRAS G12C位点突变肠癌的治疗取得长足进步,2023年ESMO报道了首个KRAS G12C突变晚期肠癌的大型III期研究:Codebreak300研究[12]提示sotorasib,960mg剂量组联合帕尼单抗组的中位PFS为5.6个月,ORR 26%,OS数据尚未成熟,此研究有望改写KARS G12C突变肠癌治疗的指南。KRYSTAL-1研究[13]也于年初登顶2023《新英格兰医学杂志》西妥昔单抗联合adagrasib的PFS 6.9个月,OS 13.4个月,ORR 46%,MAPK信号通路上多靶点的精准阻断或是KRAS G12C突变mCRC的最佳治疗方式。在≥二线的KRAS G12C突变型mCRC中评估adagrasib+西妥昔单抗对比化疗的全球、开放标签、随机Ⅲ期试验KRYSTAL-10研究[14]正在进行中。
抗表皮生长因子受体治疗NeoRAS野生型转移性结直肠癌:2例病例报告3
NeoRAS现象被定义为mCRC患者接受全身化疗后肿瘤的RAS状态从突变型(MT)转变为野生型(WT)的现象。西妥昔单抗作为一种抗EGFR抗体,在RAS WT mCRC患者中有效,但在RAS MT mCRC患者中效果不显著;然而在NeoRAS野生型mCRC患者中西妥昔单抗的疗效尚不清楚。
该研究团队报告了2例抗EGFR单抗治疗有效的NeoRAS WT mCRC病例。第1例为40岁男性患者,直肠乙状结肠癌伴腹膜转移。首次基于肿瘤组织学的RAS检测为KRAS G12C突变,经过两线化疗后,通过液体活检评估,该突变转为RAS WT。开始伊立替康联合西妥昔单抗治疗后,计算机断层扫描(CT)显示恶性腹水已消退(如图3所示),4个月后患者因疾病进展停止治疗。第2例为68岁男性患者,乙状结肠癌伴肝转移。首次基于肿瘤组织学的检测报告为KRAS G12D突变,经6线化疗后,液体活检未检测到突变。开始西妥昔单抗单药治疗,肝转移灶明显缩小(如图4所示)。患者继续西妥昔单抗单药治疗8个月,无疾病进展。
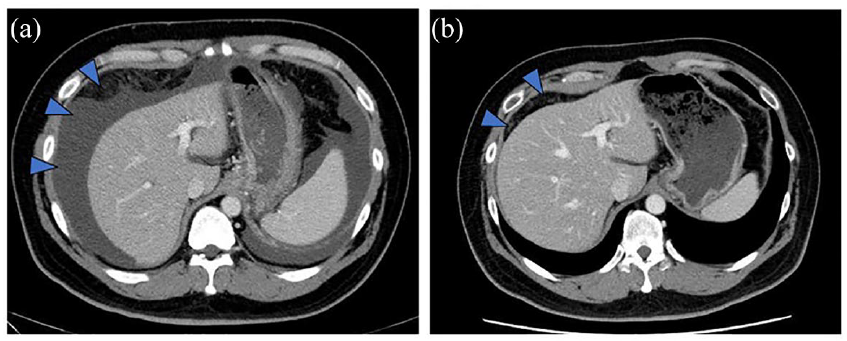
图3:(a)伊立替康联合西妥昔单抗给药前的CT扫描,(b)治疗2个月后CT扫描显示腹水(箭头指示)消失
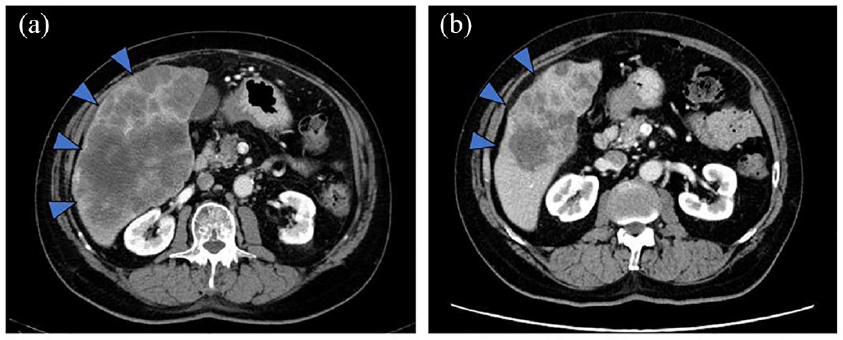
图4:(a)西妥昔单抗单药治疗给药前的CT扫描,(b)治疗3个月后CT扫描显示肝转移(箭头指示)明显缩小
这些病例证明了抗EGFR单抗治疗对NeoRAS WT mCRC的疗效,同时突出了在整个临床过程中监测基因突变谱对最佳治疗选择的重要性。
宗红教授:NeoRAS是指初始RAS突变患者在接受标准治疗后RAS突变清除的现象,即RAS突变状态转化为RAS野生型现象被称为“NeoRAS”。癌症的进化总是受到微环境施加的选择压力的影响,特别是在结直肠癌中,RAS突变体和RAS野生型细胞总是在同一肿瘤微环境中以一种平衡的方式共存,争夺空间和资源。突然改变癌症微环境的特定选择压力可以解释 RAS 突变体和 RAS 野生型克隆在疾病过程中出现和灭绝的速率,此现象越来越受到临床医生的关注。RAS突变患者预后很差,在治疗过程中如能转换成RAS野生型,此类患者的预后优于始终保持RAS突变的患者,出现NeoRAS的患者mOS与RAS WT患者相近,为31.4个月vs NR(P =0.906),而维持RAS MT的患者mOS为14.5个月(P=0.006)[15]。在既往相关研究中可以看到NeoRAS的发生率在10.7%至83.3%[3]之间;RAS野生型“窗口”的出现,主要见于贝伐珠单抗治疗的患者[16],2023ASCO SCRUM-Japan GOZILA研究中NeoRAS转移性结直肠癌患者在logistic回归多变量分析中,没有肝转移、没有淋巴结转移、除KRAS外显子2以外的其他组织RAS MT与NeoRAS WT的出现显著相关[17],以上这些人群可能是NeoRAS候选者的“肖像”;且通过治疗过程中的连续监测发现NeoRAS主要发生在接受治疗后的前6个月[16]。先前的一些报道和这项研究均再次提示出现NeoRAS WT 的mCRC患者可能从抗EGFR单抗治疗中获益[15],因此在整临床过程中捕获基因突变谱对最佳治疗选择非常重要。
抗TGF-β单抗NIS793联合spartalizumab治疗成人晚期肿瘤患者的I/Ib期、开放标签、多中心、剂量递增试验4
NIS793是一种与转化生长因子β(TGF-β)结合的人IgG2单克隆抗体。本研究是探索NIS793联合spartalizumab治疗晚期实体瘤的第一项体内研究。患者接受NIS793(0.3-1 mg/kg,每3周一次)单药治疗;在完成两次用药并进行评估后,继续递增NIS793 + spartalizumab(NIS793 0.3-30 mg/kg Q3W+spartalizumab 300 mg Q3W或NIS793 20-30 mg/kg,每2周一次+spartalizumab 400 mg,每4周一次)的剂量。在剂量扩展部分,推荐扩展剂量(RDE)被用于PD-L1耐药的非小细胞肺癌(NSCLC)患者或微卫星稳定结的直肠癌(MSS-CRC)患者的治疗。
60例患者接受了剂量递增治疗,其中11例接受了NIS793单药治疗,49例接受了NIS793+spartalizumab治疗。60例患者接受了剂量扩展治疗(MSS-CRC:n = 40;NSCLC:n = 20)。未观察到剂量限制性毒性。RDE确定为NIS793 30 mg/kg(2100 mg)+spartalizumab 300 mg Q3W。共有54例患者(49.5%)发生了≥1级治疗相关不良事件,最常见的是皮疹(n = 16;13.3%)、瘙痒(n = 10;8.3%)和疲乏(n = 9;7.5%)。共3例患者为部分缓解,其中1例为肾细胞癌患者(治疗剂量NIS793 30 mg/kg Q2W + spartalizumab 400 mg Q4W),另外2例在MSS-CRC扩展队列。生物标志物数据揭示了该药物通过增加TGF-β/NIS793复合物以及清除外周血中活化的TGF-β实现靶向治疗的证据(如图5所示)。肿瘤组织的基因表达分析也显示出TGF-β靶基因和相关特征性基因的减少以及免疫相关特征性基因的表达增加。该晚期实体瘤患者的研究证实了靶向结合以及抑制TGF-β通路是NIS793药物作用的机制。
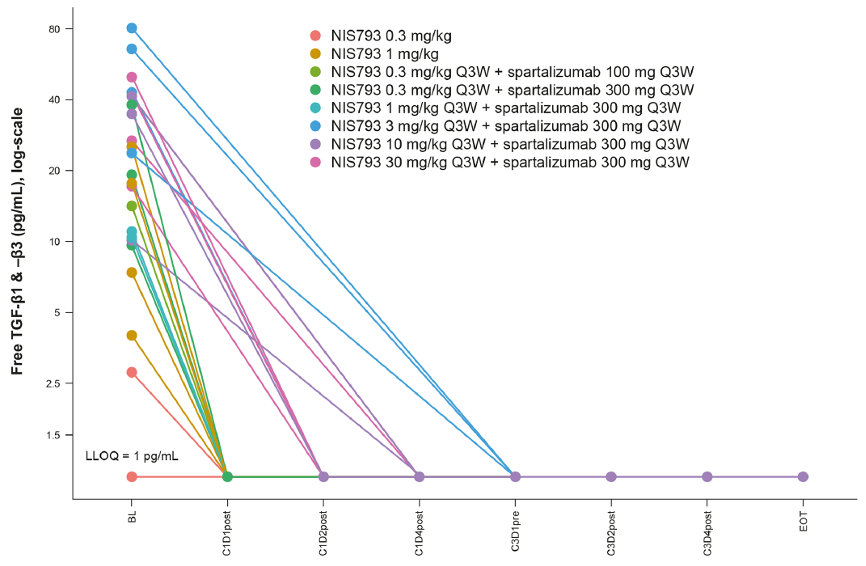
图5:在NIS793初始给药前,除1例患者外其余所有患者均检测到活化的TGF-β1及其3个配体。NIS793给药后,检测到所有血清样本均低于定量限,证明游离的、有活性的TGF-β被很大程度上减少
局部晚期结肠癌患者腹腔热灌注辅助化疗(COLOPEC):一项随机多中心试验的5年结果5
辅助腹腔热灌注化疗(HIPEC)是否可以预防高危结肠癌根治性手术后的腹膜转移,一直存在争议。随机多中心COLOPEC试验揭示了随访5年的肿瘤学结局,该试验纳入了临床或病理学分期为T4N0-2M0或伴有穿孔的结肠癌患者,并随机(1:1)分配至全身化疗序贯辅助HIPEC组(N = 100)或单独辅助全身化疗组(N = 102)。HIPEC的治疗操作是在原发灶切除后的同时(9%)或5~8周内(91%),采用奥沙利铂一次性给药(460 mg/m2,30 min,42 ℃,同步氟尿嘧啶/亚叶酸静脉注射)。
根据意向治疗原则分析临床结局,COLOPEC试验中纳入的所有202例患者的长期数据均可用于分析,中位随访时间为59个月(IQR,54.5个月~64.5个月)。结果显示全身化疗序贯辅助HIPEC组与单独辅助全身化疗组患者的5年总生存率无显著差异(69.6% vs 70.9%,log-rank;P=0.692,如图6A所示)。5年腹膜转移率分别为63.9%和63.2%(P=0.907),5年无病生存率(DFS)分别为55.7%和52.3%(log-rank;P=0.875,如图6B所示)。未发现生活质量结局的差异。该研究表明,辅助HIPEC仍应仅在试验环境中开展。
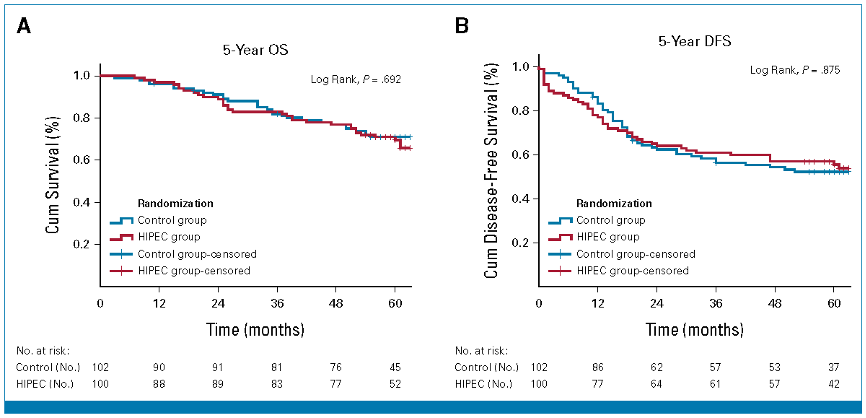
图6:全身化疗序贯辅助HIPEC组与单独辅助全身化疗组患者的5年OS(A)和5年DFS(B)
本期看点:
1、2023 ESMO指南更新关于转移性结直肠癌三线治疗的建议:对于接受氟尿嘧啶、奥沙利铂、伊立替康和生物制剂预治疗的患者,或在奥沙利铂和伊立替康方案失败后仍处于早期治疗线的患者,推荐使用曲氟尿苷替匹嘧啶(TAS-102)联合贝伐珠单抗。
2、一项真实世界研究探索了KRAS G12突变是否是TAS-102联合贝伐珠单抗治疗的疗效阴性预测标志物。研究表明TAS-102+贝伐珠单抗的有效性与RAS突变状态无关,贝伐珠单抗可能会减轻FTD/TPI单药治疗KRAS G12突变患者潜在的疗效限制。但对于KRAS G12C突变mCRC患者,MAPK信号通路上多靶点的精准阻断或是最佳治疗方式。
3、一篇case report通过2个典型病例展示了西妥昔单抗对NeoRAS WT患者的有效治疗,同时突出了在整个临床过程中持续监测基因突变谱对最佳治疗选择的重要性。
4、一项在包括结直肠癌在内的晚期实体瘤患者中开展的I/Ib期新药研究,未观察到抗TGF-β单抗NIS793联合spartalizumab的剂量限制性毒性并确定了推荐扩展剂量,此外还揭示了靶向结合以及抑制TGF-β通路是NIS793药物的作用机制。
5、一项随机多中心研究(COLOPEC),通过分析5年生存率、5年腹膜转移率等数据评估了辅助HIPEC在预防高危结肠癌根治性手术后腹膜转移中的意义,结果未发现辅助HIPEC具有显著疗效获益。
1. Cervantes A, Martinelli E; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Updated treatment recommendation for third-line treatment in advanced colorectal cancer from the ESMO Metastatic Colorectal Cancer Living Guideline. Ann Oncol. Published online November 9, 2023.
2. Doleschal B, Taghizadeh H, Lentner T, et al. Bevacizumab mitigates codon-specific effects of trifluridine/tipiracil on efficacy outcome parameters in metastatic colorectal cancer. ESMO Open. Published online November 15, 2023.
3. Harada K, Yuki S, Kawamoto Y, et al. Anti-epidermal growth factor receptor treatment for patients with NeoRAS wild-type metastatic colorectal cancer: a case report of two cases. Ther Adv Med Oncol. 2023;15:17588359231216090.
4. Bauer TM, Santoro A, Lin CC, et al. Phase I/Ib, open-label, multicenter, dose-escalation study of the anti-TGF-β monoclonal antibody, NIS793, in combination with spartalizumab in adult patients with advanced tumors. J Immunother Cancer. 2023;11(11):e007353.
5. Zwanenburg ES, El Klaver C, Wisselink DD, et al. Adjuvant Hyperthermic Intraperitoneal Chemotherapy in Patients With Locally Advanced Colon Cancer (COLOPEC): 5-Year Results of a Randomized Multicenter Trial. J Clin Oncol. Published online November 3, 2023.
6. Prager GW, Taieb J 1, Fakih M, et al; SUNLIGHT Investigators. Trifluridine-Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med. 2023 May 4;388(18):1657-1667;
7. Cremolini C, Rossini D, Aquila ED,et al. Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan. JAMA Oncol. 2019;5(3):343-350
8. Li J, Qin SK, Xu RH, et al. Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2015;16:619–629
9. Li J, Qin SK, Xu RH, et al. Effect of Fruquintinib vs Placebo on Overall Survival in Patients With Previously Treated Metastatic Colorectal Cancer: The FRESCO Randomized Clinical Trial. JAMA. 2018 Jun 26;319(24):2486-2496.
10. Xu JM, Kim TW, Shen L, et al. Results of a Randomized, Double-Blind, Placebo-Controlled, Phase III Trial of Trifluridine/Tipiracil (TAS-102) Monotherapy in Asian Patients With Previously Treated Metastatic Colorectal Cancer: The TERRA Study.J Clin Oncol, 2018 Feb 1;36(4):350-358
11. Xu XJ, Yu YY, Wang Y,Efficacy and safety of tislelizumab plus cetuximab and irinotecan in patients with previously treated RAS wild-type advanced colorectal cancer: A phase II, single-arm study.2023 ASCO GI, abs125
12. Pietrantonio F, Salvatore L, Esaki T, et al. Sotorasib plus panitumumab versus standard-of-care for chemorefractory KRAS G12C-mutated metastatic colorectal cancer (mCRC): CodeBreak 300 phase III study. 2023 ESMO LBA10,
13. Yaeger R, Weiss J , Pelster MS, et al. Adagrasib with or without Cetuximab in Colorectal Cancer with Mutated KRAS G12C.N Engl J Med 2023;388:44-54.
14. https://classic.clinicaltrials.gov/ct2/show/NCT04793958
15. Wang F, Huang YS, Wu XH, et al. Genomic temporal heterogeneity of circulating tumour DNA in unresectable metastatic colorectal cancer under first-line treatment. Gut. 2022 Jul;71(7):1340-1349
16. Nicolazzo C, Belardinilli F, Vestri A, et al. RAS Mutation Conversion in Bevacizumab-Treated Metastatic Colorectal Cancer Patients: A Liquid Biopsy Based Study. Cancers 2022, 14, 802
17. Osumi I, Shinozaki E, Nakamura Y,et al. NeoRAS wild-type metastatic colorectal cancer in the SCRUM-Japan GOZILA study.2023ASCO Abs3506
18. Parikh K, Banna G, Liu SV, et al. Drugging KRAS: current perspectives and state-of-art review.J Hematol Oncol 15, 152 (2022)
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


