2023年12月13日,国家医疗保障局公布2024国家医保目录结果。诺华凯丽隆®(琥珀酸瑞波西利片)成功纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2024年版)》乙类范围,成为我国第四款列入国家医保目录的CDK4/6抑制剂。与其他CDK4/6抑制剂不同的是,瑞波西利是首个医保适应证覆盖了绝经前/围绝经期、绝经后人群一线治疗的CDK4/6抑制剂,这将进一步为广大的中国乳腺癌患者带来更长的生存获益和更好的生活质量。
在此瑞波西利纳入医保,惠及更多乳腺癌患者之际,【肿瘤资讯】特邀中国医科大学附属第一医院金锋教授分享瑞波西利获批对临床诊疗格局的影响,并对未来指南更新进行展望。
中国医科大学附属第一医院乳腺外科主任
辽宁省抗癌协会乳腺癌专业委员会主任委员
辽宁省医学会乳腺外科分会主任委员
中华医学会肿瘤分会乳腺肿瘤学组副组长
中国抗癌协会乳腺癌专业委员会副主任委员
中国临床肿瘤学会CSCO-BC常务委员
中华医学会外科分会乳腺外科学组委员
中国老年学学会乳腺癌分委会副主任委员
北京乳腺病防治学会外科专委会副主任委员
辽宁医学会外科分会乳腺外科学组组长
乳腺癌治疗新时代,应以“患者为中心”,实现药物疗效与安全性并重
随着CDK4/6抑制剂成为HR+/HER2-晚期乳腺癌的标准一线治疗方案,其临床应用越加广泛,不良反应管理也越来越受到关注。2021年国家药品监督管理局品审评中心 (CDE)颁布《以临床价值为导向抗肿瘤药物临床研发的指导原则》1,其中指出“药物研发应以患者需求为导向”,不良反应不仅会影响患者的治疗依从性增加其治疗负担、影响其生活质量,同时还可能由于患者无法耐受药物的不良反应,导致药物减量或治疗终止,影响患者的最终疗效,或者使患者失去治疗机会。因此,《以临床价值为导向抗肿瘤药物临床研发的指导原则(2021版》和《患者报告结局 (PRO)在药物临床研发中应用的知道原则(试行)(2022版)》2均鼓励在临床上使用患者报告结局数据评估癌症患者的生活质量。其中,脱发、皮肤改变、虚弱/疲劳、腹泻、恶心呕吐、疼痛、动/静脉血栓、肌肉痛、关节痛等常见的可感知不良反应是以患者为中心的PRO评价的核心因素,可直接影响患者生活质量及治疗依从性3。
一项关于影响晚期乳腺癌患者生活质量不良反应调查的真实世界研究4显示,一半以上的晚期乳腺癌患者即使在治疗有效的情况下,也不愿意忍受疲劳、疼痛、腹泻和食欲不振等不良反应。与此同时,部分CDK4/6抑制剂因不良事件导致的停药发生率高,且随着年龄增长递增严重影响治疗进程。MONARCH 3研究5中阿贝西利因不良事件导致的停药率可达25%,而PALOMA-2研究6中哌柏西利的停药率可达10%,并且针对接受阿贝西利治疗的老年HR+/HER2-晚期乳腺癌患者的真实世界研究7显示,随着患者年龄增长因阿贝西利不良事件停药发生率逐渐升高,在18-49岁的患者组为19%,而在75~84岁的患者组可达48%。根据《中国晚期HR+/HER2-乳腺癌疾病负担与生活质量调研白皮书》8的真实世界调研结果提示,停药事件可能影响患者的无疾病进展生存期(PFS)和总生存(OS)获益,其中自行减量/断药患者一线平均用药时长为10.2个月,相较于足量服用患者足足减少了5.8个月。因此,在CDK4/6抑制剂的靶向治疗时代,如何双重保障HR+/HER2-晚期乳腺癌的疗效和安全性至关重要。
重新定义HR+/HER2-晚期乳腺癌的总生存期和生活质量改善,瑞波西利联合方案树立一线治疗新标杆
MONALEESA-7 是首个评估CDK4/6抑制剂在绝经前/围绝经期 HR+/HER2-晚期乳腺癌患者中疗效和安全性的随机 III 期试验,也是首个证实CDK4/6抑制剂一线联合治疗能带来具有统计学意义的OS和生活质量改善的研究。在MONALEESA-7试验9中,晚期未接受内分泌治疗的患者以1:1的比例被随机分配至瑞波西利组或安慰剂组。结果显示,中位随访53.5个月后,瑞波西利组和安慰剂组的中位OS分别为58.7个月和48.0个月,瑞波西利组可降低死亡风险24%(HR=0.76,95% CI 0.61-0.96)(图1)。此外,MONALEESA-7研究的亚洲数据10提示,瑞波西利联合方案可相较于安慰剂组提高亚洲绝经前患者的中位无进展生存期近3倍,降低疾病进展/死亡风险53%(中位PFS:30.4个月 vs 11.0个月,HR=0.67,95%CI 0.448-1.009),并且瑞波西利可显著改善绝经前患者的生活质量,推迟患者健康相关生活质量恶化的时间(35.8个月 vs 23.3个月,HR=0.67,95%CI 0.52-0.86),显著延长疼痛、情绪功能、社会功能和身体功能至明确恶化时间11,12。同时,接受瑞波西利的绝经前患者因不良反应导致的停药率(4%)较低,每日一次的给药方式也更便捷。因此,瑞波西利联合内分泌治疗在欧洲肿瘤内科学会-临床获益量表(ESMO-MCBS)中得到了满分5分的评价13。MONALEESA-7研究的成功是乳腺癌领域的一个重要里程碑,其填补了绝经前/围绝经期乳腺癌患者的临床空白,并且在取得总生存统计学意义的同时,也为患者的生活质量保驾护航。
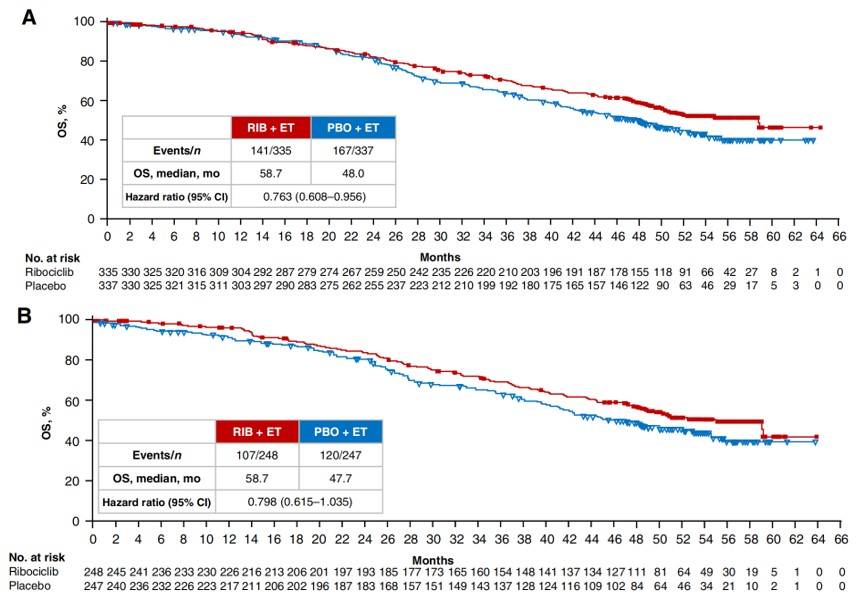
图1. MONALEESA-7研究OS结果. (A) ITT人群;(B)瑞波西利+NSAI+戈舍瑞林亚组
与此同时,尽管目前一系列III期临床试验证实CDK4/6抑制剂对绝经后HR+/HER2晚期乳腺癌患者具有明确的治疗获益。然而,除了MONALEESA-2研究外,大部分CDK4/6抑制剂在绝经后患者的一线治疗研究中尚无OS获益结果。瑞波西利是唯一一个在绝经后HR+/HER2-晚期乳腺癌的III期临床研究中取得显著OS获益的CDK4/6抑制剂。MONALEESA-2研究的最终OS分析结果14显示,中位随访80个月后,瑞波西利联合内分泌一线治疗HR+/HER2-晚期乳腺癌中位OS长达63.9个月,相比安慰剂组延长超过12个月,相对死亡风险降低24%(HR=0.76,95% CI 0.63–0.93, P=0.008)(图2),而在新发转移或晚期复发([新]辅助治疗无治疗间期[TFI]> 12个月)患者中,瑞波西利联合内分泌治疗的中位OS长达69.2个月,相比安慰剂组延长14.9个月,相对死亡风险降低25%(HR=0.75,95% CI 0.60-0.93,P = 0.005)15。而且瑞波西利联合内分泌治疗方案可延迟至化疗时间超过4年以上(HR=0.69,95%CI 0.56-0.87),有效维持绝经后患者的生活质量16。
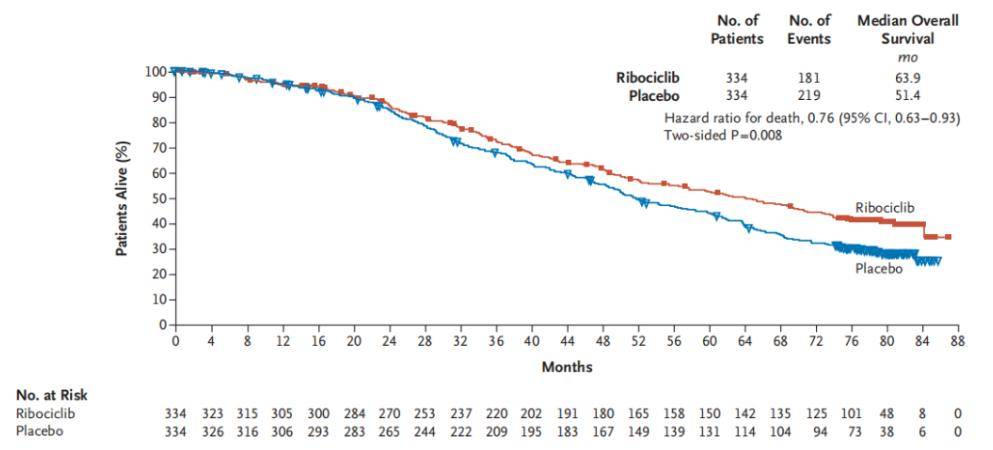
图2. MONALEESA-2研究OS结果
总而言之,瑞波西利是目前首个获批绝经前/围绝经期、绝经后晚期乳腺癌的CDK4/6抑制剂,也是所有III期试验中获得OS和生活质量双重获益的CDK4/6抑制剂,为广大中国HR+/HER2-晚期乳腺癌患者带来治疗新希望。
展望CDK4/6抑制剂一线新格局,期待指南更新指导临床实践
基于瑞波西利在HR+/HER2-晚期乳腺癌一线治疗的OS显著获益和良好的安全性,目前《中国晚期乳腺癌规范诊疗指南(2022版)》17将瑞波西利联合内分泌治疗列为HR+/HER2-晚期乳腺癌一线治疗的1A级推荐,2023 CSCO乳腺癌诊疗指南18首次入选瑞波西利作为HR+/HER2晚期乳腺癌的1类II级推荐,2023年NCCN BC V1版指南19对于CDK4/6抑制剂联合芳香化酶抑制剂一线治疗方案推荐中,仅有瑞波西利为唯一1类证据推荐,而阿贝西利、哌柏西利均为2A类证据。
与此同时,2023年瑞波西利已相继获中国国家药品监督管理局(NMPA)批准了两项适应症,分别为联合内分泌治疗和黄体生成素释放激素(LHRH)激动剂用于绝经前/围绝经期HR+/HER2-晚期乳腺癌一线治疗,以及与芳香化酶抑制剂联合用于绝经后HR+/HER2-晚期乳腺癌一线治疗,这使得瑞波西利成为国内首个在晚期乳腺癌一线治疗领域覆盖绝经前/围绝经期、绝经后人群的CDK4/6抑制剂。此外,随着此次2024国家医保目录结果公布,瑞波西利成功纳入医保,无疑将进一步提升新型高质量靶向治疗药物的可及性,并降低中国乳腺癌患者的疾病负担,让更多乳腺癌患者用得起好药、新药,获得更长的生存和更高的生活质量。
作为目前国内最权威、最规范的乳腺癌指南之一,中国抗癌协会乳腺癌专业委员会(CBCS)《乳腺癌诊治指南与规范》自2007年发布以来,一直致力于紧跟新药的发展和新的诊疗领域的变化,为广大医师提供了操作性便捷、实用性强的临床诊疗方案,同时助力广大医师更快地洞察到目前最新的乳腺癌诊疗进展。目前,在HR+/HER2-晚期乳腺癌治疗领域,CBCS指南20推荐CDK4/6抑制剂联合内分泌方案用于一线治疗,但尚未明确不同CDK4/6抑制剂的优先推荐级别,而随着瑞波西利在中国获批相关适应症,其作为目前唯一OS获益且生活质量改善的CDK4/6抑制剂,以及成功纳入医保后可及性大大提高,期待新一版本的CBCS指南中能够进一步为不同CDK4/6抑制剂的选择提供更多参考意见,帮助临床医生更好地选择用药方案。
总结
随着创新药物的更新迭代,诸如CDK4/6抑制剂的出现,为HR+/HER2-晚期乳腺癌提供了更多的选择。目前,CDK4/6抑制剂联合内分泌治疗方案已成一线标准治疗方案,获得国内外指南的一致推荐,而瑞波西利作为CDK4/6抑制剂中的翘楚者,进一步延长乳腺癌患者的生存时间和改善患者生活质量,并且性价比高,大大降低用药门槛,提高了药物的可及性,为中国乳腺癌患者带来切实惠利。因此,瑞波西利已成为CDK4/6抑制剂一线治疗新标杆,同时也期待瑞波西利可及性提升可以推动指南更新,指导CDK4/6抑制剂临床实践。
审批码KIS0014714-41577,有效期至2024-12-12,资料过期,视同作废
1.国家药品监督管理局药品评审中心.《以临床价值为导向抗肿瘤药物临床研发的指导原则》.2021
2.国家药品监督管理局药品评审中心.《患者报告结局 (PRO)在药物临床研发中应用的知道原则(试行)》. 2022
3.Basch E, et al. J Natl Cancer Inst. 2014 Sep 29;106(9):dju244.
4.Cardoso F, et al. 2022 ESMO 178P
5.Johnston S, et al. NPJ Breast Cancer. 2019 Jan 17;5:5.
6.Rugo HS, et al. Breast Cancer Res Treat. 2019 Apr;174(3):719-729.
7.Ring A, et al. Drugs Real World Outcomes. 2023 Sep 29.
8.《中国晚期HR+/HER2-乳腺癌疾病负担与生活质量调研白皮书》
9.Lu YS, et al. Clin Cancer Res. 2022 Mar 1;28(5):851-859.
10.Y. Lu, et al. ESMO Asia Virtual Congress 2020. 47MO
11.Harbeck N, et al. Ther Adv Med Oncol. 2020 Jul 26;12:1758835920943065.
12.Harbeck N, et al. SABCS 2019; abstract P1-19-06.
13.ESMO Magnitude of Clinical Benefit Scorecard. ESMO-MCBS v1.1. https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-scorecards/scorecard-158-1
14.Hortobagyi GN, et al. N Engl J Med. 2022 Mar 10;386(10):942-950.
15.Hortobagyi GN et al. ESMO 2021. abstract LBA17_PR.
16.Lu YS, et al. Clin Cancer Res. 2022 Mar 1;28(5):851-859.
17.《中国晚期乳腺癌规范诊疗指南(2022版)》
18.《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2023版)》
19.《NCCN Guidelines Version 1.2023 Breast Cancer》
20.中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2022年版)[J].中国癌症杂志,2021,31(10):954-1040.
排版编辑:肿瘤资讯-Raffle











 苏公网安备32059002004080号
苏公网安备32059002004080号


