2023年ESMO会议已经结束,在结直肠癌领域中有多项重磅研究发布,主要探索方向包括一线转化治疗、免疫治疗、BRAF突变治疗、KRAS突变治疗以及后线治疗等,其中探索KRASG12突变型转移性结直肠癌(mCRC)治疗的CodeBreak300研究受到了广泛关注。【肿瘤资讯】特邀天津医科大学肿瘤医院邓婷教授对CodeBreak300研究结果做分享解读。
天津医科大学肿瘤医院消化肿瘤内科
中国抗癌协会肿瘤支持治疗专委会常务委员
中国抗癌协会CMUP专委会常务委员
中国抗癌协会化疗专委会/胃癌专委会委员
中国抗癌协会肿瘤药物临床研究专委会委员
天津抗癌协会肿瘤营养与支持治疗专委会主任委员
北京癌症防治学会结直肠癌专委会副主任委员 CSCO青年专家委员会常务委员
研究简介
Codebreak300[1]是一项全球多中心、随机、开放标签的III期临床研究(NCT05198934),纳入既往未接受过KRASG12C抑制剂治疗的KRASG12C突变型化疗难治性mCRC患者,以1:1:1的比例随机分配接受Sotorasib 960mg每日一次+帕尼单抗(960mg Sotorasib–帕尼单抗组)、Sotorasib 240mg每日一次+帕尼单抗(240mg Sotorasib–帕尼单抗组),或研究者选择的曲氟尿苷-替匹嘧啶或瑞戈非尼(研究者选择组)(图1)。根据既往是否使用抗血管生成治疗(是 vs. 否)、从转移性疾病初次诊断至随机化的时间(≥18个月 vs. <18个月)和ECOG体能状态评分(0或1 vs. 2)对随机化进行分层。主要终点是由盲态独立中心审查(BICR)根据RECIST v1.1评估的无进展生存期(PFS)。次要终点是总生存期(OS)和客观缓解率(ORR)。
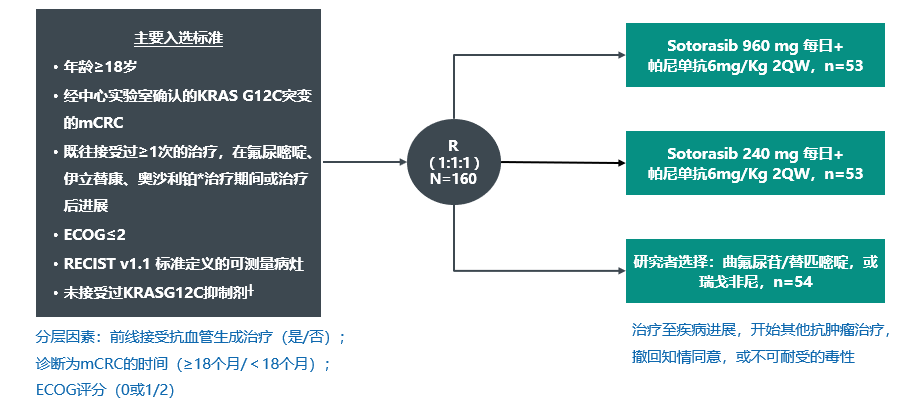
图1:研究设计
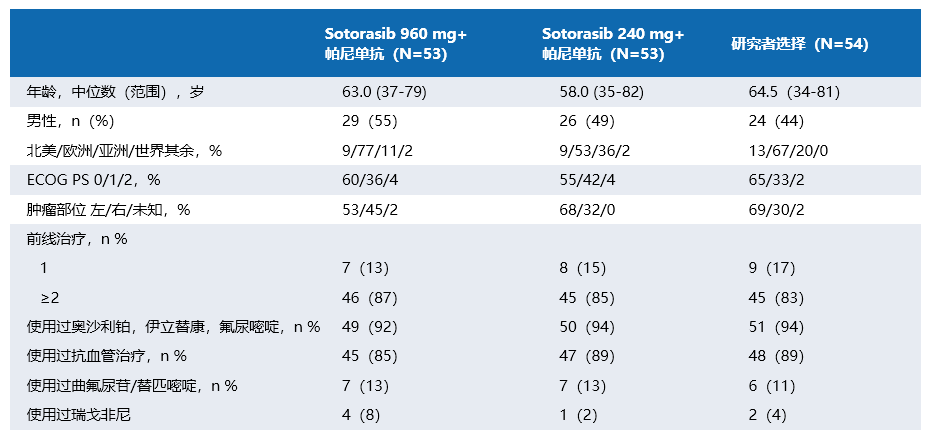
基线特征在组间大致平衡(表1),960mg Sotorasib-帕尼单抗组中右半肿瘤患者占比为45.3%,这一比例高于240mg Sotorasib-帕尼单抗组的32.1%和研究者选择组的29.6%。
表1:基线特征
中位随访时间为7.8个月,与研究者选择的治疗相比,Sotorasib(960mg和240mg)联合帕尼单抗均显著延长了经BICR评估的PFS。960mg Sotorasib–帕尼单抗组和240mg Sotorasib–帕尼单抗组的中位(m)PFS分别为5.6个月(95%置信区间[CI],4.2-6.3)和3.9个月(95%CI,3.7-5.8),相比之下,研究者选择组为2.2个月(95%CI,1.9-3.9)(图2)。在PFS亚组分析中,与研究者选择组相比,各亚组均倾向于Sotorasib+帕尼单抗更优,无论高低剂量(图3)。
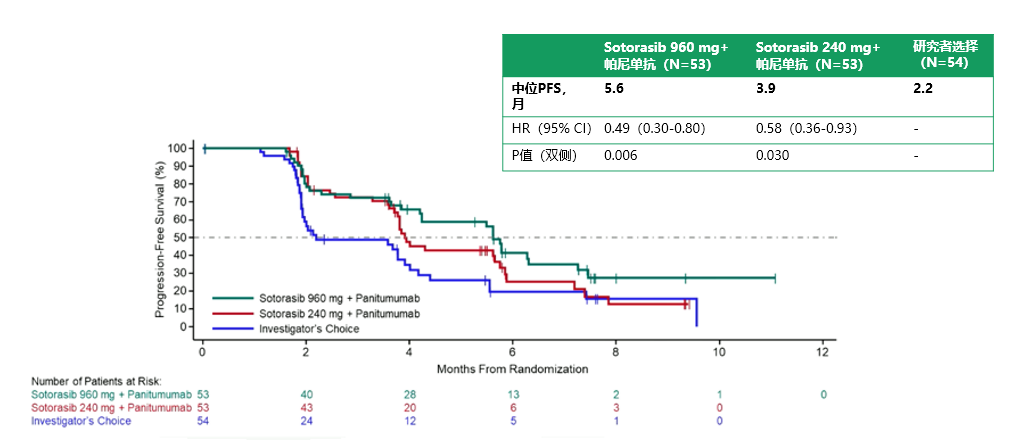
图2:PFS
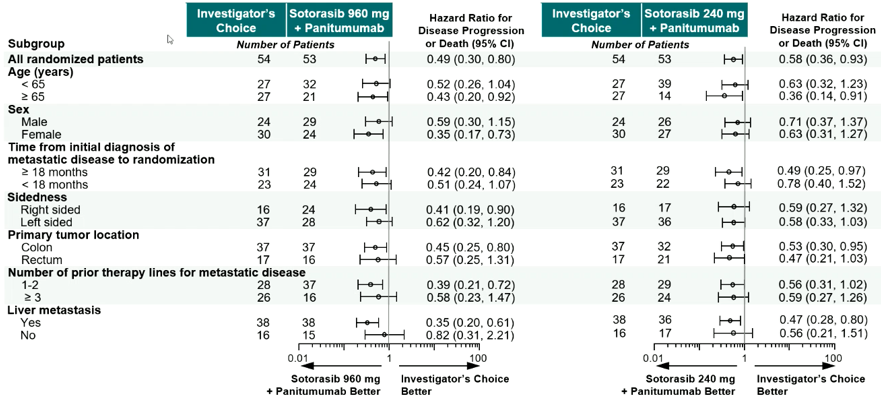
图3:PFS亚组
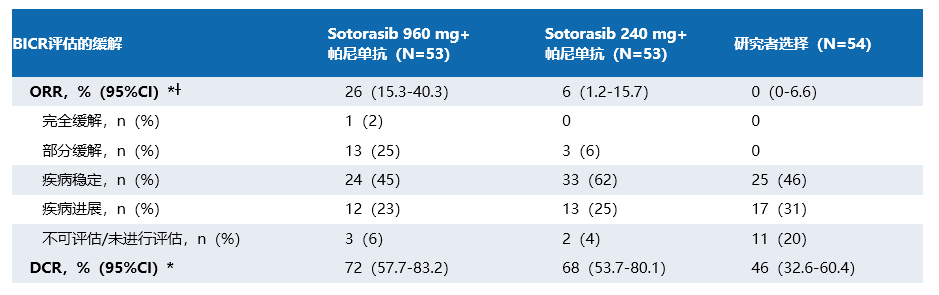
与研究者选择组相比,Sotorasib联合帕尼单抗经BICR评估的ORR与疾病控制率(DCR)更高。960mg Sotorasib–帕尼单抗组和240mg Sotorasib–帕尼单抗组的ORR(BICR评估)分别为26.4%(95%CI,15.3%-40.3%)和5.7%(95%CI,1.2%-15.7%),研究者选择组为0%(95%CI,0.0-6.6%);960mg Sotorasib–帕尼单抗组1例患者(1.9%)获得完全缓解(表2)。
表2:肿瘤缓解
Sotorasib(960mg、240mg)联合帕尼单抗、研究者选择组中观察到任何级别的肿瘤退缩患者占比依次为81%、57%、20%(图4)。
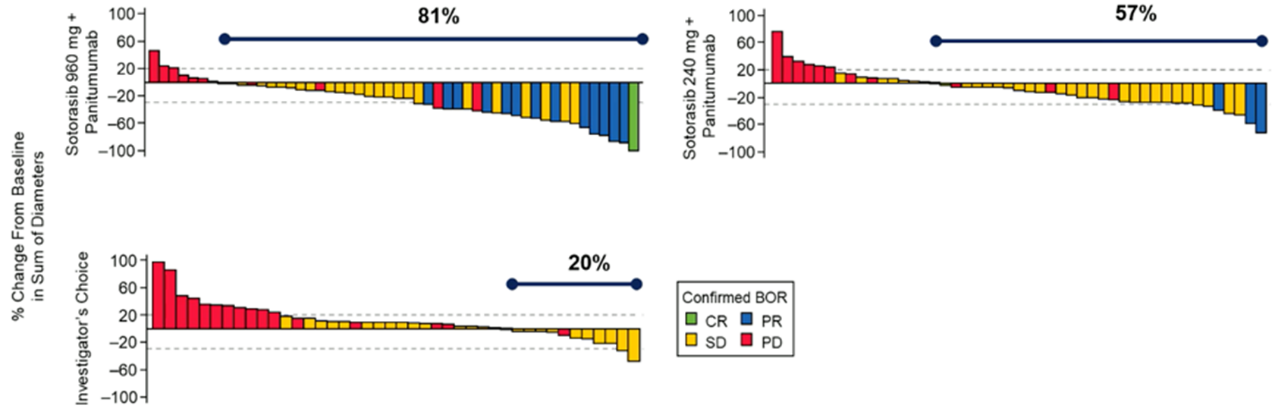
图4:自基线的肿瘤退缩
数据截止时OS数据尚未成熟(图5),仅观察到55个(34%)死亡事件数。960mg Sotorasib–帕尼单抗组相比研究者选择组的风险比(HR)为0.77(95%CI,0.40-1.45);240mg Sotorasib–帕尼单抗组与研究者选择组相比HR为0.91(95%CI,0.48-1.71)。
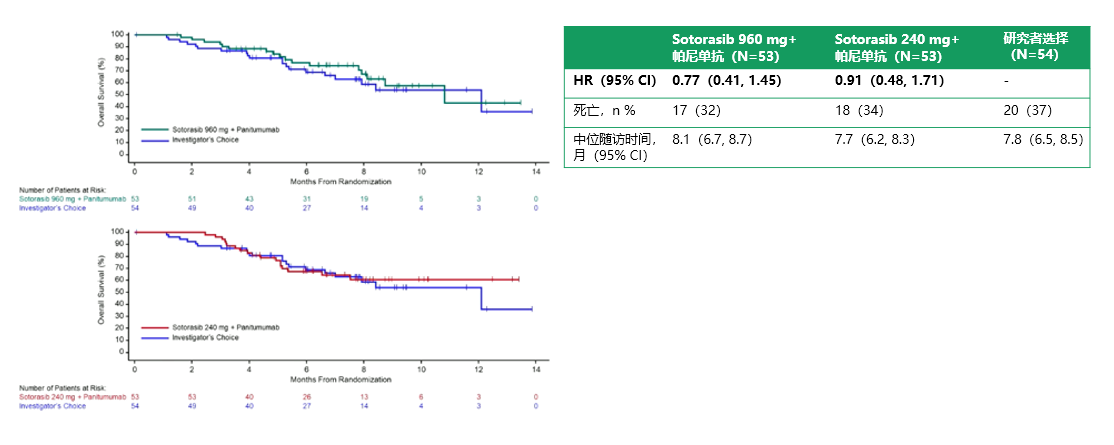
图5:OS结局
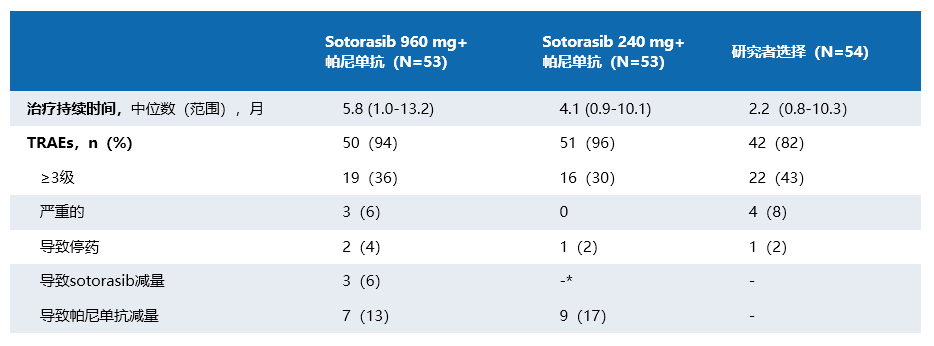
在安全性方面(表3),两种剂量的Sotorasib联合帕尼单抗均是可耐受的,没有出现新的安全性信号及致死性治疗相关不良事件(TRAE)。其中,Sotorasib联合帕尼单抗组常见的≥3级的TRAE是痤疮样皮炎、低镁血症、皮疹和腹泻;研究者选择组常见的≥3级的TRAE是中性粒细胞减少、恶心和贫血。
表3:安全性数据
研究结果表明,CodeBreaK 300研究达到了PFS优效性的主要终点;Sotorasib(960mg与240mg)联合帕尼单抗显示出有统计学显著差异的PFS提升,其中960mg剂量组在未显著增加额外毒性作用的情况下,临床获益更加显著;研究观察到双靶治疗组更高的ORR与DCR,OS在数据截止时尚未成熟;未观察到新的不良事件。CodeBreaK 300研究证实, 960mg Sotorasib联合帕尼单抗在化疗难治性KRASG12C突变mCRC患者中有望成为一种新的标准治疗方案。
研究解读
Sotorasib研发之路:路漫漫其修远兮
Sotorasib是首个KRAS突变获批药物,其意义不言而喻。CodeBreaK系列研究旨在评估Sotorasib在KRASG12C突变型实体瘤的疗效和安全性,探索最多的当属非小细胞肺癌(NSCLC)和结直肠癌(CRC)。
既往涉及肠癌领域的临床试验结果主要为CodeBreaK 100及101两项研究:
· CodeBreaK 100研究[2-3]:一项开放、单臂I/II期临床试验,主要纳入既往接受标准治疗,存在KRASG12C突变的局部晚期或转移性实体瘤患者(包含NSCLC、CRC、其他肿瘤等),给予Sotorasib(口服,1天1次)。研究分为I期(剂量爬坡)和II期(剂量扩展)两个阶段。研究的主要终点是剂量限制性毒性和安全性。I期阶段纳入42例结直肠癌患者,既往均接受过至少两线转移性结直肠癌全身治疗。中位随访12.8个月(数据截止至2020年6月1日)时, ORR 7.1%(均为部分缓解),DCR 73.8%。在II期扩展队列中,在62例难治性KRASG12C突变mCRC患者中评价了960 mg Sotorasib的临床活性。6例患者(10%)达到PR,45例患者(73%)达到SD。mPFS为4个月[95%CI 2.8-4.2个月],mOS为10.6个月(95%CI 7.7-15.6个月)。
· CodeBreaK 101伞型研究是在KRASG12C突变型晚期实体瘤患者中评价Sotorasib单药治疗和联合其他抗癌治疗的安全性、耐受性、药代动力学和疗效的Ib/II期研究(NCT04185883)。Ib期剂量扩展队列(子方案H)在mCRC患者中探索了Sotorasib+帕尼单抗±化疗的可行性。在“双靶”队列中[4],Sotorasib+帕尼单抗联合治疗的ORR为30%(12/40),DCR为93%(95%CI 79.6%-98.4%),mPFS为5.7个月(95%CI 4.2-7.6个月),OS数据尚未成熟。在“双靶+化疗”三联队列中[5],给予Sotorasib+帕尼单抗+标准剂量FOLFIRI联合治疗,剂量探索组中的6例患者没有出现剂量限制性毒性。ORR(均为部分缓解)为55%(95%CI:38.7%-70.2%),DCR为93%(95%CI:80.5%-98.5%),尽管目前PFS和OS数据尚不成熟,但从初步公布的安全性及疗效数据来看,“双靶+化疗”三联方案在肠癌是可行的。
早在2021年5月,FDA加速批准Sotorasib用于治疗KRASG12C突变型局部晚期或转移性NSCLC成人患者,这是基于CodeBreaK 100研究结果,一举打破KRAS基因“不可成药”的魔咒。遗憾的是,Sotorasib目前尚未获得完全批准。CodeBreak 200[6]是在NSCLC中的首个随机、对照、III期确证性研究,其研究结果于今年2月正式发表在Lancet杂志,Sotorasib对比多西他赛显著改善了主要终点PFS:5.6个月 vs. 4.5个月(P=0.02)。2023年10月,FDA举行的ODAC(Oncologic Drugs Advisory Committee,肿瘤药物咨询委员会)会议对于研究的设计和执行提出了诸多疑问,最终以2票赞同、10票反对的结果,认为CodeBreaK 200的主要研究终点,即BICR评估的PFS结果无法被合理地解释。CodeBreaK 300是KRASG12C突变CRC领域第一个前瞻性、全球多中心随机对照研究,同一时间研究全文在新英格兰医学杂志上发表[7],随着这些结果发布,Sotorasib的“转正”之路能否“柳暗花明又一村”,让我们拭目以待。
打破“不可成药”魔咒,KRAS靶点药物研发赛道颇丰
作为最为常见的致癌基因之一,覆盖将近25%的肿瘤患者,KRAS无疑是极具吸引力的靶点,然而三十余年的药物探索却荆棘遍布。mCRC患者中有3%~4%发生KRASG12C突变,KRAS突变肠癌患者整体预后不佳。KRAS蛋白具有光滑的球形结构,缺乏小分子结合口袋,难以设计高亲和力变构抑制剂;并且KRAS与GDP、GTP的亲和力极强,达到皮摩尔级别,考虑到细胞内GDP和GTP的含量(0.5mM左右),寻找与之相当的底物竞争性抑制剂难度极大,因此,KRAS一度被认为是“不可成药”靶点。2013年,K. Shokat[8]实验室利用一种独特的基于二硫键片段的化学库方法,通过筛选鉴定,开发出能够与KRASG12C-GDP特异性共价结合的化合物,成为KRAS靶点药物研发的破局关键,为这部分患者的临床治疗带来了新的希望。
随着Sotorasib和Adagrasib的成功,KRASG12C抑制剂研发的热潮上涨,目前已有20多个在研KRASG12C抑制剂进入临床研究阶段,包括LY3537982、GFH925、JAB-21822、IBI351(GFH925)、Garsorasib(D-1553)等。2022年12月,国研药物JAB-21822获得国家药监局药品审评中心(CDE)授予突破性治疗药物认定,用于治疗KRASG12C突变晚期或转移性NSCLC患者。JAB-21822联合西妥昔单抗治疗晚期CRC的研究正在进行中(NCT05194995)。IBI351分别于2023年1月和5月被CDE纳入突破性治疗品种,拟用于治疗至少接受过一种系统性治疗的KRASG12C突变型晚期NSCLC患者和至少接受过两种系统性治疗的KRASG12C突变型晚期CRC患者。2023 ASCO年会公布的国研药物IBI351的I期临床数据[9],在接受600 mg IBI351的42例mCRC患者中,42.9%的患者达到了疾病缓解,88.1%的患者得到了疾病控制。2023年11月,IBI351的新药上市申请被CDE正式受理并纳入优先审评程序,用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期NSCLC患者。
在G12C靶点药物的成功突破后,研究者将目光转向其他KRAS突变体。针对G12D、G12V、G13C等其他KRAS突变亚型的药物也已陆续开展,包括能同时靶向多个突变形式的KRAS蛋白的抑制剂I-2865和RMC6236,大部分药物尚在临床前阶段,期待其进一步临床数据。对于整体KRAS突变肠癌患者的靶向治疗而言,KRASG12C抑制剂的突破仅仅只是开始。
未来发展:深受期待, 道阻且长
从目前已有的Sotorasib和Adagrasib的临床数据来看,KRASG12C小分子抑制剂在经治的肠癌患者中显示出良好的缩瘤作用和疾病控制,且安全性良好。然而与NSCLC中的疗效相比,单药在晚期肠癌中的临床获益有限,Sotorasib在肠癌后线治疗中客观缓解率不足10%[3],如何优化临床策略,实现最大程度的获益是目前开展相关临床研究的重要方向。值得注意的是,治疗后的耐药问题同样存在。通过对患者接受Sotorasib治疗耐药前后的样本进行多组学分析发现,患者出现治疗后耐药主要有以下分子机制[10,11]:1)由突变本身异质性、其他位点共突变介导的原发性耐药;2)治疗后发生二次突变导致的继发性耐药;3)旁路激活导致的适应性耐药。此外,其他因素包括上皮间质转化、鳞癌转化、免疫微环境等因素可能也参与了KRAS靶向治疗后耐药的发生。目前尚未明确其中的主导机制,开展不同模式的联合治疗是现阶段应对耐药问题的主要策略。
纵向联合:Amodio等[12]已经表明,KRASG12C突变CRC仍然依赖于EGFR信号通路,EGFR的上游激活可以降低KRASG12C阻断的疗效。借鉴BRAF突变型肠癌靶向治疗过程中“EGFR 通路上下游同时阻断”的思路,在利用KRASG12C抑制剂使 KRAS 处于灭活状态的同时联合抗EGFR单抗以抑制细胞膜外EGFR受体的活性,以强化抗肿瘤作用。临床前数据已经证实EGFR/KRASG12C双重阻断可增强对KRAS依赖性信号转导的抑制,并克服适应性反馈。这种理论机制已经在CodeBreaK 101[4]、KRYSTAL-1[13]研究中得到了证实。应该注意的是,单药治疗和联合治疗之间12个月OS率相似,短期随访和患者数量减少可能影响mOS。整体来看,与单药数据相比,联合治疗策略表现出更好的抗肿瘤效力,颇具临床应用前景。而在最新的2023 V4版NCCN指南中[14],推荐KRASG12C抑制剂(Sotorasib或Adagrasib)联合抗EGFR单抗(西妥昔单抗或帕尼单抗)用于KRASG12C阳性mCRC患者的非一线治疗。
横向联合:从旁路激活的机制入手,横向联合RAS–MAPK、PI3K–AKT等信号通路、细胞周期抑制剂等,克服不同的旁路阻力,是应对临床耐药的另一个思路。KRASG12C抑制剂与MEK、mTOR、CDK4/6抑制剂的联合在体外试验中已得到初步的验证,但目前多是集中于非小细胞肺癌及胰腺癌的动物模型中[15],在肠癌中的研究相对有限。CodeBreaK-101伞形研究(NCT04185883)分别设置了Sotorasib与MEK、CDK4/6和mTOR抑制剂联合使用的队列。
免疫联合:临床前研究[16]证实Sotorasib与免疫检查点抑制剂可以发挥协同作用,增强CD8+T细胞浸润而促进抗肿瘤免疫反应。这一协同作用为临床联合应用提供了理论依据。在NSCLC中,CodeBreaK 100/101 研究[17]中Sotorasib联合免疫治疗(阿替利珠单抗或帕博利珠单抗)队列的初步疗效数据显示在58例入组患者中,DCR 83%,mOS 15.7个月。KRYSTAL-1试验(NCT03785249)探索了Adagrasib与帕博利珠单抗在KRASG12C突变肿瘤中的疗效。基于KRAS靶向治疗联合免疫在肠癌中能否复刻REGONIVO中靶免联合模式的突破,期待其进一步的临床数据。
从KRAS突变首次在肺癌中发现以来,其靶向药物的探索已经走过了三十多个年头。从“充满希望”的高频突变到打破“不可靶向”的魔咒,再到如今各个亚型相关研究齐头并进,KRASG12C小分子抑制的开发和临床应用在其中树立了重要的里程碑。然而我们也同样看到,对于KRAS肠癌的治疗目前仅仅只是开始,基于KRAS靶点的“双靶联合”、“双靶+化疗”联合治疗策略能否革新突变型肠癌患者治疗布局,期待进一步大型III期临床数据的支持。未来充满挑战,更加值得期待。
[1] F. Pietrantonio, et al. Sotorasib plus panitumumab versus standard-of-care for chemorefractory KRAS G12C-mutated metastatic colorectal cancer (mCRC): CodeBreak 300 phase III study. 2023 ESMO , Abs LBA10.
[2] Hong DS, et al. KRASG12C inhibition with sotorasib in advanced solid tumors. N Engl J Med. 2020;383(13):1207–17.
[3] Fakih MG, et al. Sotorasib for previously treated colorectal cancers with KRASG12C mutation (CodeBreaK100): a prespecified analysis of a single-arm, phase 2 trial. Lancet Oncol. 2022;23(1):115-124.
[4] Kuboki Y, et al. Sotorasib in combination with panitumumab in refractory KRAS G12C-mutated colorectal cancer: safety and efficacy for phase 1B full expansion cohort. 2022 ESMO, Abstract 315O.
[5] David S. Hong, et al. Sotorasib (Soto) plus panitumumab (Pmab) and FOLFIRI for previously treated KRAS G12C-mutated metastatic colorectal cancer (mCRC): CodeBreaK 101 phase 1b safety and efficacy. 2023 ASCO, Abstract 3513.
[6] de Langen AJ, et al. Sotorasib versus docetaxel for previously treated non-small-cell lung cancer with KRASG12C mutation: a randomised, open-label, phase 3 trial. Lancet. 2023 Mar 4;401(10378):733-746.
[7] Fakih MG, et al. Sotorasib plus Panitumumab in Refractory Colorectal Cancer with Mutated KRAS G12C. N Engl J Med. 2023 Oct 22. doi: 10.1056/NEJMoa2308795
[8] Ostrem, J. M., et al. K-Ras(G12C) inhibitors allosterically control GTP affinity and effector interactions. Nature. 2013 Nov 28;503(7477):548-51.
[9] Ying Yuan, et al. Efficacy and safety of IBI351 (GFH925) monotherapy in metastatic colorectal cancer harboring KRASG12C mutation: Preliminary results from a pooled analysis of two phase I studies.2023 ASCO, Abstract 3586.
[10] Awad, M. M., et al. Acquired Resistance to KRAS(G12C) Inhibition in Cancer. N Engl J Med 384, 2382-2393, doi:10.1056/NEJMoa2105281 (2021).
[11] Romero D. Uncovering adagrasib resistance. Nat Rev Clin Oncol. 2021 Sep;18(9):541.
[12] Amodio V, et al. EGFR blockade reverts resistance to KRASG12C inhibition in colorectal cancer. Cancer Discov. 2020;10(8):1129-1139.
[13] Samuel J. K, et al. KRYSTAL-1: Updated Efficacy and Safety of Adagrasib (MRTX849) With or Without Cetuximab in Patients With Advanced Colorectal Cancer (CRC) Harboring a KRAS G12C Mutation. 2022 ESMO, LBA 24.
[14] NCCN Guidelines Version 4. 2023 Colon Cancer. Available at NCCN. org
[15] Lou, K., et al. KRAS(G12C) inhibition produces a driver-limited state revealing collateral dependencies. Sci Signal 12, doi:10.1126/scisignal.aaw9450 (2019).
[16] Canon, J., et al. The clinical KRAS(G12C) inhibitor AMG 510 drives anti-tumour immunity. Nature 575, 217-223, doi:10.1038/s41586-019-1694-1 (2019).
[17] B.T.Li, et al. CodeBreak 100/101:First Report of Safety/Efficacy of Sotorasib in Combination with Pembrolizumab or Atezolizumab in Advanced KRAS p.G12C NSCLC. 2022 WCLC, Abstract OA03.06.
排版编辑:肿瘤资讯-Hannah











 苏公网安备32059002004080号
苏公网安备32059002004080号


