中国临床肿瘤学会(CSCO)与肿瘤资讯联袂推出【CSCO MM圆桌派】学术讨论项目,召集CSCO多发性骨髓瘤专家委员会“豪杰”, 寻觅前路,聚焦热点,探讨多发性骨髓瘤(MM)规范诊疗关键点及治疗领域热点话题及有争议的问题,为MM精准治疗之路点灯,为MM患者生命火把助燃。12月11日,【CSCO MM圆桌派·第五期】如期而至!本期特邀中国医学科学院血液病医院邱录贵教授、首都医科大学附属北京朝阳医院陈文明教授、山东大学齐鲁医院王鲁群教授以及中国医学科学院血液病医院安刚教授作嘉宾,中国医学科学院血液病医院杜辰星医生担任特邀主持,深入探讨MM首次复发治疗的决策选择及未来发展方向。【肿瘤资讯】特将讨论内容精编整理,以供学习。
观看视频,查看更多精彩内容
首次复发:明晰影响因素是制定合适治疗方案的前提
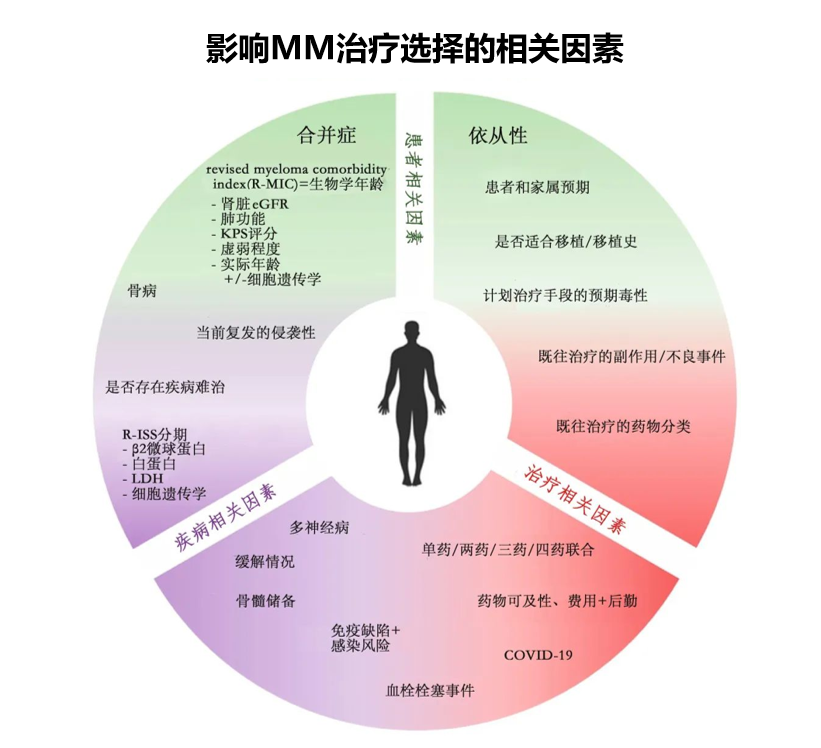
无论是首次复发,还是多次复发,都与新确诊MM患者的情况不同,治疗前需明确患者状况。一是患者的年龄和体能状况;二是患者心脏、肾脏等重要器官功能;三是患者的复发状态,是耐药性复发还是敏感性复发,以及复发时患者是否还具备移植条件;四是药物可及性,选择安全有效的药物,同时减少患者经济负担。
指南明确指出细胞遗传学是MM重要的预后因素之一。伴随着疾病进展,骨髓瘤细胞持续发生克隆演变,细胞遗传学背景也会发生变化,需要通过Fish检测、染色体核型分析、二代测序等多角度综合评估复发后细胞遗传学的变化,同时结合各种新药的临床证据、患者支付能力做出个体化的治疗决策。
患者在初诊时,可能并非细胞遗传学高危,但在复发后可能转变成高危。17p缺失被视为骨髓瘤最重要的高危因素之一,本中心早在2015年研究发现初诊时携带大克隆17p患者生存情况最差。今年最新研究发现,复发时携带17p的多发性骨髓瘤患者比例较初诊时显著升高,初诊时有6%的骨髓瘤患者携带17p缺失,而复发时则升高为17%。进一步研究发现,复发时携带小克隆的17p缺失的患者与携带大克隆的17p缺失的患者生存情况近似,也就是说部分患者尽管初诊时17p正常,但若复发后出现缺失,尽管缺失细胞的比例可能不高(约10%),其预后价值依然很大。此外1q21动态变化也很大,随着1q21拷贝数的增加,预后的恶性程度也明显提高。所以患者复发以后需重新进行遗传学检测
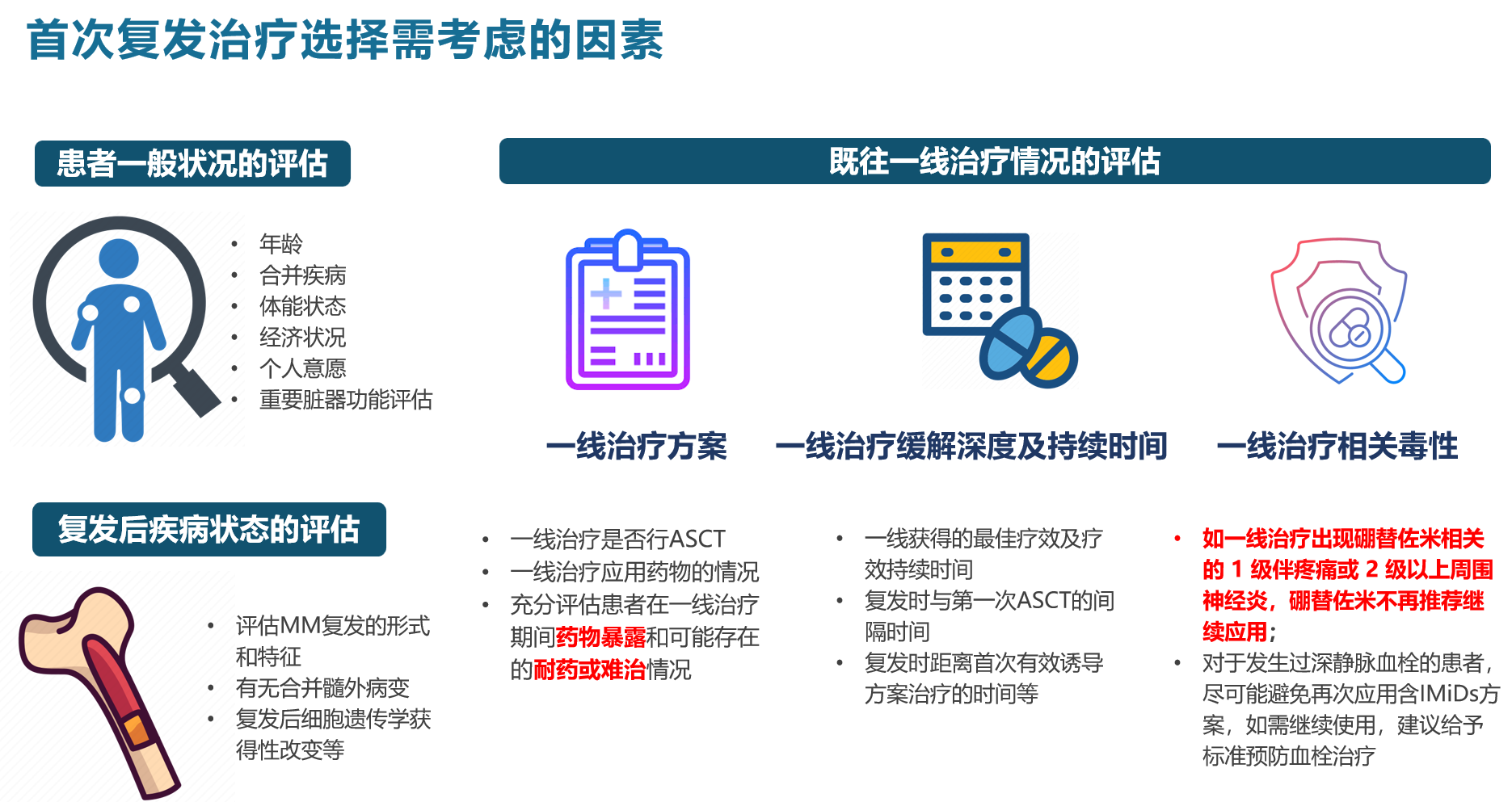
针对复发患者进行以下分析,综合平衡患者的治疗风险和获益,以此制定治疗方案。一是患者本身的因素,年龄、体能状态、器官功能、家庭状况,治疗预期目标,经济承受能力。二是疾病本身的因素,需要评估是侵袭性复发,还是长时间缓解后的复发?复发后遗传学是否发生新的改变?三是既往治疗情况。包括既往治疗药物、治疗效果、治疗的耐受性、缓解时间等1,2。
首次复发:结合影响因素和疾病特点选择最佳治疗时机
从MGUS到SMM到ND MM、RR MM, MM整体是一个逐步进展的疾病过程。在MM中,MRD是判断疾病进展一个非常重要的指标,但MRD阴转阳是否可以作为启动治疗的指征仍有待讨论。同样,真正高危的患者群,恶性程度高进展迅速,即便MRD阴性,是否能从尽早启动治疗中获益目前仍在探索中。因此临床上应结合MM疾病特点选择最佳治疗时机。
MRD阴转阳性更多的是评估流式或者二代测序检测骨髓异常浆细胞的比例。但实际上的MRD阴转阳,如果不评估细胞数量的多少,是无法反应疾病的真正状态的。临床上,会结合血清或者尿M蛋白情况评估疾病是否进展(PD)。MRD阴转阳且临床达到PD标准,再考虑是否启动治疗。MRD转阳,提示疾病复发,但不是启动治疗指征,只是判断疾病进展的重要指标。此外,目前有临床研究在探索MRD对于同时具有两个及以上细胞遗传学高危因素的超高危MM患者启动治疗的指导意义,可能会带来一些新的启示。
临床复发、快速生化复发或侵袭性复发是几个不同的概念,MM患者在初期时选择哪个阶段作为最佳的启动治疗阶段,还有待商榷。
MM复发确实有几个不同的概念,目前认为临床复发肯定是要启动治疗。而生化复发仅停留在临床试验阶段,到目前为止,国内外指南都尚未把生化复发列入启动治疗的指征。 MRD由阴转阳患者预后不良,对于MRD阳性患者的随访,不仅要监测MRD动态变化,还需监测患者有无髓外病变,是否有循环浆细胞,甚至早期监测循环血液DNA。如果患者出现上述表现再加上MRD由阴转阳,这类患者可能很快进入侵袭性复发状态。总体而言,对于个体患者是否需要早期干预,需要与患者充分沟通,并进行个体化的评估。
MRD阴性转阳性,可先保持观察。是否需要提早干预?在一些严格的临床试验中,针对高危患者,MRD阴转阳是可以进行干预的,但提早干预是否比目前的观察法疗效更好,还需要等待临床试验结果。
多发性骨髓瘤MRD的价值绝对不等同于MRD在急性淋巴细胞白血病或者急性髓细胞白血病这类侵袭性肿瘤中的价值。是否一定要追求MRD阴性,是需要思考的。临床实际工作中,更需要结合患者的年龄、体能状态、治疗耐受性、遗传学背景,是否具有侵袭性等这些因素来决定患者的治疗。此外,MRD一次转阴和持续转阴价值是不同的。MRD一次转阴并不会对患者预后产生重要影响,MRD持久阴性,才会使患者的结局更好。
关于MRD驱动的治疗,目前仍在临床试验中,更细化的患者分层可能比单纯的阴性或阳性更重要。
对于非常高侵袭性的患者,通过治疗快速缓解,达到MRD阴性,但如果1~2个月后患者MRD转阳,就需要高度警惕可能的快速进展,对于这一少部分患者,或许MRD阳性就是治疗的指征。而对于大部分患者是可以等待和观察的。另外,MRD除了细胞数量,也要关注质的问题,也即克隆演变的早期发生。
针对患者复发后的治疗时机,需根据多种因素进行考虑,包括患者目前的疾病状态和体能状态,既往疾病是相对惰性或侵袭性以及既往缓解深度。疾病复发后再次检测,是侵袭性还是保持相对惰性,除了细胞遗传学,还需关注组织形态,M蛋白的变化等。总体而言,面对复发患者需要做的评估跟初诊患者是同样的,需要做全面系统的评估来决定后续治疗方案。
首次复发:根据治疗目标选择个体化治疗方案
中国MM患者的发病年龄约60岁,第一阶段的缓解时间平均约为4年,患者仍相对年轻。另外首次复发后,有新一代的蛋白酶体抑制剂,新一代免疫调节剂以及单克隆抗体等可选择 ,可选择的药物还比较多。所以首次复发与新诊断患者治疗目标相似,应使疾病达到最大程度缓解,尽可能延长患者生命,并在此基础上提高生活质量。
相较于国外,中国MM患者的发病年龄偏年轻。随着MM治疗线数的增加,后线治疗的脱落率逐渐增高,治疗选择逐渐减少,尤其对于很多中国患者,可能没有机会接受三线及之后的治疗。因此对于首次复发患者,需要把握强效治疗时机。首次复发后进行强效联合治疗,使患者达到更长更深缓解,给患者带来长期生存可能。
应根据前线治疗药物的耐受性,药物的种类,联合治疗的效果,持续缓解时间来制定治疗方案。
NCCN指南推荐CAR-T或双抗应用在三线治疗。目前已经有研究在探索首次复发时应用CAR-T治疗,对于早期复发的患者,CAR-T未来进入二线治疗的可能性很大。同样地,双抗由于其令人惊艳的疗效,未来作为首次复发选择只是时间问题。有研究显示,对于复发难治MM患者,使用靶向BCMA和GPRC5D的两种双抗联合的有效率达到96%以上,多数患者能达到深度缓解,且安全性良好。目前CAR-T和双抗往前线应用的阻碍主要是可及性和价格问题,随着国内双抗产品的开发上市,相信将为更多首次复发患者带来获益。
国外研究显示,一线有90%的患者可以接受治疗,二线只有80%左右患者接受治疗,三、四线比例更低3。所以越在前线,患者可耐受的前提下,越需要把握患者治疗的时机,让患者达到深度缓解和更长时间生存。现在已进入到新药时代,新药的可及性大大提高。因此,应该追求让大部分体能状态良好可以耐受治疗的患者达到深度的缓解,随后进行持续治疗,使患者得到更长时间的无进展生存,最终使得MM整体总生存能够得到显著延长。
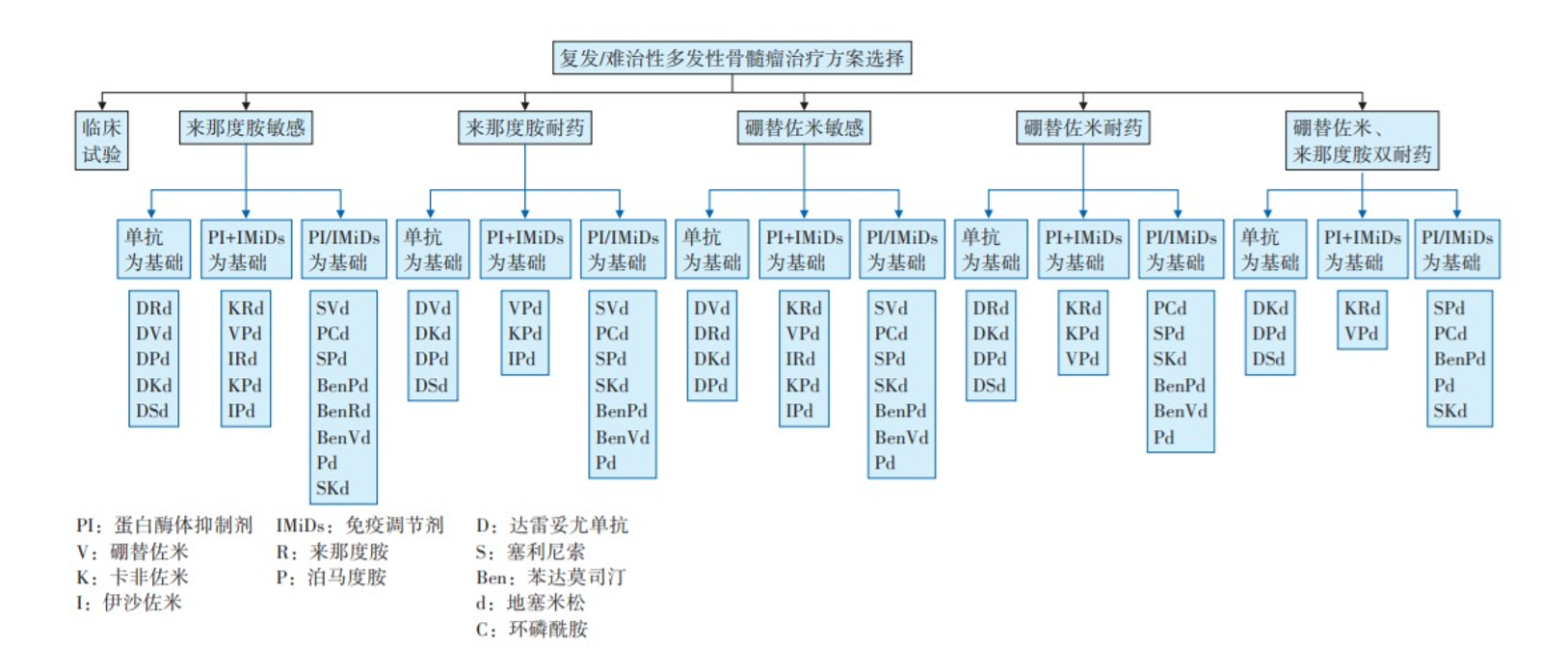
关于治疗药物的选择,从指南及目前临床实际角度出发,因为来那度胺更多被用于一线诱导及维持治疗,复发后药物选择首先判断是否对来那度胺耐药。升级为新一代药物或者选择更新不同作用机制的药物1,2。
(1)如果是来那度胺耐药患者,治疗选择蛋白酶体抑制为基础,如二代蛋白酶体抑制剂卡非佐米,或同时选择新一代免疫调节剂泊马度胺,可以部分克服来那度胺耐药。如果既往没有使用CD38单抗,则也可以作为临床选择,甚至是几种药物的联合
(2)少数高危患者在一线使用硼替佐米进行维持治疗。若在维持治疗阶段疾病发生进展,这部分患者可能对硼替佐米耐药。对于来那度胺、硼替佐米双重耐药患者,则需要全新作用机制药物,若前期未使用CD38单抗,则可以用CD38单抗联合新型蛋白酶体抑制剂和新型免疫调节剂的方案,若有条件参加新药临床试验,特别是免疫治疗的临床试验。
(3)免疫治疗包含ADC、双特异性抗体目前尚未可及,目前更多可及的是CAR-T,但目前仍多用于后线治疗,已有研究证实CAR-T治疗相比于标准的治疗对二线和三线患者能够显著的延长无进展生存,甚至有可能通过更长时间随访,总生存能够获益,这些都是一步一步在发展过程当中。
自体移植依然可以作为首次复发治疗重要选择
复发后是否可以做移植取决于首次移植后的缓解持续时间。持续时间大于两到三年的,可以考虑做二次移植。
即使在欧美国家,有大量新药的情况下,根据现有的循证医学依据,仍然不能推翻自体造血干细胞移植在一线治疗中的地位。所以,首先要强调一线符合自体造血干细胞移植条件的患者,尽可能行自体造血干细胞移植。其次,首次复发后如果患者在一线治疗没有经过自体造血干细胞移植,二线治疗达到缓解应尽可能行自体造血干细胞移植。第三,若第一次自体造血干细胞移植缓解三年以上,患者复发后行自体造血干细胞移植,仍能获益。
应该强调一线移植的重要性,现在中国MM患者的移植率很低。中国患者不进行移植的原因有些是意识问题而非经济原因。作为医生有责任去科普,让患者能接受移植,提高一线移植比例,真正让我们中国老百姓在长期生存率能够赶上西方国家。
免疫治疗-MM治疗未来方向
免疫治疗是未来的重要方向。目前治疗仍停留针对肿瘤细胞层面的治疗,而不是肿瘤细胞单基因的治疗。
免疫治疗机制相对复杂。仅针对肿瘤微环境的治疗不如针对肿瘤细胞和肿瘤微环境共同治疗的效果,这也是双抗以及CAR-T细胞治疗的疗效,比常规单抗疗效更佳的主要原因。另外,前线治疗尤其化疗过多,会影响患者体内淋巴细胞的功能。因此在临床试验中可看到双抗的治疗会更靠前,而CAR-T细胞治疗会更靠后。无论双抗还是CAR-T治疗,前移至几线、适合的患者人群、PFS获益有多大等问题还需要等待临床试验的回答。在更多的证据出来前,当前的治疗选择还是循序渐进为主,以蛋白酶体抑制剂、免疫调节剂和CD38单抗为基础,逐步尝试双抗、CAR-T等新疗法4。
首次复发后的治疗如果使患者获得长期生存,可能是患者的第二次机会。目前有很多治疗选择和治疗药物,未来可期。此外,免疫治疗是MM非常重要的方向。
高危需将强治疗前置,标危采用强治疗是否可以实现“临床治愈”仍待探讨
邱教授说的侵袭性高危,如果可及,需要将更强的治疗方案前置。但从现在的临床试验说明,所有的治疗策略对于标危的患者获益更大。如何设计系统的治疗策略,让标危患者能够达到更长生存,甚至实现“临床治愈”?
目前针对同一个治疗方案,相较高危患者,真正获益最多的还是标危患者。未来CAR-T,免疫治疗,双抗的免疫治疗是否能把这部分高危患者变得和标危患者效果一致,目前还有待时间去观察。
现在最难解决的问题就是高危患者,高危患者现有的治疗方案结局不容乐观,需要更多的探索。如果识别出是高危甚至超高危的患者,且年轻可耐受,需要选择最强的治疗,甚至有合适供者,可以考虑一线做异体移植。当然更多的选择现在在开展临床试验,因为很多MM的患者发病时年龄较大,大多数患者无法接受异体移植。对于这个问题还有待临床试验的探索。
总结
随着复发次数的增加,MM治疗难度越来越高,缓解时间越来越短。因此,首次复发成为改善治疗获益的关键时间节点。首次复发后需综合评估患者的自身状态、疾病状态及既往治疗情况,个体情况个体分析,制定最合适的治疗方案。另外MRD阴转阳时,更需要结合疾病情况,找准时间点切入治疗。新药和免疫治疗的不断涌现使得MM的治疗选择越来越丰富, 但是也不能忽视自体造血干细胞移植作为首次复发治疗选择的首要地位。虽然目前MM不可治愈,但把握好首次复发治疗的黄金时机,仍有望使患者最大程度获益。


码上填写,留下您最想要学习或了解的学术内容吧~
1. 中国肿瘤整合诊疗指南. 多发性骨髓瘤. 2022
2. 中国首次复发多发性骨髓瘤诊治指南(2022年版)
3. NCCN. NCCN Clinical Practice Guidelines in multiple myeloma, 2023.v3.
4. Blood Cancer J. 2017 Apr 21;7(4):e554;2. J Clin Oncol 36:728-734; 3. J Clin Oncol 36:728-734; 4. Mateos MV, et al. Haematologica 2017; 102(10):1767-1775.5
往期精彩回顾:
【CSCO MM圆桌派】开讲啦!多发性骨髓瘤大咖“说说道道”快来听!
【1335】【CSCO MM圆桌派·第一期】规范诊断,浇筑高危多发性骨髓瘤诊治坚实基座
【1337】【CSCO MM圆桌派·第二期】聚焦高危多发性骨髓瘤治疗:分层治疗、多药、多手段联合、动态调整
【1371】【CSCO MM圆桌派·第三期】2023 IMS 中外专家巅峰对话—骨髓瘤领域研究热点及未来方向
【CSCO MM圆桌派·第四期】多发性骨髓瘤基础和转化医学研究进展
医学审核:杜辰星医生(中国医学科学院血液病医院)
责任编辑:肿瘤资讯-Jenny
排版编辑:肿瘤资讯-tong











 苏公网安备32059002004080号
苏公网安备32059002004080号


