2023年第46届圣安东尼奥乳腺癌研讨会(San Antonio Breast Cancer Symposium,SABCS)将于12月5日至9日在美国得克萨斯州圣安东尼奥举行。作为规模最大、最具影响力的乳腺癌研究盛会,该会议吸引了全球乳腺癌领域的专家学者和医疗界人士。在本次会议的LBA专场中,共有五项重要研究成果值得关注。【肿瘤资讯】特此整理,以飨读者。
中文标题:新辅助帕博利珠单抗或安慰剂加化疗后,辅助帕博利珠单抗或安慰剂治疗早期三阴性乳腺癌:来自3期KEYNOTE-522研究的更新的无事件生存期结果
原标题:Neoadjuvant pembrolizumab or placebo plus chemotherapy followed by adjuvant pembrolizumab or placebo for early-stage triple-negative breast cancer: Updated event-free survival results from the phase 3 KEYNOTE-522 study
讲者:Peter Schmid, Centre for Experimental Cancer Medicine, Barts Cancer Institute, Queen Mary University London, London, United Kingdom
研究背景
KEYNOTE-522(NCT03036488)研究中,与新辅助安慰剂(pbo)+化疗(chemo)/辅助pbo相比,新辅助帕博利珠单抗(pembro)+chemo/辅助pembro治疗早期三阴性乳腺癌(TNBC)患者的病理完全缓解率(pCR)和无事件生存率(EFS)具有统计学意义和临床意义的改善。以下报告的是中位随访~5年的EFS更新结果。
研究方法
符合入组条件的患者为初治、无转移、经中心确诊的TNBC(根据AJCC分期为T1cN1-2或T2-4N0-2),2:1随机分入新辅助pembro 200 mg Q3W或pbo组,chemo均为4周期紫杉醇+卡铂接续4周期多柔比星或表柔比星+环磷酰胺。根治性手术后,患者接受辅助pembro或pbo治疗9周期或直至复发或发生不可耐受的毒性。双终点分别是pCR(ypT0/Tis ypN0)和EFS(从随机化到疾病进展的时间,排除根治手术、局部/远处复发、第二原发癌或任何原因的死亡)。
研究结果
1174例患者随机分入pembro(n=784)和pbo组(n=390)。数据截止时(2023年3月23日),中位随访63.1个月。Pembro和pbo组分别有145例(18.5%)和108例(27.7%)患者发生EFS事件(HR 0.63;95% CI 0.49-0.81)。60个月的EFS率分别为81.3%(95% CI 78.4-83.9)和72.3%(95% CI 67.5-76.5),二组均未达中位值。所有5个敏感性分析中,新辅助pembro+chemo/辅助pembro组相较于单独新辅助chemo的获益均与初始EFS结果一致,显示出pembro组持久而稳定的EFS获益。
根据PD-L1表达、淋巴结状态、疾病分期、绝经状态、HER2状态和乳酸脱氢酶(LDH)水平等预先指定的亚组中,pembro带来的EFS获益一致(表1)。预先设定的非随机探索性分析中,pembro和pbo组pCR患者的5年EFS率分别为92.2%和88.2%,非pCR患者分别为62.6%和52.3%。其他分析将在大会报告时分享。OS随访正在进行中。
表1 EFS结局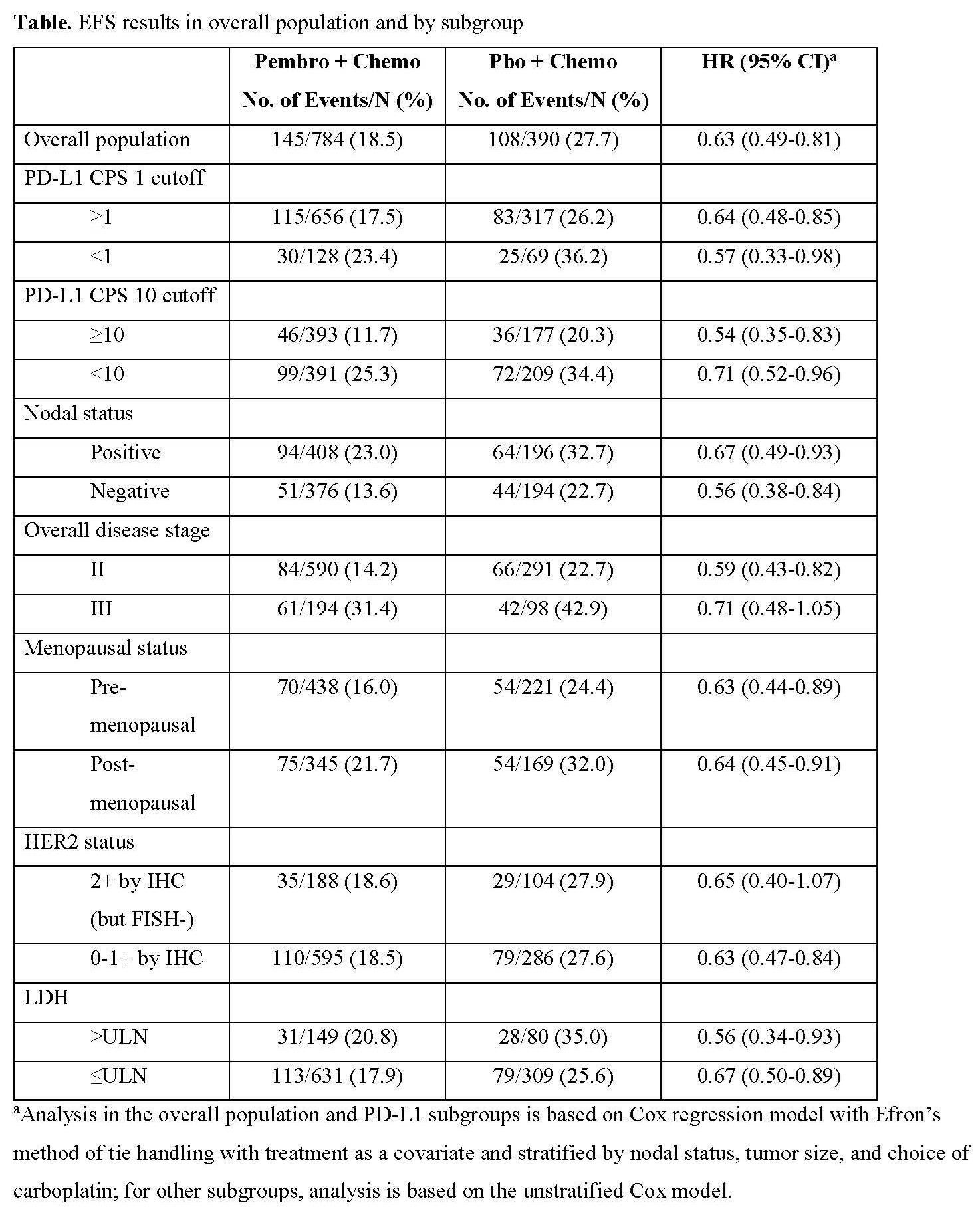
结论
早期TNBC患者,新辅助pembro+chemo/辅助pembro与单独新辅助chemo相比,EFS显示出持续有临床意义的改善,不同亚组均有改善,与pCR结果无关。
中文标题:APTneo Michelangelo随机研究:HER2阳性早期高危和局部晚期乳腺癌标准治疗基础上加用阿替利珠单抗未进一步提高pCR率
原标题:Pathologic complete response (pCR) of neoadjuvant therapy with or without atezolizumab in HER2-positive, early high-risk and locally advanced breast cancer: APTneo Michelangelo randomized trial
讲者:Luca Gianni, Fondazione Michelangelo, Milan, Italy
研究背景
新辅助HER2双靶曲妥珠单抗(H)和帕妥珠单抗(P)+化疗是高危HER2阳性(HER2+)乳腺癌(BC)的标准治疗。大量数据显示,免疫系统对预后和对靶向HER2治疗的作用具有显著影响,支持免疫检查点抑制剂与抗HER2抗体联合治疗。研究者设计了APTneo研究,旨在评估新辅助HER2双靶+化疗治疗中加入阿替利珠单抗的作用,以及此种情况下蒽环类药物的使用价值。
研究方法
这项多中心开放式Ⅲ期研究(NCT03595592)中,661例高危早期和局部晚期(LA)且经中心证实的HER2+ BC患者,随机分入新辅助HPCT(H和P d1,卡铂+紫杉醇iv d1和8),q3 wks,共6个周期,无阿替利珠单抗组n=223(A组);有阿替利珠单抗组n=438,1200 mg iv d1(B组),B组患者进一步随机分为B1组(n=218),接受蒽环类药物+环磷酰胺(AC)+阿替利珠单抗iv d1 q3 wks,共3个周期,接续HPCT+阿替利珠单抗共3个周期;B2组(n=220)接受HPCT+阿替利珠单抗,共6个周期。术后继续靶向HER2辅助治疗±阿替利珠单抗,直至1年。意向性治疗(ITT)患者中,44.8%为LABC,35%为激素受体(HR)阴性,30.4%为PD-L1阳性。
主要终点为B组和A组的无事件生存(EFS),关键次要终点是有/无阿替利珠单抗组患者的pCR率(ypT0/Tis , ypN0)。所有疗效终点的主要研究人群为ITT。此外还评估了基线PD-L1状态(Ventana SP142)和间质肿瘤浸润淋巴细胞(sTILs)。
研究结果
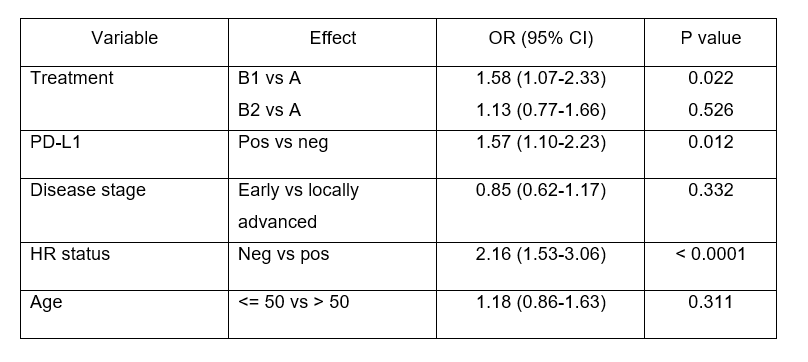
B组(57.8%)的pCR率较A组(52.0%)无显著增加(adjHR 1.33,95% CI 0.95-1.86;p=0.091)。B1(61.9%)和B2组(53.6%)的pCR率差异无统计学意义(adjHR 1.402,95% CI 0.95-2.07;p=0.089)。B1组的pCR率较A组增加9.9%,不论HR和PD-L1状态,B1和A组pCR率的不同始终存在。所有组别中高sTILs (≥30%)和PD-L1阳性肿瘤获得pCR的可能性更高。
表2 多因素分析
治疗后的严重不良事件(SAE)发生率A组6.8%,B组14.1%(p=0.0064)。由于AC的血液学毒性,B1组的SAE在数值上比B2组(16.7%和11.6%)更高。免疫相关SAE在B1(4.7%)和B2(7.8%)组均罕见且相似。未发生5级AE。
研究结论
在HP+化疗基础上加入阿替利珠单抗不能提高HER2+ BC患者的pCR率。探索性分析显示,新辅助AC接续HPCT+阿替利珠单抗较HPCT+阿替利珠单抗具有更高的pCR率,这可能是源自蒽环类药物本身的原因,也可能是药物相互作用增加蒽环类药物和免疫调节的作用。阿替利珠单抗未引起严重耐受性问题。收集的生物样本正在进行分子研究。患者将继续随访以便进行EFS和总生存分析。
中文标题:BCT1902/IBCSG 61-20 Neo-N研究:新辅助纳武利尤单抗(N)单药治疗(2周),之后接受N+卡铂+紫杉醇(CbP)(12周)vs 同时接受N+CbP治疗TNBC的Ⅱ期随机研究
原标题:Randomized Phase II Study of Neoadjuvant Nivolumab (N) 2 week lead-in followed by 12 weeks of concurrent N+carboplatin plus paclitaxel (CbP) vs concurrent N+CbP in Triple Negative Breast Cancer (TNBC): (BCT1902/IBCSG 61-20 Neo-N)
讲者:Sherene Loi, Peter McCallum Cancer Centre, Melbourne, Australia
研究背景
先前的临床研究表明,在化疗开始之前的2周内,使用程序性细胞死亡配体1(PD-L1)抑制剂单药的预处理可能比同时开始所有药物更有效。此外,联合使用免疫检查点治疗可能会缩短患者的化疗持续时间。本研究的目的是探讨预先Nivolumab(N)单药治疗后再进行12周的卡铂+紫杉醇治疗,对比同时3药联合治疗在TNBC中的应用。
研究方法
在这项多中心Ⅱ期研究中,符合入组条件的Ⅰ(cT1c)-Ⅱ期TNBC 患者被随机分配至两组,接受 A 组(导入):N 240 mg 单药治疗,两周后每组接受 N 360 mg + 卡铂 (AUC 5) 21 天 x 4 个周期 + 每周使用紫杉醇 (80 mg/m2),持续 12 周;或 B 组(同时):在 12 周内同时给予相同的药物,2 周后在手术前进行 N 240mg 单药治疗。主要终点是病理完全缓解(pCR ypT0/Tis ypN0)。次要终点包括残余肿瘤负荷(RCB)、安全性、应答情况[根据基线间质肿瘤浸润淋巴细胞(sTILs)数量、PD-L1表达、无事件生存(EFS)]。高sTILs定义为≥30%,PD-L1阳性定义为≥1%(SP142试验)。使用非比较Simon两阶段设计,分别在每个治疗组中检验零假设,即pCR率≤40%,与备择假设pCR率≥60%,置信区间为90%。未给予辅助 N,并在非pCR的情况下,辅助化疗由研究者自行决定。
研究结果
从2020年7月到2022年4月,共有110例患者进行了随机分组;分析了开始治疗的108名患者。基线特征:中位年龄为49岁(IQR 43-60岁),16.7%患有淋巴结阳性疾病,34.3/64.8%患有Ⅰ/Ⅱ期疾病,33.3%为sTIL高,47.2%为PD-L1阳性。对于A组和B组,pCR率分别为50.9%(90% CI 39.0-63.2)和54.5%(90% CI 42.7-66.2),总体pCR率为52.8%(90% CI 44.4-61.0)。RCB 0+1率总体为68.5%(90% CI 60.4-75.9);在A组和B组分别为64.2%(90% CI 52.0-75.1)和72.7%(90% CI 61.2-82.4)。
总体而言,在sTIL高亚组与低亚组中,pCR分别为66.7%(90% CI 51.7-79.5)和45.7%(90% CI 35.5-56.2%),在PD-L1阳性与阴性亚组中,pCR分别为70.6%(90% CI 58.4-80.9)和33.3%(90% CI 21.8-46.6)。Ⅰ期和Ⅱ期患者的pCR率分别为48.6%和54.9%。
两组的治疗相关不良事件相似, 64.8% 的患者发生 3-4 级不良事件。17例患者 (15.7%) 早期停用纳武利尤单抗。 22 例患者 (20.4%) 观察到免疫相关内分泌功能障碍(任何级别)。
研究结论
基于两组研究的pCR率均超过50%的结果,支持对于Ⅰ/Ⅱ期的TNBC患者行12周的新辅助非蒽环类化疗方案联合纳武利尤单抗,无论是同时还是先导应用。
中文标题:Zanidatamab+哌柏西利+氟维司群治疗HER2+/HR+转移性乳腺癌的Ⅱa期研究主要结果
原标题:Primary results from a phase 2a study of zanidatamab (zani) + palbociclib (palbo) + fulvestrant (fulv) in HER2+/HR+ metastatic breast cancer (mBC)
讲者:Santiago Escrivá-de-Romani, Vall d’Hebron Institute of Oncology (VHIO), Vall d’Hebron University Hospital, Barcelona, Spain
研究背景
HER2+ mBC 仍然无法治愈,因此需要新的 HER2 靶向疗法,包括免化疗方案。大约 50% 的 HER2+ mBC 也是 HR+,这使得雌激素成为额外的治疗靶点。CDK4/6抑制剂哌柏西利 + 氟维司群内分泌治疗被批准用于 HER2−/HR+ mBC。同时靶向这三个途径可能进一步改善HER2+/HR+ mBC患者的预后。Zani是一种双特异性HER2靶向抗体,以独特的反式构型结合HER2,驱动多种作用机制。对目前进行的这项单臂 2a 期研究 (NCT04224272) 的先前分析表明,在接受重度治疗的HER2+/HR+转移性乳腺癌患者中,Zani + Palbo + Fulv表现出抗肿瘤活性且具有可耐受的安全性。在此,我们汇报6个月时的无进展生存主要终点(PFS6)和其他终点结局。
研究方法
入组患者须具备以下条件:HER2+/ HR+,同时为不可切除的局部晚期或转移性乳腺癌;ECOG PS(Eastern Cooperative Oncology Group表现状态评分)≤1;之前接受过至少曲妥珠单抗、帕妥珠单抗和T-DM1的治疗;并且之前没有使用过CDK4/6抑制剂。患者接受了Zani(20 mg/kg 每2周一次)+ Palbo + Fulv(标准剂量)—— 第 1 部分评估中确定的推荐剂量。第2部分的主要终点是PFS6。其他终点包括中位无进展生存期 (mPFS)、确认的客观缓解率 (RECIST v1.1)、疾病控制率和缓解持续时间。 PAM50分析是探索性的。对经中心确认的HER2阳性(ccHER2)亚组进行事后分析。
研究结果
截至 2023 年 8 月 3 日,51 名患者(中位年龄 [范围] 54 岁 [36-77])接受了 zani + palbo + fulv 治疗,中位随访时间为 16.1 个月。在 51 名患者中,32 名 (63%) 为 ccHER2+。9名患者 (18%) 仍在接受治疗; Zani 治疗的中位(范围)持续时间为 8.4(1.0-29.5)个月。在转移性疾病中,患者接受了中位(范围)4个(1-12)既往全身治疗方案、3 (1-10) 种不同 HER2 靶向治疗和 1 (0-5) 种既往内分泌治疗; 12 名 (24%) 患者之前接受过 T-DXd,11 名 (22%) 患者之前接受过 fulv。
主要终点PFS6 为 67%(ccHER2+ 子集中为 69%)。 mPFS 为 11.7 个月(ccHER2+ 子集中为 14.9 个月)。其他疗效终点见下表。
表3. 三联方案 (Zani + Palbo + Fulv) 对 HER2+/HR+ mBC 的疗效
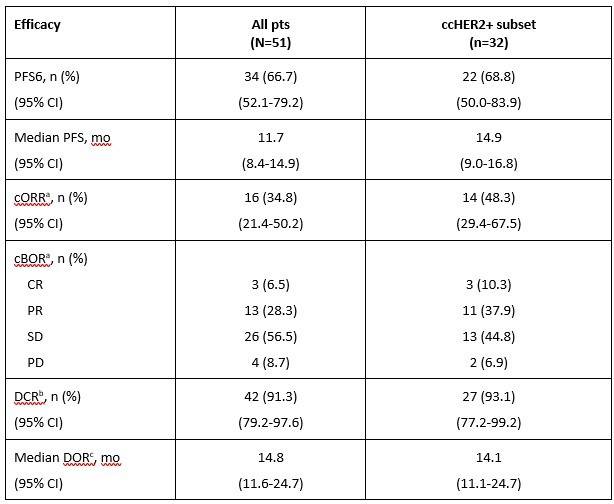
a 患有可测量疾病的患者(所有患者n=46;ccHER2+子集n=29)。
b 根据 RECIST 1.1 定义的 CR、PR、非 CR/非 PD(仅具有非目标病变的患者)或 SD 的最佳缓解。
c DOR 的患者(所有患者n=16 ; ccHER2+ 子集n=14)。
cBOR,确认最佳总体反应; ccHER2+,经中心确认的 HER2+; CI,置信区间; cORR,确认的客观缓解率; CR,完全缓解; DCR,疾病控制率; DOR,缓解持续时间; HER2+,人表皮生长因子受体2阳性; HR+,激素受体阳性; mBC,转移性乳腺癌; PD,疾病进展; PFS,无进展生存期; PFS6,6 个月无进展生存期; PR,部分缓解; RECIST 1.1,实体瘤疗效评估标准 1.1 版; SD,疾病稳定。
29 名患者可进行 PAM50 亚型分析(57%;1 名基底型;16 名 HER2 富集型;12 名Luminal B型)。与 HER2 富集型相比,Luminal B 与更长的 mPFS(11.7 个月 vs 9.3 个月;p=0.74)在数值上相关,但在统计学上没有显著差异,两种亚型PFS6相似(66.7% vs 62.5%)。
最常见 (>20%) 治疗(zani、palbo 和/或 fulv)相关不良事件 (TRAE) 为腹泻(80%)、中性粒细胞计数减少/中性粒细胞减少(59%)、恶心(39%)、口腔炎(37%)、贫血(29%)、呕吐(25%)和乏力(24%)。在至少2名患者中≥3级 TRAE 包括中性粒细胞计数减少/中性粒细胞减少(53%)、腹泻(14%)、贫血(10%)、血小板减少(6%)、低钾血症(4%)和低镁血症(4%)。报告一项严重的 TRAE(转氨酶升高)。特别关注的 AE包括:6 名患者出现心脏事件(全部为左心室射血分数降低;5名患者为1或2级事件,1名患者为3级事件),2名患者出现输注相关反应(均为1级)。 3 名患者因 AE 终止使用哌柏西利;1 名患者因 AE 停用 zani 和氟维司群。未报告治疗相关的死亡。
研究结论
Zani + palbo + fulv 显示出有潜力的 PFS6 和 mPFS 以及持久的缓解,且安全性良好。这些结果支持针对 HER2+/HR+ mBC 重度治疗患者,进一步开发新型无化疗治疗方案。
中文标题:ADAPTcycle试验:年龄和卵巢功能抑制(OFS)对短期术前内分泌治疗的内分泌应答的影响(n=4334)
原标题:Impact of age and ovarian function suppression (OFS) on endocrine response to short preoperative endocrine therapy (ET): Results from the multicenter ADAPTcycle trial (n=4,334
讲者:Oleg Gluz, West German Study Group, Moenchengladbach, Germany; Breast Center Niederrhein, Ev. Hospital Bethesda, Moenchengladbach, Germany
研究背景
在HR+/HER2-早期乳腺癌(EBC)中,短期术前内分泌治疗(ET)是一种有前景的工具,可基于ET后2-4周的Ki67减少来评估ET的疗效。大型前瞻性试验显示,内分泌治疗后较低的Ki-67 (Ki67post)水平与良好预后相关。WSG-ADAPT提示,ET应答是判定不具有辅助化疗明确适应症患者是否进行辅助化疗的有效标准,如N0 和复发评分(RS、Oncotype DX®)RS 16-25 或 N1 和 RS ≤ 25的绝经前患者。Ⅲ期 ADAPTcycle 试验初步结果表明,绝经前患者联合使用卵巢功能抑制(OFS)和他莫昔芬(TAM)或芳香化酶抑制剂(AI)可提高术前内分泌治疗(ET)疗效。在最终筛选人群中,我们验证了该结果,并评估年龄、复发分数(RS)、个体生物标志物和OFS对ET应答的影响。
研究方法
在ADAPTcycle试验中(从德国84个医疗中心招募5,290例患者,1,670例患者随机分组),RS>25的N0-1期患者或RS ≤25且ET应答良好的N2-3期患者被随机分配至(新)辅助化疗(CT)序贯ET组和瑞波西利 + AI组(绝经前患者+GnRH)。在绝经前患者中,无论 ET 应答如何,RS ≤25的N1期患者或RS 16-25的N0患者均被允许参加,但仅建议对 ET 应答者进行随机化;在术前阶段,推荐使用 OFS+TAM 或 AI 进行 ET 应答评估。
研究结果
对所有具有完整基线特征(包括 RS)和 ET 应答数据的患者(n=4,334)进行分析。ET 应答定义为治疗 2-4 周(OFS者:4 周)后 Ki67post ≤10%(中心病理学评估)。通过 IHC 和 mRNA 分析 ER、PR 和 HER2 水平。中位年龄为 56 岁(22-87 岁)。 cT2-4患者占55%,cN+患者占28%,G3患者占42%。中位 RS 为 20,中位基线 Ki67指数为25%。
1,368名患者年龄≤50岁且绝经前(“≤50 岁”),其中314 (23.0%) 例和 255 (18.6%)例患者分别接受 AI+OFS 和 TAM+OFS 治疗。2,966例患者年龄>50 岁或绝经后(“>50 岁”),其中 2,565 人接受 AI (86.5%)治疗。 “≤50 岁”患者中 48.2%具有ET应答,而“>50 岁”患者中ET应答率为72.7% (p < 0.001)。单用 TAM 的“≤50岁”与“>50岁”患者之间 ET 应答率存在显著差异(34.7% vs 46.4%);在“≤ 50 岁”患者中,TAM+OFS治疗ET应答率为55.7%,AI+OFS治疗ET应答率为76.4%;在“>50 岁”AI 治疗患者 ET 应答率为76.8%。此外,OFS 治疗具有更高的ET应答率(单变量和多变量分析),即使在部分(n=78)>50 岁的绝经前患者中亦观察到类似结果。值得注意的是,即使在 RS >25 的患者中,AI 治疗也观察到较高的ET应答率:66.7%(“≤50岁”,AI+OFS)、55.6%(“>50岁”,AI),而单用 TAM 的应答率较低(>50岁:18.2%;<50岁:15.8%)。
在单变量和多变量分析中,“≤50岁”患者 ET 应答率与 ET 类型、RS 和基线 Ki67 相关,但与年龄亚组无关(≤40 岁 vs 41-50 岁)。单变量分析显示,IHC 或 RT-PCR检测的ER、PR和 HER2 表达与 ET 应答相关。在“>50岁”的患者中,单变量和多变量分析发现,ET类型、RS和基线Ki67,以及ER表达(IHC检测)和ESR1、PR和HER2表达(RT-PCR检测)与较高的ET应答率相关。
研究结论
ADAPT 和 ADAPTcycle试验纳入约 10,000 名绝经前和绝经后患者,提供了有关ET应答的最大国际数据库。ADAPTcycle证实了ADAPT中TAM 或 AI患者ET应答率;无论 RS 如何,联合OFS 均可改善 ET 应答。ET应答评估具有治疗决策价值,特别是对于≤50岁N0-1 患者。即使在高 RS 的患者中,ET 应答也可提供关键信息。优化术前ET,尤其是在绝经前患者中,有可能使患者豁免化疗。
[1] Peter Schmid, et al. Neoadjuvant pembrolizumab or placebo plus chemotherapy followed by adjuvant pembrolizumab or placebo for early-stage triple-negative breast cancer: Updated event-free survival results from the phase 3 KEYNOTE-522 study. 2023 SABCS Abstract LBO1-01.
[2] Luca Gianni, et al. Pathologic complete response (pCR) of neoadjuvant therapy with or without atezolizumab in HER2-positive, early high-risk and locally advanced breast cancer: APTneo Michelangelo randomized trial. 2023 SABCS Abstract LBO1-02.
[3] Sherene Loi, Samuel Niman, Nicholas Zdenkowski, et al. Randomized Phase II Study of Neoadjuvant Nivolumab (N) 2 week lead-in followed by 12 weeks of concurrent N+carboplatin plus paclitaxel (CbP) vs concurrent N+CbP in Triple Negative Breast Cancer (TNBC): (BCT1902/IBCSG 61-20 Neo-N). 2023 SABCS Abstract LBO1-03.
[4] Santiago Esc, Juan Mig, Emilio Alba, et al. Primary results from a phase 2a study of zanidatamab (zani) + palbociclib (palbo) + fulvestrant (fulv) in HER2+/HR+ metastatic breast cancer (mBC). 2023 SABCS Abstract LBO1-04.
[5] Oleg Gluz, Matthias Chri, Ulrike Nitz, et al. Impact of age and ovarian function suppression (OFS) on endocrine response to short preoperative endocrine therapy (ET): Results from the multicenter ADAPTcycle trial (n=4,334).2023 SABCS Abstract LBO1-05.
排版编辑:肿瘤资讯-Paine











 苏公网安备32059002004080号
苏公网安备32059002004080号


