人类表皮生长因子受体2(HER-2)是胃癌靶向治疗的经典靶点,我国胃癌患者HER-2阳性率为12%~13%[1,2]。2010年,ToGA研究[3]开启了胃癌抗HER-2靶向治疗先河,但是此后该领域研究历经坎坷,直到近年来我国自主研发的抗HER-2抗体偶联药物(ADC)打破困境,为HER-2阳性晚期胃癌患者带来了新的治疗选择。南通市肿瘤医院袁小鹏医师分享1例HER-2阳性不可切除局部进展期胃癌病例:患者男性,71岁,胃食管结合部腺癌,IIIb期。单纯放疗进展后,一线采用免疫联合曲妥珠单抗治疗,出现严重不良反应。二线采用我国自主研发的ADC药物治疗达到疾病稳定(SD),目前疾病控制已生存23个月。【肿瘤资讯】将病例诊疗过程整理如下,并特邀南通市肿瘤医院王向前主任对病例进行点评。
病例介绍
硕士研究生,主治医师,南通市肿瘤医院放疗科
南通肿瘤防治专科联盟胃肠肿瘤委员会第一届放射治疗专业组秘书
南通市抗癌协会肿瘤转化医学会委员
南通大学教学实践基地兼职讲师
主持南通市卫健委课题1项
以第一作者撰写SCI论文2篇
基本情况
患者,男性,71岁。
主诉:因“发现贲门胃底癌5个月 ”于2019年6月就诊。
既往史:高血压;慢性肾功能不全;脑梗死。
家族史:无特殊。
既往诊疗经过
2019年1月2日 因“上腹部不适”就诊于当地医院,查胃镜示:贲门占位,病理示:“胃底-贲门”腺癌。
2019年1年11日 就诊于复旦大学附属中山医院,查胃镜示:贲门MT,慢性胃炎。腹部盆腔CT示:贲门MT、胃周及腹膜后淋巴结,双肾囊肿,双肾结石,右输尿管上段结束伴上方尿路积水、右肾功能减退。头颅MRI示:右侧侧脑室旁急性梗塞灶,脑内多发腔隙性缺血性梗塞。
PET/CT示:结合病史,提示为贲门胃底癌,胃小弯稍大淋巴结,双肾囊肿、肾结石,右侧输尿管上段结石伴近段输尿管肾盂扩张,两肺小结节,随访。
2019年2月30日 FISH检测:HER-2阳性(图1)。
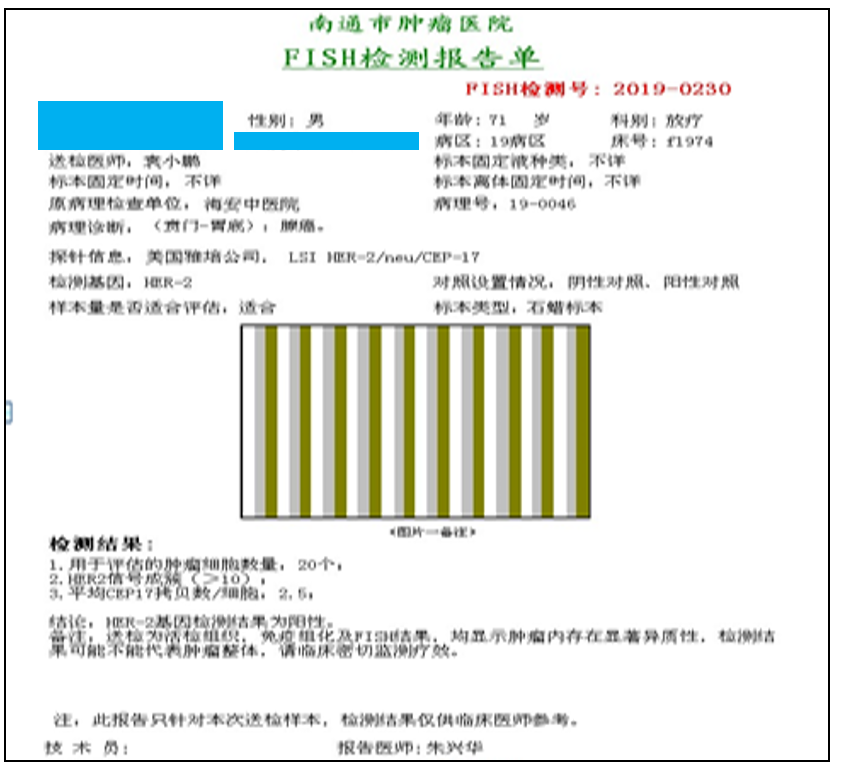 图1 2019年2月FISH检测
图1 2019年2月FISH检测
因患者存在慢性肾病、急性脑梗塞,经泌尿外科、肾内科、神经内科、肿瘤内科等会诊,考虑不能耐受手术治疗。后患者未进一步治疗。
2019年5月11日 因“上腹部不适”就诊于当地医院,查全腹部+胸部CT示:贲门胃底增厚,建议结合胃镜检查,肝胃间隙小淋巴结,右输尿管上段结石伴近段尿路轻度扩张。
本次诊疗经过
2019年7月1日 本院超声检查示:双肾皮髓质欠清,双侧输尿管不扩张,右肾大小8*4.2cm,左肾大小8.3*3.7cm,肝胆胰脾未见明显异常(正常大小约10-12*5-6cm)(图2)。
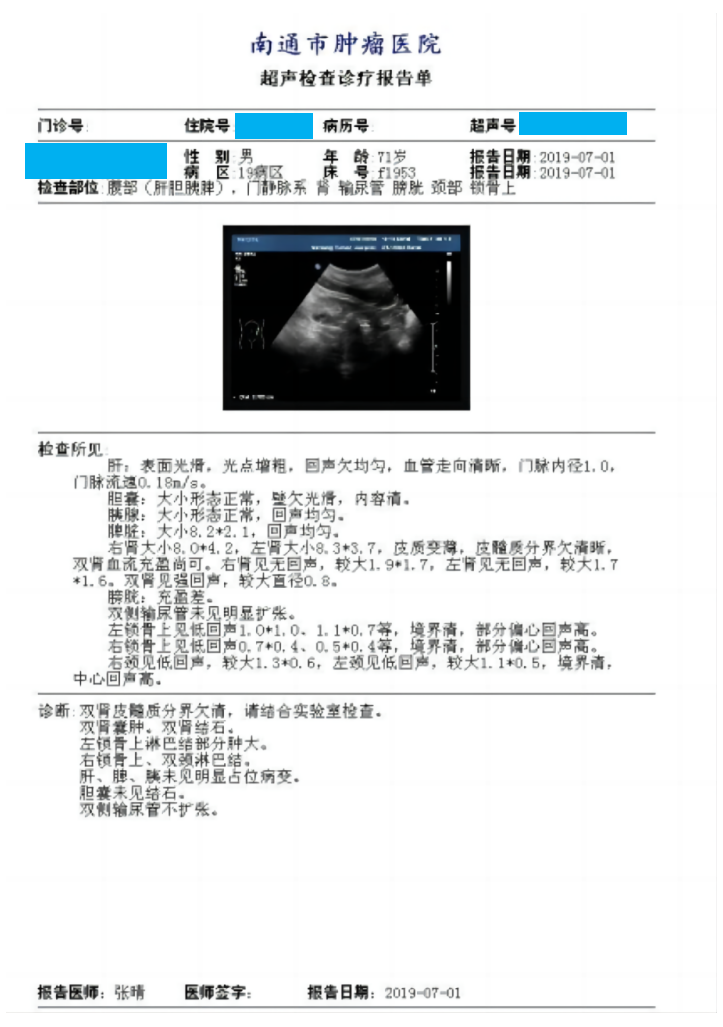 图2 2019年7月超声检查
图2 2019年7月超声检查
2019年7月肾功能:肌酐值341umol/L,尿素16.29mmol/L。
2019年7月2日 全身骨扫描:多个胸腰椎体边缘、左侧第五肋骨放射性增高,考虑退行性改变可能(图3)。
 图3 2019年7月全身骨扫描
图3 2019年7月全身骨扫描
2019年7月3日 食道造影示:食管下段贲门癌(图4)。
 图4 2019年7月食道造影
图4 2019年7月食道造影
外院肾内科会诊:既往有高血压病史、B超示肾脏缩小、肌酐值及尿素值升高,综合考虑高血压引起固缩肾可能性大,应尽量避免肾脏毒性药物,抗肿瘤药物慎重,可予控制血压、护肾药物支持治疗,定期监测肾功能指标。
入院诊断:1.胃食管结合部腺癌cT3N1M0,IIIb期;2.慢性肾功能不全;3.脑梗死;4.原发性高血压2级,极高危。
局部放疗
考虑到患者慢性肾功能不全、脑梗死,经多学科讨论,选择单纯放疗。2019年7月4日始予贲门原发病灶及淋巴引流区,PTV DT:6000cGy/30F。放疗期间定期复查食道造影提示:病灶较前缩小(图5)。疗效评价部分缓解(PR)。
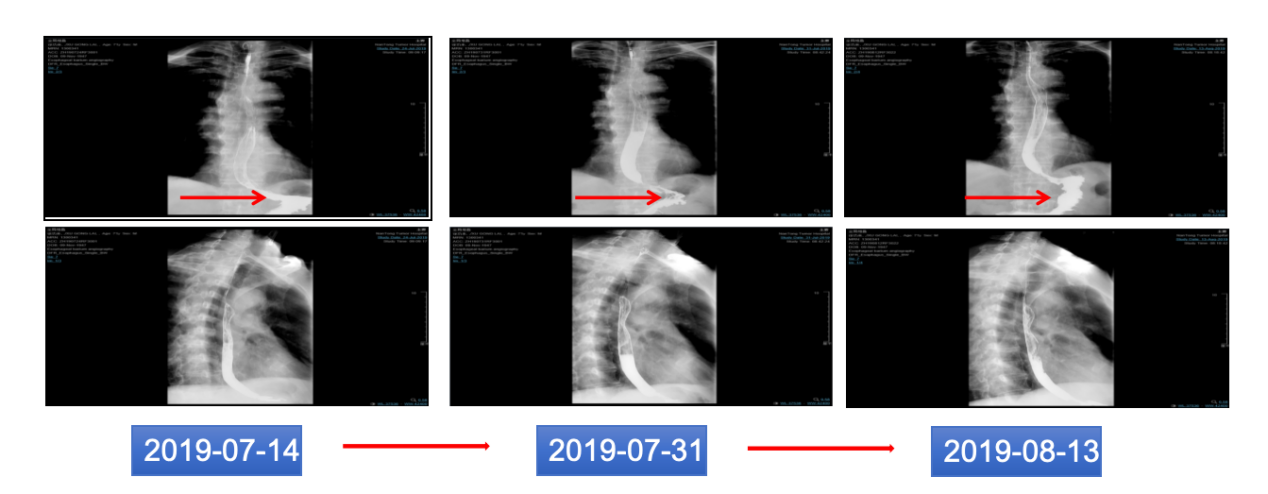 图5 放疗期间食道造影
图5 放疗期间食道造影
2019年7月至2019年11月血液指标变化:肌酐值下降,CEA下降(图6)
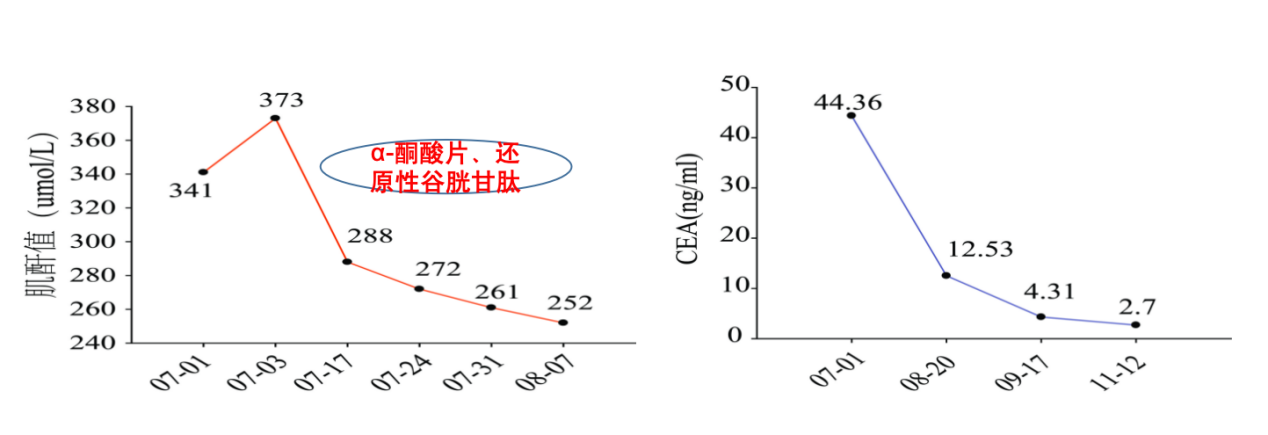 图6 2019年7月至11月血液指标变化
图6 2019年7月至11月血液指标变化
2019年11月20日 复查胃镜示:贲门癌放疗后改变,浅表性胃炎(图7)。
 图7 2019年11月胃镜检查
图7 2019年11月胃镜检查
考虑患者高血压合并基础肾病、脑梗死,化疗风险大,建议单纯靶向治疗维持,患者家属拒绝靶向治疗。
2020年3月 因新冠肺炎影响,患者于当地复查胸部+上腹部CT及食道造影未见明显异常。
2020年6月16日 胸部+上中腹部增强CT示:贲门胃壁增厚与前基本相似,双侧锁骨上、纵膈及后腹膜多发肿大淋巴结转移,肝脏稍低密度结节,考虑转移(图8)。
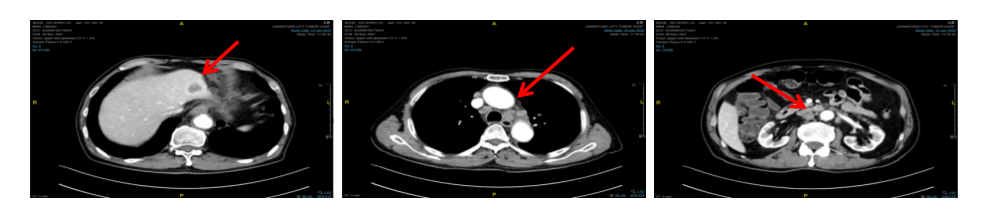 图8 2020年6月胸腹部增强CT
图8 2020年6月胸腹部增强CT
2020年6月18日 胃镜示:贲门癌放疗后改变(图9)。
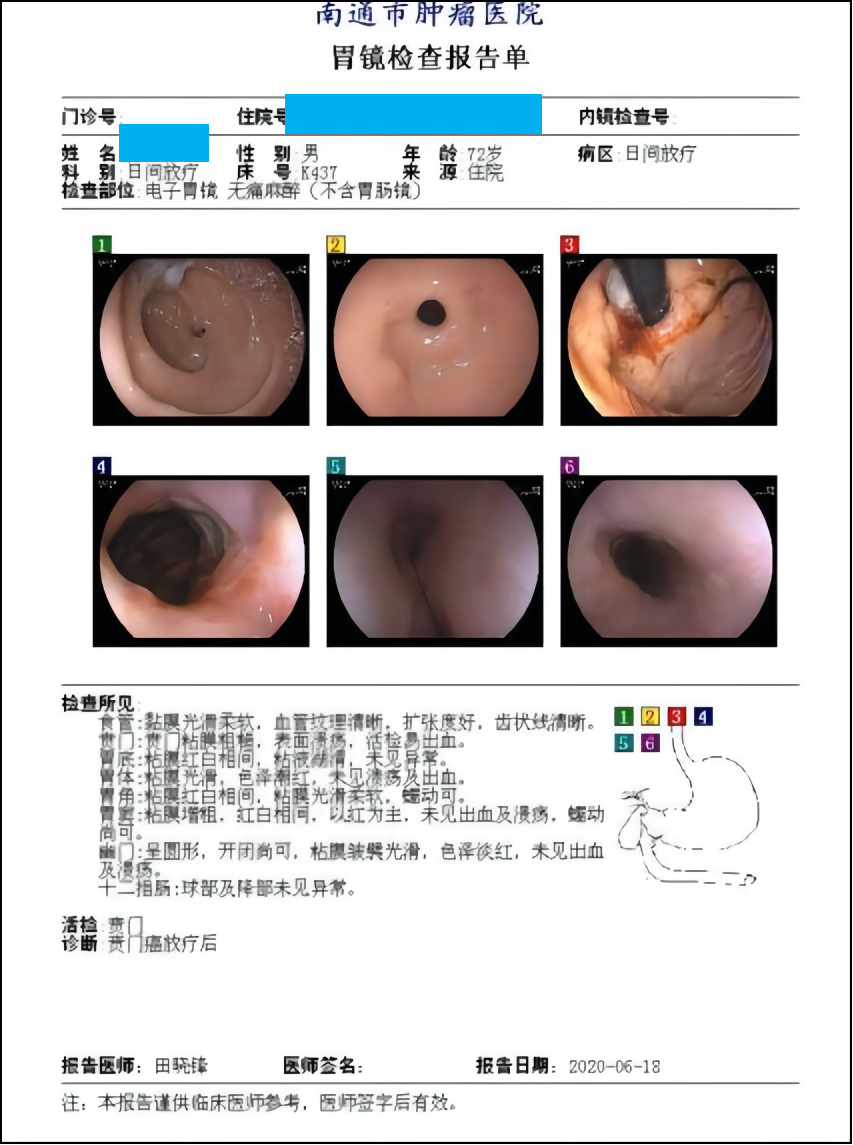 图9 2020年6月胃镜检查
图9 2020年6月胃镜检查
病理示:(贲门)急慢性炎伴肠化,少量腺体增生异性,若临床怀疑恶性肿瘤建议重新活检(图10)。
 图10 2020年6月病理检查
图10 2020年6月病理检查
晚期一线治疗
排除相关禁忌,2020年6月19日、7月11日 予替雷利珠单抗200mg d1免疫治疗2周期,2020年6月22日、7月13日 予曲妥珠单抗(首次520mg,其次390mg)靶向治疗2周期。
2020年8月4日 复查CT提示:贲门病灶及纵隔、肝脏、后腹膜转移病灶较前缩小(图11)。
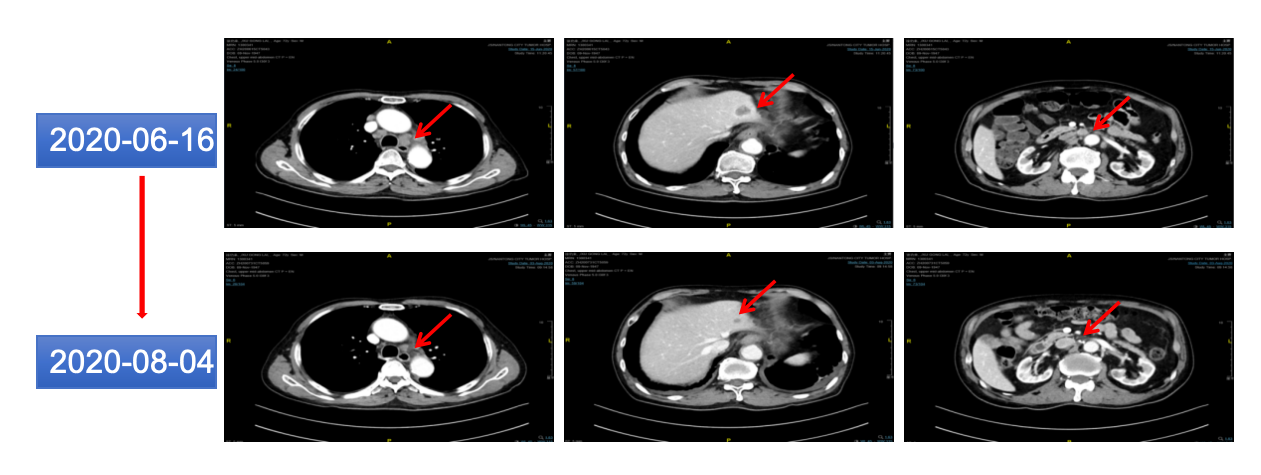 图11 2020年8月胸腹部CT
图11 2020年8月胸腹部CT
2020年6月至2020年8月血液指标变化:CEA下降,肌酐值升高(图12)。
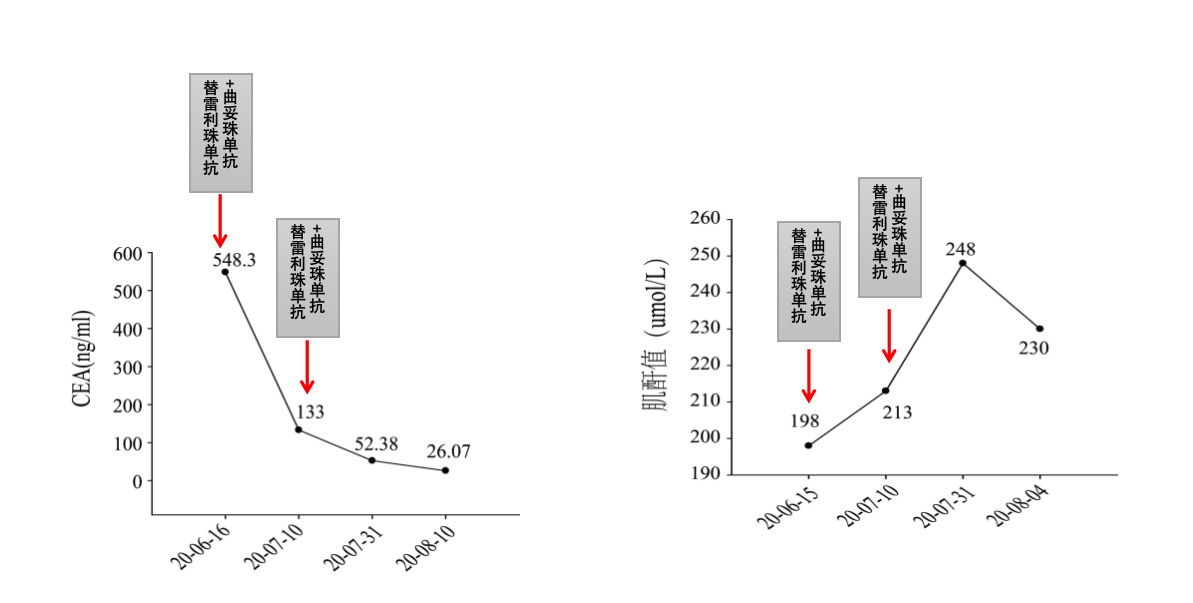 图12 2020年6月至8月血液指标变化
图12 2020年6月至8月血液指标变化
2020年7月31日 患者入院检验科汇报危急值血糖:52.44mmol/L。尿糖(4+),酮体(-)。考虑血糖高渗状态,内分泌科会诊后,予积极对症处理后好转,平素予胰岛素调节。考虑免疫治疗引起的内分泌毒性。
排除相关禁忌,2020年8月10日予替雷利珠单抗200mg d1免疫治疗1周期,2020年8月7日予曲妥珠单抗390mg靶向治疗1周期。
后续家中予门冬胰岛素30及地特胰岛素调节血糖,定期监测血糖,血糖控制可,最高在20mmol/L以下。
2020年9月1日 患者入院当日漏打一次胰岛素,入院查血糖再次报危急值,血糖44.21mmol/L,予胰岛素持续泵入调节稳定后,2020-09-03曲妥珠单抗390mg靶向治疗1周期,考虑不能耐受免疫治疗,暂停替雷利珠单抗免疫治疗,转入综合医院内分泌科治疗。
外院内分泌科进行专科治疗,考虑免疫治疗引起的胰腺功能损伤可能性大,暂停靶向及内分泌治疗,予皮下胰岛素泵持续泵入治疗,血糖控制平稳。
2020年11月19日 复查CEA:3.54ng/ml。较前降低。复查CT示:贲门病灶及纵隔、后腹膜、肝脏转移灶较2020-08-04缩小(图13)。
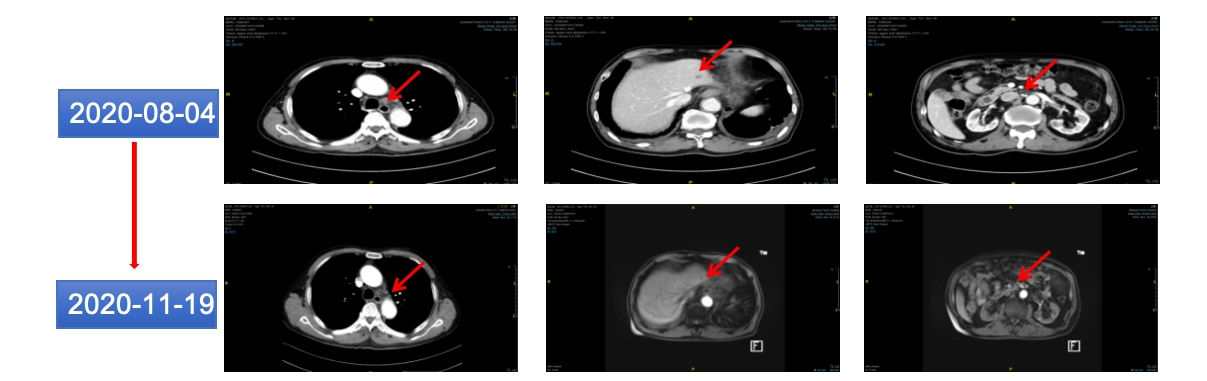 图13 2020年11月胸腹部CT
图13 2020年11月胸腹部CT
2020-11-19、2020-12-11、2021-01-11、02-04、03-01、03-24、04-16、05-11曲妥珠单抗390mg靶向治疗8周期。定期复查CT示:贲门病灶及纵隔、后腹膜、肝脏转移灶与前相仿(图14)。
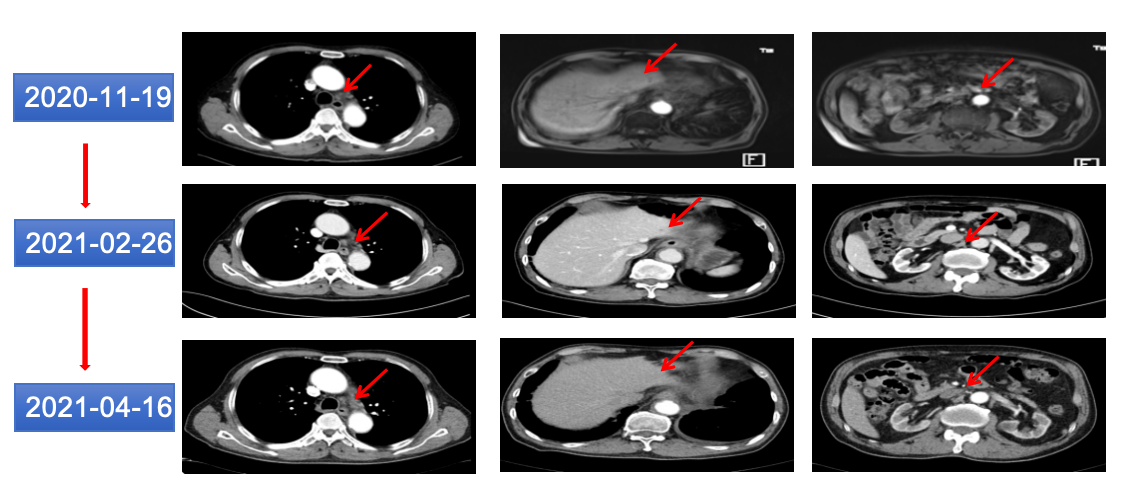 图14 2021年2月和4月胸腹部CT
图14 2021年2月和4月胸腹部CT
2021-05-11、06-01、06-22、07-13、08-04曲妥珠单抗390mg靶向治疗5周期。后复查心脏彩超示:EF 40%。考虑曲妥珠单抗引起的心脏衰竭,后暂停抗HER-2治疗。期间复查胸腹部CT及食道造影病情稳定。后患者定期复查,暂停治疗。
2021年11月1日 复查CEA升高,12-10由7.05ng/ml上升至38.7ng/ml,胸腹部CT及食道造影与前相似。PET/CT未见明显转移、复发征象。 结合患者疾病发展规律,CEA指标升高,高度提示肿瘤复发或者转移可能性大。
晚期二线治疗
考虑到患者既往有高血压病史、B超示肾脏缩小、肌酐值及尿素值升高,综合考虑高血压引起固缩肾可能性大,应尽量避免肾脏毒性药物,抗肿瘤药物慎重。曲妥珠单抗药物导致的心脏衰竭,再次使用类似的曲妥珠单抗、帕妥珠单抗、伊尼妥单抗、吡咯替尼等心脏毒性风险大。经多学科讨论,2021-12-13、12-29、2022-01-18、03-04、04-06、07-04、09-13改予维迪西妥单抗120mg ivgtt q2w方案治疗。患者全身虚弱乏力明显,口腔溃疡严重,间歇性予中药调理后好转,患者CEA指标治疗后明显下降至3.04ng/ml(正常范围),由于间歇期延长,CEA反复升高,最高达35ng/ml。定期复查胸腹部CT及食道造影与前相似(图15)。
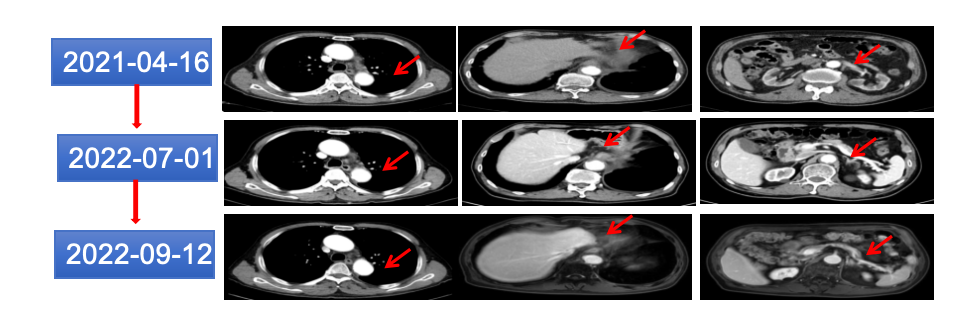 图15 2022年7月和9月胸腹部CT
图15 2022年7月和9月胸腹部CT
2022年9月11日 全身骨扫描、胃镜正常。
2022年11月18日 胸部CT平扫+增强:贲门癌放疗后,与2022-09-09片相比,贲门部胃壁稍增厚与前相仿,双侧锁骨上、纵隔淋巴与前相仿,所扫胃窦部胃壁稍增厚,与前基本相似(图16)。
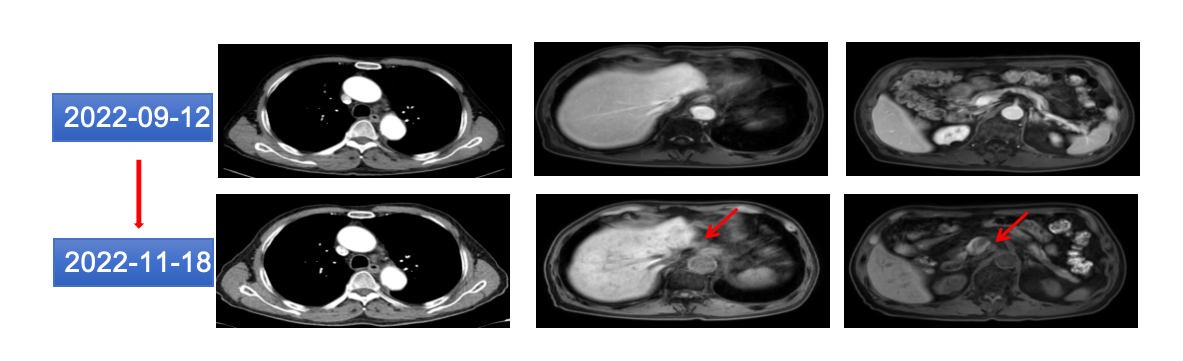 图16 2022年11月胸腹部CT
图16 2022年11月胸腹部CT
2022年11月全腹部MR平扫+增强:贲门癌综合治疗后,与2022-09-08片相比,贲门部胃壁稍增厚与前相仿,后腹膜部分淋巴结,较前增大(Se:1201004,Im:43/46),肠系膜根部部分淋巴结较前增多,转移不除外。疗效评价:疾病进展(PD)。
考虑到治疗间歇期过长,疾病进展,排除禁忌,2022-11-21、12-08起行注射用维迪西妥单抗120mg ivgtt q2w方案治疗2周期。CEA由355ng/ml降至21.9ng/ml。
2023年1月13日 因胸痛2天入院查胸主动脉CTA示:降主动脉局部管腔增宽,管壁边缘环形增高,考虑动脉粥样硬化伴壁内溃疡,局部壁间血肿形成。考虑夹层可能,转入综合医院介入科进一步治疗,予内科对症处理后好转,拒绝进一步外科手术治疗。
2023年3月28日 入院查CEA由21.9ng/ml上升至80.2ng/ml,CT示:降主动脉局部管腔增宽,管壁边缘环形增高及钙化,与前基本相似,贲门部胃壁较前增厚(图17)。
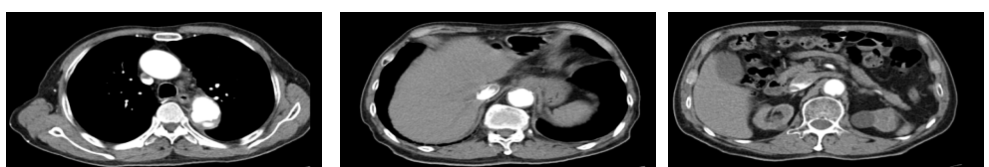 图17 2023年3月胸腹部CT
图17 2023年3月胸腹部CT
排除禁忌,2023-03-28、04-27、06-29、09-01、09-22起行注射用维迪西妥单抗120mg d1方案间歇治疗。期间定期复查胸腹部CT示贲门病灶、多发转移病灶较前相仿(图18)。疗效评价:SD。
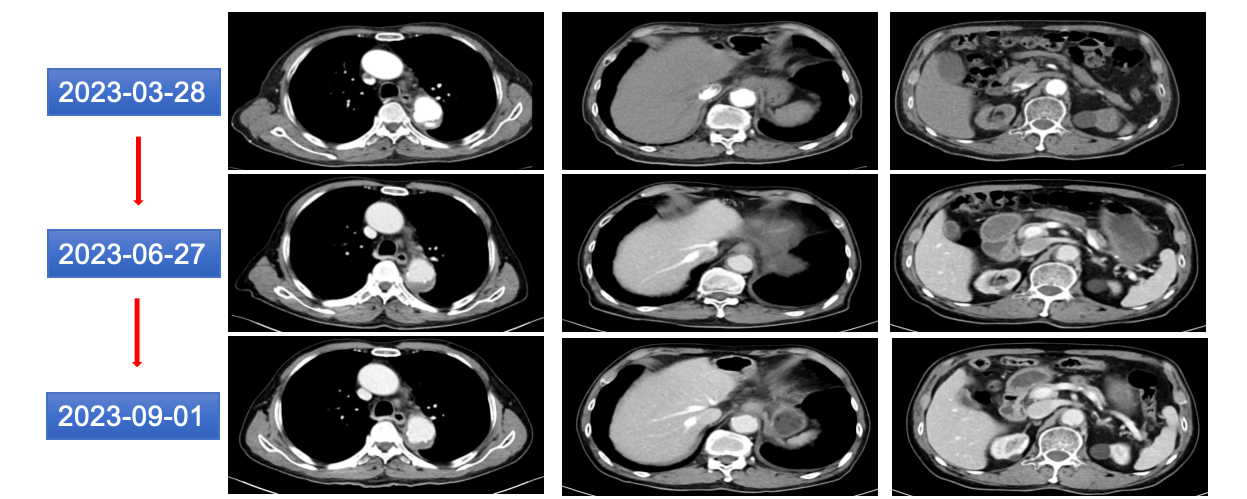 图18 2023年6月和9月胸腹部CT
图18 2023年6月和9月胸腹部CT
2023年11月3日,胸部+全腹部增强CT示:贲门癌放疗后,与2023-09-01相比,贲门部胃壁稍增厚,双侧锁骨上、纵隔及后腹膜淋巴,均与前相似,降主动脉局部管腔增宽,管壁边缘环形稍高密度影及钙化,与前基本相似(图19)。
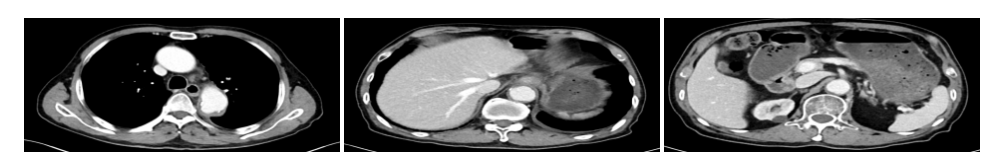 图19 2023年11月胸腹部CT
图19 2023年11月胸腹部CT
2023年11月9日 电子胃镜示:慢性萎缩性胃炎(C-1),贲门癌治疗后,未见新生物(图20)。
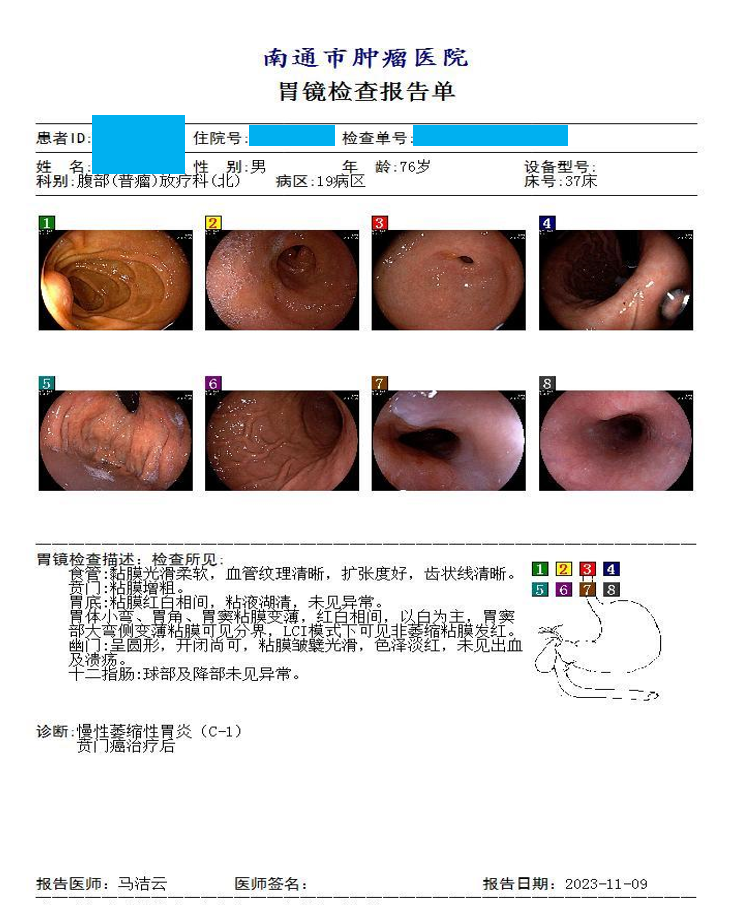 图20 2023年11月胃镜检查
图20 2023年11月胃镜检查
2023年6月至2023年11月血液指标变化:CEA下降(图21)。
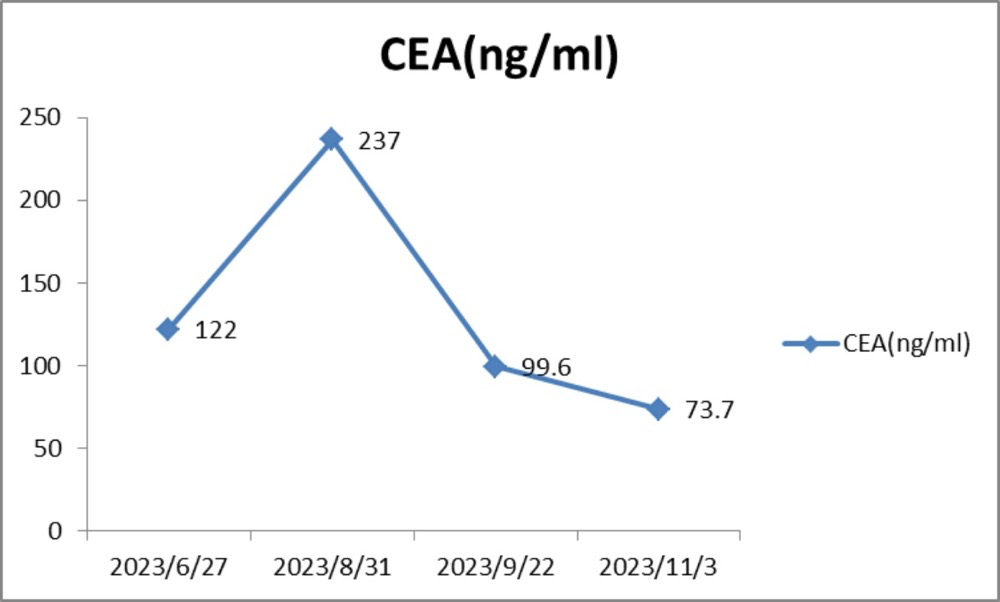 图21 2023年6月至11月血液指标变化
图21 2023年6月至11月血液指标变化
诊疗经过见图22。
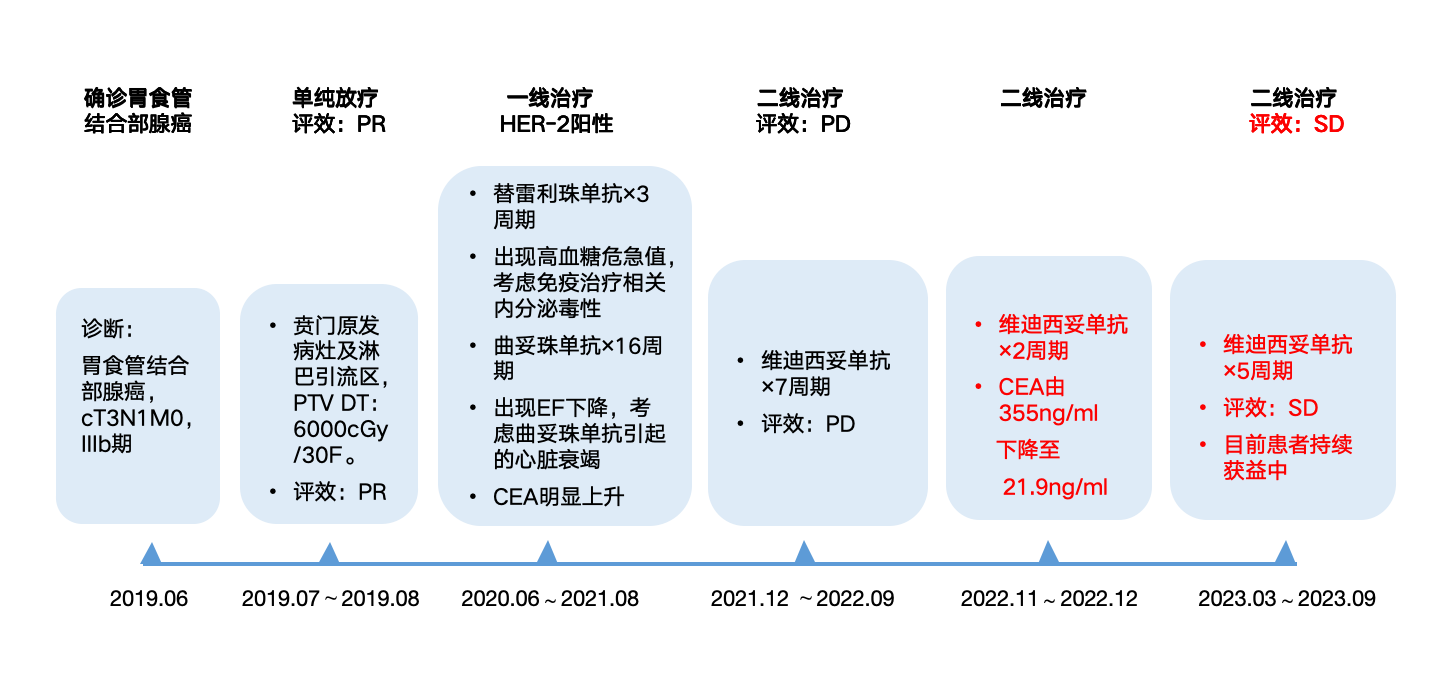 图22 诊疗经过
图22 诊疗经过
病例总结
该患者老年男性,局部进展期胃食管结合部腺癌,HER-2阳性。采用6000cGy/30F放疗达到PR,持续10个月后出现双侧锁骨上、纵隔及后腹膜多发肿大淋巴结转移,肝脏转移。考虑到患者合并高血压、脑梗死、慢性肾功能不全,一线治疗选择曲妥珠单抗联合PD-1单抗治疗,治疗期间患者出现免疫治疗相关内分泌毒性,以及曲妥珠单抗引起的心脏衰竭,暂停治疗3个月后复查CEA升高。二线治疗采用抗HER-2 ADC治疗7周期评效PD,继续治疗2周期后CEA明显下降,治疗14周期后达到SD。2023年11月最近一次复查CT,疗效评价仍为SD,目前疾病控制已经超过23个月。
病例点评
南通市肿瘤医院放疗科副主任、医务科副科长
南通大学兼职副教授
中国抗癌协会泌尿男生殖系肿瘤专业委员会青年委员
江苏省抗癌协会肿瘤放射治疗专业委员会委员
江苏省医学会放射肿瘤学分会青年委员
江苏省医师协会临床精准医疗专业委员会青年委员
江苏省肿瘤质控中心乳腺癌质控专家委员会委员
南通市医学会放射肿瘤学分会副主任委员
南通市抗癌协会康复分会副主任委员
南通市抗癌协会肿瘤放射治疗专业委员会常委
南通市抗癌协会肿瘤精准治疗专业委员会常委
南通市医师协会肿瘤放射治疗医师分会委员
南通市青年医学重点人才
我国胃癌每年的发病人数和死亡人数均居世界首位,而胃癌是一种异质性很强的疾病,传统化疗和放疗对提升和改善进展期或晚期胃癌的预后极为有限[4]。近年来,随着多组学技术的发展,基于生物标志物的精准治疗给胃癌治疗带来了翻天覆地的变化。2010年发表的ToGA研究[3]使HER-2阳性胃癌治疗进入分子靶向时代,曲妥珠单抗联合化疗成为HER-2阳性晚期胃癌一线标准治疗方案,但是曲妥珠单抗存在潜在的心脏毒性风险,在治疗前有心功能不全的患者可能需谨慎使用[5]。因此,寻找更加安全有效的抗HER-2治疗药物至关重要。
ADC药物是近年来HER-2阳性胃癌治疗领域的新星。我国自主研发的新型抗HER-2 ADC药物在其关键研究C008[6]中,针对≥2线标准治疗失败的HER-2 阳性晚期胃癌患者,客观缓解率(ORR)达到24.8%,疾病控制率(DCR)为42.4%,中位无进展生存期(PFS)为4.1个月,中位总生存期(OS)达到7.9个月。安全性方面,主要不良反应为血液学毒性,未发现间质性肺炎、心脏毒性等严重不良反应,无治疗相关死亡。基于C008研究结果,该ADC药物在国内获批HER-2阳性晚期胃癌治疗适应证,2023版中国临床肿瘤学会(CSCO)胃癌诊疗指南进一步提升了其推荐等级[7]。另外新版CSCO指南在转移性胃癌二线靶向治疗注释中标注,ADC药物用于胃癌二线治疗可取得良好的效果[7]。
对于HER-2阳性晚期胃癌患者,抗HER-2靶向治疗能够带来良好生存获益。在患者出现各种治疗禁忌症的时候,应尽可能寻求适合的个体化治疗方案,同时做好充分的沟通。如果治疗过程中出现各种不良反应,应参考临床指南、规范积极应对,并适时调整治疗策略。本例患者为HER-2阳性不可切除局部进展期胃腺癌,放疗后出现转移,一线治疗选择曲妥珠单抗联合PD-1单抗治疗,出现严重不良反应。二线采用抗HER-2 ADC药物治疗14周期达到SD,目前持续获益中。期待我国自主研发的ADC药物在HER-2阳性晚期胃癌领域取得更多新进展,为患者提供更加安全高效的治疗方案。
[1] Sheng WQ, Huang D, Ying JM, et al. HER-2 status in gastric cancers: a retrospective analysis from four Chinese representative clinical centers and assessment of its prognostic significance[J]. Annals of oncology: official journal of the European Society for Medical Oncology, 2013,24(9):2360-2364.
[2] Huang D, Lu N, Fan Q, et al. HER-2 status in gastric and gastroesophageal junction cancer assessed by local and central laboratories: Chinese results of the HER-EAGLE study. PLoS One. 2013;8(11):e80290.
[3] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER-2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
[4] 曹晖, 赵文毅, 赵恩昊. 以分子分型为基础的胃癌精准治疗策略及发展趋势. 中华消化外科杂志, 2023,22(10):1160-1165.
[5] 注射用曲妥珠单抗说明书.
[6] Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER-2 therapeutic antibody RC48 in patients with HER-2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond). 2021;41(11):1173-1182.
[7] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胃癌诊疗指南[M]. 北京:人民卫生出版社,2023.
排版编辑:肿瘤资讯-olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


