经过近百年的发展,目前抗体偶联药物(ADC)已发展至第三代。ADC是一种新型抗肿瘤药物,它利用单克隆抗体(mAb)的特异性,将细胞毒药物精准递送至表达目标抗原的肿瘤细胞,最大限度减少细胞毒药物对正常组织损伤的同时,实现了更宽的治疗窗,而ADC各个结构的特征对整体药物的特征、疗效、安全性均会产生影响。上一期【肿瘤资讯】特邀复旦大学附属肿瘤医院王佳蕾教授解读了ADC的发展历程,本期王佳蕾教授将进一步解析ADC的整体特点及理性设计。
复旦大学附属肿瘤医院胸部肿瘤内科主任
复旦大学胸部肿瘤研究所副所长
中国抗癌协会临床化疗专委会青委会副主任委员
上海市女医师协会肺癌专业委员会主任委员
中国临床肿瘤学会(CSCO)非小细胞肺癌专委会、血管靶向专委会、老年肿瘤防治专委会委员
中国医疗保健促进会肿瘤内科分会、胸部肿瘤分会常委
中国医药教育协会肺部肿瘤专业委员会常委
泛长三角胸部肿瘤联盟专业委员会副主席
中国肺癌防治联盟肺癌免疫治疗委员会常委
上海市抗癌协会脑转移瘤专委会、癌症康复与姑息治疗专委会(CRPC)、肿瘤药物临床研究专委会、转化医学专委会常委
上海市抗癌协会肺癌专委会常委,内科学组组长
美国M.D.Anderson肿瘤中心访问学者
Dato-DXd和德曲妥珠单抗(T-DXd)的结构特征[1-7]
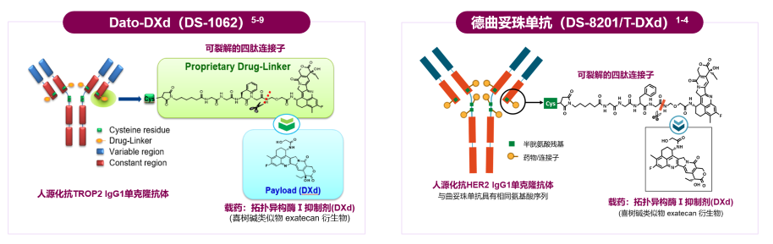 图1 Dato-DXd和德曲妥珠单抗的结构特征
图1 Dato-DXd和德曲妥珠单抗的结构特征
Dato-DXd是肺癌领域首个且唯一取得III期临床阳性结果的ADC药物,真正意义上将ADC药物在肺癌领域的发展向前推进一大步。Dato-DXd和德曲妥珠单抗都是基于DXd-ADC平台设计的ADC类药物,两款药物均采用了相同的连接子即可裂解的四肽连接子,细胞毒载药也采用相同的拓扑异构酶I抑制剂DXd。两款药物的抗体也均采用了人源化的IgG1单克隆抗体,但各自针对了不同的抗原或靶点,Dato-DXd的靶点是TROP2,德曲妥珠单抗的靶点是HER2。
有效载荷DXd的总体特征
DXd:强效抗肿瘤,抗癌活性远高于其他TROP2 ADC载药及传统化疗药物[1,8-12]
最早的ADC通常采用常规的细胞毒性药物,例如阿霉素、甲氨蝶呤、丝裂霉素、氟尿嘧啶等,但这些化疗药物的疗效低,半数抑制浓度(IC50)一般在微摩尔范围内,且具有选择性差、不能在肿瘤细胞累积等特点,因此导致早期ADC疗效较差而不能广泛用于抗肿瘤领域[1, 8]。随着ADC不断发展迭代,载药的细胞毒效力不断增强,其中拓扑异构酶I抑制剂DXd因其强效的抗肿瘤活性脱颖而出,已被成功用于新一代ADC药物Dato-DXd和德曲妥珠单抗。和同为拓扑异构酶I抑制剂SN38、KL610023相比,DXd的抗肿瘤活性是SN38的近10倍,是KL610023的2倍,这表示DXd在干扰肿瘤细胞DNA复制和重组方面更有效[3,9]。此外和常规化疗相比,DXd的抗肿瘤活性更是化疗的~1000倍[1,8]。
表1 DXd、SN38、KL610023的IC50值
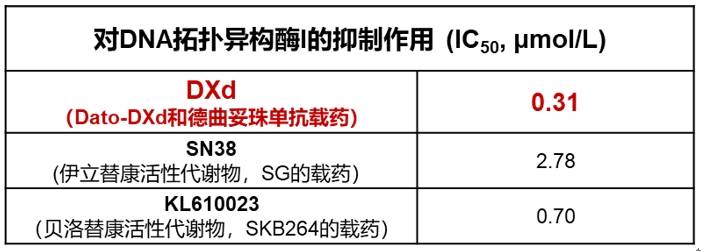
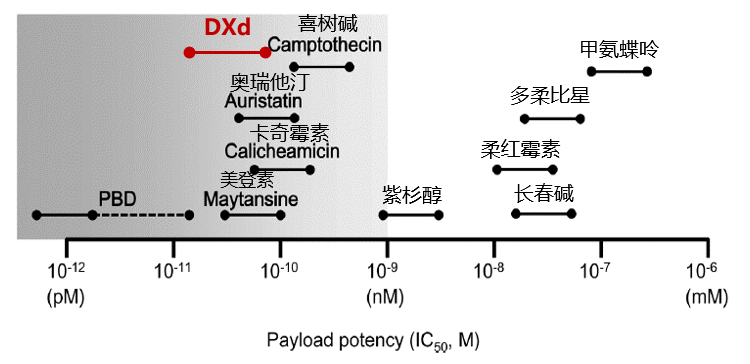
图2 常用载药和化疗IC50示意图
DXd:旁观者效应仅杀伤周围异质性肿瘤细胞,游离状态半衰期短更利于安全性 [1,3,11,12]
DXd被释放后末端可自切割形成羟基,不带电荷,易透过细胞膜。通常采用Log D评估载药的膜通透性,正值越大表示亲脂性越高。从数值来看,DXd的细胞膜通透性更高,Log D值为2.3,而Lys-SMCC-DM1(T-DM1的裂解产物)几乎不具有膜通透性(Log D为0.2),MMAE(维迪西妥单抗的载药)膜通透性较低(Log D为1.52)。动物研究显示,DXd可通过旁观者效应,消除异质性混合肿瘤(小鼠接种HER2+和HER2-组成的混合肿瘤),最终使异质性肿瘤体积明显缩小。另有临床前研究,在小鼠右侧接种NCI-N87(HER2+)和MDA-MB-468-Luc(HER2-)混合肿瘤细胞,而左侧只接种MDA-MB-468-Luc(HER2-)肿瘤细胞,使用德曲妥珠单抗治疗14天后,观察两侧的肿瘤变化情况。结果显示,小鼠右侧混合肿瘤体积明显缩小,而左侧HER2阴性肿瘤体积无明显变化。
上述研究均证明DXd具有较高的细胞膜渗透性,渗透出肿瘤细胞后能对目标靶抗原肿瘤细胞周围的其他肿瘤细胞发挥抗肿瘤活性(无论周围细胞的靶抗原表达情况如何),产生旁观者效应。但不会渗透到非旁邻肿瘤,可确保用药的安全性。
另有研究显示,给动物注射游离DXd后,DXd系统半衰期极短,仅1.37小时,表明游离的DXd可被快速清除,全身暴露及组织滞留的风险低,不易出现脱靶毒性问题,因此进一步保证了安全性。
表2 游离DXd半衰期极短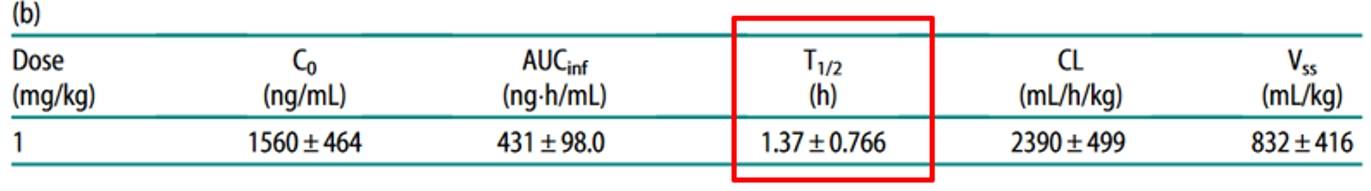
DXd:与化疗药物的作用机制不同,有效避免耐药[1,12]
常见化疗药物的机制包括抑制细胞有丝分裂、抑制胸腺嘧啶核苷合成酶从而抑制DNA的合成、与DNA交联从而抑制其合成等作用机制。渗透性糖蛋白(P-gp)是一种在细胞膜表达的外排转运蛋白,除了阻止化疗药物进入细胞外,还负责产生转运蛋白而导致肿瘤细胞的耐药性,是化疗药物常见的耐药机制之一。不同于常规化疗药物,DXd通过作用于DNA拓扑异构酶I,抑制DNA的复制和转录导致肿瘤细胞死亡。由于作用机制的不同,DXd可避免抗微管类化疗药物的交叉耐药,同时也可用于治疗对化疗耐药的肿瘤,甚至对药物泵P-gp高表达的肿瘤DXd仍然有效。
表3 常见化疗和ADC载药作用机制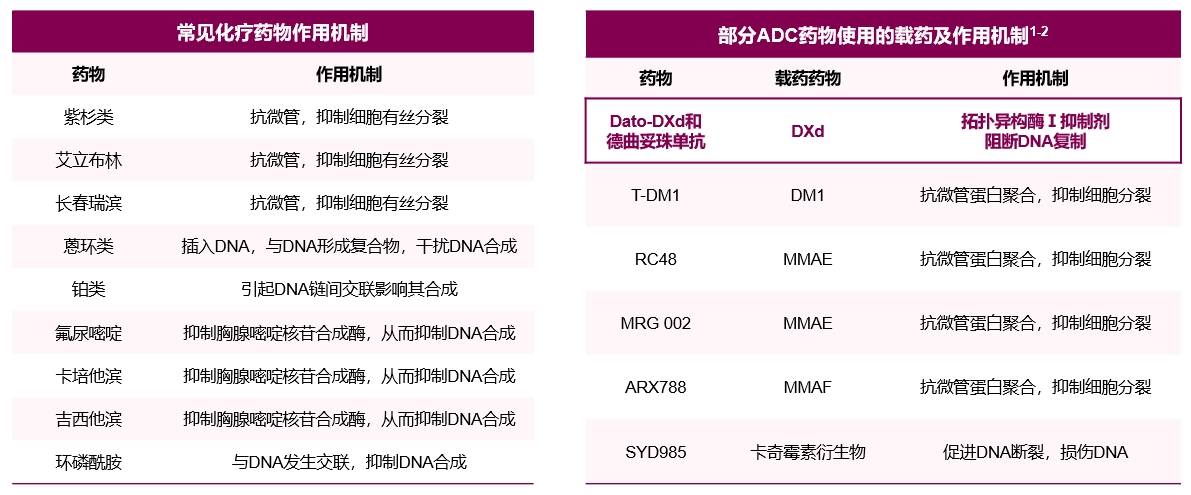
优选抗体,优化DAR
优选抗体:重组人源化IgG1半衰期长,亲和力高[13]
ADC 单克隆抗体(mAb)的选择至关重要,其对ADC的疗效、药代动力学特征、治疗指数等特征可能产生较大影响,较理想的抗体应具有对靶抗原的高亲和力、较低的免疫原性、可被高效内化以及较长的血清半衰期。人类抗体分为IgA、IgD、IgE、IgG 和 IgM五类。因具有更有利的特性,IgG是ADC药物研发中最受欢迎的类型,人类IgG包含IgG1、IgG2、IgG3 和IgG4四个亚型,具有不同的溶解度、半衰期及不同的免疫效应细胞Fcγ受体(FcγR)亲和力。
免疫球蛋白G(IgG)是ADC的主要骨架,早期ADC使用鼠源抗体,但科学家逐渐发现了此类抗体具有免疫原性高、血清半衰期短、疗效差等问题。杂交瘤技术的发现推进了嵌合抗体的发展,但仍存在免疫原性问题,因此研究者进一步开发了人源化抗体。目前新一代ADC一般采用人源化抗体或全人源抗体。Dato-DXd和德曲妥珠单抗均采用了重组人源化IgG1,二者分别选取lgG1 MAAP-9001a和lgG1曲妥珠单抗作为抗体,与lgG3相比,重组人源化IgG1在血清中更稳定,半衰期更长;与lgG2和lgG4相比,IgG1与补体和FcγR结合的效率更高。
优化药物抗体比(DAR):根据靶点特性平衡疗效和安全性[14-17]
为实现足够的细胞毒性,每个抗体需要连接一定数量“接头-药物”,而每个抗体连接的平均药物数量即药物抗体比(DAR)。DAR与ADC的药理学活性有关。有研究显示,DAR值增加与体外疗效和血浆清除率增加相关,但与小鼠最大耐受剂量呈负相关。
对于靶向TROP2的ADC Dato-DXd,因TROP2广泛表达于例如皮肤、肺、乳腺等正常组织器官,过高DAR值可能危害正常细胞。临床前研究显示,与DAR值4相比,DAR为7显示出更窄的治疗窗,安全性较差。因此,Dato-DXd在设计之初即优化DAR约为4,以期最大化治疗窗。
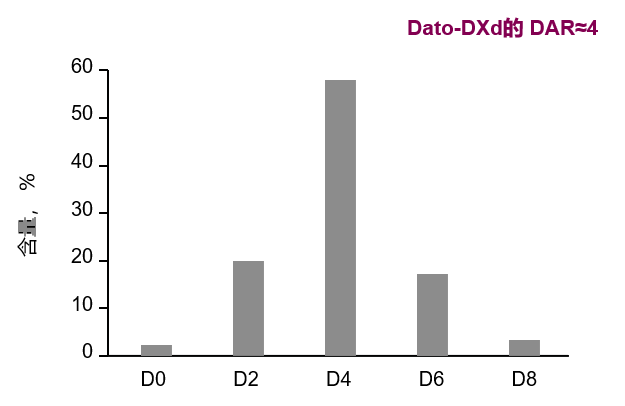 图3 Dato-DXd 的DAR
图3 Dato-DXd 的DAR
不同于TROP2,HER2变异仅发生于肿瘤细胞,只参与了肿瘤的发生发展。临床前研究显示,在不同HER2表达状态的小鼠模型中,均观察到德曲妥珠单抗的抗肿瘤活性均随药物DAR的升高而增强。因此德曲妥珠采用了较高的DAR值约为8,数值上超越了其他HER2 ADC。
总体而言,ADC药物需要根据不同抗原或靶点的特性,优化DAR值,平衡各自的疗效和安全性。因此,Dato-DXd将DAR值优化为4,这样才能使治疗最大化,并兼顾和平衡了安全性。
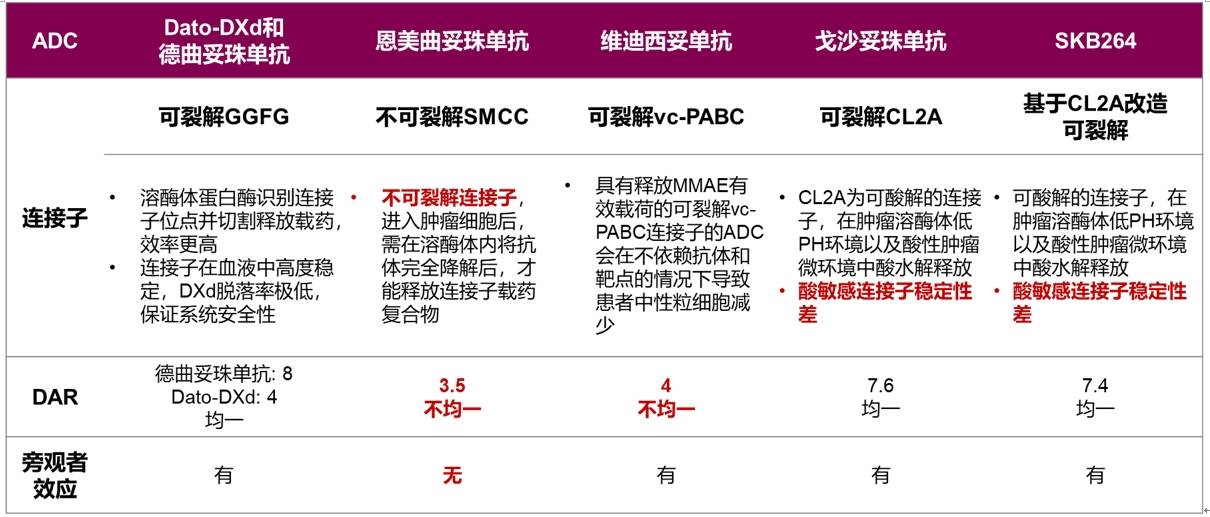
四肽连接子:血液循环中高度稳定,延长药物半衰期,稳定血药浓度,给药更便利
ADC 开发过程中最大的挑战之一是选择合适的连接子将细胞毒性有效载荷与抗体结合。连接子的化学特性会影响ADC的毒性、特异性、稳定性和疗效等特性。连接子大致可分为可裂解的连接子(有效载荷在肿瘤位点与mAb分离)与不可裂解的连接子(有效载荷和mAb保持结合,内化后mAb被降解)。其中可裂解连接子又可分为酸敏感型、蛋白酶敏感型或谷胱甘肽敏感型。酸敏感型连接子的血浆稳定性较低,如戈沙妥珠单抗和SKB264的连接子均为酸敏感型连接子,当两款药物分别与血浆混合共浴,48小时戈沙妥珠单抗载荷释放率达到100%,144小时 SKB264载荷释放率达到70%[3,9,17]。
Dato-DXd和德曲妥珠单抗的连接子为基于GGFG四肽的连接子。这是一种蛋白酶可切割的连接子,在血浆中更稳定,进入肿瘤细胞后,可被肿瘤细胞内上调表达的溶酶体选择性剪切,避免载药提前释放。体外研究显示,当Dato-DXd和德曲妥珠单抗分别与血浆混合共浴,21天载荷释放率不超过6%,证实连接子在血液循环中的稳定性,为药物提供更好的药代动力学特征[1,14]。此外动物试验同样证明,总体药物Dato-DXd半衰期长,Q3W方案下药物血药浓度维持稳定,可以起到杀死肿瘤细胞作用[17]。总体上,四肽连接子在血液中可保持高度稳定,DXd脱落率极低,保证系统用药的安全性。同时延长药物半衰期,可以能够实现更优的给药方案,提高用药的便利性。
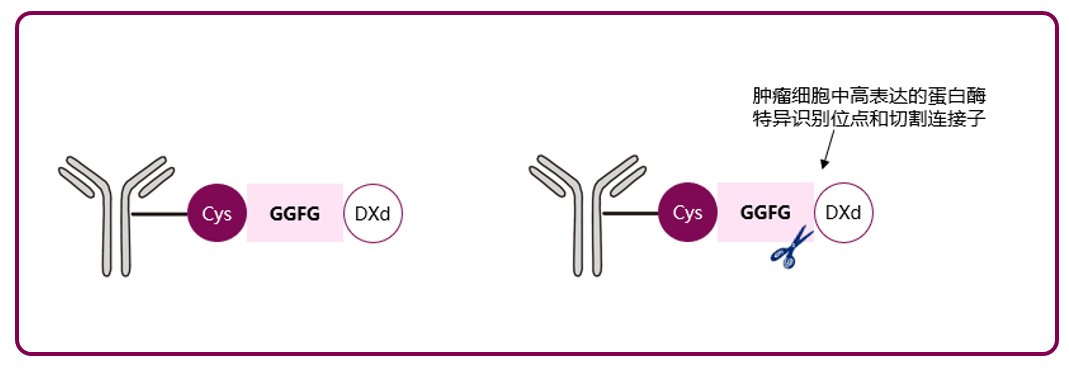
图4 四肽连接子GGFG肿瘤细胞内裂解过程
提高均一性:半胱氨酸连接使DAR更均一[18-20]
ADC的另一个关键特征是均一性,即各抗体之间连接位点的一致性,这种技术具有一定挑战性。ADC的均一性本质上与抗体-连接子的偶联方式相关。偶联一般通过抗体赖氨酸或半胱氨酸等残基侧链实现,赖氨酸侧链通常不经修饰,而半胱氨酸残基的硫醇基团几乎全部以二硫键形式存在,在偶联之前需要被选择性还原。
典型IgG1抗体约有80多个赖氨酸残基,其中抗体表面可偶联的赖氨酸残基位点超过40个,偶联的载药个数和偶联位置都具有随机性,因此得到的ADC具有较高的异质性。较早获批的恩美曲妥珠单抗即采用了该偶联方式。
半胱氨酸连接的DAR更为均一,在IgG链间的4对二硫键被还原为8个半胱氨酸基团后,偶联的载药数量可能为2、4、6、8,相比赖氨酸偶联的复杂程度降低,因而采用该偶联方式产生的ADC异质性更低。Dato-DXd和德曲妥珠单抗均采用了半胱氨酸的偶联方式。总体上,ADC的异质性会直接影响其在体内的分布和代谢,因此更高均一性的ADC具有更高的药物纯度和更好的质控。
 图5 常见mAb-连接子的偶联方式
图5 常见mAb-连接子的偶联方式
总体而言,既往ADC药物多采用赖氨酸连接方式,具有随机性,异质性较高,均一性较差。而目前包括Dato-DXd在内的新一代ADC采用了半胱氨酸的偶联方式,相比赖氨酸偶联的复杂程度降低,因此异质性更低,而使均一性更好,最终提高了药物的纯度及质控。
总结:Dato-DXd和德曲妥珠单抗结构的精心设计保障药物的疗效和安全性
我个人认为新型拓扑异构酶I抑制剂作为载药,其疗效和安全性均优于微管抑制剂,且能用于化疗耐药的肿瘤。另外,从实验数据可见,相比其他拓扑异构酶Ⅰ抑制剂,DXd的疗效和安全性更优,IC50值更低,抗肿瘤活性更强——活性是SN38的10倍,是化疗的1000倍;游离状态体内半衰期极短,利于系统毒性的控制。新型ADC的旁观者效应可进一步提高抗肿瘤活性。
表4 不同ADC的载药特征
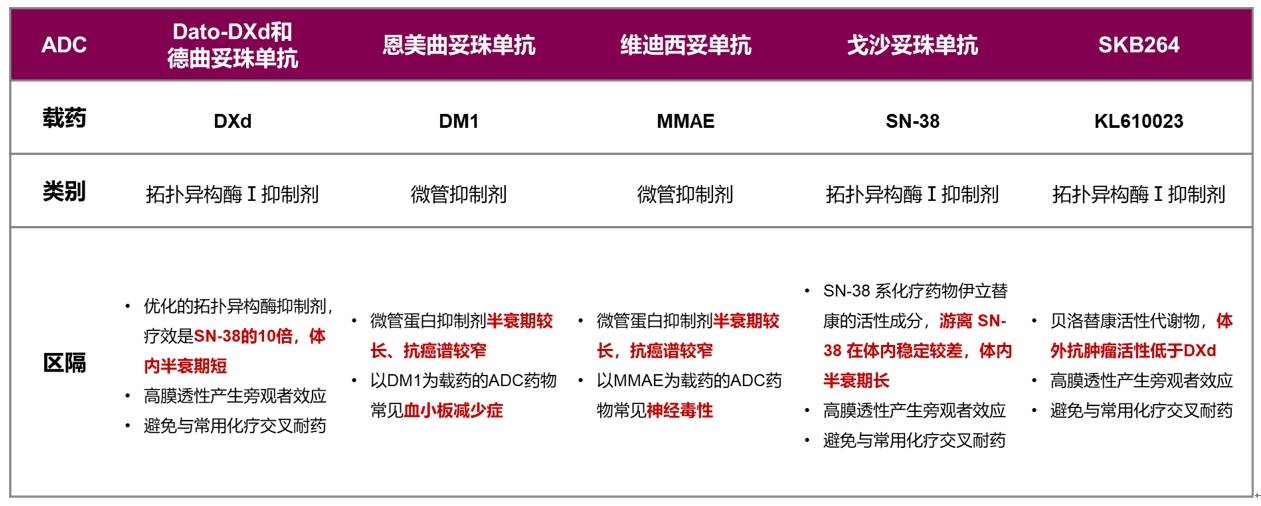
同时可以看到,Dato-DXd和德曲妥珠单抗的连接子与其它ADC的连接子有所区别,二者选用的是可裂解GGFG连接子,溶酶体蛋白酶可特异识别并切割从而释放载药,效率更高;且二者的连接子血液循环中高度稳定,DXd的脱落率极低,因此可保证系统安全性。同时GGFG连接子血液中保持稳定,有利于延长药物半衰期,可以能够实现更优的给药方案,提高用药的便利性。因靶点不同,Dato-DXd和德曲妥珠单抗的DAR分别为4和8,兼顾了疗效和安全性,而半胱氨酸偶联位点保证了药物的均一性。总体上,Dato-DXd和德曲妥珠单抗在各个结构上精心设计和优化,为整体ADC的疗效和安全性提供了保障。
表5 不同ADC的连接子与DAR
1.Nakada T, et al. Chem Pharm Bull (Tokyo). 2019; 67(3):173-185.
2.Trail PA, et al. Pharmacol Ther. 2018;181:126-142.
3.Ogitani Y, et al. Cancer Sci. 2016;107(7):1039-46.
4.Cortes J, et al. ExpressPoints: The Evolution of Antibody–Drug Conjugates in Breast Cancer.
5.Okajima D, et al. 2019 [Abstract C026];
6.Daiichi Sankyo Co. Ltd. DS-1062. Daiichi Sankyo.com
7.Krop I, et al. 2019 SABCS [Abstract GS1-03]
8.Sci Rep. 2021 Sep 9;11(1):18011.
9.Yezhe Cheng , et al. Preclinical profiles of SKB264, a novel anti-TROP2 antibody conjugated to topoisomerase inhibitor, demonstrated promising antitumor efficacy compared to IMMU-132. Front Oncol. 2022 Dec 23:12:951589.
10.Ogitani Y, et al. Cancer Sci. 2016;107:1039-1046 (supplement).
11.Yoko Nagai,Masataka Oitate,Hideyuki Shiozawa, et al. Comprehensive preclinical pharmacokinetic evaluations of trastuzumab deruxtecan (DS-8201a), a HER2-targeting antibody-drug conjugate, in cynomolgus monkeys[J].[2023-11-06].
12.Chau CH, et al. Lancet. 2019 Aug 31;394(10200):793-804.
13.Nat Rev Clin Oncol. 2021; 18(6): 327-344.
14.Ogitani, Y. et al. Clin. Cancer Res. 22, 5097–5108 (2016).
15.Ferraro E, et al. Breast Cancer Res. 2021 Aug 11;23(1):84.
16.Yu J, et al. Front Mol Biosci. 2022 Feb 28;9:847835.
17.Okajima D, et al. Mol Cancer Ther. 2021;20:2329-2340.
18.Xu Z, Guo D, Jiang Z, et al. Novel HER2-Targeting Antibody-Drug Conjugates of Trastuzumab Beyond T-DM1 in Breast Cancer: Trastuzumab Deruxtecan(DS-8201a) and (Vic-)Trastuzumab Duocarmazine (SYD985). Eur J Med Chem. 2019 Dec 1;183:111682.
19.Panowski S et al. MAbs. 2014;6(1):34-45.
20.季双敏,王玉珠,杨进波.抗体偶联药物的分子特点及其药代动力学研究考虑[J].中国临床药理学杂志,2021,37(06):777-782.
排版编辑:肿瘤资讯-小葛











 苏公网安备32059002004080号
苏公网安备32059002004080号


