当前全球已有10款自体的CAR-T细胞产品获批上市,包括中国4款自体CAR-T细胞产品。但自体CAR-T疗法面临因价格昂贵而可及性差,制备周期长,以及因患者自身T细胞质量差等因素导致无法制备自体CAR-T细胞等商业化瓶颈问题。
加拿大多伦多大学医学院张丽教授团队在小鼠模型上首次揭示了双阴性T细胞(CD3+CD4-CD8-)亚群具有抗原特异性抑制移植排斥反应的功能及其机理,并于2000年在《Nature Medicine》发表论文1。

2022年4月,张丽教授团队在 Science 子刊 Science Immunology 发表研究论文,证实在 B 细胞急性淋巴细胞白血病(B-ALL)和非小细胞肺癌(NSCLC)小鼠模型中,针对CD19 靶点的CAR-DNT 细胞(CD19-CAR-DNT)能够有效清除血液瘤和实体瘤,且不会引发移植物抗宿主病(GvHD)2,疗效与CAR-T细胞相当但毒性更低。

同年6月,美国AACR会议公布了CD19-CAR-DNT细胞冻存产品在体外和B-NHL小鼠模型中的药效、药代和初步毒理学研究数据,验证了CAR-DNT细胞作为现货通用型产品的巨大潜力3。

由浙江大学医学院附属第二医院血液科钱文斌教授团队发起并联合广东瑞顺生物技术有限公司开展的全球首个CD19-CAR-DNT细胞用于治疗复发/难治性非霍奇金淋巴瘤(r/r NHL)的I期临床研究(NCT05453669)结果将以壁报形式在今年第65届美国血液病学会 (ASH)年会上公布4。这是CD19-CAR-DNT治疗B-NHL的人体临床研究结果的首次全球亮相。 近日,ASH网站公布了该研究的摘要内容。
研究方法
这是一项针对同类首创RJMty19(CD19-CAR-DNT)细胞疗法的、开放标签、单剂量、I期研究。该研究旨在评估3+3剂量递增方案中,RJMty19的5个剂量组(DL)分别为:1×106, 3×106, 9×106, 2×107和3×107 CAR-DNT细胞/kg体重。入选人群标准包括存在可测量病灶,既往接受至少2线治疗,ECOG评分为0-1。
所有患者均接受氟达拉滨和环磷酰胺的清淋化疗预处理。主要终点是剂量限制毒性、不良事件的发生率和具有显著临床意义的实验室指标异常。次要终点包括药代动力和药效学指标,以及客观反应率 (ORR) 和疾病控制率 (DCR)。
研究结果
截至2023年7月31日,在15例被纳入研究的B-NHL患者中,有12例患者可评估(包括1名仅输注10天的受试者)。
在第28天完成DLT评估的11例患者中,有5例(45.5%)为男性,平均年龄为59.7岁(范围45-74岁);在基线时,73%的患者的IPI评分为≥3(范围0-4);既往治疗的中位线数为3线(范围2-9)。此外,5例患者既往接受过BTKi治疗,4例患者在入组前曾接受过来那度胺/维奈克拉治疗。没有患者接受过CAR-T疗法。
单次输注RJMty19后,没有观察到GvHD(移植物抗宿主病)、ICANS(免疫细胞相关神经毒性综合征)和SAEs(严重不良反应)病例。只有1例患者出现2级CRS (细胞因子释放综合症),但在24小时内症状缓解。除发热外,所有≥3级不良事件均为血液学毒性,包括白细胞减少、淋巴细胞减少、中性粒细胞减少、血小板计数减少和贫血(如下表)。
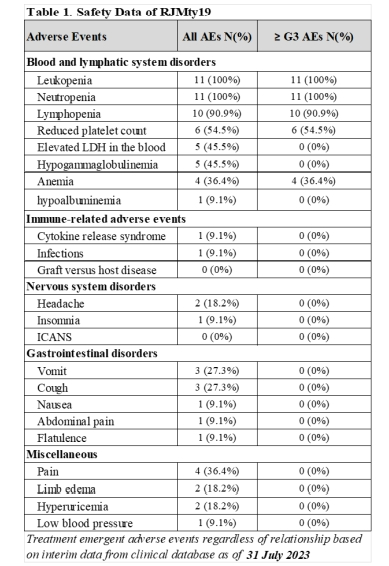
在接受≥9×106 CAR-DNT 细胞/kg体重(DL≥3;N=5)治疗的患者中, 第28天B超影像结果显示的最佳DCR和ORR分别为100% (5/5)和40%(2/5)。DL4组患者中有一例患者的肿瘤病灶(SPD)在第31天和第61天退缩87%。
体内动力学数据显示,CD19-CAR-DNT细胞以剂量依赖性方式扩增, 在第5天至第7天之间达到峰值,DL4组患者(n=3)的平均峰值达到384个CAR+细胞/ul外周血。
钱文斌教授在近日接受采访时指出, 全球首次发布的异体CAR-DNT细胞治疗B-NHL的I期研究结果显示,单次输注RJMty19注射液的安全性良好,在各剂量组均未观察到≥3级CRS、ICANS、SAE,以及GvHD。
2020年发表的一项针对已发布的19个CD19-CAR-T临床研究的890例患者的回顾性数据分析结果显示, 包括免疫相关毒性、CRS和ICANS在内的与死亡相关的毒性的致命率达5.4%。
钱文斌教授认为, 在I期研究中观察到的RJMty19注射液的安全性令人鼓舞,尤其是在高剂量组未观察到≥3级的毒性,这为后续尝试输注高剂量、多次输注的临床方案带来了可能性。
“比较令人意外的结果是研究中,接受DL4剂量组(2×107 CAR-DNT细胞/kg体重) 治疗的三例患者均观察到抗肿瘤疗效(1例CR, 2例PR)”, 钱教授补充道, “下一步,有必要在更大人群样本中探索RJMty19注射液的安全性和疗效,以及多次输注高剂量RJMty19注射液临床方案能否带来更持久的疗效和生存。”
未来,DNT/CAR-DNT细胞是否会替代CAR-T?
钱教授认为,回答这个问题还需要更多针对CAR-DNT细胞的临床研究所带来的循证医学证据来验证,但是开发通用型CAR-T细胞疗法是CAR-T疗法获得临床普及应用的关键,也是免疫细胞疗法发展的必经之路,因为唯有通用,方能降低成本,提升普惠性。“而异体来源的DNT细胞因为不引起移植物抗宿主病(GvHD)和宿主抗移植物反应(HvGR),所以天然具备了作为通用型细胞治疗产品的特征。”
据钱教授透露,此次开展的I期临床研究使用的是冷冻后复融的CD19-CAR-DNT细胞,这意味着我们可以随时给予患者CAR-DNT细胞治疗,无需像现在的自体CAR-T细胞那样需要等待几周时间去制备。
“CAR-DNT细胞不仅可降低成本,带来普适性,而且还有望提升细胞疗法的便捷性”, 钱教授表示。
今年10月, RJMty19注射液用于治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r NHL)的新药注册临床研究申请已获国家药品监督管理局(NMPA)药品审评中心(CDE)正式受理(受理号:CXSL2300725)。
在此之前(2023年9月), RJMty19注射液用于治疗复发/难治性自身免疫性疾病(r/r AID)的新药注册临床研究申请获国家药品监督管理局(NMPA)药品审评中心(CDE)正式受理(受理号:CXSL2300661)。
据瑞顺生物董事长兼首席科学官杨黎明博士介绍,中国在DNT细胞免疫疗法的开发领域已走在世界最前列,包括RJMty19注射液在内的多款基于DNT细胞开发的细胞疗法目前正在国内开展多个注册IND临床研究(RCT)和研究者发起的临床研究(IIT)。
“药物研发是一个极其严谨的科学探索过程,需要可靠的临床研究数据来证明药物的临床疗效和安全性”,杨黎明博士认为,“我们希望有更多的中国医生能了解DNT/CAR-DNT细胞,共同开发源于中国的创新好药,让更多中国患者尽早从用得起的免疫细胞疗法中获益。”
1.Z. X. Zhang, L. Yang, K. J. Young, B. DuTemple, L. Zhang, Identification of a previously unknown antigen-specific regulatory T cell and its mechanism of suppression. Nat. Med.6, 782–789 (2000)
2.Daniel Vasic et al., Allogeneic double-negative CAR-T cells inhibit tumor growth without off-tumor toxicities. SCIENCE IMMUNOLOGY, 22 Apr 2022, Vol 7, Issue 70. DOI: 10.1126/sciimmunol.abl3642
3.Yang LM et al., Abstract 5510: Preclinical study of allogeneic CD19-CARDNT cells as an off-the-shelf immunotherapy drug for NHL, Cancer Res(2022) 82 (12_Supplement): 5510, https://doi.org/10.1158/1538-7445.AM2022-5510
4.Xibin Xiao et al., A Phase 1 Study of RJMty19: Anti-CD19 Humanized CAR-Engineered Allogeneic Double Negative T Cells in Adults with B-Cell non-Hodgkin's Lymphoma, 2023 ASH,Abstract #2094
排版编辑:Maggie











 苏公网安备32059002004080号
苏公网安备32059002004080号


