本文精选6篇在2023年10月份发表的结直肠癌领域文献,部分研究邀请到山东第一医科大学附属肿瘤医院李明焕教授进行深入解读。
专家介绍
肿瘤学博士,主任医师,博士研究生导师
齐鲁卫生与健康领军人才
中国抗癌协会放射肿瘤学青年委员
山东省抗癌协会放射肿瘤分会常委
山东省医学会泌尿男生殖系肿瘤MDT组副主委
山东省临床肿瘤学会前列腺癌专委会副主委
山东省免疫学会微生态免疫专委会副主委
山东省抗癌协会大肠癌分会常委
山东省医师学会放疗专业委员
直肠腺癌患者接受全程新辅助治疗
(TNT)后保留器官的长期结果:
随机II期OPRA研究1
OPRA试验(ClinicalTrials.gov注册号:NCT02008656)更新了器官保留率和肿瘤学临床结局等数据以评估局部肿瘤再生的长期风险。该研究纳入的Ⅱ/Ⅲ期直肠癌患者被随机分配至两组:接受诱导化疗后序贯放化疗(INCT-CRT)或接受放化疗后序贯巩固化疗(CRT-CNCT)。完成治疗后,对于达到完全或接近完全缓解的患者接受观察等待策略(WW),对于达到不完全缓解的患者则被建议进行全直肠系膜切除术(TME)。该研究的主要终点为无病生存期(DFS),次要终点为无TME生存期。
共有324例患者被随机分配(INCT-CRT组,n = 158;CRT-CNCT组,n = 166)。中位随访时间为5.1年。INCT-CRT和CRT-CNCT的5年DFS率如图1A所示。INCT-CRT组无TME生存率与CRT-CNCT组如图1B所示。在81例再生的患者中,94%发生在2年内,99%发生在3年内。DFS在新辅助治疗后即接受TME的患者(64% [95%CI,53~78])和在先接受WW待肿瘤再生后再进行TME的患者(64%[95%CI,53~78];P = 0.94,如图1C所示)中是接近的。研究更新的数据显示,在接受完整新辅助治疗的直肠癌患者中有一半实现了长期器官保留。大多数接受WW的患者于2年内即出现肿瘤再生。
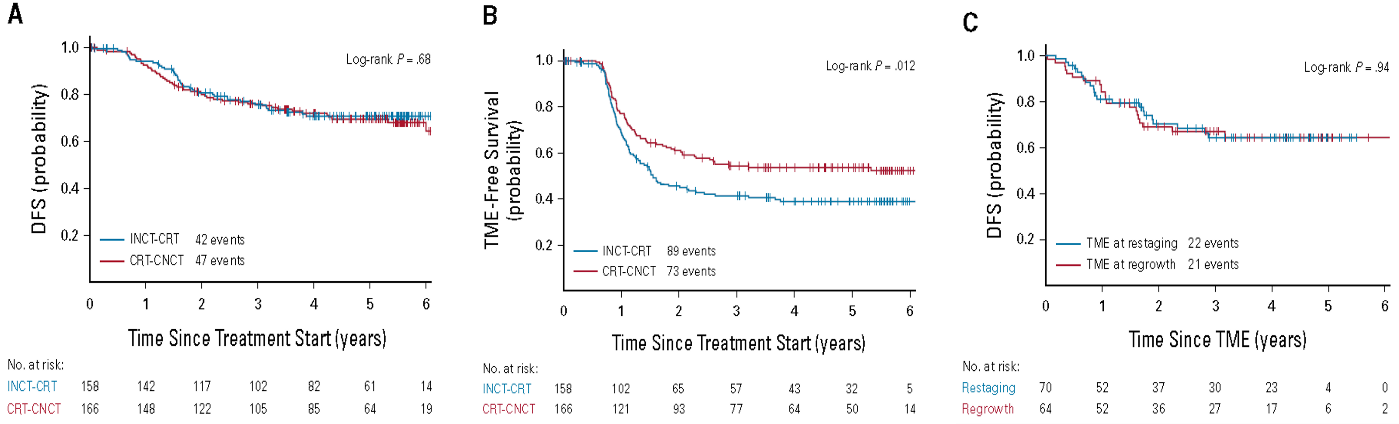
图1:(A)ITT人群各治疗组的DFS;(B) Kaplan-Meier估计的ITT人群各治疗组的无TME生存期;(C)新辅助治疗后即进行TME的患者和再生后再进行TME的患者的DFS
李明焕教授:本文关注了局部晚期直肠癌的保留器官与长期生存。 近几年的系列研究证实术前强化治疗能提高pCR 、减少远处转移甚至改善0S。而OPRA研究更是以器官保留、无TME生存期作为其次要研究终点。该研究表明在INCT-CRT或CRT-CNCT的TNT治疗模式下,患者5年DFS率分别为71%和69% (P = 0.68)。器官保留患者的生存率 INCT-CRT组为39%,CRT-CNCT组为54% (P = 0.012),这提示CRT-CNCT治疗能够获得一半以上保留器官且长期生存,这样的生存数据增加了患者保留器官的信心,但是在临床治疗过程要同时注意保肛患者肿瘤局部再生情况。该研究中患者达到cCR或nCR和WW期后的肿瘤再生如果随后进行R0-R1切除,则不认为是局部区域失败。该研究放化疗后再分期后整体人群的74%(225例) 进入了WW,其中有36%(81例) 发生了肿瘤再生,分布为cCR 组22%(27/123),nCR 组52% (49/94),iCR组 63%(5/8)。从所有的肿瘤再生发生时间看,94%发生在2年内、99%发生在3年内。但对于局部再生后TME挽救性手术的切除率(91%),并没有比新辅助放化疗后TME(90%)低;此外,保留肛门括约肌率在新辅助后直接TME组与再生后挽救组无统计学差异(55% vs. 44%,p=0.23)。研究提示: 1. cCR 或nCR后保留器官可行。但是患者需有好的随访依从性,特别是前2年内。2. 肿瘤局部再生率不低。虽然挽救治疗似乎不增加手术并发症等,但是如何进一步降低再生率?通过更进一步的功能影像学、肿瘤生物学分子检测等判断cCR?加强局部治疗及早干预再生避免转移等影响功能和预后?这些都需要进一步研究。
新辅助直肠癌试验中的早期疗效终点:
替代指标重新评估2
该研究建议在直肠癌新辅助治疗试验的早期缓解评估中,基于病理学完全缓解(pCR)、肿瘤消退分级(TRG)和直肠新辅助治疗评分(NAR)的分析可被实际应用于II期试验的早期阶段,以确定未来(随机)II/III期试验中需要采取哪些有前景的干预措施。然而必须承认的是,研究中探索的各种pCR替代指标尚未在直肠癌中得到证实,从严格角度上讲这些替代指标的意义仍不明确。pCR与长期肿瘤学预后之间的因果关联会受到治疗相关因素、肿瘤相关因素和患者相关因素等混杂因素的影响,这些因素同样也会影响替代指标与所关注的临床结局之间的相关性联系。
在未来,替代指标的发展方向可能包括基于循环肿瘤DNA(ctDNA)和循环游离DNA(cfDNA)评估的分子定义的结局指标,以检测微小残留病灶(MRD),从而制定(递增/递减)治疗方案并预测临床结局。一项近期发表的包含25项研究的系统综述显示,MRD的存在与较差的肿瘤预后显著相关。尽管有着广阔的前景,在考虑将ctDNA和cfDNA作为替代指标应用于临床去评估实际的临床终点之前,仍然需要前瞻性研究去验证它们在直肠癌结局预测和治疗决策指导中的潜力。
李明焕教授:该述评针对目前新辅助治疗中替代研究终点的思考,实际上是一个临床有趣的问题,即治疗的缓解率与长期生存的关系。为了降低成本并加快新治疗策略的临床实施,临床试验越来越关注早期且易于获得的替代指标。为了正式验证这些早期终点作为中期 (例如,3年DFS) 或长期终点 (5年OS) 的替代指标,通常需要两级统计方法,其中包括检查 (1) 替代终点是否与个体患者的最终终点相关,以及 (2) 治疗对替代终点的影响是否可以用来可靠地预测对最终终点的效果。理想情况下,替代终点应该在治疗和最终终点之间的因果途径上,在完美的情况下,这意味(后续或其他)治疗对最终终点的效果是间接的,而应完全由替代终点来影响或指示最终终点。众所周知,就个体患者水平而言、直肠癌的新辅助治疗中实现pCR患者可获得较好的预后。值得思考的是,肿瘤到了局部进展期,局部治疗加强后,远处转移成为失败的主要模式,同样也是影响OS的最主要原因。肿瘤的演进史显示,肿瘤在发生早期,即有循环肿瘤细胞(CTC)播散以及播散肿瘤细胞团(DTC)的形成,并在特定的靶器官形成转移前小巢,一并形成MRD,可处于休眠状态。而且对转移灶的研究显示,由于TME等影响可能导致对治疗更加抵抗。因此原发灶对系统治疗敏感且达到pCR,并不意味着对MRD的有效。MRD在与机体免疫的斗争中胜出后,成为显性转移灶,造成死亡。综上,替代终点除了考虑原发灶外还应考虑MRD以及后续治疗等影响。考虑到机体系统免疫与MRD博弈的微妙与复杂性,将ctDNA和cfDNA作为替代指标应用于临床任重道远。
错配修复缺陷型结直肠癌新辅助免疫治疗病理完全缓解的生物标志物3
免疫检查点抑制剂(ICIs)已成为错配修复缺陷/微卫星高度不稳定型(dMMR/MSI-H)结直肠癌(CRC)患者的标准治疗。然而,提示ICIs疗效的生物标志物仍然缺乏。该研究前瞻性地纳入了42例接受PD-1单抗新辅助治疗的dMMR CRC患者。为了确定预测新辅助治疗达到病理完全缓解(pCR)的生物标志物,研究人员分析了基于二代测序的基因组和转录组谱,以及基于多色免疫荧光(mIF)染色的免疫细胞密度。研究人员还利用他们既往研究及基因芯片GSE178341中的单细胞RNA测序数据进行了综合分析,并通过mIF进一步探索了pCR与肿瘤微环境(TME)变化之间的联系。
分析结果显示肿瘤组织和血浆样本的肿瘤突变负荷在pCR组和非pCR组中是相当的,但HLA-DQA1和HLA-DQB1在pCR组显著过表达。基因富集分析显示,包括T细胞受体通路、抗原呈递通路在内的多条通路在pCR组中显著富集。此外,较高的既存CD8 + T细胞密度与pCR相关(767.47/mm2 vs. 326.64/mm2,Wilcoxon检验P = 0.013,如图2所示)。进一步的整合分析显示,PD-1低表达的CD8 + T细胞(PD-1lo CD8 + T细胞)可表达高水平的TRGC2、CD160和KLRB1,此外还发现低水平的增殖和耗竭基因与pCR显著相关。
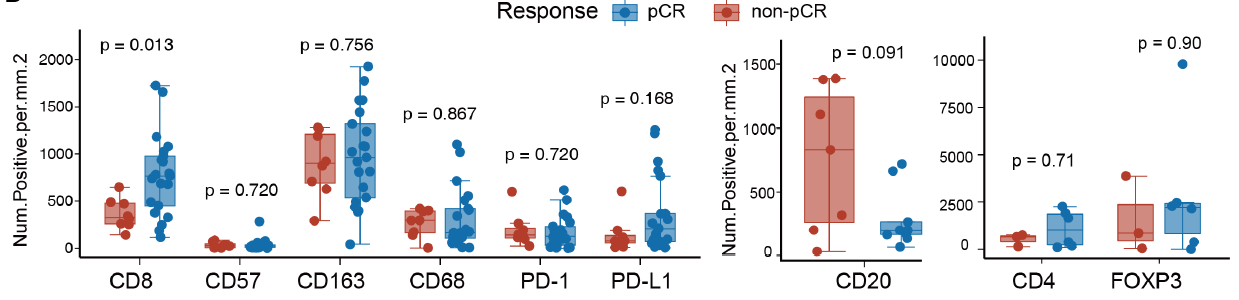
图2:箱式图显示ICI治疗前pCR组和非pCR组之间的细胞密度(每mm2的细胞数量)。通过Wilcoxon 检验确定p值
该研究通过免疫相关转录组学特征探索了dMMR CRC中ICI与pCR之间的关联,其中特别是CD8 + T细胞与ICI治疗后的pCR相关。dMMR CRC中TME的异质性可能有助于识别接受新辅助ICI治疗后达到完全缓解的患者。
李明焕教授 :这是一项非常好的研究,预测pCR 对于个体化指导治疗意义重大。dMMR 的患者虽然免疫治疗有效率高,但是IV期患者一线治疗有效率也不到50%,双免联合初步显示有效率较单免治疗高。局部晚期患者小样本的研究显示有效率较高,本研究中,T3-4N+患者pCR达到81%。肿瘤细胞和免疫微环境,血管微环境等之间互相影响,共同决定抗肿瘤疗效。肿瘤细胞的MSI-H状态可能引起更多淋巴细胞浸润,但是也有各种原因导致的T细胞浸润差异,本研究中pCR组有明显高密度的CD8+T 细胞,且包括T细胞受体通路、抗原呈递通路在内的多条通路在pCR组中显著富集。说明只有浸润T细胞的数量和功能都“给力”才能有更好的疗效。 而TMB似乎不能提供更多信息,可能与MSI-H之间有较多重叠有关。
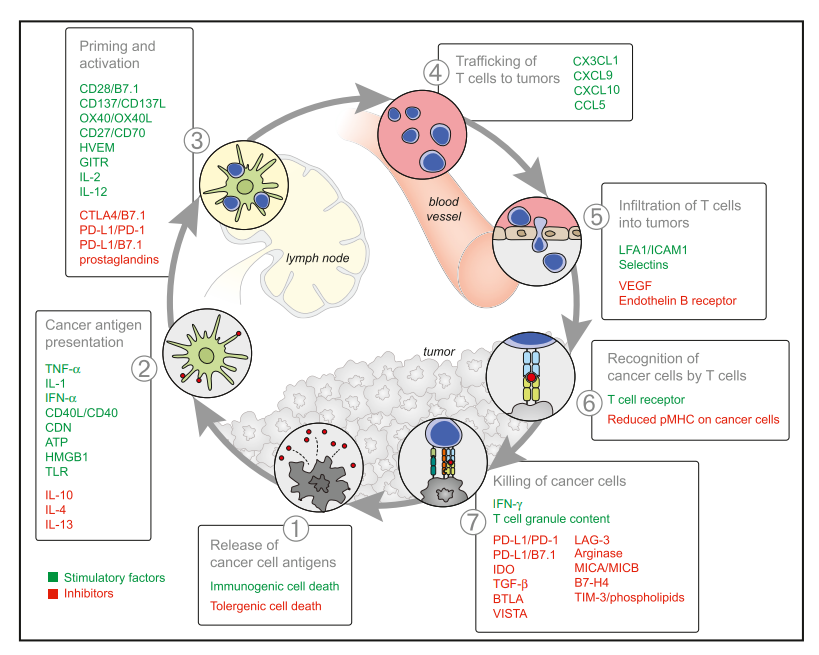
图3:肿瘤免疫循环
在免疫杀伤肿瘤细胞的7个经典步骤中,各个步骤之间互相影响但相对独立,如图3(Immunity. 2013 IF:32.4)。 整个环路任何一步不通畅,都可能导致免疫治疗不能很好起效。不难理解双免的有效率可能会高于单免,可能是由于在免疫环的第3步抗CTLA-4 环节促进了T细胞激活,而本研究提示pCR 组患者在抗原递程以及TCR多样性,T细胞浸润表现更好,也是说明更加促进了免疫环中第2、5、6步的畅通,从而进入良性循环。期待有更简便、经济的检测方法指导临床实践。
转移性器官受累对晚期转移性结直肠癌维持治疗的预后和预测影响:PanaMa试验中接受治疗患者的亚组分析(AIO KRK 0212)4
尽管通过分子层面筛选出RAS野生型人群,但RAS野生型mCRC人群仍然呈现出多样性,这种多样性体现在肿瘤转移扩散方面的异质性。该研究探索了不同转移模式对“5-氟尿嘧啶/亚叶酸±帕尼单抗”维持治疗的预后和预测影响。研究人群根据以下因素分层:转移灶的数量(单器官转移vs. 多器官转移)、肝脏局限性疾病vs. 肝转移加1个额外部位转移vs. 肝转移加≥2个额外部位转移。采用Kaplan-Meier法和Cox回归法描述有效性终点。
研究观察到133例患者(53.6%)为单器官转移,其中102例患者(41.1%)为肝脏局限性疾病。此外还报告了 114例患者(46.0%)为多器官转移。与单器官转移相比,多器官转移与较差的维持治疗阶段PFS(HR 1.48,95%CI 1.13-1.93;P = 0.004)和OS(HR 1.37,95%CI 0.98-1.93;P = 0.068)相关。具体来看,与肝脏局限性疾病相比,肝转移加1个额外部位转移未表现出显著的生存期缩短,但肝转移加≥2个额外部位转移则表现出较差的维持治疗阶段PFS(HR 1.92,95%CI 1.30-2.83;P < 0.001)和OS(HR 2.38,95%CI 1.51-3.76;P < 0.001)(如图4所示)。
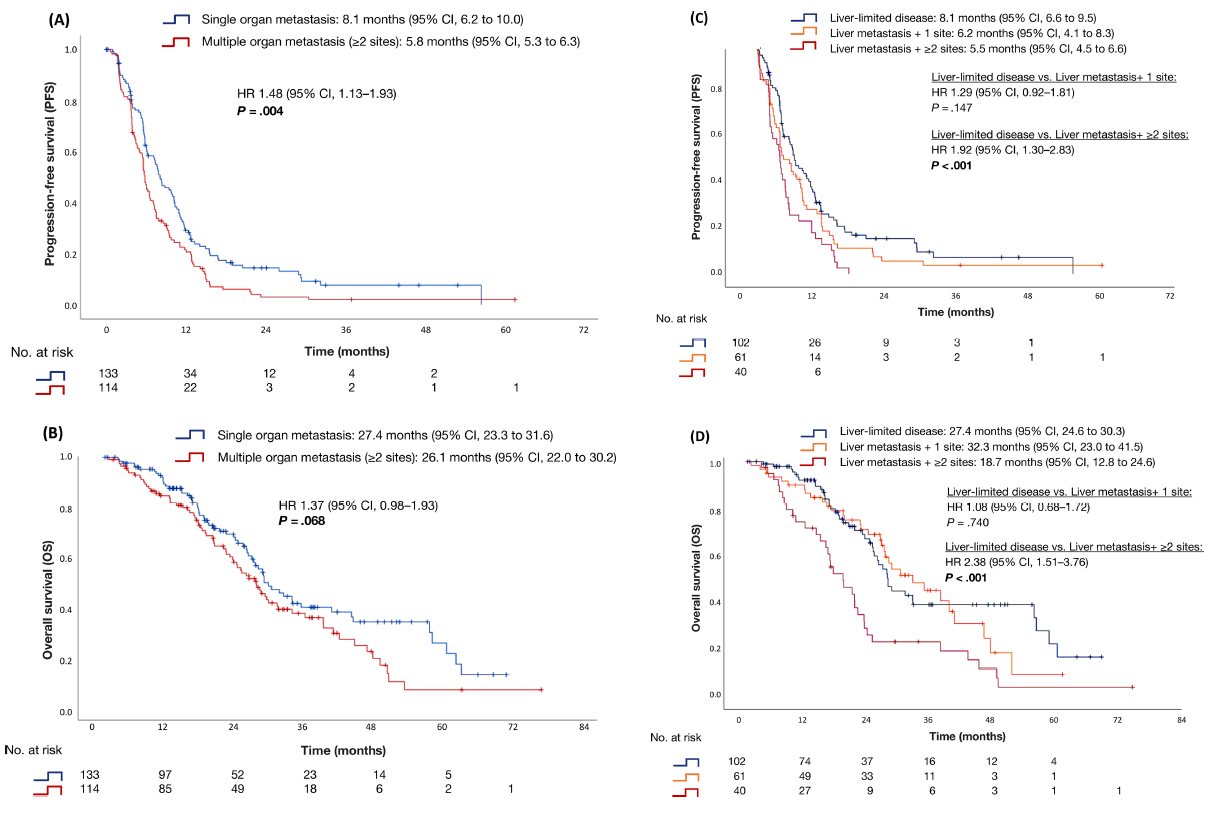
图4:根据不同转移部位数量分组患者,各组患者的PFS和OS(Kaplan-Meier估计值)。单器官转移vs.多器官转移患者的PFS(A)和OS(B);肝脏局限性疾病vs.肝转移加1个额外部位转移vs.肝转移加≥2个额外部位转移患者的PFS(C)和OS(D)。
含帕尼单抗的维持治疗方案在多器官转移患者中显示出PFS获益(HR 0.58;95%CI,0.39-0.86;P = 0.006),在单器官转移的患者同样显示出PFS获益(HR 0.83;95%CI,0.57-1.21;P = 0.332;交互作用P = 0.183)(图5)。当考虑是否选择包含抗EGFR单抗的维持治疗时,该研究的数据可能为临床决策提供支持。
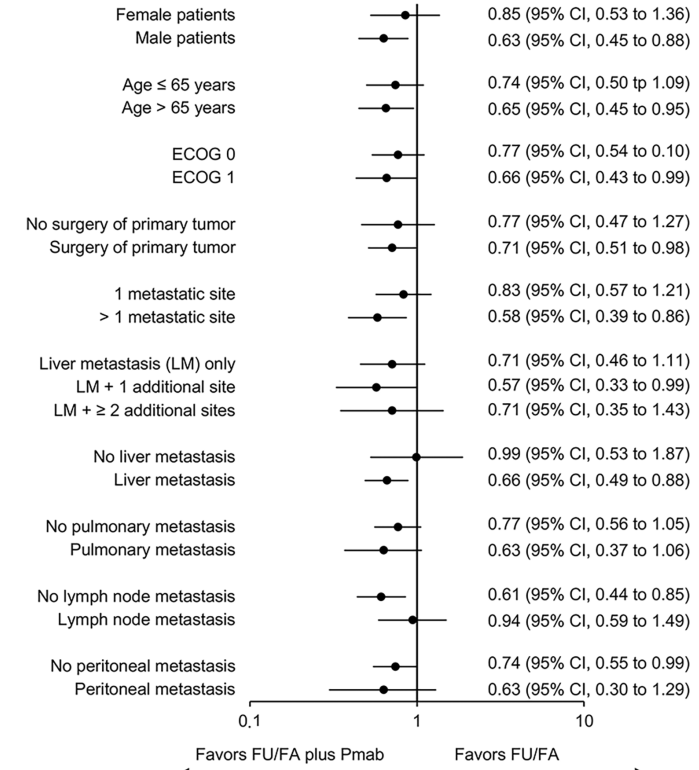
图5:帕尼单抗组及FU/FA组PFS亚组分析
瑞戈非尼单药或联合高/低剂量放疗
加特瑞普利单抗作为转移性结直肠癌患者的
三线治疗:一项前瞻性、随机、
对照II期临床研究方案(SLOT)5
寻找可以提高微卫星稳定型转移性结直肠癌(MSS mCRC)免疫治疗疗效的联合方案仍是未满足的需求。几项单臂临床试验已经显示出瑞戈非尼和免疫检查点抑制剂(ICIs)之间有前景的协同作用,但同时也存在一些相反的结果,因此还需要开展随机对照试验来进一步验证瑞戈非尼与ICIs联合治疗的效果。此外,低剂量放疗与高剂量放疗联合或与ICIs联合的方案已被证实可以通过重建肿瘤微环境来诱导局部免疫反应。
该项研究设计为前瞻性、随机、对照的Ⅱ期试验,旨在探索瑞戈非尼+高/低剂量放疗+特瑞普利单抗与瑞戈非尼单药相比治疗MSS型mCRC的疗效和安全性。将纳入的MSS型转移性结肠或直肠腺癌患者随机分配至对照组和试验组。对照组患者将接受瑞戈非尼单药治疗(第1-21天120 mg,每日一次,28天为一个周期)。试验组患者将首先接受一个周期的瑞戈非尼(第1-21天80 mg,每日一次,28天为一个周期)和特瑞普利单抗(240 mg,q3w)治疗,然后接受高剂量(8-12 Gy/4-8次)和低剂量(1-10 Gy,0.5-2 Gy/次)放疗,再继续瑞戈非尼和特瑞普利单抗治疗。主要终点是客观缓解率,次要终点是疾病控制率、缓解持续时间、中位无进展生存期、中位总生存期和不良事件。该研究招募开始于2023年8月,目前正在进行中,本文只公布该研究的设计方案。
同步不可切除转移性结直肠癌
前期原发灶切除术的临床结局6
前期原发灶切除术(PTR)在无严重症状的不可切除转移性结直肠癌患者中的作用仍存在争议。这项研究回顾性地分析了PTR在该类人群总生存期(OS)中发挥的作用。
在入组的205例患者的基线特征中,与化疗组(n = 163)相比,PTR组(n = 42)ECOG体能状态更好 (p = 0.061),右半原发灶患者比例更高(p = 0.058)、T4分期(p = 0.003)和M1a分期患者更多(p = 0.012),同时PTR组患者中< 2个器官转移的患者数量更多(p = 0.002),一线接受靶向治疗的人数更少(p = 0.011)。
PTR组相比于化疗组显示出OS获益的趋势(20.5个月vs.16.0个月,p = 0.064),但通过多因素Cox回归分析却未发现PTR与OS的相关性(p = 0.220)。男性(p = 0.061)、体能状态良好(p = 0.078)、T3分期(p = 0.060)、M1a分期(p = 0.042)、< 2个器官转移(p = 0.035)、RAS野生型肿瘤(p = 0.054)和前线接受过靶向治疗(p = 0.037)尤其是贝伐珠单抗治疗(p = 0.067)等亚组人群似乎可以从PTR中获益。在某些亚组中前期PTR可能被认为是有效的,但仍需要更大规模的研究来验证。
本期看点:
1、随机II期研究—OPRA更新了器官保留率和肿瘤预后等数据以评估局部肿瘤再生的长期风险。研究显示,在接受完整新辅助治疗的直肠癌患者中有一半实现了长期器官保留。新辅助治疗后达到完全或接近完全缓解的患者,在仅接受观察的情况下大多于2年内出现肿瘤再生。
2、综述新辅助治疗阶段pCR是否可以成为长期肿瘤结局的替代终点,同时讨论了ctDNA、cfDNA等作为替代指标的可行性。
3、一项国内的前瞻性研究,在dMMR CRC患者中通过二代测序、多色免疫荧光、单细胞RNA测序等多种技术探索了预测新辅助免疫治疗达到病理完全缓解的生物标志物,发现CD8+ T细胞与免疫治疗后的pCR相关,此外肿瘤微环境的异质性可能有助于识别接受新辅助免疫治疗后达到完全缓解的患者。
4、PanaMa研究的后续分析发现多器官转移与较差的维持治疗阶段PFS及OS相关,但是针对两种不同维持治疗方案的PFS亚组分析提示:帕尼单抗+FU/FA组在多器官转移患者以及单器官转移患者中均相对于使用FU/FA维持方案具有PFS显著获益。
5、II期前瞻性随机对照研究(SLOT)方案公布,旨在探索瑞戈非尼+高/低剂量放疗+特瑞普利单抗与瑞戈非尼单药相比治疗MSS型mCRC的疗效和安全性。
6、回顾性分析了前期原发灶切除术对不可切除的转移性结直肠癌患者生存获益的影响。研究发现在一些亚组中前期原发灶切除术可能是有助于患者疗效获益的,但仍需要更大规模的研究去验证。
1、Verheij FS, Omer DM, Williams H, et al. Long-Term Results of Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy: The Randomized Phase II OPRA Trial. J Clin Oncol. 2023;JCO2301208.
2、Fokas E, Smith JJ, Garcia-Aguilar J, Glynne-Jones R, Buyse M, Rödel C. Early Efficacy End Points in Neoadjuvant Rectal Cancer Trials: Surrogacy Revisited. J Clin Oncol. 2023;JCO2301196.
3、Li J, Hu H, Qin G, et al. Biomarkers of Pathological Complete Response to Neoadjuvant Immunotherapy in Mismatch Repair Deficiency Colorectal Cancer. Clin Cancer Res. 2023;10.1158/1078-0432.CCR-23-2213.
4、Sommerhäuser G, Karthaus M, Kurreck A, et al. Prognostic and predictive impact of metastatic organ involvement on maintenance therapy in advanced metastatic colorectal cancer: Subgroup analysis of patients treated within the PanaMa trial (AIO KRK 0212). Int J Cancer. 2023;10.1002/ijc.34760.
5、Zhou S, Wang C, Shen L, et al. Regorafenib alone or in combination with high/low-dose radiotherapy plus toripalimab as third-line treatment in patients with metastatic colorectal cancer: protocol for a prospective, randomized, controlled phase II clinical trial (SLOT). Front Oncol. 2023;13:1274487.
6、Shin JE, An HJ, Shim BY, et al. Clinical Outcomes of Upfront Primary Tumor Resection in Synchronous Unresectable Metastatic Colorectal Cancer. Cancers (Basel). 2023;15(20):5057.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


