抗体偶联药物(ADC)由单克隆抗体和小分子细胞毒性药物通过连接子偶联而成,兼具抗体的高特异性和小分子细胞毒性药物的高毒性。抗HER-2 ADC能够以肿瘤表面的HER-2蛋白为靶点,精准识别癌细胞,在快速穿透细胞膜后释放出灭杀能力强大的细胞毒药,从而实现快速消灭癌细胞的效果。维迪西妥单抗是我国自主研发的新型抗HER-2 ADC,其在HER-2过表达晚期胃癌患者中展现出巨大治疗潜力。漳州市医院吴雯医师分享1例HER-2阳性晚期胃癌病例:患者男性,63岁,胃癌伴胃周并腹腔淋巴结多发转移和肝转移,HER-2阳性,一般状况不佳,一线mDCF联合曲妥珠单抗治疗进展后,二线治疗采用多西他赛化疗病情进展迅速,三线治疗综合考虑后采用维迪西妥单抗治疗,用药4周期后达到部分缓解(PR),且治疗过程中无不良事件(AE)发生,展现出维迪西妥单抗对于HER-2阳性胃癌患者三线治疗的出色疗效和安全性。
病例介绍
福建医科大学附属漳州市医院
肿瘤内科 主治医师
福建省海峡医药卫生交流协会临床肿瘤学诊疗分会胃肠学组委员
基本情况
患者,男性,63岁,初诊时间:2021年4月。
主诉:吞咽困难伴进食后嗳气2月余。
既往史:有“高血压”病史,规律服药治疗。
个人史:否认吸烟史,否认肿瘤家族史。
辅助检查
2021年4月 内镜检查:贲门下,胃底后壁见巨大一深溃疡型病变周边粘膜不规则隆起,ca可能。
活检病理:(贲门)腺癌,累及食管下段。免疫组化:HER-2(3+),PD-L1(MXR003) TPS0 CPS 0; MMR:无错配修复缺陷的免疫组化证据。
2021年4月 盆腹腔MRI:贲门部及胃底恶性肿瘤突破浆膜面,肝内多发转移,贲门下、胃小弯侧、腹膜后、腹腔肠系膜上多发淋巴结,部分转移可能(图1)。
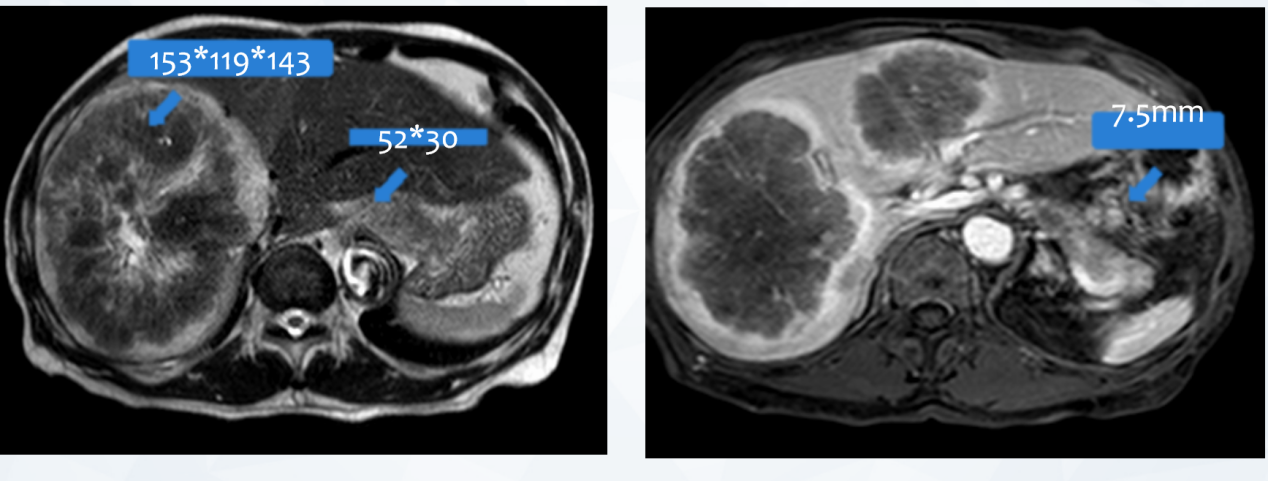
图1 2021年4月盆腹腔MRI
2021年4月7日 胸部CT:右斜裂胸膜两实性微结节(大者直径约4.8mm)(图2),建议年度随诊。
 图2 2021年4月胸部CT
图2 2021年4月胸部CT
本次诊疗经过
贲门部及胃底腺癌并腹腔多发淋巴结、肝转移cT4N+M1 IV期,HER-2阳性,pMMR。
一线治疗
由于该患者HER-2阳性,原发病灶较大且伴有转移,目前已不可切除,综合考虑于2021年4月22日行mDCF(多西他赛+顺铂+氟尿嘧啶)联合曲妥珠单抗方案化疗6周期。2021年5月,治疗2周期复查盆腹腔MRI及肺部CT(图3),疗效评价为疾病稳定(SD)。
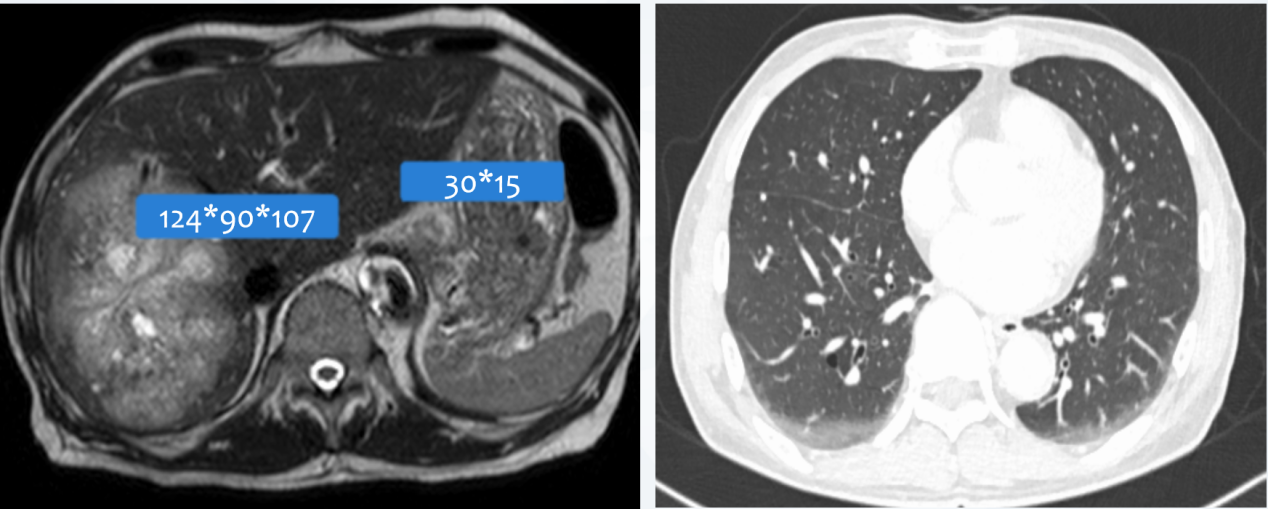
图3 2021年5月盆腹腔MRI及肺部CT
2021年7月5日 4周期复查全腹部MRI显示:病灶继续缩小(图4),疗效评价为PR。
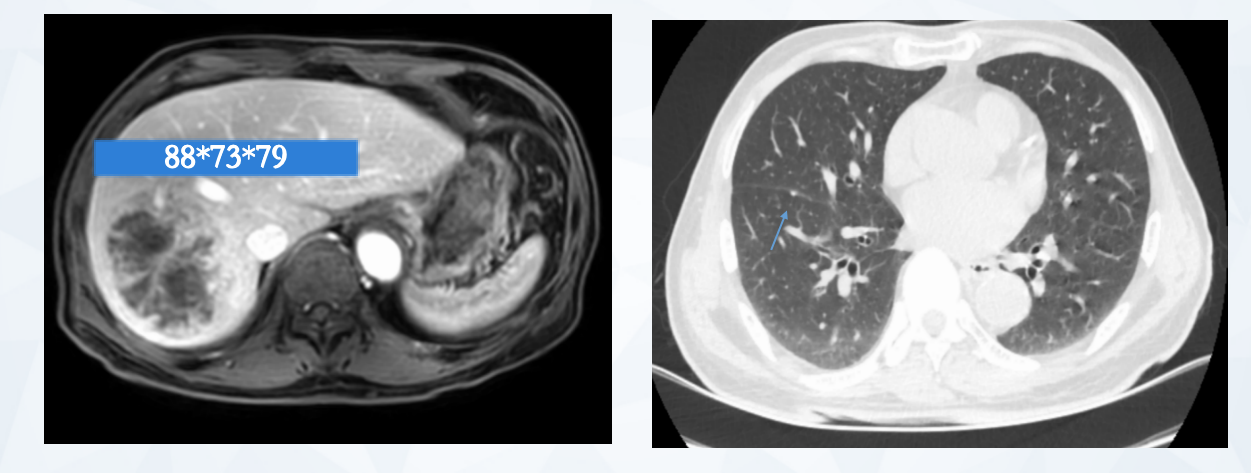
图4 2021年7月全腹部MRI
2021年9月6日 6周期复查盆腹腔MRI显示:原发病灶和转移淋巴结有所缩小(图5),疗效评价为PR。
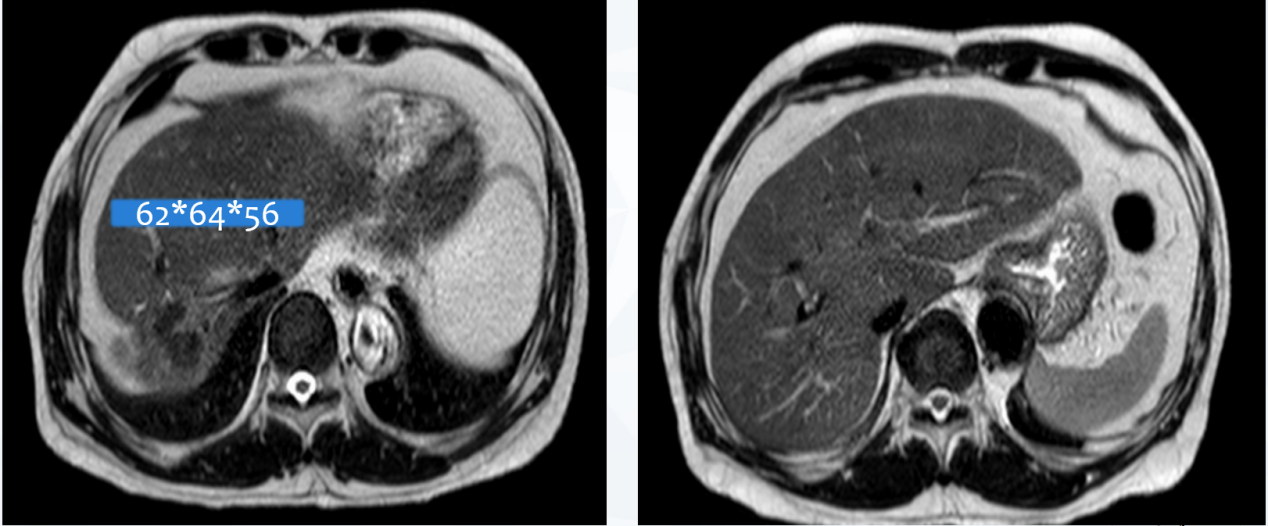
图5 2021年9月盆腹腔MRI
2021年9月6日用药方案调整为:曲妥珠单抗+替吉奥60mg bid d1-14 q3w 维持治疗(替吉奥末次服药至2023.1.10,曲妥珠单抗末次2022.12.21)。定期复查病情稳定。
2023年1月4日 胸部CT显示:1.右肺下叶外基底段新增一结节影(图6),建议抗炎后短期复查。
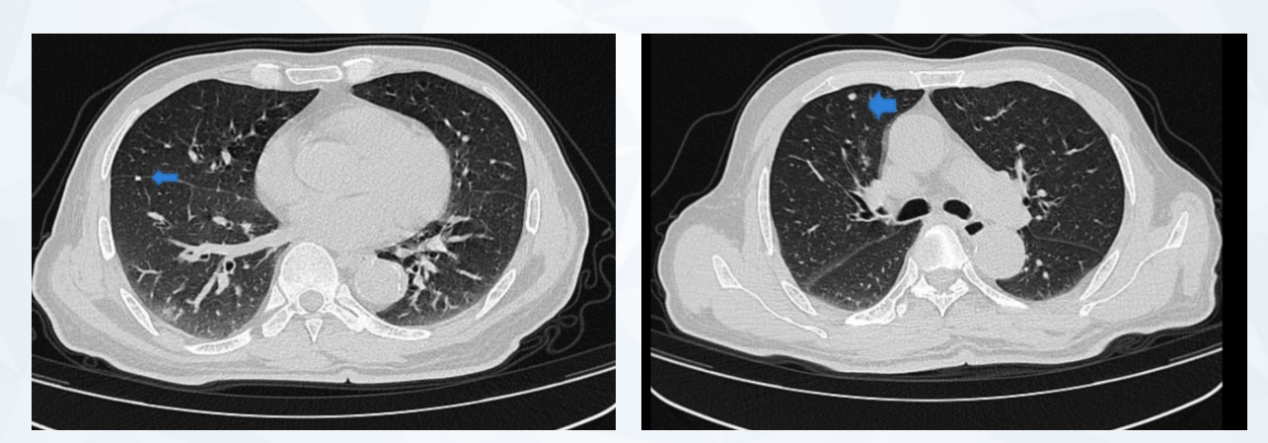 图6 2023年1月胸部CT
图6 2023年1月胸部CT
2023年1月6日 盆腹腔MRI显示:胃恶性肿瘤化疗后,贲门部及胃底占位较前增大、浸润外膜;胃小弯侧、贲门旁淋巴结转移较前增大,部分与原发灶界限不清;肝脏多发转移瘤较前稍增大,腹膜后、腹腔肠系膜上多发淋巴结大致同前(图7),疗效评价为疾病进展(PD)。
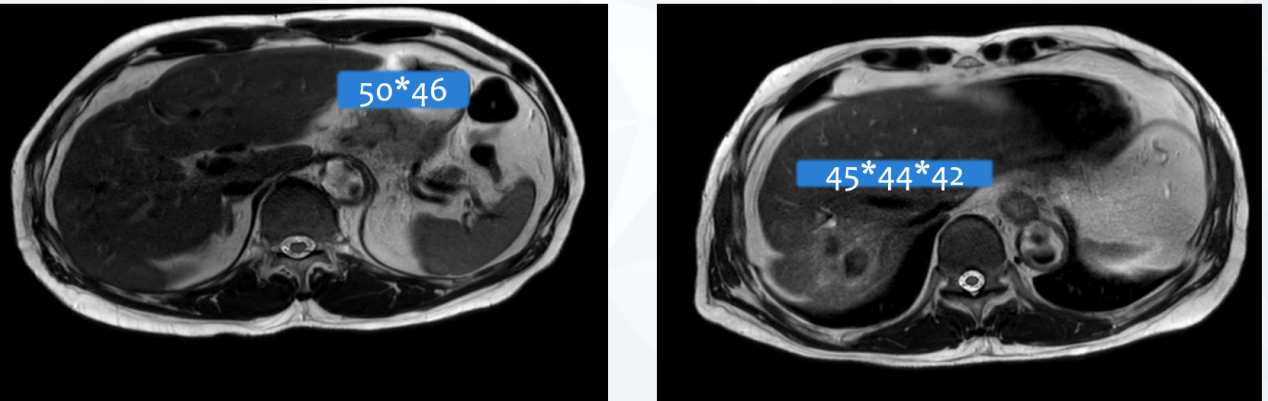
图7 2023年1月盆腹腔MRI
二线治疗
考虑患者既往接受过曲妥珠单抗,包括含铂类药物/氟尿嘧啶类药物的一线化疗方案,目前病情进展,且患者考虑经济原因,建议该患者入组人源化HER-2单抗-AS269偶联药物(ARX788)在HER-2阳性晚期胃癌及胃食管连接部腺癌二线患者有效性及安全性的国际多中心III临床试验。该患者进入对照组:2023-02-14开始予多西他赛化疗2周期。
2023年3月27日 胸部CT显示:(图8)
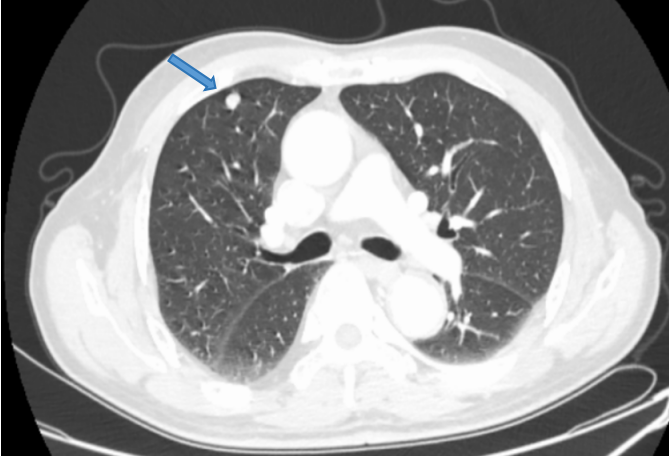 图8 2023年3月胸部CT
图8 2023年3月胸部CT
2023年3月28日 盆腹腔MRI显示:贲门部及胃底病灶较前增大,胃小弯侧、贲门旁淋巴结转移较前增大,大部分与原发灶界限不清;肝脏多发转移瘤较前增大(图9),疗效评价为PD。患者出组。
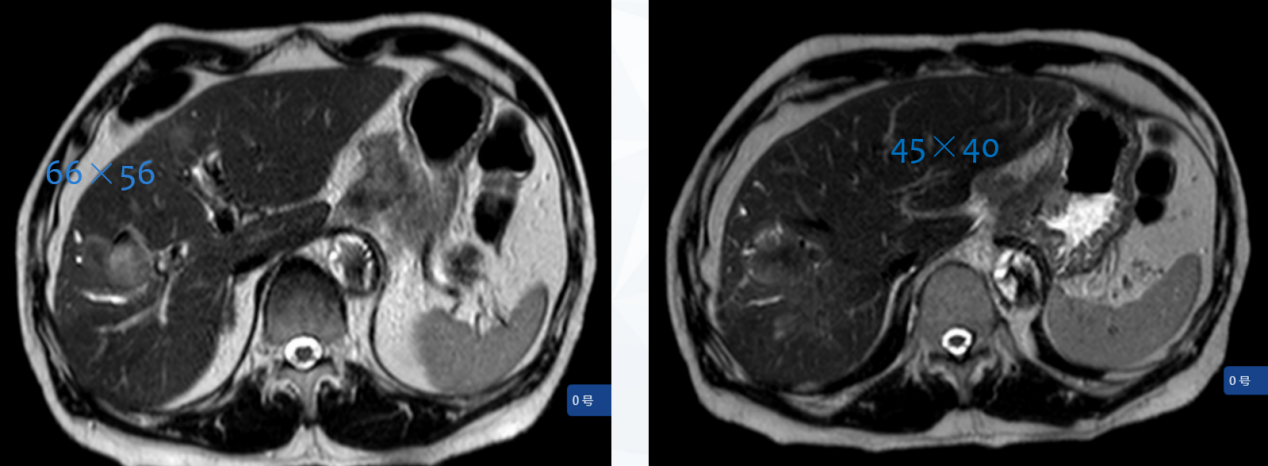
图9 2023年3月盆腹腔MRI
三线治疗
考虑患者二线治疗较快进展,于2023-03-31开始予“维迪西妥单抗”治疗7周期。
2023年6月 4周期复查盆腹腔MRI显示:贲门部及胃底病灶较前缩小(原约14mm),胃小弯侧(原45mm×40mm)、贲门旁淋巴结转移较前缩小,部分与原发灶界限不清;肝脏多发转移瘤较前缩小(原66mm×56mm)(图10)。
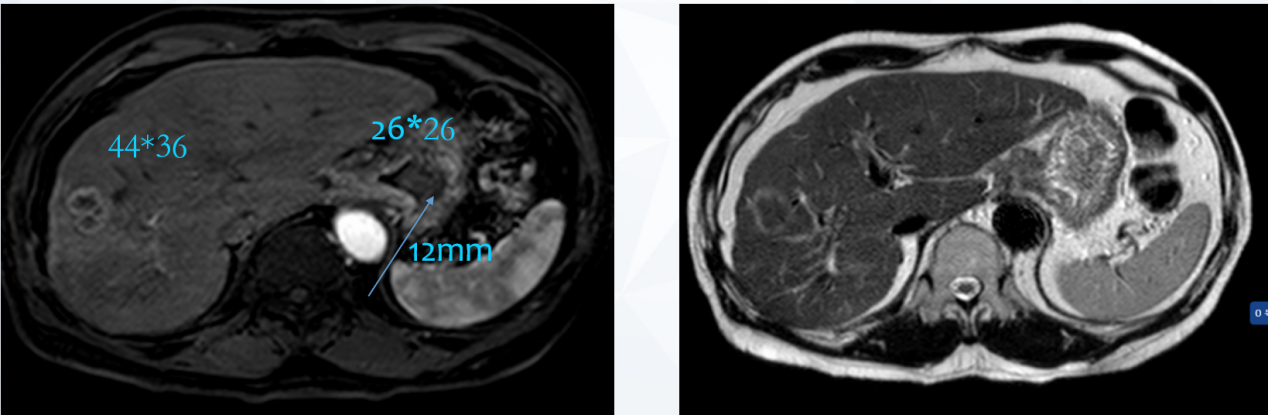
图10 2023年6月盆腹腔MRI
2023年7月 胸部CT显示:右肺上叶前段小结节、中叶外侧段微小结节较前略增大,考虑转移瘤可能;余同前(图11)。
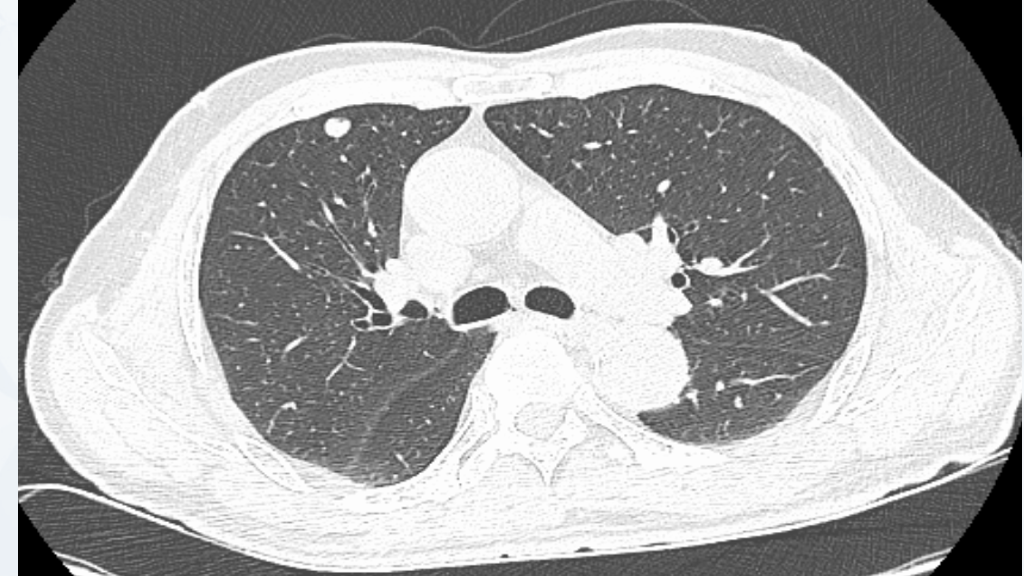 图11 2023年7月胸部CT
图11 2023年7月胸部CT
疗效评价:PR。
2023年8月26日 复查盆腹腔MRI显示:(图12)
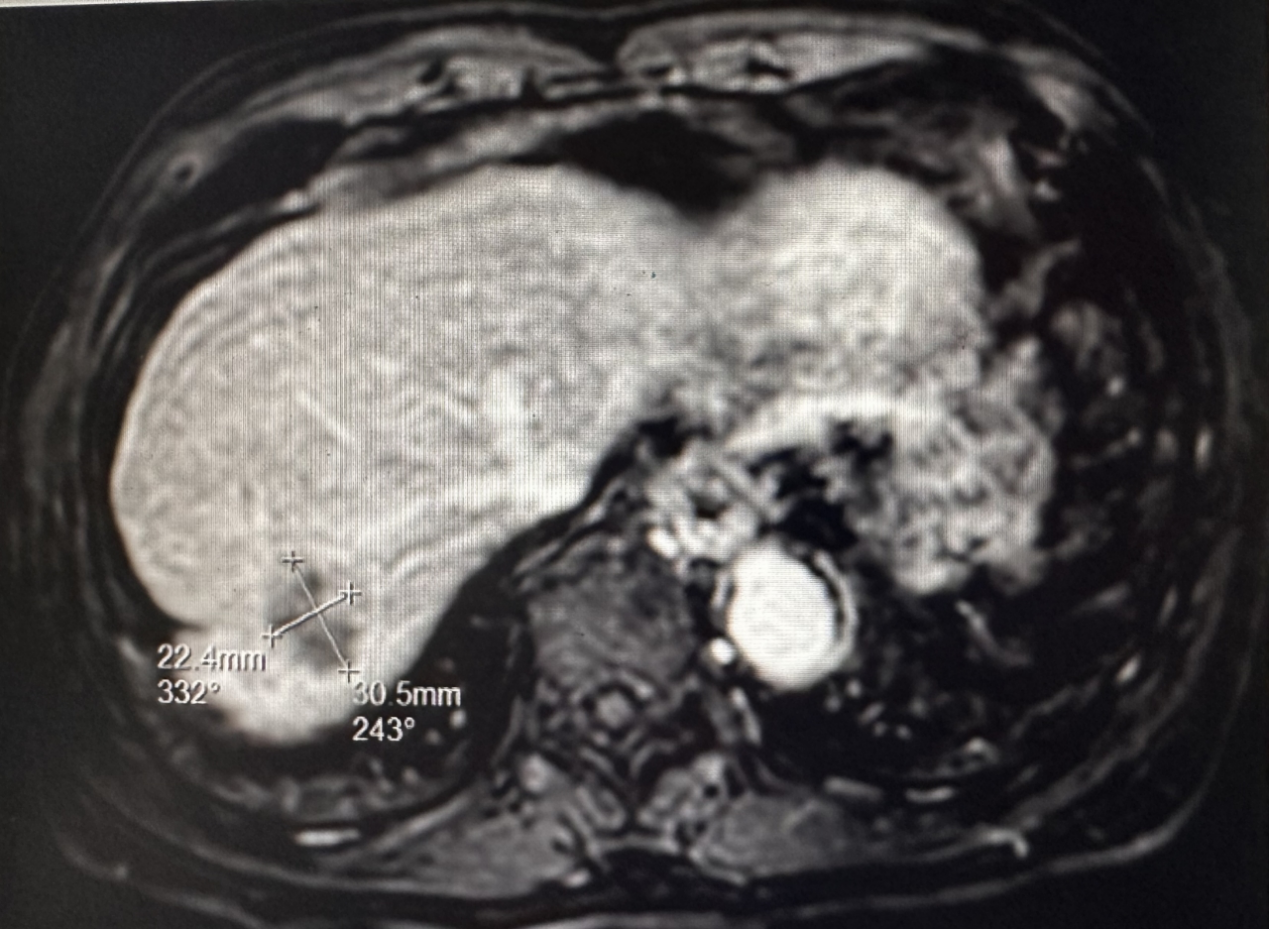 图12 2023年8月盆腹腔MRI
图12 2023年8月盆腹腔MRI
诊疗经过见图:
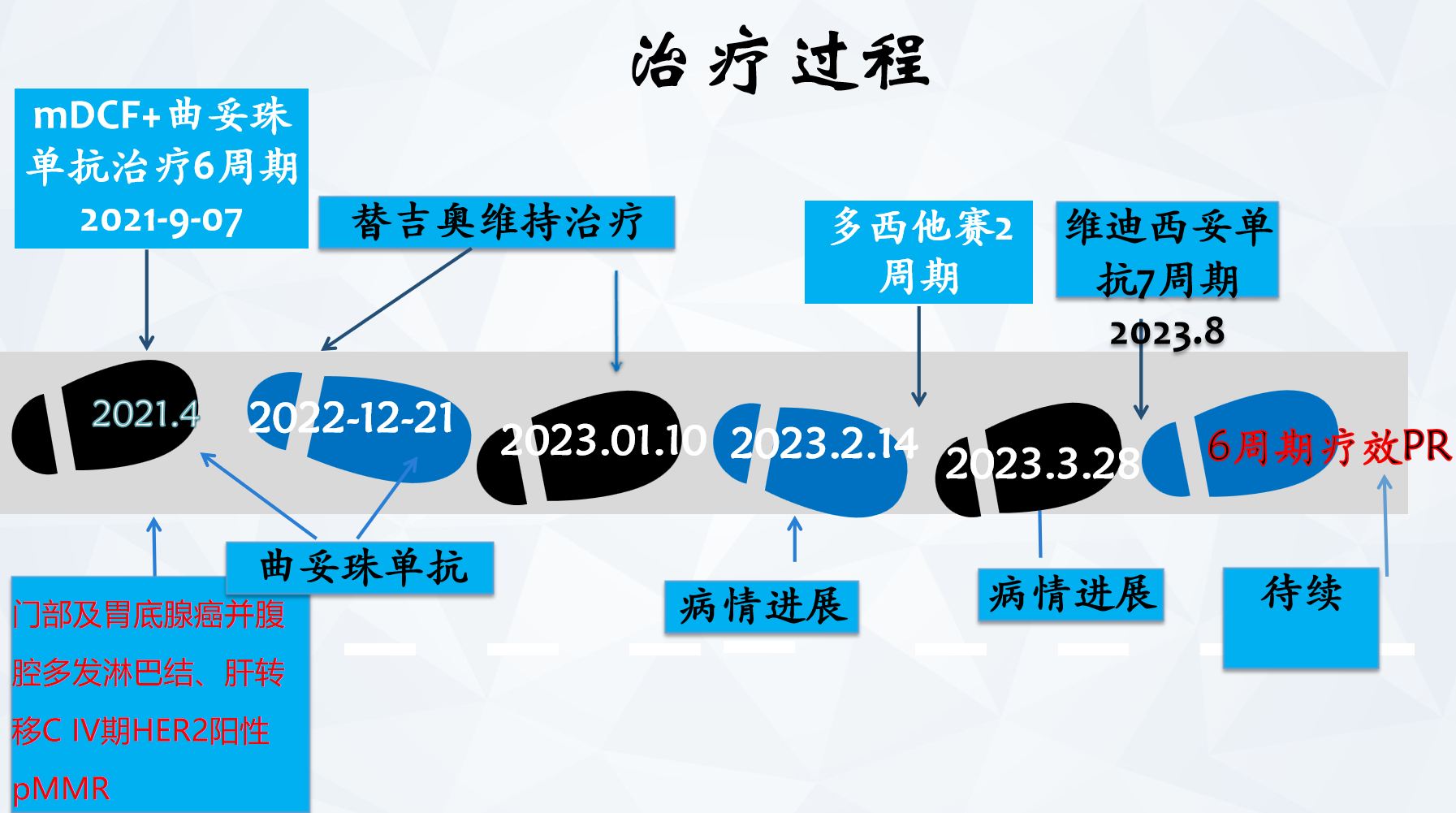
病例总结
该患者老年男性,2021年4月初诊即晚期胃癌,胃底腺癌并腹腔多发淋巴结、肝转移,HER-2阳性。一线治疗首选mDCF联合曲妥珠单抗方案治疗,6周期评效PR。后行曲妥珠单抗+替吉奥方案维持一线治疗,2周期后评估PR。2023年1月治疗出现进展,二线治疗建议患者参加人源化HER-2单抗-AS269偶联药物(ARX788)的III临床试验,希望能够使用ADC药物治疗,因临床试验分组的随机性,患者接受多西他赛化疗2周期,疗效PD。考虑二线治疗进展较快,患者接受维迪西妥单抗治疗,4周期后复查疗效PR,目前无进展生存期(PFS)已经5个多月。
病例点评
漳州市医院肿瘤内科副主任医师
福建省抗癌协会第一届肿瘤心理学专业委员会副主任委员
漳州市抗癌协会肝胆肿瘤专业委员会委员副主任委员
福建省抗癌协会第二届肿瘤内科专业委员会委员
福建省海峡精准医学专业委员会委员
福建省抗癌协会第二届肿瘤营养与支持治疗专业委员会委员
福建省海峡肿瘤防治科技交流协会肿瘤临床研究协作分会理事
据统计,2020年我国新发胃癌病例高达47.8万人,占全球新发病例的43.9%[1]。我国胃癌患者中HER-2阳性率约13%[2]。HER-2阳性胃癌通常表现为更加具有侵袭性,预后较差,标准化疗后疾病控制时间有限,生存率低,严重影响患者的生存和生活质量[3]。近年来,随着靶向治疗在HER-2阳性晚期胃癌治疗领域的突破,曲妥珠单抗联合化疗已逐渐成为一线治疗的标准方案。尽管这一治疗方法改善了患者的预后,但患者生存率仍然相对较低,且耐药性问题逐渐展现,这表明在胃癌抗HER-2治疗领域仍存在巨大的治疗需求。
近年来,ADC药物在HER-2阳性胃癌治疗中展现出高度的靶向性和疗效,为临床医生提供了更有效的治疗方法。维迪西妥单抗是我国第一个进入临床研究的ADC药物,在其针对≥2线标准治疗失败的HER-2过表达晚期胃癌的临床研究RC48-C008[4]中,客观缓解率(ORR) 为 24.8%,中位 PFS 和总生存期 (OS)分别为 4.1 个月和 7.9 个月。安全性方面,主要不良反应为白细胞减少、虚弱、脱发、中性粒细胞减少等,对症支持治疗后可获得缓解;未发现间质性肺炎、心脏毒性等严重不良反应,无治疗相关死亡。基于RC48-C008研究结果,维迪西妥单抗在国内获批HER-2过表达(IHC 2+/3+)晚期胃癌三线及以上治疗适应证。2023版《CSCO胃癌诊疗指南》将维迪西妥单抗治疗由HER-2阳性晚期胃癌三线治疗II级推荐前移至I级推荐[5]。
随着ADC生物工程技术的不断提升,新一代ADC具备更高的药物抗体比例、可切割型连接子以及能引发旁观者效应的毒性载荷,使其在靶向特定癌细胞的治疗中表现出更显著的疗效。维迪西妥单抗作为我国自主研发的新型ADC药物,在HER-2阳性晚期胃癌治疗中显示了优异的疗效和可控的安全性。本例患者晚期胃癌合并多发淋巴结转移和肝转移,二线治疗进展之后采用维迪西妥单抗治疗达到PR,目前仍在持续获益中。未来可以探索ADC药物与其他药物联合使用的价值,例如ADC药物联合免疫检查点抑制剂被认为具有良好前景,期待这种联合治疗方案可以进一步提高疗效,为HER-2阳性胃癌患者提供更多选择。
[1] Wei Cao, Hong-Da Chen, Yi-Wen Yu, et al. Changing profifiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J].Chinese Medical Journal,2021;134(7):783-791.
[2] Sheng WQ, Huang D, Ying JM, et al. HER2 status in gastric cancers: a retrospective analysis from four Chinese representative clinical centers and assessment of its prognostic significance[J]. Annals of oncology: official journal of the European Society for Medical Oncology, 2013,24(9):2360-2364.
[3] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
[4] Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond). 2021;41(11):1173-1182.
排版编辑:肿瘤资讯-Riddy











 苏公网安备32059002004080号
苏公网安备32059002004080号


