
浙江大学附属第一医院
肿瘤内科(三)主任
主任医师
中国临床肿瘤学会胆道肿瘤专家委员会常委
中国临床肿瘤学会理事
国家卫健委能力建设及继教肿瘤专委会委员
第三期的BTC 双月评又和大家见面了,我们精选了六篇风(研究内容)格(影响因子)迥异的文章,邀请了六位活跃在临床与科研一线的中青年专家进行了展示她(他)们多彩画(聚焦方向)风(行文特色)的点评。本期月评不仅有新药研究,也有真实世界拓展,更有前沿分子分型等转化研究结果的分享;点评专家们基于胆系肿瘤本身的特点,从特定泛瘤种标志物扩增或表达在创新药物设计的持续聚焦,到传统靶点和组合疗法在真实世界“路遥知马力”式获益的精彩呈现,再到被专家们全程无漏点关注的转化及机制研究结果剖析,让我们这次月评有了可与往期内容媲美的广度和深度,希望依然能给读者们带来临床与科研的参考,以及点赞。
本期检索了2023年6月1日至7月31日期间发表的最新文献以及BTC相关最新指南。现挑选6篇文献进行专家点评,优选3篇最新指南以及9篇IF≥5的文献进行泛读,供大家参考阅读。
本期文献检索和内容编辑得到了基石医学团队的大力帮助。
文献点评
Zanidatamab for HER2-amplified, unresectable, locally advanced or metastatic biliary tract cancer (HERIZONBTC- 01): a multicentre, single-arm, phase 2b study
Zanidatamab治疗HER2扩增、不可切除、局部晚期或转移性胆道肿瘤(HERIZON-BTC-01):一项多中心、单臂、2b期研究

文献引用:Harding JJ, et al. Lancet Oncol. 2023 Jul;24(7):772-782. [PMID: 37276871 doi: 10.1016/S1470-2045(23)00242-5.]
期刊:Lancet Oncology(IF=51.1)
文献类型:靶向治疗,二线治疗
Zanidatamab是一种能够同时结合HER2的两个非重叠表位的双特异性抗体,作用机制包括双重阻断HER2信号、增强结合并去除细胞表面的HER2蛋白、强有力的抗体效应子功能,在胆道肿瘤(BTC)治疗方面有着非常积极的意义。
HERIZON-BTC-01是一项全球、多中心、单臂、2b期试验,针对HER2扩增、不可切除、局部晚期或转移性BTC且既往应用吉西他滨为基础治疗方案后进展患者,纳入北美、南美、亚洲和欧洲9个国家32个中心总计87例患者,基于肿瘤免疫组化的不同状态分组,队列一80例,队列二7例,每2周静脉注射Zanidatamab 20mg/kg。主要观察终点为独立评审中心确认的客观缓解率,且对所有应用任何治疗剂量的患者进行了Zanidatamab抗肿瘤活性和安全耐受性的评估。
数据截至2022年10月10日,中位治疗持续时间为5.1个月(IQR 1.9–8.8;范围0.5–19.8),18例(21%)患者继续接受治疗,23例(26%)患者停药但仍接受生存期随访。64例(74%)患者因放射学显示肿瘤进展停药,这也是停药最常见的原因。中位随访时间为12.4个月(IQR 9.4–17.2),37例患者死亡,9例出组。
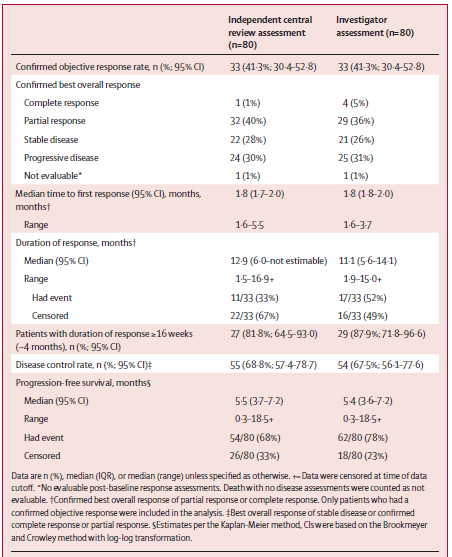
队列一80例患者中33例达到缓解,客观缓解率41.3%(95% CI30.4–52.8),包括1例完全缓解(CR)和32例部分缓解(PR),中位缓解持续时间为12.9个月。中位至首次缓解时间为1.8个月(IQR 1.7–2.0;范围1.6–5.5)。ORR 41.3% (95% CI 30.4-52.8),总体疾病控制率为68.8%(95% CI 57.4–78.7)。中位无进展生存期(PFS)为5.5个月(95% CI 3.7–7.2),中位总生存期(OS)未达到,9个月OS率为69.9%(95% CI 57.8–79.1)。队列二无缓解患者,中位PFS为1.9个月 (95% CI 1.2–NE),中位OS为5.5个月(95% CI 1.2–10.1)。
84例(97%)接受治疗的患者出现至少一次不良事件(AE),63例(72%)出现至少一次研究者认为与治疗相关不良事件(TRAE)。最常见(>10%)TRAE为腹泻(37%)和输注反应(33%),大多数腹泻为1-2级,可临床对症管理。16例(18%)出现3级TRAE,其中腹泻(5%)、射血分数降低(3%)、贫血(2%)发生的患者数超过1例。没有发现4或5级TRAE。7例(8%)发生严重TRAE,末次治疗后30天内5例患者死亡,但均认为与药物副作用无关。
总体而言,该项目前已知最大规模的HER2扩增BTC试验广受关注,本次最新成文发表的数据进一步展现出Zanidatamab在意向人群中的治疗潜力和有利的安全性特征。
表:队列1中独立中心审查和研究者评估的缓解情况(HER2阳性)
专家点评

近年来,有关晚期BTC精准靶向治疗的研究得到越来越多的关注,也正在不断取得突破。HER-2突变或扩增是BTC相对常见的基因改变之一。国外资料显示,HER-2突变或扩增在整个BTC中主要发生在胆囊癌,发生率10%-19%左右,而在肝内胆管癌较低,约为5%,中国患者的发生情况与国外基本一致。目前靶向HER-2的BTC治疗药物通常分为三大类:小分子酪氨酸激酶抑制剂,如来那替尼;大分子的单抗,如曲妥珠单抗、帕妥珠单抗和泽尼达妥单抗等;抗体偶联药物,如德曲妥珠单抗(DS-8201)、维迪西妥单抗等。
HERIZON-BTC-01是一项全球、多中心、Ⅱb期、关键注册研究,旨在评价泽尼达妥单抗(Zanidatamab)治疗HER-2扩增的不可切除、局部晚期或转移性并且先前接受过基于吉西他滨治疗的BTC患者的疗效与安全性。研究结果于2023年6月在ASCO大会上进行了口头报告,并同步在Lancet Oncology杂志在线发表。泽尼达妥单抗是一种人源化、双特异性、IgG1型的靶向HER-2抗体,同时双特异靶向HER-2的ECD4(曲妥珠单抗结合域)和ECD2(帕妥珠单抗结合域)两个表位,通过多种机制,包括HER-2信号的双重阻断、增加HER-2蛋白从细胞表面的清除以及提高抗体介导的细胞毒性作用,从而提高抗肿瘤活性。在本项研究中,入组队列1中的80例HER-2阳性的BTC患者经过Zanidatamab治疗,经确认客观缓解率(ORR)达到41.3%,中位起效时间是1.8个月,中位反应持续时间(DOR)更是达到了12.9个月,展现出了令人鼓舞的抗肿瘤疗效。安全性方面,泽尼达妥单抗3级治疗相关不良事件(TRAE)的发生率较低,为18.4%,其中腹泻的发生率仅为5%,没有4级的TRAE和治疗相关死亡发生,耐受性良好。HERIZON-BTC-01研究的结果充分表明泽尼达妥单抗在HER-2阳性的BTC领域具有良好的治疗前景。
当然,这只是一项Ⅱ期、单臂的研究,目前报告的是近期疗效结果,缺乏长期生存的数据,期待后续更大样本量的随机、对照研究结果能够确认最为重要的生存获益;同时,在Zanidatamab治疗的基础上联合化疗或者免疫检查点抑制剂等不同作用机制的药物,能否进一步提高疗效也非常值得深入探索。
Targeting CD44 Variant 5 with an Antibody-Drug Conjugate Is an Effective Therapeutic Strategy for Intrahepatic CholangiocarcinomaSilmitasertib
抗体-药物偶联物靶向CD44变异体5是肝内胆管癌的有效治疗策略

文献引用:Bei YC, et al. Cancer Res. 2023 Jul 14;83(14):2405-2420. [PMID: 37205633. doi: 10.1158/0008-5472.CAN-23-0510]
期刊:Cancer Research(IF= 11.2)
文献类型:基础研究
肝内胆管细胞癌(ICC)是最具致命性的恶性肿瘤之一,迫切需要新的治疗方法。研究表明,ICC细胞中选择性表达CD44变体异构体(而非CD44标准异构体),为开发基于抗体-药物偶联物(ADC)的靶向治疗策略提供了机会。
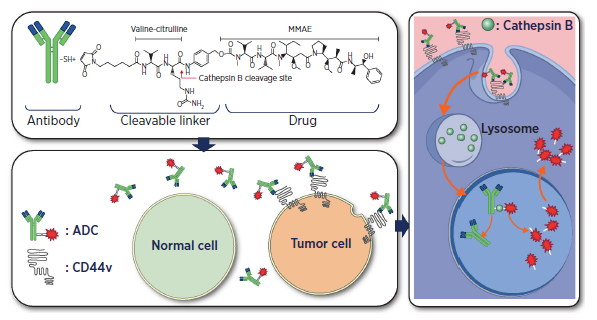
本研究来自南京鼓楼医院团队,观察到CD44变体5(CD44v5)在ICC肿瘤中的特异表达。CD44v5蛋白在大多数ICC肿瘤表面(155个样本中的103位点)上表达。研发了针对CD44v5的ADC H1D8-DC(H1D8-药物偶联物),它由人源化的抗CD44v5单克隆抗体与微管抑制剂单甲基噁唑啉E(MMAE)通过可切割的缬氨酸-瓜氨酸基连接剂结合而成。H1D8-DC在表达CD44v5的细胞上表现出高效的抗原结合和内化作用。由于ICC细胞中组织蛋白酶B的高表达,H1D8-DC药物优先释放于癌细胞而不是正常细胞,因此在皮摩尔浓度下引发强效的细胞毒性。体内研究显示,H1D8-DC对CD44v5阳性的ICC细胞有效,并在患者来源的异种移植模型中诱导肿瘤退缩,而没有观察到明显的毒性反应。这些数据表明CD44v5可以作为ICC的靶点,并为基于CD44v5的ADC的临床研究提供了理论基础。
在肝内胆管细胞癌中CD44变体5的高表达使其成为新开发的抗体-药物偶联物H1D8-DC的可靶向易感因子,能够诱导强效的抑制肿瘤生长效应而不引起明显的毒副作用。
专家点评

肝内胆管癌(ICC)发病率在全球范围内呈上升趋势,亚洲人群发病率高于欧美人群。对于不可切除和转移性的ICC患者,全身药物治疗是疾病控制的关键组成部分。在过去的十年中,ICC的全身治疗通常采用吉西他滨+顺铂的方案,但生存获益有限。近年来,ICC的分子靶向治疗进展迅速,其中针对FGFR2融合和IDH1突变已具备较为成熟的治疗策略。然而,还有相当一部分患者不具备这样的分子特征。因此,我们需要寻找新的潜在治疗靶点。
该研究发现CD44V5在ICC中特异性表达,研究人员通过可切割的缬氨酸-瓜氨酸接头将人源化抗CD44v5单克隆抗体(mAb)连接到微管抑制剂单甲基auristatin E( MMAE)上,构建了一种靶向CD44v5的ADC,H1D8- DC。H1D8-DC在细胞表面表达CD44v5的细胞中具有高效的抗原结合和内化能力。由于Cathepsin B在ICC细胞中高表达,药物在肿瘤细胞中优先释放,而在正常细胞中不释放,从而在皮摩尔浓度下就发挥较强的细胞毒性。研究表明,H1D8-DC在体外和体内均特异性清除CD44v5阳性的ICC细胞。此外,在CD44v5阳性的ICC患者来源的异种移植瘤(PDXs)中观察到了有效的抗肿瘤活性,具有良好的安全性。该研究结果为基于CD44v5靶向ADC的临床研究提供了理论基础。
ICC是一种侵袭性较强且预后较差的恶性肿瘤,复杂的疾病特征是其治疗面临的主要困难。靶向治疗正得到越来越多的认可,为经过筛选的患者带来了令人欣喜的疗效。ADC药物借助了抗体的特异靶向性以及小分子的高毒性,具有独特的优势,也面临着诸多挑战,期待靶向CD44v5的ADC药物能够进入临床研究阶段,为ICC患者带来更多的生存获益。
Updated survival outcomes with ivosidenib in patients with previously treated IDH1-mutated intrahepatic-cholangiocarcinoma: an Italian real-world experience
既往经治的IDH1突变肝内胆管癌患者使用艾伏尼布的最新生存结果:意大利的真实世界经验

文献引用:Rimini M , et al. Ther Adv Med Oncol. 2023;15:17588359231171574. (PMID: 37457302,DOI: 10.1177/17588359231171574)
期刊:Ther Adv Med Oncol (IF: 4.9)
文献类型:靶向治疗,IDH1
最近已发表过IDH1突变的晚期CCA患者使用艾伏尼布的真实世界经验的有效性及安全性,本次更新长期生存结果。
本研究纳入了11例IDH1突变的局部晚期或转移性CCA的患者,从2021年5月至2022年4月在意大利6家机构接受艾伏尼布治疗(500mg qd口服),进行回顾性分析,评估艾伏尼布的疗效及安全性。此外,根据NGS分析所揭示的基因组和分子图谱评估生存结果。
63%的患者ECOG PS评分0分,45%的患者在诊断时接受了原发性肿瘤切除术。所有患者都接受了化疗作为一线治疗。2名患者(18%)接受了艾伏尼布二线治疗,7名患者(64%)接受了三线治疗,2名患者(18%)接受了四线治疗。
中位随访为13.7个月。总体而言,不论治疗线数如何,艾伏尼布开始治疗后的中位OS为15个月(95% CI: 6.6-15.0),而中位PFS为4.4个月(95% CI: 2.0-5.8)。所有患者的DCR为63%,其中2例患者(18%)达到PR,5例患者(45%)达到SD,4例患者(37%)达到PD。

此外,研究者先前对IDH1突变的CCA进行的聚类分析揭示了三个基因组簇,从分子和基因组的角度对这些患者进行了分组。第1组确定了三名患者,主要特征是KRAS/NRAS途径和参与细胞周期和凋亡的基因的突变;第2组确定了三名患者,特征为涉及染色质修饰、DNA损伤调控系统和PI3K的基因变异;最后,第3组确定了两名患者,特征为TP53共突变。生存分析显示,第2组患者的中位PFS未达到,第1组和第3组患者的中位PFS为4.3个月,但没有达到统计学显著性。
研究中包括的所有患者开始接受标准剂量为500mg的艾伏尼布治疗,每天口服一次。2例患者(18%)发生治疗相关AE(TRAE),均为II级。其中1例II级心电图Q-T间期延长,1例II级低镁血症,均无主观症状。1例患者因TRAEs(Q-T间期延长)中断治疗,随后剂量减少到250mg/天。
专家述评

Ivosidenib(艾伏尼布)是一款新型靶向IDH1的抑制剂,IDH抑制剂是通过精准靶向IDH1突变,降低肿瘤代谢产物2-HG至正常水平,同时促进细胞的正常分化,达到控制肿瘤生长的目的。大型III期临床研究ClarIDHy研究证实艾伏尼布用于经治的IDH1突变胆管癌患者显著提升患者的OS至10.3个月,且安全性良好,基于此艾伏尼布于2021年FDA获批晚期胆管癌二线适应症。
本文是艾伏尼布治疗IDH1突变晚期CCA的首个真实世界研究的中IDH1突变队列的最新随访数据更新。聚焦在艾伏尼布治疗IDH1突变人群的疗效与安全性,随着随访时间的延长至13.7个月,共纳入11例(新纳入2例)IDH1突变的晚期胆管癌患者,mPFS延长至4.3个月(95% CI: 2.0–5.8),mOS达到15个月(此前OS未达到);2例(18%)患者PR,在这个意大利的小样本真实世界研究艾伏尼布治疗IDH1突变晚期CCA疗效优于ClarIDHy研究(非头对头比较),安全性数据相似。此研究的局限性在于样本量偏小以及缺少后续抗肿瘤治疗数据。8例患者进行了二代测序,R132C错义突变是队列中观察到的最普遍IDH1错义突变(56%);同时发现BAP1、KRAS/NRAS、TP53、ARID1A、PBRM1、PI3KCA和MTAP是较常见的同突变基因。结果与ClarIDHy试验中报告的一致。但基因突变类型与预后的关系由于样本量较小无法得到准确判断,需大样本数据进一步研究。
随着对IDH1突变的CCA患者的分子和基因组研究的不断深入,我们期待基因图谱助力临床解决更多问题,探索新的联合治疗方案以及艾伏尼布潜在的原发性或获得性耐药机制。
Effectiveness and safety of radiotherapy plus programmed death‑1 inhibitors and lenvatinib in patients with advanced biliary tract carcinoma: a real‑world study
放疗联合PD1抑制剂和仑伐替尼治疗晚期胆道癌的有效性和安全性:一项真实世界研究

文献引用:Wang Y, et al. Cancer Immunol Immunother. 2023;72(7):2197-2204. [PMID: 36856834. doi: 10.1007/s00262-023-03399-2]
期刊:Cancer Immunology, Immunotherapy(IF= 5.8)
文献类型:胆管癌联合治疗、PD-1抑制剂、Lenvatinib、同步放疗、挽救性放疗
胆管癌(BTC)预后较差,对于化疗失败后出现疾病进展的晚期胆管癌患者,后续可用的抗肿瘤治疗方案有限。放疗(RT)可能与免疫治疗和靶向药物(TA)存在协同作用。本研究旨在评估RT联合程序性死亡-1(PD-1)抑制剂和仑伐替尼治疗复发或难治性晚期胆管癌的有效性和安全性。
这项回顾性研究纳入北京协和医院接受放疗联合PD-1抑制剂和仑伐替尼治疗的复发或难治性晚期BTC患者。评价总生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)、疾病控制率(DCR)和安全性。
31例接受RT联合PD-1抑制剂和仑伐替尼作为二线或后线治疗的患者纳入了分析。ORR和DCR分别为32.3%和87.1%。中位PFS和中位OS分别为7.9个月和11.7个月。亚组分析分别有12例患者接受了同步RT治疗,19例患者接受了挽救性RT治疗(开始PD-1抑制剂治疗6周后)。挽救性RT组有更高的mOS(11.7vs10.5;p=0.75)和mPFS(7.9vs.6.9;p=0.85)高于同步RT组;但未达到统计学意义。所有患者都经历了任何级别的不良事件(AEs),没有观察到过量的PD-1抑制剂或RT毒性。研究提示将RT加入PD-1抑制剂和仑伐替尼联合治疗可能会产生良好的安全性和有前景的抗肿瘤疗效。

图1:接受RT+PD-1抑制剂和仑伐替尼治疗患者的无进展生存期A和总生存期B的Kaplan-Meier曲线

图2:根据RT和PD-1抑制剂之间的时间间隔分层后的无进展生存期A和总生存期B的Kaplan-Meier曲线
专家点评

如研究者所述,这是第一项评估放疗联合PD-1抑制剂和仑伐替尼治疗复发或难治性晚期胆管细胞恶性肿瘤(BTC)的有效性及安全性的研究。放疗可以增强肿瘤细胞表面主要组织相容性复合体I(MHC-I)的呈递作用,提高肿瘤抗原的交叉呈递,促进T细胞浸润、必需细胞因子分泌。放疗还能增加肿瘤微环境中抑制性髓样细胞群的表达。其对于肿瘤微环境的改变为联合免疫治疗、靶向治疗提供坚实的基础,放疗+靶免的联合治疗方案在肝癌的治疗上已取得了部分进展。本研究的结果也初步证实联合方案(放疗+PD-1抑制剂+仑伐替尼)可以安全地联合使用,并对晚期BTC患者具有抗肿瘤作用。
应该指出胆道系统肿瘤的研究常受限于研究人群的异质性,以病种而言,BTC所包含的肝内胆管癌、肝外胆管癌和胆囊癌在手术方法、临床行为和分子特性方面有显著的差异。单独放疗来治疗肝内胆管癌、胆囊癌并未获得广泛认可。对于晚期肝门部胆管癌(HCCA),无论是单独使用放疗还是与其他方式联合使用的数据都较少见。并且由于HCCA特殊的解剖位置、较高的异质性等特点,传统的外放疗治疗在HCCA的临床应用上受到了严重的限制。因此,选择相同病种或同质型高的研究对象对后续研究至关重要。同时,由于放疗靶区(瘤体、淋巴结)、肿瘤大小及特性(HCCA往往瘤体小,血液学评估更为常用)等差异,传统的RECIST 1.1标准难以精确的评估放疗或是联合治疗对于BTC的疗效,需结合实验室检查进行综合评价。另外如果能以常见BTC化疗方案(GC或FOLFOX)联合靶免治疗的作为对照,研究的结果会更有说服力。
尽管如此,作为初步探索这项研究对于临床实践和未来的研究仍具有重要的意义,对于BTC这一相对“少见”的肿瘤,多中心的密切合作将更有助于对新的治疗方案的评估与确定。
Refining Classification of Cholangiocarcinoma Subtypes via Proteogenomic Integration Reveals New Therapeutic Prospects
通过蛋白基因组整合对胆管癌亚型的精细分类揭示了新的治疗前景

文献引用:Brandi G, et al. Gastroenterology. 2023 Jun;164(7):1293-1309. [PMID: 36898552 DOI: 10.1053/j.gastro.2023.02.045]
期刊:Gastroenterology(IF= 29.4)
文献类型:肝内胆管癌,蛋白质组学,ALDH1A1抑制剂
肝内胆管癌(ICCs)具有罕见、诊断困难、预后差等特点。本研究探索了ICC分子分类。
对102例ICC患者治疗早期的肿瘤样本进行了全面的基因组学、转录组学、蛋白质组学和磷酸蛋白质组学分析,并构建了一个类器官模型来测试治疗潜力,用于制定精准医疗策略。
研究通过基因和蛋白组学整合分析,在蛋白质组基因组学分辨率上揭示了ICC的全面信息,确定了三种临床的亚型(干细胞样、弱免疫原性和代谢),并确定了高风险分子亚型。在干细胞样亚型的类器官模型中,NCT-501(ALDH1A1抑制剂)与白蛋白紫杉醇表现出协同作用,提示了使用白蛋白紫杉醇联合NCT-501的新治疗策略。肿瘤代谢产物失调与干细胞样和代谢亚型的不同临床结果有关。低免疫原性的亚型包含非T细胞肿瘤浸润。综合多组学分析不仅再现了三种亚型,而且显示了ICC的异质性。
这种大规模的蛋白基因组分析提供了基因组分析之外的信息,使基因组改变造成的功能影响得以被辨别。这些发现可能有助于对ICC患者进行分层,并制定合理的治疗策略。
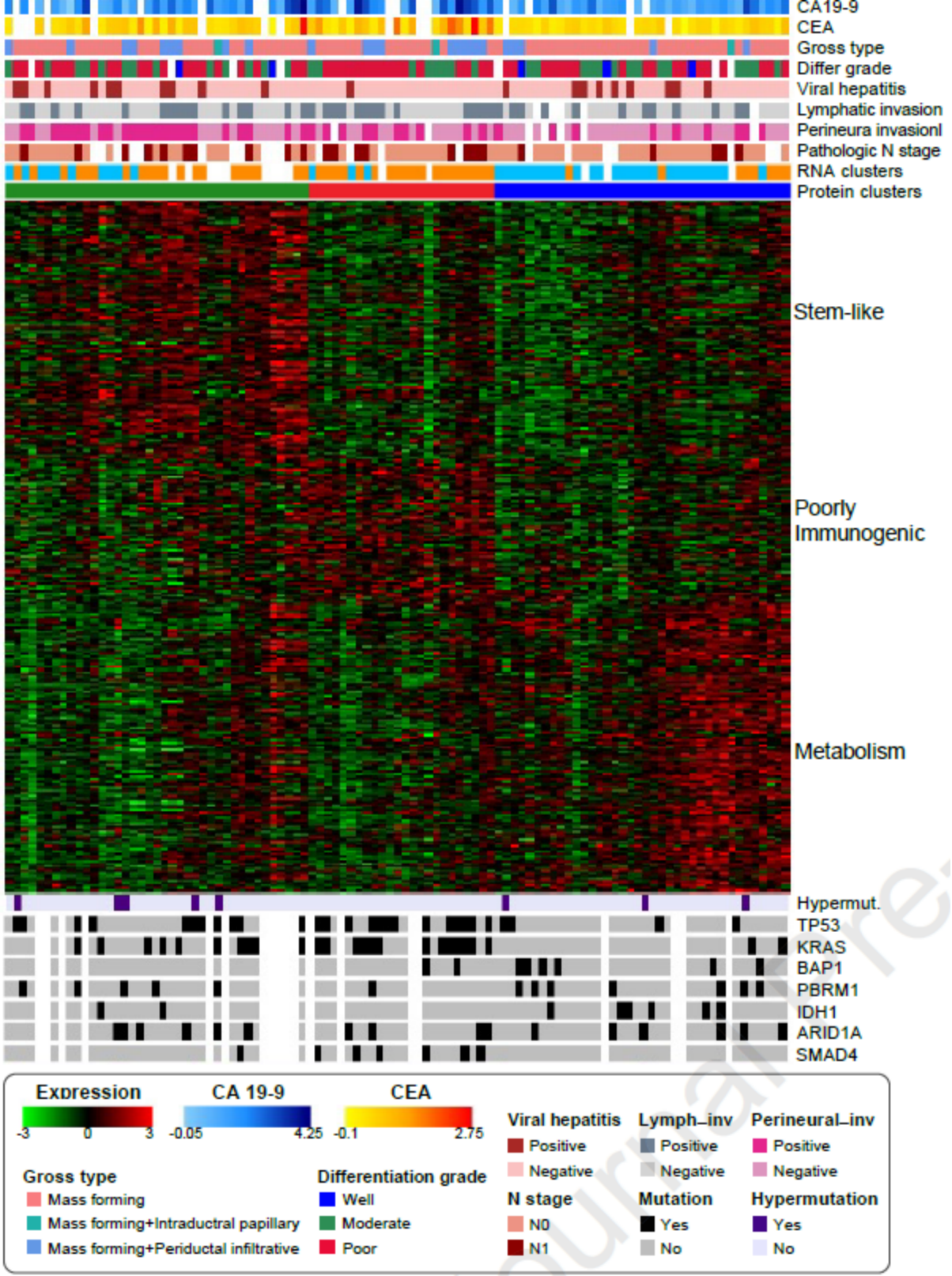
图1:蛋白质组学分析鉴定出三种分子亚型

图2:应用NCT-501和白蛋白紫杉醇处理的CCA细胞活性和增殖测定
专家点评

胆管癌发病率逐年上升,具有高度的恶性及异质性,一线治疗仍以化疗为基础。TOPZA-1和KEYNOTE-966虽证实化免联合方案可改善晚期胆管癌患者的预后,但效果远不及化免组合在其他癌种中“惊艳”;FGFR2融合/重排、IDH1突变虽开启了胆管癌靶向治疗的新局面,但存在受众人群低等不足;因此,亟需进一步探索胆管癌的分子机制以指导临床精准诊疗。多组学研究可从不同维度对肿瘤进行系统描绘以实现精准的肿瘤分子分型。
本研究对102例初治肝内胆管癌(ICC)患者的手术标本进行了WES、RNA-seq、蛋白质组学和磷酸化蛋白质组学研究,综合多组学分析,将ICC分为3个临床亚型:代谢型(metabolism)、干细胞样型(stem-like)和弱免疫原性型(poorly immunogenic)。基因组提示,3个亚型分别以IDH1突变/BAP1突变、ALDH1A1高表达、TP53突变/KRAS突变为主要特征;后续结合蛋白组学、IHC等在蛋白层面得到了进一步验证,如代谢型和干细胞样型中肿瘤代谢产物失调、弱免疫原性型中CD8+T细胞/NK细胞浸润低等。对干细胞样型(stem-like)ICC,作者结合类器官模型,发现在ALDH1A1+ICC中,NCT-501(ALDH1A1抑制剂)可增强肿瘤对白蛋白紫杉醇的敏感性。此外,作者结合多个公共外部队列对研究结果进行了验证。
综上,本文通过多组学研究对ICC进行了分子分型,并结合不同维度进行了验证、对相关分子机制做相应阐述及潜在治疗靶点探索。笔者认为,本文的方法学值得借鉴,但临床队列的选择尚需结合临床特征进一步优化。在治疗模式日益多样化的当下,通过单纯收集手术标本叠加组学分析似乎已不能满足基础临床转化的需求,未来应基于经治且具有特征性的临床队列,结合多维的测序等手段,为临床存在的问题提供具有真正参考意义研究结论,并指导后续临床研究的开展。
Liquid biopsy-based protein biomarkers for risk prediction, early diagnosis, and prognostication of cholangiocarcinoma
基于液体活检的蛋白生物标志物的风险预测,早期诊断和胆管癌的预后

文献引用:J Hepatol. 2023 Jul;79(1):93-108. doi: 10.1016/j.jhep.2023.02.027. Epub 2023 Mar 1.
期刊:J Hepatol(IF= 25.7)
文献类型:基础研究

胆管癌(CCA)是一种预后较差的异质胆道肿瘤,缺乏准确的早期诊断方法,对高危人群(即原发性硬化性胆管炎[PSC])尤为重要。尽管大多数CCA被认为是散发的,但高达20%的原发性硬化性胆管炎(PSC)患者会发展为CCA,是构成PSC相关死亡的主要原因。
本文在血清细胞外囊泡(EV)中寻找蛋白质生物标志物。EV来自孤立性PSC患者(n=45),合并PSC-CCA患者(n= 44),随访期间发生CCA的PSC患者(PSC到CCA;N=25),非PSC病因的CCAs(n=56),肝细胞癌(n=34)和通过质谱分析进行特征分析的健康个体(n=56)。通过ELISA对PSC-CCA、非PSC CCA或CCAs的诊断性生物标志物(Pan-CCAs)进行定义和验证。在CCA肿瘤中以单细胞水平评估其表达,对CCA的EV预后生物标志物进行了研究。
EVs的高通量蛋白质组学鉴定了PSC-CCA、非PSC CCA或Pan-CCA的诊断性生物标志物,以及肝内CCA和肝细胞癌的鉴别诊断标志物,并通过总血清ELISA交叉验证。循环EV蛋白可用于CCA风险预测、早期和鉴别(与HCC相比)诊断和预后。
基于机器学习的算法揭示了CRP/纤维蛋白原/FRIL与CA19-9联合用于诊断PSC-CCA(局部疾病[LD])与CA19-9。CRP/PIGR/VWF可诊断LD非PSC CCAs与健康个体(AUC=0.992;或=387.5)。值得注意的是,CRP/FRIL准确诊断了LD Pan-CCA(AUC=0.941;或= 89.4)。CRP/纤维蛋白原/FRIL/PIGR水平显示了在临床证据为恶性肿瘤之前PSC中CCA发展的预测能力。血清CRP/纤维蛋白原/FRIL水平可区分早期PSC-CCA和PSC患者。在有放射学肿瘤证据之前,血清CRP/纤维蛋白原/FRIL/PIGR水平可预测PSC患者的CCA发展。
多器官转录组分析显示,血清EV生物标志物主要在肝胆组织中表达,CCA肿瘤的单细胞RNA测序和免疫荧光分析表明,它们主要存在于恶性胆管细胞中。多变量分析揭示了EV预后生物标志物,其中COMP/GNAI2/CFAI和ACTN1/MYCT1/PF4V分别与患者生存呈负相关和正相关。EV蛋白COMP/GNAI2/CFAI和ACTN1/MYCT1/PF4V的丰度独立预测患者的总生存期。
血清EV包含蛋白质生物标志物,用于预测、早期诊断和CCA的预测,这些标志物可以用总血清检测到,代表了一种肿瘤细胞来源的液体活检工具,用于个性化医疗。
专家点评

液体活检(liquid biopsy,LB)是采集患者的体液(血液、尿液等)进行肿瘤成分分析,因标本获取途径相对容易,临床应用充满期待,但时至今日,因其质量控制,假阴性等问题,临床应用结果不尽如人意。在此背景下,Lapitz团体设计一项国际多中心研究,利用液体活检蛋白标志物针对胆管癌的危险预测,早期诊断,预后分析以及与肝细胞肝癌的鉴别,并且取得较好的结果,对这项技术进入临床应用重燃希望。
这项研究的精彩之处,在于病例的分组和蛋白标志物的筛选方法。研究人员将病例为6组:PSC(primary sclerosing cholangitis,PSC)患者、有PSC背景的CCA(cholangiocarcinoma,CCA)患者(PSC-CCA)、PSC患者在随访过程中发展成CCA的患者(PSC to CCA)、没有PSC背景的CCA患者(non-PSC CCA)、正常人、肝细胞肝癌(hepatocellular carcinoma,HCC)患者。液体活检仍采集患者的血液,但分离检测的是血液中细胞外囊泡(extracellular vesicles,EV),通过对EV中蛋白质进行蛋白质组学以及单细胞测序等方法分析。研究发现CRP/FIBRINOGEN/FRIL联合CA199对于PSC-CCA具有更好的诊断意义,可用于早期诊断。而CRP/PIGR/VWF可用于诊断non-PSC CCA,同时CRP/FRIL可以提高CCA的诊断。蛋白ANGP1可用于鉴别HCC和CCA。血清中CRP/FIBRINOGEN/FRIL/PIGR的水平相较于影像学表现等可以更早的预测PSC患者进展为CCA。多因素分析表明COMP/GNAI2/CFAI和ACTN1/MYCT1/PF4V水平分别与CCA的预后相关,其中COMP/GNAI2/CFAI水平与患者的差预后相关(中位总生存期5个月vs.102个月),ACTN1/MYCT1/PF4V水平与患者好的预后相关(中位总生存期102个月vs.9个月)。同时,研究人员通过检测血清中这些蛋白的表达水平,得到相同结果,表明向临床转化的可能性。
本研究尚存在一些不足,该研究主要关注于PSC相关CCA的患者早期诊断,对于非PSC相关的CCA,缺乏相应早期检测指标。另外,除了EV中的蛋白质外,血清中ctNDA/cfDNA(KRAS、TP53等)、EV中的miRNA(miR-21,miR126等)以及细胞角蛋白(cytokeratin-19)等均对CCA的诊断具有一定的作用,如何综合利用上述指标进行更精确的预测,仍需不断探索总结。人工智能的发展也许会给LB带来新的契机,寻找更方便易检测的CCA的标志物,为患者带来更好的获益。
指南

NCCN Clinical Practice Guidelines in Oncology:Biliary Tract Cancers(Version 2.2023)
NCCN临床实践指南:胆道肿瘤(2023.V2)
NCCN指南是国际公认的肿瘤学临床实践规范标准,旨在为临床医生提供最新的诊断、分期和治疗建议。NCCN临床实践指南:胆道肿瘤(2023.V2)根据最新的研究阳性结果和药物研发进展,优化了部分胆道肿瘤患者的治疗推荐方案,更新了免疫及靶向治疗进展,为临床实践提供了更好的建议。

EASL-ILCA Clinical Practice Guidelines on the management of intrahepatic cholangiocarcinoma
SASL-ILCA肝内胆管癌管理临床实践指南
SASL-ILCA指南由欧洲肝脏研究学会和国际肝癌协会发布,是目前再欧洲首要地位的肝病协会。本指南主要针对肝内胆管癌的临床管理提供循证指导。

胆管癌临床前模型标准:科学和医学相关性
这份共识声明中,由来自10个国家的45名CCA分子和细胞生物学专家以及临床医生(包括病理学家)组成的工作组,就临床前模型的最低标准提出了建议,以提供统一的方法。
泛读文献

Pembrolizumab plus chemotherapy as first-line treatment for advanced biliary tract cancer
帕博利珠单抗联合化疗作为晚期胆道癌的一线治疗
文献引用:Susanna S, David C.Lancet. 2023 Jun 3;401(10391):1826-1827. [PMID: 37075782 DOI: 10.1016/S0140-6736(23)00767-5]
期刊:Lancet(IF=168.9)
文献类型:免疫联合化疗,一线治疗

Cholangiocarcinoma - novel biological insights and therapeutic strategies
胆管癌——新的生物学见解和治疗策略
文献引用:Ilyas SI, et al. Nat Rev Clin Oncol. 2023 Jul;20(7):470-486. [PMID: 37188899. DOI: 10.1038/s41571-023-00770-1]
期刊:Nat Rev Clin Oncol(IF=78.8)
文献类型:综述

Second-line FOLFOX is not the standard of care for all patients with advanced biliary tract cancer-a commentary from the Young International Society of Geriatric Oncology
FOLFOX二线治疗并非所有晚期胆道癌患者的标准治疗——Young International Society of Geriatric Oncology的评论
文献引用:Liposits G, et al. Ann Oncol. 2023 Jun;34(6):555-556. [PMID: 36813114. DOI: 10.1016/j.annonc.2023.02.007]
期刊:Ann Oncol(IF=50.5)
文献类型:点评,化疗

Dual antiplatelet therapy inhibits neutrophil extracellular traps to reduce liver micrometastases of intrahepatic cholangiocarcinoma
双联抗血小板治疗抑制中性粒细胞胞外诱捕网减少肝内胆管癌肝微转移
文献引用:Yoshimoto M, et al. Cancer Lett. 2023 Jul 28;567:216260. [PMID: 37295551. DOI: 10.1016/j.canlet.2023.216260]
期刊:Cancer Lett(IF=9.7)
文献类型:动物试验

与(18)F-FDG PET/CT和常规CT相比,(68)Ga-FAPI-46对胆管癌患者的肿瘤检出率更高"
文献引用:Pabst KM, et al. J Nucl Med. 2023 Jul;64(7):1049-1055. [PMID: 37024301. DOI: 10.2967/jnumed.122.265215]
期刊:J Nucl Med(IF=9.3)
文献类型:影像学诊断

Laser ablation under intraductal cholangioscopic guidance for cholangiocarcinoma
胆管镜引导下激光消融治疗胆管癌
文献引用:Xia M, et al. Endoscopy.2023 Dec;55(S 01):E590-E591. [PMID: 36996886. DOI: 10.1055/a-2051-7984]
期刊:Endoscopy(IF=9.3)
文献类型:影像学诊断

Clinical prospective study of Gallium 68 ((68)Ga)-labeled fibroblast-activation protein inhibitor PET/CT in the diagnosis of biliary tract carcinoma
68 (68)Ga标记的成纤维细胞活化蛋白抑制剂PET/CT诊断胆道系统恶性肿瘤的临床前瞻性研究
文献引用:Jinghua L, et al. Eur J Nucl Med Mol Imaging.2023 Jun;50(7):2152-2166. [PMID: 36809426. DOI: 10.1007/s00259-023-06137-z]
期刊:Eur J Nucl Med Mol Imaging(IF=9.1)
文献类型:影像学诊断

"Preclinical and clinical studies of immunotherapy for the treatment of cholangiocarcinoma
免疫疗法治疗胆管癌的临床前和临床研究"
文献引用:Lu X, et al. JHEP Rep. 2023 Mar 9;5(7):100723. [PMID: 37229173. DOI: 10.1016/j.jhepr.2023.100723]
期刊:JHEP Rep(IF=8.3)
文献类型:免疫治疗、综述

Durvalumab联合吉西他滨和顺铂治疗晚期胆道癌:对真实世界数据的早期探索性分析
文献引用:Rimini M, et al. Liver Int. 2023 Aug;43(8):1803-1812. [PMID: 37452505 DOI: 10.1111/liv.15641]
期刊:Liver Int(IF=6.7)
文献类型:免疫联合化疗
【往期回顾】
CSCO胆道肿瘤|前沿进展双月评-第一期(2023年1月-3月)
CSCO胆道肿瘤|前沿进展双月评-第二期(2023年4-5月+ASCO)
材料编号:NPM-CN-ICC-420-20240807
责任编辑:Maria
排版编辑:Mia











 苏公网安备32059002004080号
苏公网安备32059002004080号


