
赫捷, 陈万青, 李兆申, 等. 中国胃癌筛查与早诊早治指南(2022,北京)[J]. 中华肿瘤杂志, 2022, 44(7):634-666.
DOI: 10.3760/cma.j.cn112152-20220617-00430.
【关键词】胃肿瘤;筛查;早诊早治;指南;中国
一、引言
胃癌是威胁我国居民生命健康的主要恶性肿瘤之一。世界卫生组织(World Health Organization, WHO)数据显示,2020年我国胃癌新发病例47.9万例,死亡病例37.4万例,分别占全球胃癌新发和死亡病例的44.0%和48.6%。在我国,胃癌发病率位列恶性肿瘤发病率的第4位,死亡率的第3位,严重威胁人民群众的生命健康,成为我国重大的公共卫生问题。胃癌防治是我国恶性肿瘤防控面临的重大挑战。
2003—2015年,我国胃癌5年相对生存率有所升高,从27.4%提高至35.1%,但仍然明显低于日本(80.1%)和韩国(75.4%)。胃癌患者的生存时间与其临床诊断发现的早晚密切相关。胃癌早期症状不明显,多数患者在确诊时已处于中晚期,即使接受手术治疗的患者5年生存率仍<30%,而早期患者经过及时治疗5年生存率可>90%。
开展胃癌筛查可显著提高胃癌早期病变检出率,改善患者预后,大幅提高患者生存率。民众对于胃癌及其筛查的认知程度低等现状制约着我国胃癌筛查与早诊早治工作的效果与收益。我国目前已发布多部胃癌筛查与早诊早治相关的专家共识,但尚缺乏基于循证医学证据的胃癌筛查与早诊早治指南。为了推进我国胃癌筛查工作的规范化、均质化和优质化,国家癌症中心成立中国胃癌筛查与早诊早治指南制定专家组,联合肿瘤学、消化内科学、内镜学、外科学、病理学、临床检验学、流行病学、循证医学、卫生经济学和卫生管理学等多学科专家,基于WHO推荐的指南制定原则和方法,制定符合我国国情的胃癌筛查与早诊早治指南,以期为我国胃癌筛查与早诊早治的规范开展提供参考。
二、指南形成方法
1. 指南发起机构与专家组成员:本指南受国家卫生健康委员会疾病预防控制局的委托与指导,由国家癌症中心发起,联合多学科专家共同制定。指南制定启动时间为2021年8月16日,定稿时间为2022年6月17日。
2. 指南工作组:本指南成立了多学科工作组,主要涵盖肿瘤学、消化内科学、内镜学、外科学、病理学、临床检验学、流行病学、循证医学、卫生经济学和卫生管理学等学科专家。证据检索与评价由国家癌症中心、兰州大学、哈尔滨医科大学和深圳大学共同完成。所有工作组成员填写了利益冲突声明表,不存在与本指南直接的利益冲突。
3. 指南使用者与应用的目标人群:本指南适用于各级医疗机构开展胃癌筛查。指南的使用者为各级医疗机构的医务工作者,包括肿瘤科、腹部外科、病理科和消化内科等筛查相关学科医师及工作人员。指南推荐意见的应用目标人群为有意向或适宜接受胃癌筛查的受检者。
4. 临床问题的遴选和确定:通过系统检索国内外胃癌筛查领域已发表的指南和系统评价,以及对胃癌筛查领域部分专家的访谈,工作组初步拟定了8大类关键问题框架,涵盖25个临床问题,以在线问卷的形式对临床问题的重要性进行调研和评分。收集汇总2轮共74人次(第1轮23人次、第2轮51人次)专家函评反馈,最终遴选出本指南拟解决的21个临床问题。
5. 证据的检索:指南制定工作组成立了证据检索与评价小组,针对最终纳入的关键问题,按照人群、干预、对照和结局原则进行检索,具体检索数据库包括PubMed、Embase、Clinicaltrial、Cochrane Library、Web of Science、中国知网、万方数据知识服务平台、维普资讯网和中国生物医学文献数据库。此外,也对胃癌筛查相关综述、系统评价或Meta分析和指南的参考文献进行滚雪球检索。证据检索截止日期为2021年11月5日。
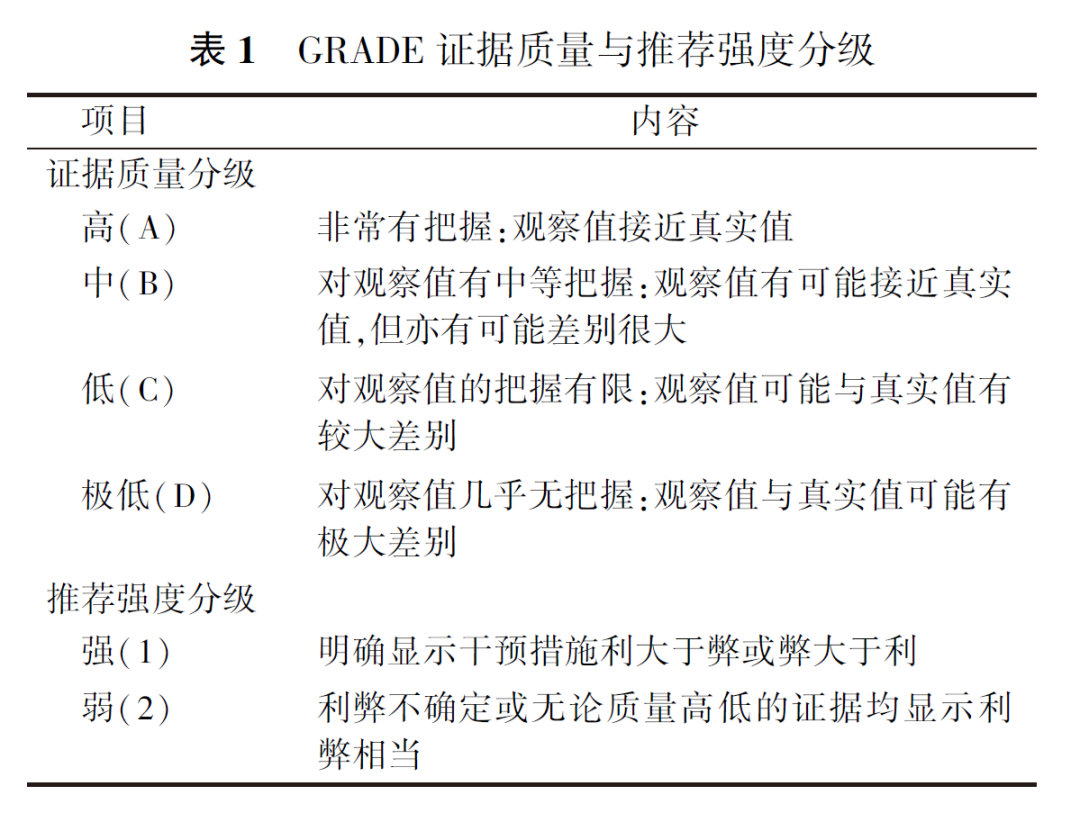
6. 证据的评价与分级:证据检索与评价小组对随机对照试验(randomized controlled trial, RCT)采用Cochrane Reviewer′s Handbook 5.0.1标准进行评价;对队列研究采用纽卡斯尔-渥太华量表进行评价;对诊断准确性研究采用QUADAS-2进行评价;对病例系列研究采用英国国立临床优化研究所制定的评价工具进行评价;对指南采用开发指南研究和评估工具Ⅱ进行评价。评价过程由2个人独立完成,若存在分歧,则共同讨论或咨询第三方解决。使用推荐意见分级的评估、制定及评价(Grading of Recommendations Assessment,Deve-lopment and Evaluation, GRADE)方法对证据质量和推荐意见进行分级,见表1。
7. 推荐意见的形成:指南工作组基于证据评价小组提供的国内外证据,同时考虑我国筛查目标人群的偏好和价值观、筛查措施的成本和利弊后,初步拟定了胃癌筛查临床问题推荐意见。指南工作组先后2次以德尔菲法通过邮件形式发送至相关专家进行意见征询,对推荐意见进一步修改后,于2022年3月进行面对面评议,并形成共识。
8. 指南文稿的形成与外审:指南工作组参考国际实践指南报告规范草拟指南文稿,内部审议后形成征求意见稿。通过国家癌症中心组织的会议等方式公开征求意见,根据反馈结果完善形成最终稿。
9. 指南的传播、实施与更新:指南发布后,指南工作组将主要通过以下方式对指南进行传播和推广:(1)在相关学术会议中对指南进行解读;(2)有计划地在中国部分省份组织指南推广专场会议,确保基层的恶性肿瘤筛查工作人员充分了解并正确应用本指南;(3)在学术期刊和书籍出版社公开发表本指南;(4)通过媒体等进行推广。指南工作组将综合临床实践的需求与证据产生的进展,对本指南进行更新。计划在3年内对本指南的推荐意见进行更新。
三、关键问题及推荐意见
我国胃癌发病率和死亡率
(A)我国胃癌负担严重,是恶性肿瘤死亡的主要原因之一
(B)我国胃癌发病率呈现出性别、年龄和地区差异
(C)我国胃癌死亡率呈现出性别、年龄和地区差异
我国胃癌患者的生存率
我国胃癌5年相对生存率近年来有所升高,但总体依然较低
胃癌相关危险因素和保护因素
危险因素
(A)幽门螺杆菌(Helicobacter pylori, Hp)感染是胃癌的危险因素
(B)长期高盐饮食、烟熏煎炸食品、红肉与加工肉的摄入及不良饮食习惯是胃癌的危险因素
(C)吸烟是胃癌的危险因素
(D)重度饮酒是胃癌的危险因素
(E)一级亲属胃癌家族史是胃癌的危险因素
保护因素
足量摄入蔬菜水果是胃癌的保护因素
筛查相关胃部肿瘤病变组织学分型和病理学分期
(A)胃癌的组织学分型包括乳头状腺癌、低黏附性癌(包括印戒细胞癌和非印戒细胞癌)、管状腺癌、黏液腺癌等
(B)根据美国癌症联合会(AJCC)TNM分期系统(第8版),胃癌病理学分期分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期
胃早期癌和癌前病变定义
(A)胃早期癌指癌组织仅局限于黏膜层及黏膜下层,不论是否有区域性淋巴结转移
(B)胃癌前病变指已证实与胃癌发生密切相关的病理学变化,即胃黏膜上皮内瘤变,根据病变程度,分为低级别上皮内瘤变(LGIN)和高级别上皮内瘤变(HGIN)
胃癌前病变检出率情况
我国胃癌前病变检出率男性高于女性,且年龄越大癌前病变检出率越高,同时具有明显地区差异,胃癌高发区检出率常高于低发区
胃癌筛查不良结局事件指标
(A)胃癌筛查的危害是指与未筛查比较,个体或群体在参与筛查过程中产生的任何负面效应
(B)胃癌筛查的潜在危害主要有过度诊断、假阳性、假阴性以及筛查相关并发症和感染
胃癌前病变检出率情况
建议将胃癌年龄标化发病率(ASR)>20/10万的地区定义为胃癌高发区(强推荐,证据分级:中)
胃癌高风险人群定义
年龄45岁及以上,且符合下列任一条件者为胃癌高风险人群(强推荐,证据分级:中):
(1)长期居住于胃癌高发区;
(2)Hp感染;
(3)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;
(4)一级亲属有胃癌病史;
(5)存在胃癌其他高危因素(高盐、腌制饮食、吸烟、重度饮酒等)
胃癌前病变检出率情况
推荐高风险人群胃癌筛查起始年龄为45岁,至75岁或预期寿命<5年时终止筛查(强推荐,证据分级:中)
Hp感染检测
(A)推荐在胃癌高发地区人群进行Hp感染检测筛查(强推荐,证据分级:低)
(B)推荐首选尿素呼气试验(UBT)进行Hp的检测,血清Hp抗体检测和粪便抗原检测作为UBT的辅助诊断措施,或不能配合UBT者的二线诊断措施(强推荐,证据分级:低)
Hp感染以外的胃癌其他生物标志物筛查
(A)不建议将血清胃蛋白酶原(PG)检测单独用于胃癌筛查(弱推荐,证据分级:极低)
(B)不建议将血清胃泌素-17(G-17)检测单独用于胃癌筛查(弱推荐,证据分级:极低)
(C)不建议将血清胃癌相关抗原MG7-Ag检测单独用于胃癌筛查(强推荐,证据分级:极低)
(D)PG、G-17、MG7-Ag和血清Hp-Ag等联合检测,配合评分系统或许有利于胃癌的精准筛查,但需要考虑经济效益问题(强推荐,证据分级:极低)
胃癌筛查人群
(A)推荐胃癌高风险人群接受胃癌筛查(强推荐,证据分级:极低)
(B)不建议胃癌非高风险人群接受胃癌筛查(强推荐,证据分级:极低)
胃癌筛查与监测间隔
根据ABC分级
(A)A级,PG(-)、Hp(-)患者可不行内镜检查(弱推荐,证据分级:低)
(B)B级,PG(-)、Hp(+)患者至少每3年行1次内镜检查(弱推荐,证据分级:低)
(C)C级,PG(+)、Hp(+)患者至少每2年行1次内镜检查(弱推荐,证据分级:低)
(D)D级,PG(+)、Hp(-)患者应每年行1次内镜检查(弱推荐,证据分级:低)
根据新型胃癌筛查评分系统
(A)胃癌高危人群(17~23分),建议每年1次胃镜检查(弱推荐,证据分级:低)
(B)胃癌中危人群(12~16分),建议每2年1次胃镜检查(弱推荐,证据分级:低)
(C)胃癌低危人群(0~11分),建议每3年1次胃镜检查(弱推荐,证据分级:低)
早期胃病变和胃癌术后患者
(A)局限于胃窦或胃体的萎缩性胃炎或肠上皮化生,建议每3年接受1次内镜检查(强推荐,证据分级:低)
(B)可操作的与胃癌风险联系的萎缩评估(OLGA)和可操作的与胃癌风险联系的肠上皮化生评估(OLGIM)分期Ⅲ级以上的高危慢性萎缩性胃炎或肠上皮化生患者,建议每2年接受1次内镜检查(强推荐,证据分级:低)
(C)经内镜黏膜下剥离术(ESD)切除且未接受其他治疗的早期胃癌患者,建议术后6个月内复查内镜,然后根据内镜检查结果制定下一步监测策略(强推荐,证据分级:中)
(D)经ESD切除的上皮内瘤变或常规手术切除的早期胃癌患者,建议术后6个月内复查内镜,然后根据内镜检查结果制定下一步监测策略(强推荐,证据分级:低)
内镜种类的选择
(A)推荐首选普通白光胃镜联合窄带成像放大胃镜进行筛查,尤其是存在以下任一情况时:胃萎缩、胃肠上皮化生、怀疑早期胃癌(强推荐,证据分级:极低)
(B)对于不能接受常规内镜检查者,可考虑使用磁控胶囊胃镜(弱推荐,证据分级:极低)
(C)建议根据医院设备和医师水平,灵活选择色素内镜、蓝激光成像放大内镜、荧光内镜等新型内镜成像技术(弱推荐,证据分级:极低)
胃镜检查操作过程
(A)推荐对内镜医师进行系统化训练以提高诊断能力(弱推荐,证据分级:极低)
(B)推荐胃镜下对胃内部进行系统地观察,并需要有充分与合理的检查时间(弱推荐,证据分级:低)
(C)推荐在胃蠕动剧烈而难以观察时考虑使用抗痉挛药(强推荐,证据分级:低)
(D)推荐使用黏液溶解剂和消泡剂提高胃镜下黏膜的可见度(强推荐,证据分级:极低)
早期胃癌治疗——ESD和功能保留胃切除术
对满足ESD绝对和扩大适应证的早期胃癌患者,推荐行ESD治疗;对不满足ESD绝对和扩大适应证的早期胃癌患者,推荐以胃切除术作为标准治疗方案并优先考虑功能保留胃切除术,同时根据胃切除术范围选择适当的淋巴结清扫术(强推荐,证据分级:高)
高级别胃黏膜上皮内瘤变的治疗——ESD
对HGIN的患者,推荐进行内镜切除治疗(首选ESD)(强推荐,证据分级:高)
早期胃癌和癌前病变治疗——根除Hp
若早期胃癌或癌前病变(萎缩性胃炎、肠上皮化生、上皮内瘤变)合并Hp感染,推荐根除Hp(强推荐,证据分级:高)
开展胃癌筛查医师应具备的能力
胃癌筛查内镜医师应清楚了解胃的解剖学特征、具备一般内镜检查能力并至少有300例内镜检查的个人经验。内镜医师通过内镜诊断培训后需要至少对20例HGIN或早期胃癌病变进行诊断评估来获得胃癌光学诊断的能力。内镜医师满足内镜诊断培训标准,并达到20个HGIN或早期胃癌病变诊断≥80%的准确率后,可以进行胃癌内镜诊断(强推荐,证据分级:低)
胃癌筛查质量控制
检查过程应至少持续7 min(观察胃部时间≥3 min),并保留足够数量的清晰内镜图像,推荐设定胃癌早期诊断率作为质控指标(强推荐,证据分级:中)
我国胃癌发病率和死亡率
(A)我国胃癌负担严重,是恶性肿瘤死亡的主要原因之一
(B)我国胃癌发病率呈现出性别、年龄和地区差异
(C)我国胃癌死亡率呈现出性别、年龄和地区差异
胃癌是全球负担较重的恶性肿瘤之一。据WHO估计,2020年全球新发胃癌病例约108.9万例,占全部恶性肿瘤的5.6%,死亡病例约76.9万例,占恶性肿瘤相关死亡的7.7%。胃癌是我国常见的恶性肿瘤之一。国家癌症中心数据显示,2016年我国胃癌新发病例39.7万例,其中男性27.6万例,女性12.1万例。全国胃癌发病率(粗率)为28.7/10万,世标率为17.6/10万,其中男性和女性发病率(粗率)分别为39.0/10万和17.8/10万。胃癌发病率在40岁之前处于较低水平,自40岁之后快速上升,男女发病率均在80岁以上人群中达到高峰。分地域来看,农村地区胃癌年龄标化发病率(19.8/10万)高于城市地区(15.5/10万)。从东部、中部、西部三大经济区域来看,胃癌的发病率也存在着较大差异,2015年我国中部地区的胃癌发病率(粗率)最高(33.7/10万),东部地区次之(29.9/10万),西部地区胃癌发病率略低(23.4/10万)。
2016年我国约有28.9万人死于胃癌,其中男性20.0万例,女性8.8万例。全国胃癌死亡率(粗率)为20.9/10万,男性死亡率显著高于女性,分别为28.3/10万和13.1/10万。胃癌死亡率在40岁之前处于较低水平,自40岁之后快速上升,男女死亡率均在80岁以上人群中达到高峰。分地域来看,农村地区胃癌年龄标化死亡率为14.3/10万,高于城市地区(10.6/10万)。从东部、中部、西部三大经济区域来看,2015年胃癌死亡率(粗率)分别为21.2/10万、24.2/10万、17.6/10万。
我国胃癌患者的生存率
我国胃癌5年相对生存率近年来有所升高,但总体依然较低
2003—2015年全国17个肿瘤登记地区的数据显示,胃癌合计标化5年相对生存率从27.4%(95%CI:26.7%~28.1%)上升至35.1%(95%CI:34.5%~35.7%)。2012—2015年男性和女性的胃癌标化5年相对生存率分别为35.0%和35.4%,城市地区和农村地区的胃癌标化5年相对生存率分别为36.9%和34.4%。我国胃癌5年相对生存率在近年来虽呈上升趋势,但仍然显著低于日本(80.1%)和韩国(75.4%)。
胃癌相关危险因素和保护因素
危险因素
(A)幽门螺杆菌(Helicobacter pylori, Hp)感染是胃癌的危险因素
(B)长期高盐饮食、烟熏煎炸食品、红肉与加工肉的摄入及不良饮食习惯是胃癌的危险因素
(C)吸烟是胃癌的危险因素
(D)重度饮酒是胃癌的危险因素
(E)一级亲属胃癌家族史是胃癌的危险因素
保护因素
足量摄入蔬菜水果是胃癌的保护因素
1. 目前研究已经明确的主要危险因素
胃癌的发生是多因素参与、多步骤演变的复杂过程,是遗传和环境等因素相互作用的综合结果。胃癌危险因素的研究不仅有利于胃癌的一级预防,更为准确区分胃癌高危人群,有针对性进行二级预防提供重要依据。
(1)Hp感染:早在1994年,WHO国际癌症研究署(International Agency for Research on Cancer, IARC)将Hp列为Ⅰ类致癌因子。Hp在胃部的长期存在会引起慢性胃炎,并在胃黏膜萎缩和肠化生的发生发展中起重要作用。Eslick等开展的一项Meta分析纳入了42项研究,结果表明,Hp感染者胃癌发生风险是非感染者的2.04倍(OR=2.04,95%CI:1.69~2.45)。在《Hp京都共识(2015)》和《Hp Maastricht V共识(2016)》中均认为Hp感染与胃癌的发生密切相关,根除Hp是预防胃癌的有效措施。2019年我国制定的《中国幽门螺杆菌根除与胃癌防控的专家共识意见(2019年,上海)》指出,Hp感染是我国胃癌的主要病因,根除Hp可降低我国的胃癌发生风险。北京大学肿瘤医院基于山东省临朐县胃癌高发区的干预试验经14.7年随访,在全球范围内首次报告根除Hp可显著降低胃癌的发生风险,成为2014年国际癌症研究机构(IARC)发布“根除幽门螺杆菌感染预防胃癌策略”共识报告的重要依据。基于该干预试验22.3年随访的研究还首次报告根除Hp可显著降低胃癌的死亡风险。Ford等对截至2020年2月的10项RCT研究进行Meta分析,结果显示,Hp根除治疗可使胃癌发生风险降低46%(RR=0.54,95%CI:0.40~0.72),胃癌死亡风险降低39%(RR=0.61,95%CI:0.40~0.92);并且对于胃癌患者进行Hp根除治疗也可使胃癌复发风险降低51%(RR=0.49,95%CI:0.34~0.70)。在此Meta分析中,基于山东省临朐县高发区的研究对胃癌发病和死亡风险相关分析的贡献权重分别达63.6%和80.7%。
(2)饮食与饮食习惯:饮食与饮食习惯是胃癌发病的重要因素之一。具体包括高盐饮食、经常摄入腌熏煎烤炸食品、红肉及加工肉类、不良饮食习惯等。世界癌症研究基金会(World Cancer Research Fund, WCRF)将过量盐份摄入列为胃癌重要的危险因素之一。虽然人体需要足量的食盐,但过量摄入可能会刺激胃黏膜,导致黏膜萎缩、DNA合成增加和细胞增殖,从而促进胃癌的发生。多项研究表明,过量摄入盐分与胃癌发病风险相关。D′Elia等开展的一项Meta分析纳入7项研究,结果表明,食盐摄入过高者患胃癌的风险是摄入较低者的1.68倍(RR=1.68,95%CI:1.17~2.41)。Fang等开展的一项Meta分析结果表明,高盐饮食会增加胃癌的发生风险(RR=1.11,95%CI:1.05~1.16),进一步研究表明,食盐摄入量每增加5 g/d,胃癌发生风险增加12%(RR=1.12,95%CI:1.02~1.23)。
腌熏煎烤炸食品(比如咸鱼、咸菜、烧烤等)的长期摄入也会增加胃癌的发生风险。这类食品在制作过程会产生多环芳烃、N-亚硝基化合物等致癌物,在多项研究中显示出其与胃癌关系密切。Ren等开展的一项Meta分析纳入60项研究(包括50项病例对照研究和10项队列研究),结果表明,腌制食物的摄入可使胃癌发生风险增加52%(OR=1.52,95%CI:1.37~1.68),在我国人群(OR=1.86,95%CI:1.61~2.15)和韩国人群(OR=1.89,95%CI:1.29~2.77)中,腌制食物对胃癌发生风险的增加更显著,在日本人群中则影响较低(OR=1.16,95%CI:1.04~1.29)。Fang等的研究显示,盐腌食物摄入过多可增加胃癌的发生风险(RR=1.55,95%CI:1.17~2.05)。程时磊等的Meta分析纳入39项研究(6项涉及煎炸食品),结果表明,喜食煎炸食品与我国人群胃癌发生风险相关(OR=2.28,95%CI:1.87~2.78)。
红肉和加工肉类摄入与胃癌发病风险增高有关。Kim等的一项Meta分析纳入了43项研究(包括11项队列研究和32项病例对照研究),结果表明,食用红肉(RR=1.41,95%CI:1.21~1.66)和加工肉(RR=1.57,95%CI:1.37~1.81)均可增加胃癌的发生风险,进一步分析表明,红肉食用量每增加100 g/d,胃癌发生风险增加26%(RR=1.26,95%CI:1.11~1.42);加工肉食用量每增加50 g/d,胃癌发生风险增加72%(RR=1.72,95%CI:1.36~2.18)。
不良饮食习惯会导致胃黏膜反复损伤修复,降低胃黏膜的保护作用,长期作用可引发癌变。一项在中国人群中开展的Meta分析显示,不吃早餐、饮食不规律、吃饭速度快、暴饮暴食、吃剩饭菜是胃癌的危险因素。
(3)吸烟:吸烟可增加胃癌的发病风险,且吸烟与胃癌发生风险呈剂量反应关系。吸烟量越大、吸烟年限越长,胃癌发生风险越高。Poorolajal等对1985—2018年的77项研究进行Meta分析,结果显示,正在吸烟者和曾经吸烟者胃癌的患病风险分别是不吸烟者的1.61倍(OR=1.61,95%CI:1.49~1.75)和1.43倍(OR=1.43,95%CI:1.29~1.59)。Ordñóez-Mena等对欧洲国家和美国的19项前瞻性队列研究(包括897 021例研究对象)进行的Meta分析,结果显示,在调整了性别、年龄、体质指数(body mass index, BMI)等多个因素后,正在吸烟者和曾经吸烟者胃癌的发病风险分别是不吸烟者的1.74倍(HR=1.74,95%CI:1.50~2.02)和1.18倍(HR=1.18,95%CI:0.95~1.46)。Moy等在上海地区对18 244例45~64岁男性进行的前瞻性队列研究表明,经过20年的随访,在调整教育水平、BMI、饮酒年限以及腌制食品、新鲜水果、新鲜蔬菜的总摄入量后,开始吸烟年龄为<20岁、20~24岁、≥25岁的吸烟者胃癌发病风险分别是不吸烟者的1.62倍(HR=1.62,95%CI:1.18~2.22)、1.48倍(HR=1.48,95%CI:1.11~1.97)和1.64倍(HR=1.64,95%CI:1.27~2.13;Ptrend=0.002),吸烟包年数[每日吸烟量(包)×吸烟时间(年)]<30包年和≥30包年者胃癌的发病风险分别是不吸烟者的1.58倍(HR=1.58,95%CI:1.24~2.02)和1.59倍(HR=1.59,95%CI:1.21~2.10;Ptrend=0.0005)。Praud等对来自北美、欧洲及亚洲地区的23项研究(包括10290例病例和26145例对照)进行Meta分析,结果显示,正在吸烟者和曾经吸烟者胃癌的发病风险分别是不吸烟者的1.25倍(OR=1.25,95%CI:1.11~1.40)和1.20倍(OR=1.20,95%CI:1.09~1.32);并且每天吸烟0~10支、11~20支、>20支的正在吸烟者胃癌发病风险分别是不吸烟者的1.08倍(OR=1.08,95%CI:0.91~1.28)、1.30倍(OR=1.30,95%CI:1.16~1.45)和1.32倍(OR=1.32,95%CI:1.10~1.58;Ptrend=0.0001);吸烟时长为<30年、30~40年、>40年的吸烟者胃癌的发病风险分别是不吸烟者的1.04倍(OR=1.04,95%CI:0.94~1.16)、1.32倍(OR=1.32,95%CI:1.17~1.49)和1.33倍(OR=1.33,95%CI:1.14~1.54;Ptrend<0.0001)。
(4)饮酒:饮酒是胃癌的危险因素之一。饮酒对胃的影响与酒的类别、饮酒量和饮酒时长相关,但目前尚无定论。一些研究表明,重度饮酒会增加胃癌的发生风险。Tramacere等的Meta分析纳入了59项研究(包括34557例胃癌病例),结果表明,饮酒者胃癌发生风险是不饮酒者的1.07倍(RR=1.07,95%CI:1.01~1.13),重度饮酒者(≥50 g乙醇/d)胃癌发生风险是不饮酒者的1.20倍(RR=1.20,95%CI:1.01~1.44)。Rota等对欧洲的20项研究(包括9669例病例和25336例对照)进行Meta分析,结果显示,与不饮酒/已戒酒者比较,重度(48~72 g乙醇/d)和极重度(>72 g乙醇/d)饮酒者发生胃癌的风险分别增加了26%(OR=1.26,95%CI:1.08~1.48)和48%(OR=1.48,95%CI:1.29~1.70)。
(5)一级亲属胃癌家族史:一级亲属胃癌家族史是胃癌发生的危险因素。Shin等的研究结果显示,对于一级亲属患有胃癌者,其胃癌发病风险显著增加(OR=2.85,95%CI:1.83~4.46)。Jiang等的研究结果显示,远端胃腺癌的发生与胃癌家族史相关(OR=2.15,95%CI:1.18~3.91)。一项对美国肠上皮化生患者的回顾性队列研究显示,胃癌家族史可增加胃癌的发病风险(HR=3.80,95%CI:1.50~9.70)。也有研究显示,男性同卵双胞胎中若一方发生胃癌,则另一方发生胃癌的风险为无胃癌疾病史男性双胞胎的9.9倍,男性同卵双胞胎发生胃癌的一致性为0.08,这意味着患有胃癌的男性,其同卵双胞胎患相同恶性肿瘤的概率为8%。
2. 足量摄入蔬菜水果是胃癌的保护因素
部分研究也表明,蔬菜水果的摄入可以降低胃癌的发病风险。一项大规模前瞻性研究显示,与每日水果蔬菜低摄入组比较,高摄入组的胃癌发生风险降低44%(HR=0.56,95%CI:0.34~0.93)。一项Meta分析显示,与低膳食纤维摄入者比较,高膳食纤维摄入者胃癌发生风险下降42%(OR=0.58,95%CI:0.49~0.67),并且膳食纤维摄入量每增加10 g/d,胃癌的发生风险可降低44%(OR=0.56,95%CI:0.46~0.67)。Bertuccio等对15项病例对照研究的汇总分析显示,与柑橘类水果低摄入组比较,高摄入组胃癌发生风险降低20%(OR=0.80,95%CI:0.73~0.87)。基于山东省临朐县胃癌高发区的研究表明,食用富含维生素C的蔬菜和葱蒜类蔬菜可显著降低胃黏膜病变进展和胃癌的风险。补充维生素制剂和大蒜素制剂在22.3年随访研究中展示出潜在的胃癌预防作用。
筛查相关胃部肿瘤病变组织学分型和病理学分期
(A)胃癌的组织学分型包括乳头状腺癌、低黏附性癌(包括印戒细胞癌和非印戒细胞癌)、管状腺癌、黏液腺癌等
(B)根据美国癌症联合会(AJCC)TNM分期系统(第8版),胃癌病理学分期分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期
胃癌的组织学分型主要参考WHO消化系统肿瘤分类(2019年版)。
胃癌病理分期系统推荐应用AJCC第8版。具体定义如下。
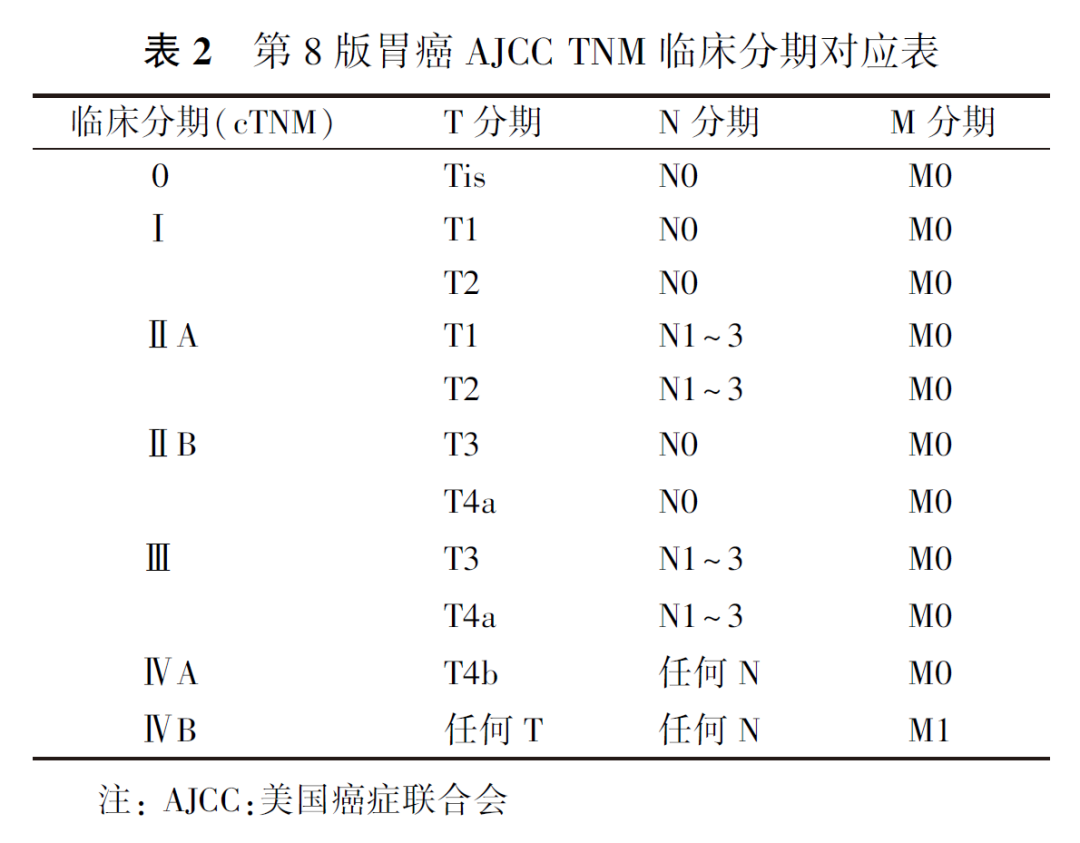
(1)原发肿瘤(T):Tx:原发肿瘤无法评价;T0:无原发肿瘤证据;Tis:原位癌,上皮内肿瘤未侵犯黏膜固有层,高度不典型增生;T1:肿瘤侵犯黏膜固有层、黏膜肌层或黏膜下层;T1a:肿瘤侵犯黏膜固有层或黏膜肌层;T1b:肿瘤侵犯黏膜下层;T2:肿瘤侵犯固有肌层;T3:肿瘤穿透浆膜下结缔组织,但未侵犯脏层腹膜或邻近结构;T4:肿瘤侵犯浆膜(脏层腹膜)或邻近结构;T4a:肿瘤侵犯脏层腹膜;T4b:肿瘤侵犯邻近结构。
(2)区域淋巴结(N):Nx:区域淋巴结无法评价;N0:无区域淋巴结转移;N1:1~2枚区域淋巴结转移;N2:3~6枚区域淋巴结转移;N3:≥7枚区域淋巴结转移;N3a:7~15枚区域淋巴结转移;N3b:≥16枚区域淋巴结转移。
(3)远处转移(M):M0:无远处转移;M1:有远处转移。具体AJCC TNM分期(第8版)定义规则见表2和表3。

胃早期癌和癌前病变定义
(A)胃早期癌指癌组织仅局限于黏膜层及黏膜下层,不论是否有区域性淋巴结转移
(B)胃癌前病变指已证实与胃癌发生密切相关的病理学变化,即胃黏膜上皮内瘤变,根据病变程度,分为低级别上皮内瘤变(LGIN)和高级别上皮内瘤变(HGIN)
胃早期癌和癌前病变定义主要参考来源包括《WHO消化系统肿瘤分类(2019年版)》《中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)》《胃癌诊疗规范(2018年版)》《中国临床肿瘤协会(CSCO)胃癌诊疗指南(2020年版)》《胃癌规范化诊疗指南(试行)》等多部国内外指南及专家共识。
胃癌前病变检出率情况
我国胃癌前病变检出率男性高于女性,且年龄越大癌前病变检出率越高,同时具有明显地区差异,胃癌高发区检出率常高于低发区
世界范围内,胃癌前病变[上皮内瘤变和(或)异型增生]的发病规律与胃癌相似,通常男性高于女性。同时,胃癌前病变也具有与胃癌相似的地理分布,亚洲部分地区发病率较高,北美和欧洲部分地区发病率较低。我国目前已有大量针对胃癌的流行病学研究,但对胃癌前病变关注较少。
自2005年以来,我国多地陆续开展了上消化道筛查项目,各地癌前病变检出率并不一致。2017年,山东省上消化道癌早诊早治项目数据显示,在山东省农村地区31264例筛查对象中,共检出胃癌前病变643例,其中,LGIN 573例(1.83%),HGIN 70例(0.22%)。上述各级病变检出率在男性中均高于女性(P<0.05),符合我国胃癌发病的性别分布特点,同时,年龄分层显示,各级别病变在40~49岁、50~59岁及60~69岁3个年龄组的构成均有随年龄增长而增加的趋势(P<0.05)。山东省临朐县一项较早的研究也显示,在30~64岁随机人群中以5岁年龄段分组,异型增生检出率与年龄呈明显正相关(r=0.97,P<0.01),且>45岁组异型增生检出率迅速增加。甘肃省武威地区胃癌筛查的相关研究也显示,胃癌筛查的检出率随年龄呈明显的上升趋势。
2011—2015年在胃癌高发区甘肃省高台县的上消化道早诊早治项目中,胃LGIN检出率为1.39%,HGIN检出率为0.14%。贵州省上消化道癌早诊早治项目中,胃LGIN检出率为0.15%(3/2048),HGIN检出率为0.05%(1/2048)。2015—2018年云南省昆明市城市癌症早诊早治项目中,胃LGIN检出率为0.39%(20/5068),胃HGIN检出率为0.04%(2/5068),上皮内瘤变不能分类检出率为3.63%(184/5068),胃癌前病变检出率为4.06%(206/5068)。2018—2019年河北省城市癌症早诊早治项目中,内镜筛查发现胃LGIN 25例(1.36%),不确定的上皮内瘤变2例(0.11%),癌前病变共检出27例(1.47%)。2014—2015年新疆维吾尔自治区乌鲁木齐城市早诊早治项目中,上消化道筛查发现的胃低级别上皮内肿瘤4例(0.26%)。2015—2019年黑龙江省农村上消化道癌筛查项目中,胃HGIN检出率为0.12%(10/8022)。2019年发表的一项全国性多中心横断面研究显示,14929例无胃肠道症状且符合胃癌“高危”人群定义的参与者中,LGIN有82例(0.55%)。总体而言,胃癌前病变检出率有明显的地区差异,胃癌高发区的检出率常高于低发区。
胃癌筛查不良结局事件指标
(A)胃癌筛查的危害是指与未筛查比较,个体或群体在参与筛查过程中产生的任何负面效应
(B)胃癌筛查的潜在危害主要有过度诊断、假阳性、假阴性以及筛查相关并发症和感染
胃癌筛查不良结局事件主要参考日本胃癌筛查指南以及美国国家癌症研究所的PDQÒ项目,具体包括以下内容。
1. 筛查的危害:筛查的危害是指与未筛查比较,个体或群体在参与筛查过程中产生的任何负面效应。胃癌筛查的潜在危害主要有过度诊断、假阳性以及筛查相关并发症,其次还有辐射暴露、感染和假阴性。胃癌常规筛查的危害没有得到很好地量化或报告,主要来自日本等高风险地区的筛查经验,目前主要集中于内镜检查和影像检查危害的研究。
2. 过度诊断:过度诊断是指个体通过参加筛查被诊断为恶性肿瘤,但如果个体未进行筛查,则终生不会发现这些恶性肿瘤。过度诊断是一种较为常见的恶性肿瘤筛查危害,但在实际的恶性肿瘤筛查过程中,很难区分过度诊断与可能进展的恶性肿瘤。与其他恶性肿瘤筛查一样,胃癌筛查的过度诊断常导致不必要的检查和治疗,并且诊断结果可能导致患者出现心理问题。
3. 假阳性:又称误诊率,指实际无病但根据筛查判定为有病的比例,反映的是筛查试验误诊患者的情况。假阳性是恶性肿瘤筛查中的常见危害,需要进一步检查以明确诊断胃癌,因此会导致不必要的后续检查和筛查参与者的额外医疗负担。
4. 假阴性:由于现有的筛查手段对于胃癌的检出概率均不能达到100%,胃癌筛查中的漏诊(假阴性)可能导致延误病情的情况发生。
5. 筛查相关并发症和感染:筛查过程中可能出现的并发症包括术前用药的不良反应,内镜检查可能会导致出血、穿孔,还可能导致心肺事件及吸入性肺炎,影像筛查中服用钡剂可能引起的误吸和肠梗阻,其中肠梗阻是较为严重的并发症。此外内镜检查还可能导致感染,相关报道有乙型肝炎病毒感染和Hp感染。为了减少相关情况的发生,我国已制定《软式内镜清洗消毒技术规范WS 507-2016》。
胃癌前病变检出率情况
建议将胃癌年龄标化发病率(ASR)>20/10万的地区定义为胃癌高发区(强推荐,证据分级:中)
世界范围内不同地区胃癌发病率差异较大,以Segi′s世界标准人口为标准,按照胃癌的ASR,可以划分为低风险(ASR<10/10万)、中风险(10/10万≤ASR<20/10万)和高风险(ASR≥20/10万)地区。据此标准,2020年,东亚(如日本和蒙古)以及东欧地区为胃癌的高发区,澳大利亚/新西兰、北欧、北美及非洲地区为胃癌低发区。我国胃癌高发地区分布广泛,以西北地区和东南沿海较为集中,多地散在典型高发区,地区差异明显,且农村地区高于城市地区。数据显示,辽东半岛、山东半岛、长江三角洲和太行山脉等地是胃癌高发区,而辽宁、福建、甘肃、山东、江苏等地是胃癌高发省份。
胃癌高风险人群定义
年龄45岁及以上,且符合下列任一条件者为胃癌高风险人群(强推荐,证据分级:中):
(1)长期居住于胃癌高发区;
(2)Hp感染;
(3)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;
(4)一级亲属有胃癌病史;
(5)存在胃癌其他高危因素(高盐、腌制饮食、吸烟、重度饮酒等)
高风险人群是指患病风险处于较高水平的人群,确定风险人群是疾病预防控制中一项极其重要的措施,有助于恶性肿瘤的早期发现、早期诊断及早期治疗。我国在早期胃癌筛查方面目前缺乏简便、有效的诊断方法来进行普查;胃镜等方法由于医疗成本、条件的限制,无症状以及非高风险人群接受度低,尚难以大规模开展。因此,针对高风险人群开展胃癌筛查是较为可行的方法。
当前许多发达国家由于胃癌发病率较低,因此并不推荐进行胃癌筛查。一些国外指南或共识在定义胃癌高风险人群时,多数将胃癌家族史列为一项评判标准,其次是Hp感染以及一些胃癌前疾病。同时,吸烟、高盐饮食等不良生活习惯被认为是胃癌的高危因素,部分定义也予以考虑。具体定义见表4。

《中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)》中,将胃癌高风险人群定义为年龄≥40岁,且符合下列任意一条者:(1)胃癌高发地区人群;(2)Hp感染;(3)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;(4)一级亲属有胃癌病史;(5)存在胃癌其他高危因素(高盐、腌制饮食、吸烟、重度饮酒等)。
若以40岁为筛查人群起始年龄,将导致胃癌高风险人群人数过多,而实际上符合该标准的人群胃癌及早期胃癌的检出率并不高。因此,将胃癌高风险人群的起始年龄调整为45岁(具体依据见临床问题10:胃癌筛查目标人群的推荐起止年龄)。综上所述,本指南在制定胃癌高风险人群推荐意见时考虑了年龄、是否来自胃癌高发区、Hp感染、胃癌前疾病、胃癌家族史、是否存在高盐、腌制饮食、吸烟、重度饮酒等胃癌其他高危因素。
胃癌前病变检出率情况
推荐高风险人群胃癌筛查起始年龄为45岁,至75岁或预期寿命<5年时终止筛查(强推荐,证据分级:中)
目前,多数亚洲国家设定40~45岁为胃癌筛查的起始临界年龄。我国早前多部共识/技术方案将胃癌筛查的起始年龄定为40岁(表5)。然而,日本的一项研究显示,40~49岁年龄组人群胃癌的发病率有所降低,40岁开始筛查的成本效益低于50岁开始,因此,日本胃癌筛查指南(2018年)建议将起始年龄推迟至50岁。筛查年龄过宽可能导致较高的成本支出,同时由于我国处于人口老龄化阶段,适当延后筛查的起始年龄更为合理。我国现行的“城市癌症早诊早治项目技术方案”中已经将胃癌筛查的起始年龄范围由40岁修订为45岁。因此,本指南建议45岁作为胃癌筛查的起始年龄。
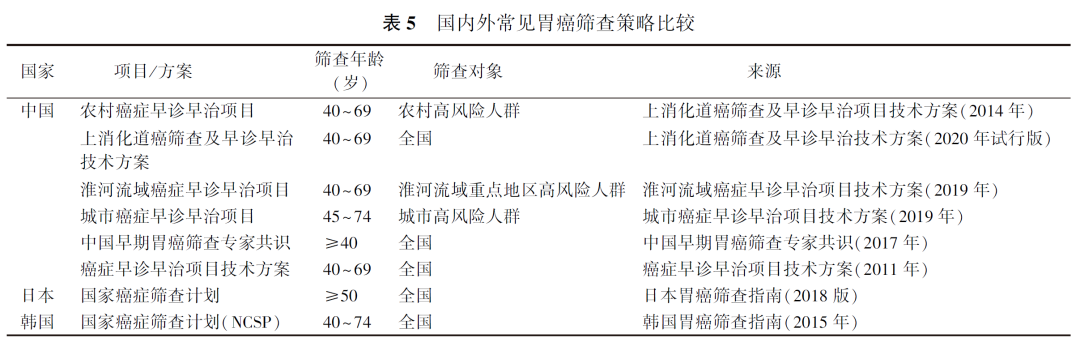
关于胃癌筛查的终止年龄,各国标准尚不统一。在亚洲的胃癌高发国家中,只有韩国和日本开展了全国性的胃癌筛查计划,韩国胃癌筛查指南建议40~74岁无症状成人每2年进行1次胃癌筛查,而日本的胃癌筛查指南则未确定胃癌筛查的终止年龄。我国“城市癌症早诊早治项目”将胃癌筛查终止年龄定为74岁,与韩国胃癌筛查终止年龄一致。据2018年全国肿瘤登记中心数据显示,我国胃癌年龄别发病率在40岁之前处于较低水平,40岁后开始上升,在80~85岁达到高峰。考虑到老年人的身体状况、预期寿命及胃镜筛查可能造成的创伤,在高龄人群中进行筛查的利弊难以权衡。因此,本指南推荐75岁或预期寿命<5年时终止筛查。
Hp感染检测
(A)推荐在胃癌高发地区人群进行Hp感染检测筛查(强推荐,证据分级:低)
(B)推荐首选尿素呼气试验(UBT)进行Hp的检测,血清Hp抗体检测和粪便抗原检测作为UBT的辅助诊断措施,或不能配合UBT者的二线诊断措施(强推荐,证据分级:低)
Hp是一种革兰氏阴性杆菌,1994年即被WHO列为胃癌的第Ⅰ类致癌原,已被证实与萎缩性胃炎、胃溃疡、胃癌等相关疾病的发生发展有密切联系,国内外指南和专家共识关于Hp检测的推荐意见见表6。已有动物实验结果表明,早期根除Hp可逆转炎症、化生和异型增生从而阻断胃癌进展,同时在动物模型中也观察到疾病自然病程后期根除Hp获益减少。目前已有多项人群层面队列研究和RCT评估了无症状人群Hp检测和治疗对降低胃癌发病率的影响。一项纳入7项研究、8 323例患者的Cochrane系统评价结果显示,在亚洲人群中,Hp根除治疗在预防胃癌的发生方面优于安慰剂或不治疗(RR=0.54,95%CI:0.40~0.72)。另有2个独立研究小组对相关研究进行了系统评价和Meta分析,得出了类似结论,筛查和根除Hp可以降低健康无症状感染者的胃癌发病率。从人群层面实施Hp筛查和根除计划的可行性,需要考虑包括卫生资源优先度、成本-效益比和筛查可能带来的负面影响。据《筛查与根除幽门螺杆菌预防胃癌:台北全球共识》,基于预防1例Hp归因胃癌所需的医疗费用(筛查根除)和所产生的潜在价值(节省医疗费用、减少误工和延长寿命等)进行计算,按我国胃癌发病率为30/10万、平均寿命77岁、Hp感染率50%和根除Hp可降低50%的胃癌发生风险评估,约根除42例Hp可预防1例胃癌,即需治疗人数为42例。据此计算,预防1例胃癌费用约为2.6万元,可获益21万元(3倍年人均国内生产总值)。此外,筛查根除Hp的获益不仅是预防胃癌,根除Hp还可预防和治疗Hp相关消化性溃疡和消化不良,额外获益未被纳入经济模型。在胃癌高发病率的地区筛查根除Hp是可行有效且具有潜在成本效益的策略,可降低胃癌发生风险,预防胃癌的成本-效益比也进一步提高。同时在评估策略的风险与获益时,应考虑大范围筛查根除Hp的其他潜在负面影响,包括可能出现的耐药菌株和治疗相关不良反应。本指南推荐在胃癌高发地区人群进行Hp感染检测筛查,而在低发地区尚不建议将人群筛查检测Hp作为预防胃癌的策略。
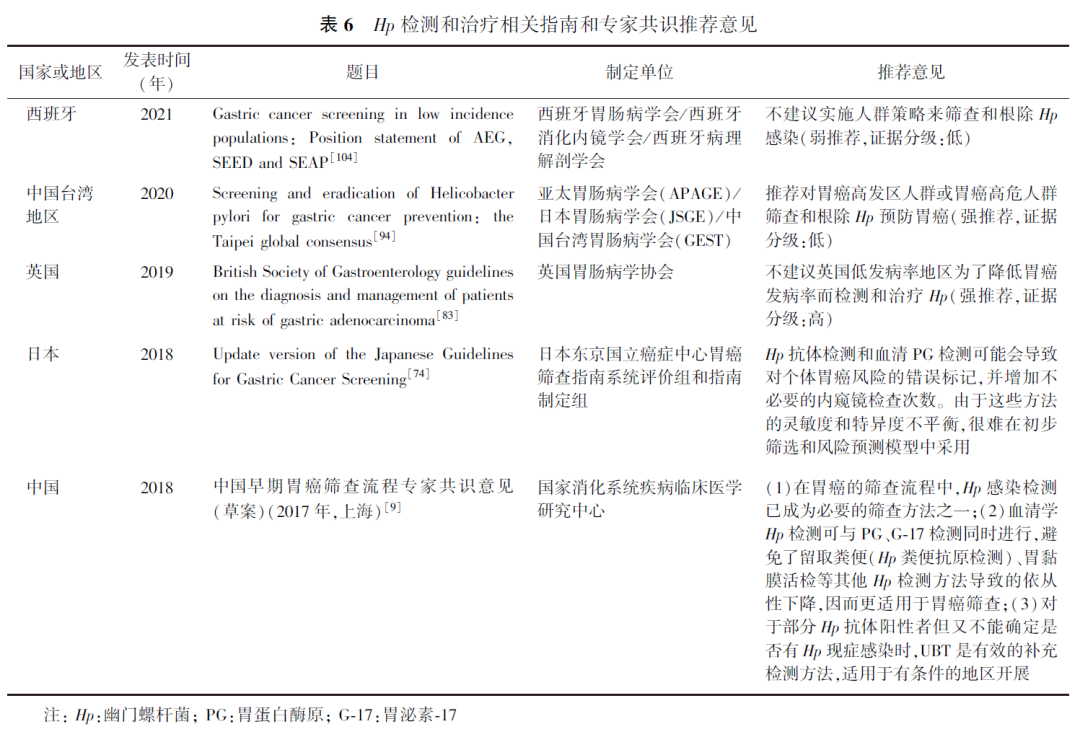
Hp感染检测方法目前主要有3种:(1)血清Hp抗体检测:当患者感染Hp后,其血液循环中可以出现2种抗Hp抗体:IgG和IgA,血清Hp抗体检测廉价、快速,且容易被患者接受,能反映一段时间内的Hp感染情况,但只要感染过Hp均会出现抗体阳性,因此不能区分现症感染与既往感染。2019年武汉大学人民医院开展的一项临床研究显示,血清Hp抗体定量检测阳性预测值为81.43%,阴性预测值为82.14%,建议把血清Hp抗体定量检测作为UBT的一种辅助诊断方式。(2)UBT:包括13C-UBT和14C-UBT,是临床最常应用的非侵入性试验,具有准确性相对较高、操作方便和不受Hp在胃内灶性分布影响等优点。一项纳入23项研究的Meta分析评估了UBT检测Hp感染的准确度,结果显示,UBT检测Hp感染的灵敏度为0.96(95%CI:0.95~0.97),特异度为0.93(95%CI:0.91~0.94)。2017年发表的纳入18项原始研究的Meta分析专门评价了14C-UBT的诊断准确率,结果显示,14C-UBT的诊断灵敏度和特异度分别为0.96和0.93,阳性似然比为12.27(95%CI:8.17~18.44),阴性似然比为0.05(95%CI:0.04~0.07)。2019年发表的另一项评估13C-UBT在亚洲人群中诊断准确性的Meta分析显示,诊断灵敏度为0.97(95%CI:0.96~0.98),特异度为0.96(95%CI:0.95~0.97)。(3)粪便抗原检测:现有许多粪便抗原试验用于诊断Hp感染,根据检测原理不同将粪便抗原试验分为酶联免疫法和免疫层析法,根据使用抗体不同又可分为单克隆法和多克隆法。一般来说,单克隆抗体测试比多克隆抗体测试更准确,酶联免疫测定法比免疫层析测定法提供更可靠的结果。一项纳入45项研究、5931例患者在内的Meta分析评估了粪便抗原检测在儿童中Hp感染诊断的准确性,结果显示,Hp感染粪便抗原检测汇总的灵敏度和特异度分别为92.10%和94.10%,在亚组分析中,单克隆法、多克隆法、一步式快速单克隆法的灵敏度和特异度分别为96.20%和94.70%、88.00%和93.00%、88.10%和94.20%。Hp粪便抗原检测准确性良好,就成本和设备而言,粪便抗原检测比UBT更适用于大规模筛查,且粪便样本在获取和储存上更具优势,适用于基层医院进行Hp感染的筛查,优先考虑儿童、老年人等不能配合完成UBT检测的人群。
2018年发表的一项纳入101项原始研究、涉及11003例研究对象(5839例确诊感染Hp)的大型Meta分析显示,血清Hp抗体检测、UBT和粪便抗原检测准确性存在统计学差异(P=0.024)。13C-UBT诊断准确性的OR值为153.0(95%CI:73.7~316.0),14C-UBT诊断准确性的OR值为105(95%CI:74~150),血清Hp抗体检测诊断准确性的OR值为47.4(95%CI:25.5~88.1),粪便抗原检测诊断准确性的OR值为45.1(95%CI:24.2~84.1)。13C-UBT的特异度为0.94(95%CI:0.89~0.97),14C-UBT的特异度为0.92(95%CI:0.89~0.94),血清Hp抗体检测的特异度为0.84(95%CI:0.74~0.91),粪便抗原检测的特异度为0.83(95%CI:0.73~0.90)。2022年发表的另一项Meta分析同样显示,UBT的诊断准确性高于粪便抗原检测(灵敏度:0.90比0.89,特异度:0.91比0.75),且粪便抗原检测会出现假阳性。因此,本指南推荐首选UBT进行Hp的检测,血清Hp抗体检测和粪便抗原检测作为UBT的辅助诊断措施,或不能配合UBT者的二线诊断措施。
Hp感染以外的胃癌其他生物标志物筛查
(A)不建议将血清胃蛋白酶原(PG)检测单独用于胃癌筛查(弱推荐,证据分级:极低)
(B)不建议将血清胃泌素-17(G-17)检测单独用于胃癌筛查(弱推荐,证据分级:极低)
(C)不建议将血清胃癌相关抗原MG7-Ag检测单独用于胃癌筛查(强推荐,证据分级:极低)
(D)PG、G-17、MG7-Ag和血清Hp-Ag等联合检测,配合评分系统或许有利于胃癌的精准筛查,但需要考虑经济效益问题(强推荐,证据分级:极低)
PG是胃蛋白酶的无活性前体,可分为PG Ⅰ和PG Ⅱ 2种亚型。PGⅠ主要由胃体和胃底腺的主细胞和颈黏液细胞分泌,而PG Ⅱ除由胃底腺分泌外,胃窦幽门腺和近端十二指肠Brunner腺亦可分泌。当胃黏膜发生萎缩时,血清PG Ⅰ水平和(或)PG Ⅰ/Ⅱ比值(PGR)降低。血清中约存在人体1%的PG,其血清水平可作为胃黏膜形态和功能状态的标志,联合Hp检测可识别出胃癌的高危个体。一项纳入27项人群筛查研究和15项针对特定高危人群(如萎缩性胃炎)研究、涉及约30万例受试者的Meta分析结果显示,在一般人群研究中血清PG(PGⅠ≤70 ng/ml,PGR≤3)检测诊断胃癌的灵敏度和特异度分别为77%和73%,在特定高危人群中灵敏度和特异度分别为57%和80%。另有3项Meta分析评估了PG检测对胃癌诊断的灵敏度和特异度,结果显示,血清PG检测对胃癌诊断的灵敏度和特异度分别为57%~69%和73%~85%。
血清G-17是由胃窦G细胞合成和分泌的酰胺化胃泌素,主要生理功能为刺激胃酸分泌和促进胃黏膜细胞增殖分化,其在人体中的含量占所有生物活性胃泌素总量的90%以上。G-17是反映胃窦内分泌功能的敏感指标之一,可提示胃窦黏膜萎缩状况或是否存在异常增殖,血清G-17水平取决于胃内酸度和胃窦G细胞数量,G-17本身在胃癌的发生发展过程中亦有促进作用。一项纳入20项原始研究、涉及4241例受试者的Meta分析评估了组合测试(PG、G-17和Hp血清学检查的组合)在诊断萎缩性胃炎方面的表现,结果显示,灵敏度仅为74.7%(95%CI:62.0%~84.3%),特异度为95.6%(95%CI:92.6%~97.4%)。
有研究显示,血清胃癌相关抗原MG7-Ag诊断胃癌前疾病、胃癌前病变和胃癌的阳性率分别为40.5%、61.0%和94.0%,且胃癌前病变中MG7-Ag的假阳性率仅为12.8%,可提示胃癌的高风险。2014年发表的一项Meta分析显示,血清MG7-Ag诊断胃癌的灵敏度为0.73(95%CI:0.63~0.82),特异度为0.91(95%CI:0.84~0.94),阳性似然比为8.59(95%CI:5.62~13.11),阴性似然比为0.29(95%CI:0.21~0.42)。一项纳入17项研究的Meta分析显示,MG7-Ag单独诊断胃癌方面的灵敏度为0.67(95%CI:0.58~0.75),特异度为0.91(95%CI:0.89~0.93),阳性似然比为7.75(95%CI:5.76~10.43),阴性似然比为0.36(95%CI:0.28~0.47)。该Meta分析还显示,PG、G-17和Hp血清抗体三者联合诊断胃癌的灵敏度为0.78(95%CI:0.53~0.92),特异度为0.92(95%CI:0.88~0.95),阳性似然比为10.20(95%CI:6.78~15.37),阴性似然比为0.24(95%CI:0.10~0.58);其诊断准确性高于单用血清MG7-Ag[相对诊断比值比(diagnostic odds ratio, DOR)=1.91,95%CI:0.65~5.62]。
2021年西班牙胃肠病协会和2019年英国胃肠病协会发布的指南均不推荐在一般人群中采用血清标志物筛查胃癌,2018年日本发布的指南考虑到生物标志物诊断胃癌的灵敏度和特异度偏低,同样不推荐在一般人群中使用。2017年我国发布的胃癌筛查共识认为联合2种及以上的生物标志物可能提高胃癌的筛查价值,但缺乏高级别的证据,应开展相关研究并积累关于胃癌生物标志物检测的高质量研究证据。国内外指南和专家共识关于胃癌生物标志物检测推荐意见见表7。因此,PG、G-17、MG7-Ag和血清Hp-Ag等联合检测,配合评分系统用于胃癌高危人群筛查,可有效浓缩高危人群、实现适于靶向精查的人群风险分层,或许有利于胃癌的精准筛查,但需要考虑经济效益问题。

胃癌筛查人群
(A)推荐胃癌高风险人群接受胃癌筛查(强推荐,证据分级:极低)
(B)不建议胃癌非高风险人群接受胃癌筛查(强推荐,证据分级:极低)
2008年一项日本的病例对照研究显示,接受胃镜筛查组人群发生胃癌的相对风险是未接受胃镜筛查组患者的0.347倍(95%CI:0.140~0.860)。2013年另一项日本的病例对照研究显示,过去36个月内接受过胃镜检查的患者胃癌诊断率与未接受过胃镜检查的患者胃癌DOR为0.695(95%CI:0.489~0.986),表明过去36个月内接受胃镜检查的患者胃癌发生率比未接受检查者低30%,但观察人群年龄均>40岁,且>60岁人群占78.8%。2018年一项纳入342013例亚洲人群的Meta分析显示,胃镜筛查与胃癌死亡风险降低40%有关(RR=0.60,95%CI:0.49~0.73);与不筛查比较,内镜筛查后胃癌死亡率显著下降(RR=0.58,95%CI:0.48~0.70);与放射学筛查比较,内镜筛查后胃癌死亡率也显著下降(RR=0.33,95%CI:0.12~0.91)。2020年的另一项基于中国人群的马尔可夫预测模型的研究估计,2019年我国共有约222万例胃癌患者[95%CI:1.97~2.47(百万例)],其中约42.7%(95%CI:40.3%~45.0%)的患者未被确诊;若无胃镜筛查,未来30年(2019—2049年)将累计新增1046万例[95%CI:9.07~11.86(百万例)]胃癌新发病例,新增735万例[95%CI:6.59~8.11(百万例)]胃癌死亡病例;若每3年1次胃镜筛查的覆盖率分别为10%、40%和70%时,可分别减少85万例[95%CI:0.63~1.06(百万例)]、232万例[95%CI:1.79~2.86(百万例)]和304万例[95%CI:2.38~3.70(百万例)]胃癌病例的发生,减少117万例[95%CI:1.01~1.32(百万例)]、308万例[95%CI:2.70~3.46(百万例)]和393万例[95%CI:3.46~4.40(百万例)]因胃癌死亡病例。2021年在我国开展的一项胃癌筛查研究显示,胃镜检查能降低浸润性胃癌的发生风险(RR=0.69,95%CI:0.52~0.92)和胃癌的特异性死亡率(RR=0.33,95%CI:0.20~0.56)。可见,前期筛查能降低胃癌的发生率与死亡率。2018年荷兰和挪威对279例萎缩性胃炎和肠化生患者平均随访57个月发现,4例(1.4%)患者在随访期间被确诊为胃癌。2018发表的对在我国2002—2005年间332例确诊为慢性萎缩性胃炎患者的长期随访显示,有16例被确诊为胃肿瘤,其中早期胃癌和晚期胃癌的发生率分别为0.20%和0.33%。2022年一项在韩国进行的对肠化生患者的前瞻性多中心研究显示,2980例患者中21例被诊断为胃肿瘤,并建议胃肠化生患者2年内必须接收内镜检查。一项有关我国50~70岁男性高危人群(胃癌的标准发病率为25.9例/10万人)的成本效应分析显示,每2年进行1次内镜筛查胃癌高度符合成本效应原则。可见,对于高危人群而言,胃癌筛查意义重大且符合成本效益原则。
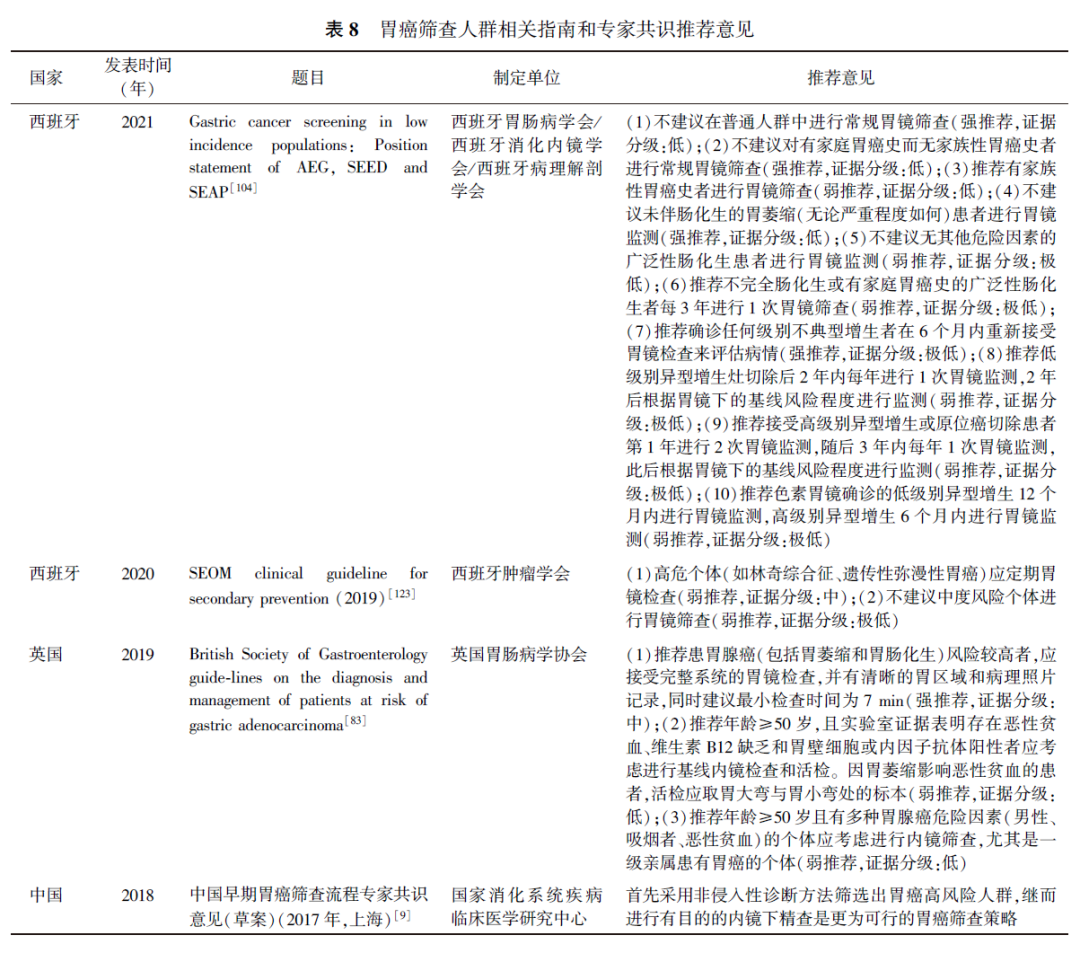
2021年西班牙胃肠病学会联合西班牙消化内镜学会和西班牙病理解剖学会制定的胃镜筛查指南中,不推荐在非高风险人群中进行常规胃镜筛查。2019年西班牙肿瘤学会制定的指南中推荐高危个体(如林奇综合征、遗传性弥漫性胃癌)应定期胃镜检查(弱推荐,证据分级:中),而不建议非高风险人群进行胃镜筛查(弱推荐,证据分级:极低)。2017年我国国家消化系统疾病临床医学研究中心发布的《中国早期胃癌筛查流程专家共识意见(草案)(2017年,上海)》指出,首先应采用非侵入性诊断方法筛选出胃癌高风险人群,继而进行有目的的内镜下精查是更为可行的胃癌筛查策略。国内外指南和专家共识关于胃癌筛查人群的推荐意见见表8。本指南推荐胃癌高风险人群接受胃癌筛查,而不建议胃癌非高风险人群接受胃癌筛查。
胃癌筛查与监测间隔
根据ABC分级
(A)A级,PG(-)、Hp(-)患者可不行内镜检查(弱推荐,证据分级:低)
(B)B级,PG(-)、Hp(+)患者至少每3年行1次内镜检查(弱推荐,证据分级:低)
(C)C级,PG(+)、Hp(+)患者至少每2年行1次内镜检查(弱推荐,证据分级:低)
(D)D级,PG(+)、Hp(-)患者应每年行1次内镜检查(弱推荐,证据分级:低)
根据新型胃癌筛查评分系统
(A)胃癌高危人群(17~23分),建议每年1次胃镜检查(弱推荐,证据分级:低)
(B)胃癌中危人群(12~16分),建议每2年1次胃镜检查(弱推荐,证据分级:低)
(C)胃癌低危人群(0~11分),建议每3年1次胃镜检查(弱推荐,证据分级:低)
早期胃病变和胃癌术后患者
(A)局限于胃窦或胃体的萎缩性胃炎或肠上皮化生,建议每3年接受1次内镜检查(强推荐,证据分级:低)
(B)可操作的与胃癌风险联系的萎缩评估(OLGA)和可操作的与胃癌风险联系的肠上皮化生评估(OLGIM)分期Ⅲ级以上的高危慢性萎缩性胃炎或肠上皮化生患者,建议每2年接受1次内镜检查(强推荐,证据分级:低)
(C)经内镜黏膜下剥离术(ESD)切除且未接受其他治疗的早期胃癌患者,建议术后6个月内复查内镜,然后根据内镜检查结果制定下一步监测策略(强推荐,证据分级:中)
(D)经ESD切除的上皮内瘤变或常规手术切除的早期胃癌患者,建议术后6个月内复查内镜,然后根据内镜检查结果制定下一步监测策略(强推荐,证据分级:低)
2016年韩国的一项病例对照研究显示,内镜下观察到的萎缩(OR=8.47,95%CI:4.65~15.40,P<0.001)和肠化生(OR=5.80,95%CI:3.24~10.35,P<0.001)是胃癌的独立危险因素。2015年的一项研究显示,与胃黏膜萎缩程度相关的胃癌检出率在整个胃部出现萎缩的患者中为5.33%,而在萎缩仅限于胃窦和胃角或胃体下部的患者中分别为0和0.25%。另外,多项研究结果表明,胃内广泛病变患者发生胃癌的风险会增加。
国内外指南和专家共识关于胃癌筛查的监测间隔推荐意见见表9。2019年英国胃肠病学学会指南提出不建议对仅有胃窦部的胃萎缩或胃肠化生患者进行监测,但是如果存在其他危险因素,如强烈的胃癌家族史或持续性Hp感染,仍然建议仅有胃窦部的胃萎缩或胃肠化生患者每3年检查1次。诊断为广泛性胃萎缩或胃肠化生的患者应每3年进行1次内镜检查,“广泛”定义为累及胃窦和胃体。2021年AEG、SEED和SEAP指南指出对无肠化生的胃萎缩患者、OLGIM Ⅰ~Ⅱ(局灶性肠化生)患者不建议进行内镜检查,对于与不完全肠化生或胃癌家族史相关的广泛胃萎缩(OLGIM Ⅲ~Ⅳ)患者,建议每3年进行1次内镜检查。2013年MAPS推荐对广泛萎缩和(或)肠化生的患者每3年进行1次内镜检查。2020年台北全球共识建议对胃萎缩或肠道发育不良的受试者每2至3年进行1次监测内窥镜检查,在切除肿瘤后每12个月进行1次内镜检查。2019年MAPS Ⅱ指南推荐患有晚期萎缩性胃炎(胃窦和胃体严重萎缩性改变或肠上皮化生,OLGA/OLGIM Ⅲ/Ⅳ)的患者应每3年接受1次高质量的内镜检查。
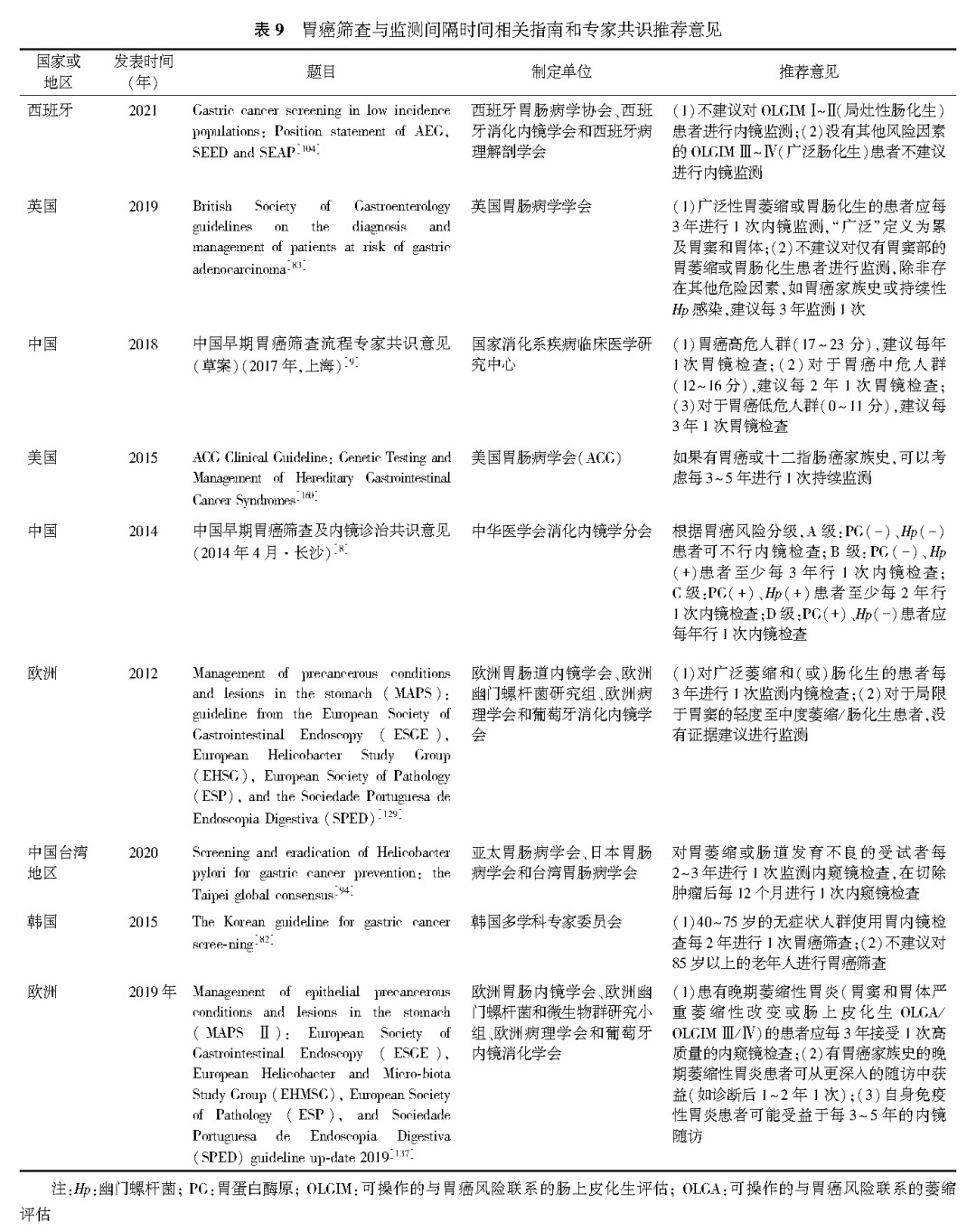
2011年,评估血清抗Hp抗体滴度和血清PG水平的血清筛查系统(ABC分类系统)被开发用于反映胃部炎症的状态(包括胃萎缩)。多项研究也证明了ABC分类系统在胃癌筛查中的应用价值。《中国早期胃癌筛查及内镜诊治共识意见((2014年4月·长沙))》提出,胃癌筛查方法根据胃癌风险分级进行分类,A级患者可不行内镜检查,B级患者至少每3年行1次内镜检查,C级患者至少每2年行1次内镜检查,D级患者应每年行1次内镜检查。
2017年中国国家消化病临床研究中心牵头制定了《中国早期胃癌筛查流程专家共识意见(草案)(2017年,上海)》,提出了新型胃癌筛查评分系统,将各项风险因素赋值量化,并建议将其作为我国早期胃癌筛查的风险分层管理办法,该系统包含5个变量,总分0~23分,根据分值可将胃癌筛查目标人群分为3个等级:胃癌高危人群(17~23分):胃癌发生风险极高;胃癌中危人群(12~16分):有一定胃癌发生风险;胃癌低危人群(0~11分):胃癌发生风险一般。2019年,国内一项研究对比了3种筛查方法后得出,新评分系统在早期胃癌筛查中有较高的价值,其高危组的早期胃癌检出率高于低、中危组。2021年,另一项研究比较了新型胃癌筛查评分系统与PG联合G-17(新ABC法)在胃癌及癌前病变筛查中的价值,并得出2种方法均适用于胃癌及癌前病变筛查,而其中新评分系统在胃癌筛查及癌前病变早期干预方面中可能具有更高价值。
一项纳入107项研究的系统评价与Meta分析显示,萎缩性胃炎和胃黏膜肠上皮化生在人群中的患病率分别高达33%和25%,对这些患者全部进行随访成本效益过低。一项纳入279例患者的队列研究显示,局限性萎缩性胃炎和肠上皮化生进展的可能性显著低于广泛性萎缩性胃炎和肠上皮化生(0比3.8%,P=0.02)。另一项随访16年的队列研究显示,虽然与无肠上皮化生比较,局限性肠上皮化生可能会增加胃癌的发生风险(0.55%,95%CI:0%~1.3%),但这种风险太小,不足以证明对其监测是合理的。此外,欧洲指南和英国指南均不建议对局限性萎缩性胃炎或肠上皮化生进行监测。然而,当局限性病变合并危险因素时,胃癌发生的风险会大大增加。一项平均随访12年的西班牙前瞻性多中心队列研究显示,与完全性肠上皮化生比较,不完全性肠上皮化生发展为胃癌的风险显著增加(HR=2.57,95%CI:1.06~6.26)。另一项队列研究也显示,不完全性肠上皮化生发展为胃癌的风险显著高于完全性肠上皮化生(HR=11.30,95%CI:1.40~91.40)。此外,也有研究报道了胃癌家族史与胃癌进展的关系,一项纳入3项病例对照研究和8项队列研究的系统评价与Meta分析显示,胃癌患者的一级亲属Hp感染(OR=1.925,95%CI:1.419~2.611)、萎缩性胃炎(OR=2.200,95%CI:1.266~3.824)和肠上皮化生(OR=1.982,95%CI:1.763~2.881)的风险增加;还有研究显示,早期胃癌患者的一级亲属OLGA Ⅲ/Ⅳ期萎缩性胃炎和异型增生的发病率升高。以上研究结果提示,有必要对合并有高危因素的局限性病变进行内镜监测。此外,欧洲指南和英国指南均建议对合并有危险因素的局限性萎缩性胃炎或肠上皮化生每3年进行1次胃镜监测。因此,本指南推荐对合并有危险因素的局限性萎缩性胃炎和肠上皮化生每3年进行1次胃镜监测。
OLGA和OLGIM是将胃黏膜组织学与胃癌风险联系起来的评价系统,OLGA和OLGIM分期越高,说明萎缩性胃炎或肠上皮化生越严重,发生胃癌的风险越高。一项研究OLGA/OLGIM分期与胃癌风险的系统评价与Meta分析显示,OLGA Ⅲ/Ⅳ期患者发生胃癌的风险显著增高(OR=2.64,95%CI:1.84~3.79),OLGIM Ⅲ/Ⅳ期患者发生胃癌的风险也显著增高(OR=3.99,95%CI:3.05~5.21)。在一项纳入7 436例患者的长期随访(平均随访6.3年)队列研究中,OLGA Ⅲ和OLGA Ⅳ期也是胃癌发生的独立危险因素(OLGA Ⅲ期比OLGA 0期,OR=712.4,95%CI:92.5~5484.5;OLGA Ⅳ期比OLGA 0期,OR=1450.7,95%CI:166.7~12626.0)。欧洲指南和意大利指南均建议对OLGA或OLGIM分期Ⅲ级以上的患者每3年进行1次高质量内镜检查。然而,关于随访的时间间隔尚未经过队列研究的验证。有2项队列研究对高危患者(OLGA或OLGIM分期Ⅲ级以上)进行间隔2年的随访,结果显示,高危患者中部分胃癌(3.65%Ⅲ级,6.31%Ⅳ级)的发生时间早于指南推荐的3年随访。因此,有研究者认为每2年1次的随访更适合OLGA或OLGIM分期Ⅲ级以上的高危慢性萎缩性胃炎或肠上皮化生患者。中国胃癌前病变处理的专家共识推荐对高危的萎缩性胃炎(OLGA或OLGIM分期Ⅲ级以上)患者每2年进行1次高质量的内镜检查。基于以上研究证据,本指南建议对高危的萎缩性胃炎或肠上皮化生(OLGA或OLGIM分期Ⅲ级以上)患者每2年行1次高质量的内镜检查。此外,对患者的检查应尽可能使用高质量内镜。一项系统评价与Meta分析结果显示,在诊断癌前疾病患者的异型增生和早期胃癌方面,虚拟染色内镜都有非常高的准确性(灵敏度为90%,特异度为83%),可考虑作为定期内镜检查的工具。
为评价ESD对早期胃癌的治疗效果,有研究者建立了一个简单易行的评分系统,即eCura评分系统:淋巴结侵犯得3分,肿瘤长径>30 mm、垂直切缘阳性、静脉侵犯、黏膜下侵犯≥500 μm满足一项得1分;0~1分为低风险,2~4分为中风险,5~7分为高风险,低、中、高风险组之间的5年胃癌生存率差异有统计学意义(分别为99.6%、96.0%和90.1%;P<0.001)。日本指南采用eCura评价系统对ESD术后的复发风险进行评级,并决定是否需要进一步治疗。eCura评价系统包括:(1)eCuraA:肿瘤能整块切除,且满足以下其中一项:①术后病理学检查显示肿瘤分期为pT1a,分化型癌占优势且不伴溃疡,水平及垂直切缘阴性,无淋巴管和血管侵犯;②术后病理学检查显示肿瘤分期为pT1a,未分化型癌占优势,肿瘤长径≤2 cm,水平及垂直切缘阴性,无淋巴管和血管侵犯;③术后病理学检查显示肿瘤分期为pT1a,分化型癌占优势伴溃疡,长径≤3 cm,水平及垂直切缘阴性,无淋巴管和血管侵犯;(2)eCuraB:肿瘤能整块切除,术后病理显示肿瘤分期为pT1b但浸润<500 μm,分化型癌占优势,肿瘤长径≤3 cm,水平及垂直切缘阴性,无淋巴管和血管侵犯;(3)eCuraC:包括eCuraC1和eCuraC2,eCuraC1指在分化型癌中,满足eCuraA或eCuraB部分条件,但未能整块切除或切缘阳性者;eCuraC2则表示与eCuraA、eCuraB、eCuraC1均不相符者。针对eCuraA或eCuraB,日本指南建议每年行1~2次内镜检查(eCuraB还应行腹部超声等确定有无转移),eCuraC1可再行ESD或选择外科切除,eCuraC2原则上应追加外科切除。
一项纳入2779例胃癌患者的随访研究显示,ESD治疗后上皮内瘤变和早期胃癌的5年累积异时性胃癌发病率分别为4.1%和4.7%,10年累积异时性胃癌发病率分别为8.4%和11.3%,提示术后及时随访和定期监测确实可以使一部分患者受益。另有研究显示,上皮内瘤变和早期胃癌经内镜切除后异时性胃癌的发生率相当(分别为4.1%和4.7%,P=0.578),提示应重视上皮内瘤变的术后监测。但是,关于早期胃癌和HGIN的术后随访和定期监测的时间间隔目前尚无一个明确的标准。有研究显示,大部分胃癌复发集中于ESD术后1年内。因此,本指南推荐在上皮内瘤变或早期胃癌患者ESD术后6个月进行高质量内镜复查,并根据胃黏膜状态(萎缩及化生程度)决定下一步的监测策略,必要时可每年进行复查。此外,由于目前早期胃癌主要行ESD切除,关于手术切除早期胃癌复发或异时性胃癌的文献较少,难以设置一个合适的随访和检测策略。但有2项系统评价与Meta分析表明,行外科手术切除的早期胃癌患者复发的风险小于行ESD的患者。因此,本指南认为行外科手术切除的患者也能从ESD术后随访、监测策略中获益,故行外科手术切除的早期胃癌患者的术后随访和监测方案暂定与ESD相同。
内镜种类的选择
(A)推荐首选普通白光胃镜联合窄带成像放大胃镜进行筛查,尤其是存在以下任一情况时:胃萎缩、胃肠上皮化生、怀疑早期胃癌(强推荐,证据分级:极低)
(B)对于不能接受常规内镜检查者,可考虑使用磁控胶囊胃镜(弱推荐,证据分级:极低)
(C)建议根据医院设备和医师水平,灵活选择色素内镜、蓝激光成像放大内镜、荧光内镜等新型内镜成像技术(弱推荐,证据分级:极低)
在内镜下,早期胃癌表现为轻微的息肉状隆起、浅表斑块、胃黏膜颜色的改变、凹陷或溃疡等。早在胃镜最开始在临床应用的年代,有研究报道显示,普通白光内镜检出早期胃癌的准确率为90%~96%。胃镜筛查是目前诊断早期胃癌最有效的技术,普通白光内镜虽然价格低廉但在早期胃癌和癌前病变的筛查中灵敏度和特异度较低。2013年一项比较窄带成像内镜与普通白光内镜的RCT研究显示,在200例患者中普通白光内镜检出17例病变(12例萎缩性胃炎,5例萎缩性胃炎伴肠化生),窄带成像内镜检出31例病变(22例萎缩性胃炎,9例萎缩性胃炎伴肠化生),二者间的差异有统计学意义(P=0.001)。2015年发表的一项纳入中国和日本人群的Meta分析结果显示,放大内镜联合窄谱成像诊断早期胃癌的灵敏度、特异度、阳性似然比、阴性似然比和DOR分别为0.76、0.97、12.99、0.27和51.05,放大内镜联合窄谱成像和传统白光内镜诊断早期胃癌的灵敏度、特异度、阳性似然比、阴性似然比和诊断比值比分别为0.88、0.94、12.99、0.11和125.28。2020年另一项纳入34项原始研究共计7 255例胃癌患者的Meta分析显示,放大内镜联合窄谱成像诊断胃癌的灵敏度、特异度、阳性似然比、阴性似然比和诊断比值比分别为0.87、0.96、10.91、0.15和82.61。可见,普通白光内镜联合使用窄谱成像技术的放大内镜用来诊断胃癌具有更高的灵敏度、特异度和阳性似然比。一项国外的单中心研究也表明,放大内镜联合窄谱成像诊断胃的细微黏膜结构消失、微血管扩张和不均一性的灵敏度和特异度分别为92.9%和94.7%,远高于单纯普通白光内镜的42.9%和61.0%。因此,本指南推荐普通白光胃镜联合窄带成像放大胃镜进行筛查,尤其是存在以下任一情况时:胃萎缩、胃肠上皮化生、怀疑早期胃癌、判断早期胃癌浸润深度有困难。
一项纳入9项原始研究262例胃癌患者的Meta分析显示,磁控胶囊内镜精确度是普通白光内镜的97.18%,完成检查花费的时间长于传统内镜均数差(mean difference, MD;MD=24.01,95%CI:10.77~37.25,P<0.01),且患者的可接受度远高于传统胃镜(96.70%比1.10%)。2021年发表的纳入7项研究涉及916例患者的Meta分析显示,磁控胶囊内镜的平均检查时间为(21.92±8.87)min,合并灵敏度为0.87(95%CI:0.84~0.89);亚组分析显示,诊断胃溃疡的灵敏度为0.82(95%CI:0.71~0.89),诊断为息肉的灵敏度为0.82(95%CI:0.76~0.87),诊断胃糜烂的灵敏度为0.95(95%CI:0.86~0.98);患者总体耐受性好、不良反应最小。因此,本指南建议磁控胶囊胃镜用于特殊人群的筛查,如老人、儿童和孕妇等。
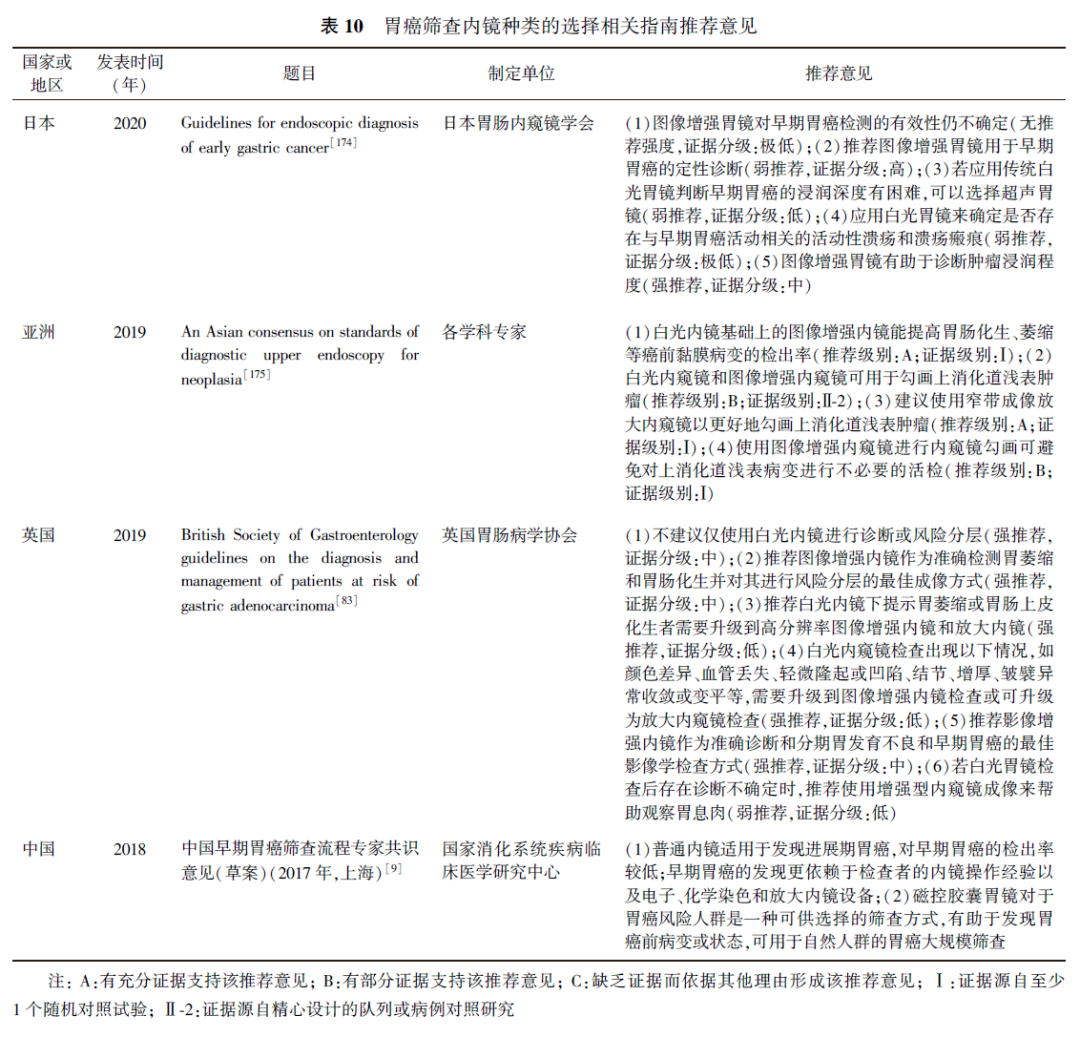
2016年发表的一项纳入9项原始研究包含699例胃癌患者的Meta分析显示,色素内镜的诊断灵敏度、特异度和曲线下面积(area under the curve, AUC)分别为0.90(95%CI:0.87~0.92)、0.82(95%CI:0.79~0.86)和0.9464;色素内镜对早期胃癌(RR=0.36,95%CI:0.11~0.61)和胃癌前病变(RR=0.17,95%CI:0.07~0.28)的诊断准确性均高于普通白光内镜,差异有统计学意义(P值分别为0.005和0.001)。2020年发表的一项纳入28项原始研究的Meta分析比较了蓝色激光成像与窄谱成像对胃癌和胃癌前病变的诊断准确性,研究显示,蓝色激光成像对胃癌诊断的灵敏度为0.89(95%CI:0.80~0.95),特异度为0.92(95%CI:0.76~0.98),窄谱成像对胃癌诊断的灵敏度为0.83(95%CI:0.75~0.89),特异度为0.90(95%CI:0.80~0.96);蓝色激光成像对胃癌前病变的诊断的灵敏度为0.81(95%CI:0.71~0.87),特异度为0.90(95%CI:0.80~0.96),窄谱成像对胃癌诊断的灵敏度为0.80(95%CI:0.75~0.85),特异度为0.88(95%CI:0.77~0.94);蓝色激光成像和窄谱成像对胃癌、胃癌前病变的诊断灵敏度和特异度基本一致。可见,随着技术的发展及更多临床研究的开展,未来色素内镜和蓝激光成像放大内镜将在胃癌筛查中占有非常重要的地位。2003年发表的一项观察性研究显示,注射吲哚菁绿后,25例早期胃癌中发生黏膜下浸润在内镜下均可见。2005年另一项观察性研究显示,在注射吲哚菁绿后通过红外线内窥镜来观察静脉曲张情况发现,与未注射吲哚菁绿比较,注射吲哚菁绿后可以观察到更深处的组织(分别为11.2和3.2 mm)。2007年的一项观察性研究同样显示,注射吲哚菁绿后用红外荧光内镜进行观察,10例黏膜下浸润胃癌中8例(80%)能观察到荧光染色。此外,自体荧光技术与窄带成像联合应用也有利于发现胃癌。2013年我国的一项包含140例患者的观察性研究显示,自体荧光内镜联合窄带成像技术对肠上皮化生诊断的灵敏度和特异度分别为88.89%和91.58%,对上皮内瘤变诊断的灵敏度和特异度分别为83.33%和98.51%,对早期胃癌诊断的灵敏度和特异度分别为90.91%和99.22%,均高于单纯荧光内镜。可见,在筛查过程中怀疑有浸润发生时,可以联合使用荧光胃镜进一步筛查。因此,本指南建议根据医院设备和医师水平,灵活选择与联合色素内镜、蓝激光成像放大内镜、荧光内镜等新型内镜成像技术。国内外指南和专家共识关于胃癌筛查内镜种类选择的推荐意见见表10。
胃镜检查操作过程
(A)推荐对内镜医师进行系统化训练以提高诊断能力(弱推荐,证据分级:极低)
(B)推荐胃镜下对胃内部进行系统地观察,并需要有充分与合理的检查时间(弱推荐,证据分级:低)
(C)推荐在胃蠕动剧烈而难以观察时考虑使用抗痉挛药(强推荐,证据分级:低)
(D)推荐使用黏液溶解剂和消泡剂提高胃镜下黏膜的可见度(强推荐,证据分级:极低)
胃镜筛查结果是否准确与内镜医师识别可疑病变及进行病理鉴别的能力息息相关。因此,对内镜医师的培训除需提高其操作技术水平,还应提高其基础知识。2013年一项基于YouTube内镜医师的网络培训的前瞻性研究显示,6名接受培训医师的全局准确度提高了10%,在观看200个视频后一般参与者观察到肠上皮化生的灵敏度和特异度均达80%以上,观察到异常增生的特异度达95%。2014年的一项自身对照研究也显示,62名内镜医师接受讲座前与接受讲座后内镜检查的准确率由53.1%提升至70.8%,且差异具有统计学意义(P<0.001)。2016年一项涉及35个国家的RCT显示,151名接受基于互联网电子学习系统的医师内镜诊断能力提升的平均值和标准误为1.24±0.26,高于未接受培训的144名内镜医师(1.00±0.16),差异有统计学意义(P<0.001)。我国的一项回顾性研究同样显示,内镜医师分别接受9个月、12个月和17个月内镜培训后早期胃癌的检出率分别为0.3%、0.6%和1.5%,未经培训的分别为0.005%、0.008%和0.100%。可见,基础知识和胃镜操作技术的培训可以提高胃镜医师的诊疗水平。因此,本指南建议对内镜医师进行系统化训练以提高诊断能力。
一项纳入432202例患者的多中心回顾性研究显示,胃镜前镇静组早期胃癌(2.39/10000人年和1.91/10000人年,P=0.020)和HGIN(4.70/10000人年和4.09/10000人年,P=0.042)的检出率高于未镇静组,且镇静组的平均观察时间更长(分别为16.53和14.72 min,P<0.001),碘染色(3.64%比1.68%,P<0.001)、图像增强技术(0.58%比0.21%,P<0.001)和放大内镜(3.94%比0.52%,P<0.001)使用率更高。一项纳入2项RCT的系统评价与Meta分析显示,镇静剂的使用可提高患者对内镜检查的满意度(RR=2.29,95%CI:1.16~4.53)。这些研究结果提示镇静剂的使用可能提高患者对内镜检查的配合度,进而提高早期胃癌和HGIN的检出率,但目前缺乏高级别的证据,是否使用镇静剂要根据具体情况。
在内镜检查过程中胃痉挛尤其是胃窦部的痉挛,极有可能干扰内镜医师的观察。因此,有必要在胃镜检查前使用抗痉挛药。目前抗痉挛药物主要包括两类:注射用药(如丁莨菪碱、胰高血糖素)和局部喷雾剂(如薄荷油及其主要成分薄荷醇)。2003年Hiki等发表一项RCT比较了胃镜前注射用的丁莨菪碱和喷雾剂薄荷油的抗痉挛效果,给药3 min后薄荷油组幽门最大开度比明显高于丁莨菪碱组、最小开度环是丁莨菪碱组的4倍,薄荷油组肌肉的收缩率也明显低于丁莨菪碱组,薄荷油组收缩环消失时间短于丁莨菪碱组[分别为(97.1±11.4)s和(185.9±10.1)s,P<0.0001];且薄荷油组仅2%患者出现腹胀,丁莨菪碱组26%患者出现舌燥、16%患者出现短暂性视觉调节障碍、2%患者出现尿潴留和头痛。2011年Hiki等再次开展一项RCT来评估胃镜前使用薄荷油抗痉挛的有效性与安全性,薄荷油组胃蠕动的完全抑制率为35.6%(21.9%~51.2%),安慰剂组为7.1%(1.5%~19.5%),差异有统计学意义;而两组患者的不良反应发生率差异无统计学意义(P=0.512)。因此,本指南推荐在胃蠕动剧烈而难以观察时考虑使用抗痉挛药。基于目前的证据表明薄荷油比丁莨菪碱具有更好的抗痉挛效果,且不良反应更小,建议首选薄荷油作为胃镜检查前使用的抗痉挛药物。
附着在胃黏膜表面的泡沫和黏液会干扰胃镜下的观察,尤其会令胃镜医师忽视黏膜的微小病变。因此,推荐使用黏液溶解剂和消泡剂来提高胃镜下黏膜的可见度。2007年发表的我国台湾地区的一项RCT探索了在胃镜前20 min使用链酶蛋白酶或N-乙酰半胱氨酸的影响,结果显示,链酶蛋白酶与N-乙酰半胱氨酸组黏膜的可见性高于糖水组,链酶蛋白酶和N-乙酰半胱氨酸组黏膜的可见性无差异,链酶蛋白酶和N-乙酰半胱氨酸组联合用药组检测的灵敏度和特异度分别为92.5%和93.9%。2012年韩国的一项RCT同样显示,内镜检查前使用链酶蛋白酶可以显著改善内镜下的可见度,并减少冲水的次数。2014年韩国的另一项研究评价了链酶蛋白酶对窄带成像的影响,结果显示链酶蛋白酶组胃近端可见性评分和内窥镜医师满意度评分均显著高于对照组(P值分别为0.014和0.034)。2015年韩国的一项研究评估了链酶蛋白酶对放大内镜的诊断影响,链酶蛋白酶改善了放大内镜下的黏膜可见性并减少冲水的次数。此外,二甲基硅油也被用于提高内镜的可见度。2014年发表的纳入10项原始研究(1541例患者)的Meta分析结果显示,与未使用二甲基硅油的患者组比较,二甲基硅油改善了内镜下的可见度(MD=-4.3,95%CI:-4.94~-3.67)。因此,本指南推荐使用黏液溶解剂和消泡剂来提高胃镜下黏膜的可见度。具体使用何种药物更为安全与有效,受限于目前原始研究的不足,并不能进行对比分析。国内外指南和专家共识关于胃镜检查的推荐意见见表11。

早期胃癌治疗——ESD和功能保留胃切除术
对满足ESD绝对和扩大适应证的早期胃癌患者,推荐行ESD治疗;对不满足ESD绝对和扩大适应证的早期胃癌患者,推荐以胃切除术作为标准治疗方案并优先考虑功能保留胃切除术,同时根据胃切除术范围选择适当的淋巴结清扫术(强推荐,证据分级:高)
ESD由内镜下黏膜切除术(endoscopic mucosal resection, EMR)发展而来,是利用高频电刀切开病灶周围的黏膜,由黏膜下层剥离切除病变的方法,适用于淋巴结转移可能性极低(<1%)且能一次性完整切除整块肿瘤的早期胃癌。一项纳入18项病例对照研究的系统评价与Meta分析显示,ESD的整块切除率(OR=9.00,95%CI:6.66~12.17)、完全切除率(OR=8.43,95%CI:5.04~14.09)和根治性切除率(OR=2.92,95%CI:1.85~4.61)均高于EMR,且局部复发率(OR=0.18,95%CI:0.09~0.34)较低。因此,ESD成为目前主流的早期胃癌内镜切除术式。
根据第6版《日本胃癌治疗指南》,ESD的绝对适应证包括:(1)大体可见的分化型黏膜内癌(临床分期cT1a),不伴溃疡;(2)肿瘤长径≤3 cm大体可见的分化型黏膜内癌(临床分期cT1a),伴溃疡;(3)肿瘤长径≤2 cm的未分化型黏膜内癌(临床分期cT1a),不伴溃疡。ESD的扩大适应证为:(1)符合绝对适应证的分化型黏膜内癌,初次ESD或EMR治疗后eCura为C1,局部复发后内镜下判断临床分期为cT1a的病变;(2)肿瘤长径>2 cm的大体可见的未分化型黏膜内癌(临床分期cT1a),不伴溃疡。几项队列研究表明,符合ESD绝对或扩大适应证的早期胃癌患者经ESD治疗后预后良好。除此之外,一项纳入18项回顾性队列研究的系统评价与Meta分析显示,ESD与其他手术(胃近端切除术、胃远端切除术、腹腔镜手术、开放手术等)比较,虽然术后局部复发率较高(OR=5.42,95%CI:2.91~10.11),但总生存率和疾病特异生存期无明显差异;同时,行ESD治疗的患者手术相关死亡以及不良事件发生率均低于其他手术组。另一项比较ESD和其他手术对未分化型早期胃癌治疗效果的系统评价与Meta分析也未显示ESD组和外科手术组的总生存率存在显著性差异。此外,有队列研究显示,行ESD治疗的早期胃癌患者术后并发症更少、功能恢复更好。以上研究表明,ESD对符合其绝对或扩大适应证的患者具有与传统外科手术相近的治疗效果,同时又具有对患者损伤小、不良事件及并发症的发生率较低等优点,有利于改善患者的术后生命质量,因此可作为符合适应证患者的推荐治疗方式。除了上述证据外,2项研究显示ESD治疗后未能根治追加根治性切除术的患者5年生存率与不进行ESD治疗直接行标准胃切除术的患者5年生存率的差异并无统计学意义,这也提示在符合适应证的情况下先行ESD治疗是合理的。除ESD外,内镜下治疗还包括激光刀、微波治疗等,由于这些方法无法获得完整的病理学标本,也无法确定肿瘤是否完全切除,因此本指南不建议将其作为早期胃癌的首选治疗方式。
虽然ESD具有诸多优点,但是由于适应证的限制无法用于所有早期胃癌,特别是伴淋巴结转移的早期胃癌。对不满足ESD绝对和扩大适应证的患者,第6版《日本胃癌治疗指南》推荐使用胃切除术作为标准治疗方案。第6版《日本胃癌治疗指南》将胃切除术分为全胃切除术、远端胃切除术、保留幽门胃切除术、近端胃切除术、胃分段切除术以及胃局部切除术。在确保切缘距离肿瘤边缘2 cm以上的基础上,可根据患者的实际病情以及胃切除术的适应证选择合适的切除方案。(1)若术前判断存在淋巴结转移(cN+)且能确保上述切缘距离时,选择远端胃切除术,否则选择全胃切除术;(2)对胃中部且远侧缘距幽门4 cm以上的肿瘤,若术前不存在淋巴结转移,可选择保留幽门胃切除术;(3)对胃上部的肿瘤,若术前不存在淋巴结转移,可选择近端胃切除术。保留幽门胃切除术、近端胃切除术、胃分段切除术和胃局部切除术均属于功能保留胃切除术,其中保留幽门胃切除术是胃分段切除术中最具代表性的手术。已有2项系统评价与Meta分析比较了保留幽门胃切除术和远端胃切除术的安全性和功能效益,发现两者的复发率和生存率相近,保留幽门胃切除术组更易发生胃潴留,但胆汁反流、残胃炎和倾倒综合征的发生率显著低于远端胃切除术组。这些研究结果说明保留幽门胃切除术安全性与远端胃切除术相当,但对患者术后生命质量的改善效果优于远端胃切除术。在对另一种功能保留手术——近端胃切除术的研究中,有研究者对15项队列研究和3项病例对照研究进行系统评价与Meta分析,比较近端胃切除术与全胃切除术对早期胃癌的近期和远期临床疗效,结果显示近端胃切除术和全胃切除术的总生存率无统计学差异(HR=0.68,95%CI:0.33~1.03),但近端胃切除术术后患者的长期营养状况(指标包括体质量损失、总蛋白、总胆固醇等)更佳;近端胃切除术组吻合口狭窄(OR=2.01,95%CI:1.32~3.07)和反流性食管炎(OR=2.70,95%CI:1.73~4.21)的发生率显著高于全胃切除术组,但可以通过空肠间置术、双通道吻合术等方法克服。另一项纳入9项回顾性队列研究的系统评价与Meta分析也显示,近端胃切除术与全胃切除术治疗早期胃癌的5年生存率差异无统计学意义(OR=1.16,95%CI:0.72~1.86)。综合目前的证据,可认为在患者病情符合适应证的情况下功能保留胃切除术是全胃切除术或远端胃切除术的理想替代术式。至于除保留幽门胃切除术外的胃分段切除术以及胃局部切除术,尚需更多的临床证据证明其安全性和功能保留效果,故暂时只列为研究性手术。此外,根据目前的循证医学证据,第6版《日本胃癌治疗指南》和我国胃癌诊疗指南(2022版)均建议对行胃切除术的患者按照胃切除范围确定淋巴结清扫范围,具体为:(1)cT1N0、分化型、长径<1.5 cm的胃癌行D1清扫,其余的cT1N0胃癌行D1+清扫;(2)cT1N+的胃癌行D2清扫。不同胃切除术的D1、D2淋巴结清扫术的范围有所不同,详见表12。
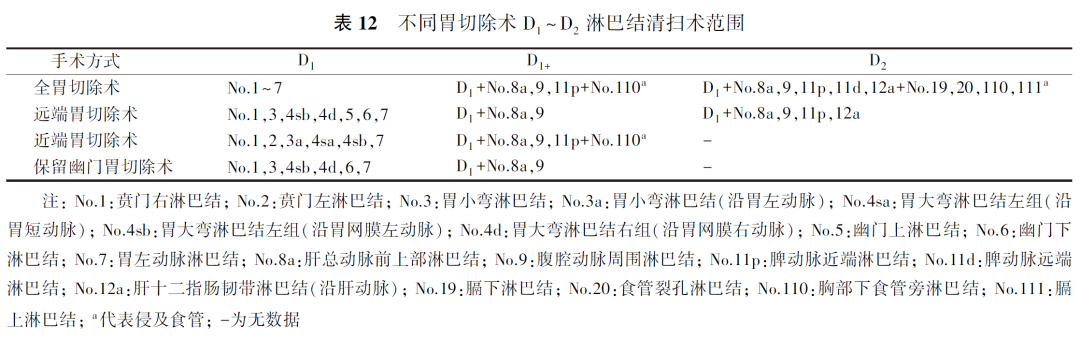
综上,本指南推荐对满足ESD绝对和扩大适应证的患者行ESD治疗,对不符合ESD绝对和扩大适应证的患者以胃切除术作为标准治疗方案并优先考虑功能保留胃切除术,同时根据胃切除术范围选择适当的淋巴结清扫术。值得一提的是,以胃切除手术为标准治疗的病变中,有一部分通过ESD也能够治愈,这样的病变称为ESD的相对适应证。符合ESD相对适应证的前提是术前判断淋巴结转移率极低,在此基础上,若患者因身体状况不能选择胃切除术,在充分向患者说明情况、患者知情同意的情况下,可选择ESD进行治疗。
高级别胃黏膜上皮内瘤变的治疗——ESD
对HGIN的患者,推荐进行内镜切除治疗(首选ESD)(强推荐,证据分级:高)
HGIN是Correa级联反应模式中最接近胃癌的一环,60%~85%的HGIN在4~48个月的时间内进展为胃癌。一项纳入30项队列研究的系统评价与Meta分析显示,HGIN发展为胃癌的风险是LGIN的16倍。此外,英国胃肠病学会建议对HGIN患者进行ESD治疗。北美的一项纳入347例胃肿瘤病变(包括82例HGIN)的队列研究显示,ESD对HGIN的整体切除率可达89%,R0切除率可达86%;葡萄牙的一项纳入114例胃肿瘤病变(包括39例HGIN)的队列研究结果显示,ESD对胃部肿瘤的整体切除率可达96.5%,R0切除率可达87.6%;另一项纳入427例患者的韩国队列研究结果显示,ESD对HGIN的整体切除率和R0切除率分别为97.4%和95.3%。由于ESD治疗HGIN有较高的安全性和有效性,本指南推荐对HGIN患者进行ESD治疗。
早期胃癌和癌前病变治疗——根除Hp
若早期胃癌或癌前病变(萎缩性胃炎、肠上皮化生、上皮内瘤变)合并Hp感染,推荐根除Hp(强推荐,证据分级:高)
Hp是WHO国际癌症研究署认定的Ⅰ类致癌源,一项纳入7项RCT研究的系统评价与Meta分析显示,在健康人群中根除Hp可降低胃癌的发病率(RR=0.54,95%CI:0.40~0.72),如果在全球范围内实施胃癌筛查和治疗,可获得8743815个伤残调整寿命年(95%CI:5646173~11847456)。实际上,根除Hp不仅使健康人群受益,也可降低早期胃癌患者异时性胃癌的发生率。一项纳入11项回顾性队列研究的系统评价与Meta分析分别比较了经内镜治疗后Hp阴性、根除Hp和未根除Hp的早期胃癌患者异时性胃癌的发生率,结果显示,根除Hp组发生异时性胃癌的风险显著低于未根除Hp组(HR=0.65,95%CI:0.50~0.86),而与Hp阴性组相比异时性胃癌的发生率无显著差异(HR=0.97,95%CI:0.30~3.16),说明Hp感染是异时性胃癌发生的危险因素。另一项系统评价与Meta分析也表明,根除Hp组和未根除Hp组异时性胃癌发生率分别为6.57%和12.73%(RR=0.46,95%CI:0.37~0.57)。综上,根除Hp可以有效减少早期胃癌术后异时性胃癌的发生率。因此,本指南推荐对早期胃癌合并Hp感染的患者,经ESD或胃切除手术后进行Hp根除治疗。
对胃癌前病变合并Hp感染的患者,根除Hp也有利于逆转胃部病变的进展。
日本的一项研究分析了232份萎缩性胃炎活检标本(包含根除Hp 3年后的胃黏膜和同期未根除Hp的胃黏膜),结果显示,根除Hp有助于减少胃萎缩性黏膜的部分基因位点甲基化水平,从而逆转胃黏膜萎缩。除此之外,一项纳入16项回顾性队列研究的系统评价与Meta分析也显示,根除Hp后胃窦部及胃体部的萎缩性胃炎均消退[根除Hp前和根除Hp后比较,胃窦部黏膜组织学评分的加权平均差(weighted mean difference, WMD)=0.25,95%CI:0.15~0.35,P<0.05;胃体部黏膜组织学评分的WMD=0.14,95%CI:0.04~0.24,P<0.05]。一项2020年发表的回顾性队列研究显示,根除Hp可显著改善胃体(P<0.001)和胃窦部(P=0.008)的萎缩性胃炎。这些结果提示根除Hp对萎缩性胃炎有治疗作用。在预防胃癌方面,一项纳入4项RCT和12项队列研究的针对东亚人群的系统评价与Meta分析显示,根除Hp有利于降低萎缩性胃炎患者的胃癌风险(HR=0.47,95%CI:0.38~0.59)。因此,我国和欧洲的专家共识均推荐对萎缩性胃炎合并Hp感染者根除Hp治疗。
一项随访16年的队列研究显示,肠上皮化生合并Hp感染的患者16年内进展为上皮内瘤变和胃癌的概率为69%(95%CI:60%~77%),而根除Hp的肠上皮化生患者16年内进展为上皮内瘤变和胃癌的概率为44%(95%CI:34%~54%),两者差异有统计学意义(P=0.001),提示根除Hp可能有助于减少肠上皮化生进展为上皮内瘤变和胃癌的风险。一项纳入2项RCT的系统评价与Meta分析显示,与安慰剂组比较,根除Hp组的肠上皮化生有显著改善(OR=2.61,95%CI:1.66~4.11)。此外,近年来发表的长时间随访研究(随访时间>5年)也显示,根除Hp可显著降低肠上皮化生进展为胃癌的风险,提示根除Hp后可能需要较长时间才能逆转肠上皮化生、降低胃癌风险。因此,本指南推荐对肠上皮化生合并Hp感染的患者行根除Hp治疗。
关于在LGIN的患者中根除Hp是否能阻断其进展到HGIN或胃癌,目前尚无明确的结论。一项纳入6项队列研究的系统评价与Meta分析显示,根除Hp对LGIN的进展无明显影响(RR=0.88,95%CI:0.59~1.31)。但另有队列研究显示,根除Hp可降低胃癌和LGIN复发的概率,并在一定程度上阻断LGIN进展为胃癌的过程。因此,欧洲指南推荐对LGIN合并Hp感染的患者进行Hp根除治疗。基于Hp根除对LGIN患者潜在的益处,本指南推荐在LGIN合并Hp感染的患者中根除Hp。
2018年的一项RCT纳入了470例接受内镜下切除的早期胃癌或HGIN患者,根据是否根除Hp将患者分为两组,经过长时间的随访(中位随访时间5.9年),结果显示,根除Hp后胃癌复发的发生率显著降低(HR=0.50,95%CI:0.26~0.94)。中国的一项回顾性队列研究分析了362例上皮内瘤变患者的预后影响因素,结果显示,Hp感染是上皮内瘤变复发的危险因素(OR=1.871,95%CI:1.048~3.343)。另一项纳入282例接受内镜切除的上皮内瘤变患者的研究也显示成功根除Hp可能减少胃上皮内瘤变患者异时性胃肿瘤的发展。这些研究结果提示根除Hp可能有利于减少内镜切除术后胃癌的复发或异时性胃癌的发生。
综上所述,本指南推荐对早期胃癌或癌前病变合并Hp感染的患者行根除Hp治疗。
开展胃癌筛查医师应具备的能力
胃癌筛查内镜医师应清楚了解胃的解剖学特征、具备一般内镜检查能力并至少有300例内镜检查的个人经验。内镜医师通过内镜诊断培训后需要至少对20例HGIN或早期胃癌病变进行诊断评估来获得胃癌光学诊断的能力。内镜医师满足内镜诊断培训标准,并达到20个HGIN或早期胃癌病变诊断≥80%的准确率后,可以进行胃癌内镜诊断(强推荐,证据分级:低)
对于内镜下病变的评估,内镜检查医师需掌握胃的解剖学特征和基本的内镜技术技能,才能对黏膜和病变进行准确地观察和判断。因此,在进行内镜诊断培训之前,内镜医师必须熟练掌握标准内镜检查技术。一项研究显示,超过90%的受训人员在执行200次上消化道内窥镜检查后能够达到95%的完成率(即在没有物理帮助的情况下将内窥镜送达十二指肠)。国家卫生健康委员会2019年《消化内镜诊疗技术临床应用管理规范》建议,开展内镜诊疗技术的医师需满足:(1)执业范围为与开展消化内镜诊疗工作相适应的临床专业;(2)有5年以上临床工作经验,目前从事消化系统疾病诊疗工作,累计参与完成消化内镜诊疗病例不少于200例;(3)经过消化内镜诊疗技术相关系统培训并考核合格,具有开展消化内镜诊疗技术的能力。欧洲内镜学会建议,在开始上消化道光学诊断培训之前,每名内镜医师应至少有300例上消化道内镜的个人经验,并满足上消化道内镜的ESGE质量标准;内镜医师需要通过内镜诊断培训,并至少对20例HGIN或早期病变进行诊断评估,获得胃癌光学诊断的能力。内镜医师在满足内镜诊断培训标准,并在20个HGIN或早期胃癌病变诊断中达到≥80%的准确率后,可以进行胃癌内镜诊断。
在具备一般内镜检查能力后,还需对内镜医师进行进一步的系统培训以提高胃癌和癌前病变的检出率。有研究者基于白光内镜开发了胃镜的标准学习系统,该系统由对知识和技术进行讲解的视频讲座和自我锻炼测试组成,用于指导内镜医师根据胃炎样病变(gastritis-like, G)、溃疡(ulcerative, U)和息肉(polypoid, P)对观察到的病变定性,从而诊断早期胃癌,故又称GUP系统。有研究者进行了一项多中心的RCT试验,纳入了来自35个国家的515名内镜医师并将其分为GUP系统学习组和非GUP系统学习组,结果发现GUP系统有助于改善内镜医师诊断早期胃癌的能力。还有研究显示,GUP系统也可提高内镜医师应用放大窄带成像技术诊断早期胃癌的能力。因此,本指南推荐对胃癌筛查医师进行类似GUP系统的学习培训,从而提高筛查的准确度。
胃癌筛查质量控制
检查过程应至少持续7 min(观察胃部时间≥3 min),并保留足够数量的清晰内镜图像,推荐设定胃癌早期诊断率作为质控指标(强推荐,证据分级:中)
目前缺乏完整的胃癌筛查质量控制流程,尚无临床试验直接阐明胃癌筛查质量控制的关键因素,但有证据提示内镜检查时间和内镜图像数量可能是影响胃癌筛查质量的重要指标。
理想状态下,胃镜检查时间越长病变的检出率越高。2012年一项前瞻性多中心研究显示,延长胃镜检查观察时间可以提高重度不典型增生和腺癌的检出率,内镜运行时间每增加1 min/cm,发现可疑病变的概率能由13.3%提升到54.2%,差异有统计学意义(P=0.04);重度不典型增生和腺癌的检出率能由6.7%提升到40.2%,但差异无统计学意义(P=0.06)。2015年在新加坡进行的一项回顾性研究显示,检查时长7 min以上的胃镜医师检查出高危病变的数量是检查时间<7 min的2.50倍(OR=2.50,95%CI:1.52~4.12)。2017年在日本进行的一项类似研究也显示,平均时间4.4、6.1和7.8 min组内镜医师检出肿瘤病灶的概率分别是0.57%、0.97%和0.94%;与时长<5 min组比较,5~7 min组和>7 min组肿瘤病灶检出率OR值分别为1.90(95%CI:1.06~3.40)和1.89(95%CI:0.98~3.64)。2017年韩国的一项回顾性研究也得出同样的结论,8名医师的平均检查时长为2 min 38 s,6名医师的平均检查时长为3 min 25 s;在111962例接受内镜检查者中,短时间组上消化道肿瘤的确诊率为0.2%,长时间组上消化道肿瘤的确诊率为0.28%,长时间组内镜医师更有可能检查出胃腺瘤或胃癌(OR=1.52,95%CI:1.17~1.97)。2016年欧洲胃肠镜协会和2019年英国胃肠病学会均在发布的指南中,要求从插管到拔管,对食管、胃和十二指肠的检查时间至少持续7 min。2020年日本胃肠内窥镜协会同样要求胃镜下对胃内部进行系统的观察,并认为观察时长与胃癌确诊相关,建议观察时间足够长。中国的一项研究显示,若拍摄20张内镜图像,则早期胃癌的检出率可从0.2%提高到2.3%。根据以上研究结果,本指南推荐内镜检查应至少持续7 min(观察胃部时间≥3 min),并保留足够数量的清晰内镜图像。
同时,由于早期胃癌的内镜检查存在一定漏诊率,本指南推荐设定胃癌早期诊断率(单位时间内上消化道内镜检查发现早期胃癌患者数/同期上消化道内镜检查发现胃癌患者总数×100%)作为质控指标。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


