
金鹏, 刘昊, 李洋, 等. 可切除胃癌精准诊治共识与争议[J]. 中华肿瘤杂志, 2021, 43(3):282-288.
DOI: 10.3760/cma.j.cn112152-20201115-00989.
胃癌是中国常见的消化系统恶性肿瘤,精准、微创、规范化的外科手术是胃癌综合治疗的重要环节。近年来,胃癌微创外科的适应证不断扩大,精准化手术的研究不断深入,规范化手术质量评价和控制体系不断完善。精准诊断分期、多学科综合诊疗模式、加速康复外科以及营养支持的全程管理等方面取得了全面发展,多项中国专家共识已经发布,有利于胃癌患者的康复,并使患者实现提高生活质量和延长生存的双重获益,但是对于复杂情况的精准治疗仍有争议,期望能达成共识以利于胃癌的规范化诊治。
【关键词】胃肿瘤; 精准医疗; 微创; 手术
在我国,胃癌发病率和死亡率分别占恶性肿瘤的第2位和第3位,但是早期胃癌检出率不足20%。外科治疗是肿瘤综合治疗过程中不可或缺的重要组成部分,微创外科是未来外科的发展趋势。随着高质量的证据不断充实,微创外科的适应证逐渐扩大,从早期内镜下切除、腹腔镜早期胃癌根治术到腹腔镜进展期胃癌根治术,再到新辅助或者转化治疗后腹腔镜手术,腹腔镜下联合脏器切除亦有所尝试。精准手术的实施有赖于术前对肿瘤的精准定位和精准诊断分期。精准、微创、规范的手术要求在根治性切除肿瘤的前提下,以最微创、精准的方式,最大程度地保留残胃功能。在治疗过程中,需要强调的是,对胃癌患者的全程管理,需要多学科协作讨论制定个体化诊疗方案,外科治疗只有在适当的时机给予精准、规范的治疗,才能使患者持续获益。本文中,我们从胃癌的精准诊断分期,微创外科治疗适应证,精准、微创、规范的外科手术,以及多学科合作、快速康复、全程营养管理等方面的共识和争议进行评论,以期为临床决策提供参考。
精准诊断分期
精准诊断分期是精准治疗的前提。随着影像学技术的发展,术前影像学评估取得一定进展,但仍面临挑战,无法同时满足术前分期的高敏感性和特异性。对于早期胃癌,主要依据胃镜和超声内镜判断肿瘤侵犯深度和淋巴结转移情况。对于进展期胃癌,薄层强化CT是最常用的检查手段。胃癌淋巴结转移的判断主要依据淋巴结形状、大小、位置和侵犯情况,CT对诊断淋巴结转移特异性较低。当怀疑伴有腹腔转移或远处转移时联合应用MRI或PET-CT可提高诊断率。PET-CT用于胃癌多发远处转移,尤其是骨转移有较大价值。此外,腹腔镜探查和细胞学冲洗,为精准分期和治疗提供了有力证据。美国国家综合癌症网(National Comprehensive Cancer Network, NCCN)指南从2016年开始推荐腹腔镜探查+细胞学用于cT1b以上胃癌的分期。日本胃癌治疗指南从2018年第5版开始推荐腹腔镜联合内镜、超声和CT用于肿瘤分期。腹腔镜探查发现腹膜转移的敏感度达80%以上。细胞学检查可发现约32%肉眼无法识别的腹腔播散。术前细胞学阴性的进展期胃癌患者,术后再次细胞学检查的阳性率高达60%。无腹膜转移,而细胞学阳性患者的中位生存时间仅22个月。关于细胞学冲洗方法,Liu等报道了四步冲洗法可提高细胞学阳性检出率。我们采用类似的检查方法,原则为由上到下,由远及近,最后冲洗胃周及网膜囊,避免直接冲洗瘤体部位。对于无肉眼可见腹膜转移,但是细胞学阳性的患者(CY1,P0)如何治疗,日本学者Yasufuku等回顾性分析了腹腔镜探查39例CY1,P0的胃癌患者,其中13例转化为CYO后再次行根治性手术,3年生存率达76.9%。对于CY1,P0患者,先进行转化治疗,再次腹腔镜探查转化为CY0,P0后进行根治性手术,可能使患者的生存获益最大。
微创外科治疗适应证
1.早期胃癌内镜手术:
根据第5版日本胃癌治疗指南,内镜黏膜切除术(endoscopic mucosal resection, EMR)的绝对适应证为分化型腺癌,T1a期,无溃疡,肿瘤直径≤2 cm。内镜黏膜下层剥离术(endoscopic submucosal dissection, ESD)的绝对适应证为:(1)分化型腺癌,T1a期,无溃疡,肿瘤大小无明确限定;(2)分化型腺癌,T1a期合并溃疡,肿瘤直径≤3 cm。扩大适应证为:未分化型腺癌,无溃疡,T1a期,肿瘤直径≤2 cm。早期胃癌内镜下治疗逐渐被认可。对于部分术后切缘阳性或者具有脉管浸润等非根治性切除者,建议行根治性补救手术。对于超出内镜下治疗适应证的早期胃癌,采用内镜下定位和黏膜下注射示踪剂,再行腹腔镜下胃癌根治术的双镜联合模式,有利于精准切除和精准前哨淋巴结活检和清扫。
2.早期胃癌根治术:
腹腔镜下早期胃癌根治术已被广泛认可,腹腔镜下早期胃癌根治术具有创伤小、术后恢复快、并发症少等优势,患者的长期生存与开腹无差异。韩国KLASS-01和KLASS-03研究以及日本JCOG0912研究表明,对于术前临床分期为Ⅰ期近端、中部1/3和远端1/3的胃癌患者,无论是全胃切除术或者远端或近端胃切除术,腔镜组和开腹组患者的长期生存率和术后并发症的发生率差异均无统计学意义(P<0.05)。因此,腹腔镜应用于Ⅰ期胃癌安全、可行,并在中国、日本、韩国胃癌治疗指南中推荐为早期胃癌(非ESD适应证)的首选术式。
3.进展期胃癌根治术:
中国的多中心CLASS-01研究表明,对于临床分期为T2、T3和T4a的进展期远端胃癌患者,腔镜组与开腹组患者的3年无病生存率分别为18.8%和16.5%,术后并发症的发生率分别为15.2%和12.9%,死亡率分别为0.4%和0,差异均无统计学意义(P<0.05)。韩国多中心KLASS-02研究表明,对于进展期胃癌,腹腔镜远端胃癌根治术与开腹组相比,具有并发症发生率低,恢复快、疼痛轻等优势。日本多中心回顾性研究LOT-A中,纳入1948例临床分期为Ⅱ期和Ⅲ期的进展期胃癌患者,腔镜组与开腹组相比,5年生存率分别为53.0%和54.2%,复发率分别为30.8%和29.8%,差异均无统计学意义。Shizuki等回顾性分析了79例胃食管结合部SiewertⅡ型、进展期胃癌患者的资料,腔镜组较开腹组患者的5年总生存率(HR=0.42,95%CI为0.05~3.47)和无复发生存率(HR=0.47,95%CI为0.10~2.12)的差异均无统计学意义。因此,对于进展期胃癌患者,采用腹腔镜手术的近期和远期疗效均非劣于开腹手术。期待韩国(KLASS-02)和日本(JCOG-0901)长期研究结果公布,为腹腔镜在进展期胃癌中的应用提供更有力的证据。
4.局部晚期联合脏器切除:
2018年,第4版日本胃癌治疗指南推荐胃癌侵犯周围脏器时行根治性联合脏器切除。2020年,Lee等回顾性报道了19例T4b期胃癌行腹腔镜下联合脏器切除术,术后并发症和围术期死亡率无明显增加,但是远期肿瘤学效果仍需要进一步观察。2020年,周声宁等报道了21例腹腔镜全胃联合脾脏切除治疗T4b胃癌患者的资料,与开腹组手术时间[(226.6±49.9)min]比较,腔镜组手术时间明显延长[(264.0±35.1)min,P=0.011],但术后并发症和术后30 d死亡率的差异均无统计学意义。开腹组和腔镜组患者的3年无病生存率分别为38.1%和37.5%,差异无统计学意义(P=0.751)。随着腹腔镜技术的逐渐成熟,腹腔镜联合脏器切除的安全性和有效性,需要更多研究去探索。
5.寡转移联合脏器切除:
1995年,有学者首次提出寡转移的概念,寡转移是指肿瘤介于广泛转移和局部进展之间的中间状态。这部分患者通过局部治疗(手术、放疗、介入等)可以获得根治性机会和长期生存获益。多个临床研究报道,部分胃癌患者局限性肝转移、肺转移、卵巢转移、腹膜转移等,可采取胃癌联合转移瘤的切除获益,并在多个指南中被推荐。Min等回顾性分析了117例Ⅳ期胃癌患者的临床资料,腹腔镜胃+转移灶切除与开腹组比较,5年生存率分别为23.9%和25%,中位生存时间分别为17.9和22.8个月,差异无统计学意义。值得注意的是,2016年,日本、韩国和新加坡44个中心参与的Ⅲ期临床试验(REGATTA),纳入175例具有单一不可切除因素(包括肝转移、腹膜转移、腹主动脉旁淋巴结转移)的进展期胃癌,研究表明,不切除转移灶仅行单纯的胃切除+化疗不优于单纯化疗。因此,Ⅳ期胃癌手术的开展,也只有在根治性胃联合脏器切除的前提下,才具有获益的可能性。胃癌肝转移最常见,2019版《胃癌肝转移诊断和综合治疗中国专家共识》中对胃癌肝转移的诊治做出详细推荐。我们回顾性分析了189例胃癌伴卵巢转移患者的资料,腹水阴性时,不管是同时性还是异时性转移,胃癌联合卵巢切除均可有效延长患者生存。究竟是先新辅助治疗再手术,还是直接联合脏器切除,尚无定论,但新辅助治疗的优势越来越明显,行新辅助治疗后再次联合脏器切除似乎是更合理的选择,期待更多研究证据进一步证实。
6.新辅助和转化治疗后腹腔镜手术:
2019年,Li等开展了前瞻性Ⅱ期随机对照试验,纳入临床分期为cT2~4aN+M0的进展期远端胃癌患者,新辅助治疗后行手术治疗,腹腔镜组较开腹组并发症的发生率更低(分别为20%和46%,P=0.007),疼痛更轻,化疗耐受性更好,化疗完成度更高。我们在临床工作中观察到,新辅助治疗后腹腔镜组患者在手术时间、术后淋巴结清扫总数、术后带胃管时间、术后第1天白细胞数、并发症的发生率方面与开腹手术组的差异均无统计学意义(均P>0.05),但术中出血量、术后住院时间少于开腹手术组。2012年,日本进行的一项前瞻性Ⅱ期临床研究(LANDSCOPE Trial)拟对新辅助治疗后腹腔镜和开腹手术治疗远端胃癌患者的3年无病生存率进行比较,遗憾的是,日本早期胃癌占绝大多数,新辅助治疗后病例数少,该研究到目前为止仍未完成入组。2017年,德国的前瞻性Ⅱ期临床研究(AIO-FLOT3)中,36例胃癌患者行4个周期新辅助化疗后,行胃癌和转移灶根治性切除,术后继续4个周期化疗,与单纯化疗组比较,新辅助化疗+手术+化疗组患者的中位总生存时间和中位无进展生存时间均有获益。一项多中心Ⅲ期临床研究(AIO-FLOT5)旨在评价寡转移的胃癌和胃食管结合部癌化疗后手术与单纯化疗患者的远期生存和近期生活质量,其结果尚未公布。目前研究显示,新辅助治疗或者转化治疗后行腹腔镜手术,近期疗效优于开腹手术,长期疗效需要关注。
7.腹腔镜下胃部分离断胃空肠吻合术:
早在1997年,日本学者Kaminishi等提出了胃部分离断胃空肠吻合术治疗胃十二指肠流出道梗阻而无法根治性切除的胃肠肿瘤。2018—2019年我们完成了9例全腔镜下胃癌手术,术中出血量为(13.3±5.0)ml,手术时间为(103.3±10.6)min。9例患者术后第1天可进流食,术后排气时间为(3.1±0.8)d,术后住院时间为(5.4±1.1)d,无胃排空障碍发生。一项Meta分析显示,腹腔镜下胃部分离断胃空肠吻合术用于姑息治疗梗阻比单纯胃肠吻合发生胃排空障碍的概率低(OR=4.997, 95%CI为2.310~10.810),经口进食时间早(OR=0.156,95%CI为0.055~0.442),住院时间短(分别为19.7和23.3 d),生存时间长(分别为189.2和115.2 d)。该术式另一潜在优势为部分患者经过转化治疗后,有望再次行根治性手术,只需二次切除远端肿瘤和淋巴结清扫,近端吻合保留。全腔镜操作的优势为:(1)全腔镜下操作,创伤更小,有助于尽早下床活动和经口进食。(2)解除胃输出道梗阻的同时保留了内镜治疗肿瘤出血的通道,也可以减少食物刺激肿瘤出血。(3)阻隔了肿瘤向胃空肠吻合口的蔓延,降低了二次梗阻的发生率。但需要注意的是,只有极少数患者有可能转化成功,该术式对于晚期梗阻患者姑息性短路手术,解决进食问题的优势更明显。
精准、规范、微创的外科手术
精准微创外科要求在根治性切除肿瘤的前提下以最微创的方式,尽可能保留功能。对于胃癌的精准切除涉及许多方面,比如胃次全切除保留更多的残胃体积、保留迷走神经、保障胃的蠕动功能,保留幽门和贲门降低反流,淋巴结示踪引导的精准淋巴结清扫等。
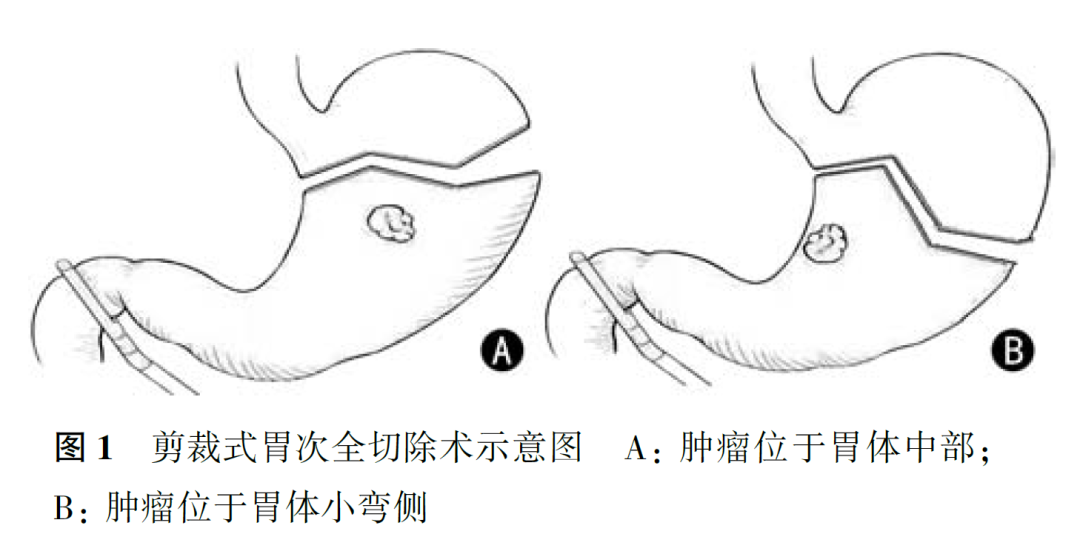
1.腹腔镜剪裁式胃次全切除术(laparoscopic tailored subtotal gastrectomy,LTSG):
对于进展期胃癌,越来越多的研究表明,胃次全切除术可取得与全胃切除术同样的肿瘤学效果,且具有术后并发症少和营养状况更佳方面的优势。但是,残胃体积过小并不能改善胃癌患者的术后营养状况和生活质量,因此,我们设计了LTSG(图1)治疗进展期胃中部癌,在保证肿瘤安全性的前提下,根据肿瘤部位进行剪裁式切除,最大限度地保留胃体积。操作的要点是需保留1~2支胃短血管,不进行NO.2组淋巴结清扫;保证上下和外侧切缘>3 cm,如无法达到上述要求则行全胃切除。主要适应证为:(1)根据第8版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)实体肿瘤TNM分期系统,术前临床分期为cT2~4NxM0(临床分期依据胃镜检查、内镜超声以及腹部CT检查);(2)大体分型为BorrmannⅠ、Ⅱ和Ⅲ型;(3)肿瘤直径<4 cm;(4)肿瘤位于胃体中部或小弯侧。前期研究结果表明,LTSG组术后并发症少,营养状况更佳,LTSG没有增加复发率,但具有长期生存获益。可能是通过改善营养状况,进而延长患者的总生存。
2.精准淋巴结清扫:
精准的淋巴结清扫指对不同分期的患者进行适度的淋巴结清扫,既不遗漏可能转移的淋巴结,又要避免过度清扫。当前的淋巴结示踪技术主要包括染料法和放射性同位素标记法,两种示踪技术可以单独应用或者联合应用,用来显示肿瘤周围引流区域的淋巴结,并不能特异性靶向识别转移的淋巴结。对于Ⅰ期(cT1~T2N0M0)胃癌,前哨淋巴或前哨淋巴池的概念逐渐被认可,染料+放射性物质双重示踪技术被认为可提高前哨淋巴结检出率,进而避免过度清扫。日本的一项多中心试验纳入了397例cT1~2N0M0原发肿瘤<4 cm的胃癌患者,运用双重示踪技术,前哨淋巴结的检出率、灵敏度和准确度分别为97.5%、93.0%和99%。日本的另一项多中心研究(JCOGO302)对cT1、原发肿瘤<4 cm的胃癌患者,在肿瘤周围的浆膜下使用吲哚菁绿(indocyanine green, ICG)标记示踪,前哨淋巴结检出率达97.8%,但是假阴性率高达46.4%,最终试验提前终止。因此,对于前哨淋巴结示踪导航手术的临床应用,尚需进一步研究。对于进展期胃癌,根据美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)指南,D2根治术至少应检出16枚淋巴结,第8版AJCC胃癌TNM分期提出清扫>30枚淋巴结有利于更精准分期,降低分期的偏倚,提高患者的预后。淋巴结示踪技术引导的淋巴结清扫有利于检出更多的淋巴结。Chen等在国内率先研究ICG引导的淋巴结清扫在腹腔镜胃癌根治术中的应用,结果表明,ICG引导的淋巴结清扫增加了检出数目,没有增加手术风险。我们对于进展期胃癌常规开展了ICG引导的精准淋巴结清扫,并且参与了即将开始入组的"吲哚菁绿示踪在腹腔镜胃癌淋巴结清扫术的前瞻性多中心随机对照临床研究(CLASS-12)",将进一步明确ICG引导的精准淋巴结清扫在进展期胃癌根治术中的价值。2019版《吲哚菁绿标记荧光腹腔镜技术在腹腔镜胃癌根治术中的应用专家共识》对ICG注射适应证和注射方法进行了推荐,对开展ICG研究和临床应用提供了指导。
3.联合手段的应用:
腹膜的复发转移是胃癌术后最常见和最重要的致死原因。研究人员对预防和治疗腹膜复发转移进行了许多探索,例如术中预埋置腹腔化疗泵、腹腔化疗药物的灌洗、腹腔热灌注等。腹腔热灌注的研究最为广泛,《中国腹腔热灌注化疗技术临床应用专家共识(2019版)》对腹腔热灌注的应用方式和治疗适应证进行了详细的介绍。治疗主要分为3种模式:(1)预防模式:对于腹腔复发高危患者,根治术后联合腹腔热灌注预防腹腔复发。(2)治疗模式:对于腹膜局限性转移患者,根治性腹膜减瘤术联合腹腔热灌注,治疗腹膜转移癌。(3)转化治疗模式:对于广泛腹腔转移和伴有恶性腹水患者,腹腔热灌注联合系统化疗有望转化为可切除。多项研究正在进行中。
4.完善手术质量控制和评价体系:
完善的手术质量控制和评价体系是精准外科的保障,涉及术前、术中、术后多个环节。术前的风险评估和精准分期定位等、术中精准的无瘤原则下的肿瘤切除和精准的淋巴结清扫、合理的消化道重建、术后切除标本的大体评估和淋巴结分组送检、并发症的评估、手术质量的监控等。《中国腹腔镜胃癌根治手术质量控制专家共识(2017版)》对以上内容做了详细推荐。其中规范的淋巴结送检是精准治疗的重要环节,规范的淋巴结分组送检,有利于准确获取淋巴结转移信息,即转移淋巴结的数目和范围,降低分期的偏移,是胃癌精准分期和制定治疗计划以及预测预后的重要依据。《胃癌根治术标本规范淋巴结送检和操作中国专家共识(2019版)》的发布,将有利于淋巴结分拣送检工作进一步规范和推广,使其成为胃癌外科医师的必备技能。
5.胃癌经自然腔道取标本手术(natural orifice specimen extraction surgery, NOSES):
胃癌NOSES可进一步减少腹部伤口,是近年来胃癌微创外科领域关注的热点之一,《胃癌经自然腔道取标本手术专家共识(2019版)》对胃癌NOSES进行了全面阐述,为该技术在临床实践中的规范开展提供了参考依据和行业准则。我们在国内率先对胃癌NOSES进行尝试,其应用和推广尚需要不断摸索和完善。
多学科合作、快速康复和全程营养管理
1.多学科协作诊疗模式:
肿瘤的综合治疗需要多学科合作。由内科、外科、影像科、病理科、放疗科等相关科室专家共同讨论制定个体化的诊疗方案。精准诊治,不仅强调精准切除,更要强调外科干预的合理时机,精准外科只是肿瘤综合治疗中的重要环节之一。《胃癌多学科综合治疗协作组诊疗模式专家共识》(2017版)对各期胃癌的讨论重点和治疗原则进行了推荐,多学科诊疗模式是精准诊疗的保障。
2.加速康复外科(enhanced recovery after surgery, ERAS):
自1997年丹麦Kehle率先提出ERAS以来,ERAS已在外科各个领域广泛开展。新时代下,胃癌精准、微创外科和ERAS理念的结合,加速了患者康复,能使患者快速进入下个治疗环节。《胃癌胃切除手术加速康复外科专家共识(2016版)》对胃癌的术前评估、术中规划、术后管理进行详细推荐。需要强调的是,随着技术的发展,ERAS涉及的具体措施会不断改变,但ERAS的理念不会改变。
3.全程营养管理:
胃癌患者营养不良的发生率达45%以上。营养不良会增加围术期的手术风险,降低术后辅助治疗的耐受度,甚至影响患者的远期生存。营养管理需要贯穿抗肿瘤治疗的全过程,是各项治疗的基础保障。外科医师往往对患者的营养评估和干预不够重视,《胃癌围手术期营养治疗中国专家共识(2019版)》对术前、术后营养评估和筛查、干预措施和出院后复查和指导进行了详细推荐,将有利于对患者进行全程营养管理,保障综合治疗的顺利进行,进而实现患者生活质量和长期生存的双重获益。
结语
肿瘤诊疗已进入精准化、个体化治疗时代,多学科合作、精准诊断分期、制定个体化诊疗方案是精准诊疗的前提。精准、微创、规范的外科手术,是胃癌综合诊治的重要环节,是早期肿瘤获得根治的唯一手段。对于每一例可切除胃癌均要在根治性切除肿瘤的前提下,以最微创的方式精准切除病灶,清扫合理范围的淋巴结,既要防止扩大清扫,又要避免遗漏可能转移的淋巴结,同时注重保留残胃功能。不断完善和优化手术质量评价和控制体系,有利于快速提高整体外科治疗水平。通过ERAS理念的深入研究和推广、营养支持的全程管理,多学科诊疗模式的开展,使患者又快又好的康复、实现生活质量和长期生存的双重获益是精准诊疗的最终目的。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


