慢性髓性白血病(CML)是一类起源于造血干细胞的,以粒细胞过度增殖为特征性表现的恶性克隆性疾病,是成人白血病中较为常见的类型。以伊马替尼为代表的酪氨酸激酶抑制剂(TKI)的出现为CML患者的预后带来改善,也开启了实体瘤及血液肿瘤治疗的靶向时代。如今,越来越多的TKI上市,为临床实践中的选择及转换带来考验。【血液肿瘤资讯】特邀南方医科大学南方医院许娜教授以“CML治疗中TKI转换病例实战分享”为题,分享CML治疗中的TKI转换时机,2例TKI转换病例及南方医院单中心氟马替尼治疗CML-CP患者研究数据。
专家简介
南方医科大学南方医院血液科
广东省医学青年杰出人才
中华医学会血液学分会第十一届白血病淋巴瘤学组委员
中国抗癌协会血液肿瘤委员会第二届MDS/MPN工作组委员
广东省抗癌协会血液肿瘤委员会CML/MPN执行主任委员
广东省中西医结合学会血液病专业委会常委
广东省抗癌协会血液肿瘤专委会委员
广东省血液科质控中心秘书兼副组长
广东省基层医药学血液病学专业委员会常委
广东省医学会血液病学分会贫血/MDS组成员
广东省预防医学会血液肿瘤专委会委员
广东省女医师协会-血液学分会委员
广东省弥漫性实质性肺疾病多学科成员
核心观点
对于早期治疗未达EMR的患者应尽早实行转换,转换越早,患者有望获得更多获益;
临床实践中对于TKI的选择应注重高效、低毒,避免患者无法耐受治疗;
单中心研究数据中,氟马替尼在一线及多线治疗中疗效、安全性表现优异。
未达EMR患者尽早转换TKI,
有望为患者带来更大获益
此前,一项回顾性研究显示了CML中早期分子学反应(EMR)与深度分子学反应(DMR)的相关性,提示3个月及6个月的BCR-ABLIS转录本水平是获得MR4.0的独立预后因素[1]。中国CML联盟的研究也显示,接受伊马替尼治疗3个月后未达EMR的患者,远期疗效也不佳[2]。
此外,更有研究尝试探索更早期的分子学反应(VEMR)与远期疗效的相关性,研究显示1个月时达到BCR-ABLIS≤40%的患者5yMMR及DMR可达89.1%与56.5%,使用2代TKI的患者较使用伊马替尼的患者在1个月时达到VEMR的比例更高,且在后续3个月时≤10%及6个月时≤1%的患者比例更高[3]。国际研究DASCERN显示对于伊马替尼治疗3个月未达EMR的患者早期转换二代TKI将有望改善患者长期获益[4]。这些研究都提示对于一代TKI疗效不佳的患者应尽早完成转换。
无法耐受也是TKI转换关键因素,
安全性可能影响患者依从性
除疗效因素外,安全性因素也是促进转换的关键因素。欧美真实世界观察性研究SIMPLICITY研究显示,患者无法耐受是TKI转换的最常见原因[5]。CML治疗中的低级别不良反应可能会影响到患者的生活质量以及治疗依从性[6,7]。而研究显示,依从性差是阻碍患者获得MMR的重要因素,日本的一项回顾性真实世界研究提示,严重的不良事件甚至会影响患者预后[8,9]。
此外,不同的TKI具有不同的不良反应风险,例如合并代谢性疾病、心血管高危人群应避免使用尼罗替尼,胸腔积液高危因素患者应避免使用达沙替尼[10,11],在选择TKI时也需尽量选择患者容易耐受、安全性更好的TKI。总体而言,对于疗效不佳或无法耐受的患者,尽早完成TKI的转化,将有望从疗效、安全性、依从性等多个方面为患者带来更大获益,转化时应尽量选择疗效更好、安全性更好的TKI。
氟马替尼优效低毒,获得权威指南推荐
在III期临床研究中,氟马替尼治疗处于慢性期的慢性髓系白血病(CML-CP),对比伊马替尼分子学反应率更高,反应更快、更深,达到MMR的时间明显缩短,细胞遗传学反应率更高,患者12个月无进展生存率更高[12]。在与其他二代TKI尼洛替尼、达沙替尼的上市前数据非头对头对比中,也可观察到类似的疗效[13,14],由于氟马替尼可以高选择性抑制Abl激酶,脱靶现象更少,也导致了更低的不良反应风险[15-18]。
临床研究中,氟马替尼导致的腹泻多为轻度,49%的患者发作持续时间<1天,62%持续时间<2天,93%的患者为CTCAE 1级。
目前,氟马替尼已经获得2020版中国慢粒指南慢性期一线治疗推荐[19]。
病例分享
病例① 44岁,男性
2017-10-29外院诊断CML-CP,血常规显示:WBC 291.42G/L;Neu:40%;未成熟细胞总数:157.37G/L;HGB 105g/L;PLT 391G/L。骨髓细胞形态学示:骨髓增生极度活跃,粒:红=24:1,粒系以中晚幼粒细胞为主,红系增生减低,占比4%。外周血幼稚细胞:6%。CML-CP可能性大。Sokal评分:1.7155(高危);ELTS评分:2.423(高危)。
2017-10起伊马替尼治疗,2018-3-1 Q-PCR 86.401%,提示耐药,未检测到ABL激酶区突变,2018-3-10转换为达沙替尼治疗,期间出现血小板减少,并因反复胸腔积液多次减停药物;剂量减少至50mg后,出现CMV肠炎。考虑患者对伊马替尼耐药,达沙替尼不耐受,2020-4-28转换为氟马替尼治疗,Q-PCR持续下降,达到并持续MMR,除早期轻度腹泻外无明显不良反应。
病例② 32岁,男性
2021-10诊断CML-CP,血常规显示:WBC 58.50G/L;HGB 134g/L;PLT 873G/L。骨髓细胞形态学示:骨髓增生极度活跃,粒:红=40.33:1,考虑CML-CP。Sokal评分:0.7(低危);ELTS评分:0.5738(低危)。
2021-11-1起尼洛替尼治疗,期间出现手脚疼痛、睡眠质量差、消瘦,自服止痛药后出现呕吐等不适,2021-12-2 因药物性肝损伤(ALT:552U/L,ALT 347U/L,胆红素进行性升高,最高37.9μmol/L)停药,考虑患者不耐受,2021-12-21转换为氟马替尼,3个月后达到MMR并持续。
单中心研究内容
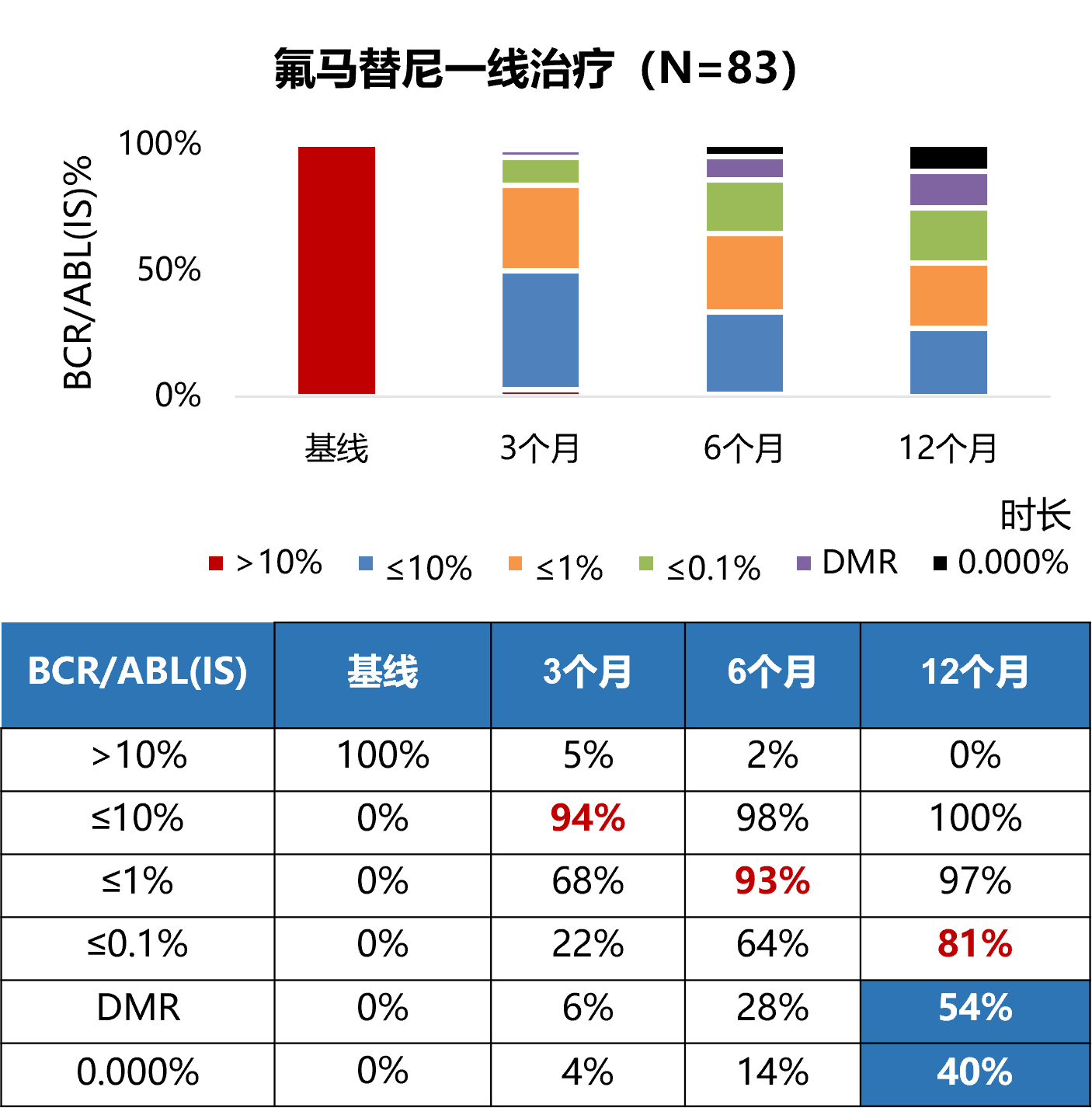
在氟马替尼治疗新诊断CML-CP患者的南方医院单中心数据中,随治疗时间延长,氟马替尼治疗CML-CP的MMR率不断提高。一线治疗可评估的83例患者中,氟马替尼一线治疗的EMR率为94%,一线治疗CML-CP患者12个月MMR率达到81%,DMR率54%,转阴患者占比40%。
表1. 一线治疗患者基线状态

表2. 一线治疗患者疗效数据
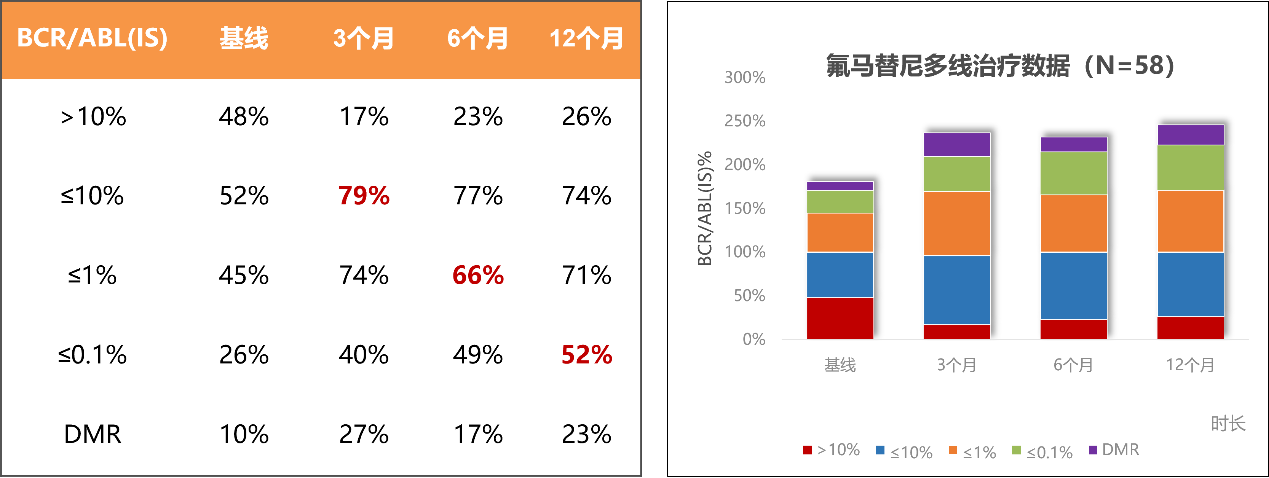
多线治疗的58例可评估患者中,28例为二线转换,19例为三线转换,11例为四线及以上患者转换。其中,二线转换患者中,一线使用伊马替尼后转换至氟马替尼的患者比例达到71%,如下表3所示:
表3. 多线治疗患者状态统计
 多线治疗患者中,随着治疗时间延长,氟马替尼治疗CML-CP患者的MMR率不断提高,12个月MMR率可达52%。
多线治疗患者中,随着治疗时间延长,氟马替尼治疗CML-CP患者的MMR率不断提高,12个月MMR率可达52%。
表4. 多线治疗患者疗效统计
尽早进行TKI转换有助于患者取得更好获益,
氟马替尼优效低毒可作为临床优选
多项临床研究相继验证了EMR与DMR之间的相关性,对于新诊断的CML-CP患者,一线接受伊马替尼治疗如早期(3个月)未达EMR,或因药物不可耐受而需更换TKI,应尽早转换至二代TKI,以为患者达到更好的获益。《慢性髓性白血病中国诊断和治疗指南(2020年版)》中亦推荐,对于一线TKI不耐受的患者应尽早更换至其他TKI。
兼顾考虑到临床疗效与安全性,氟马替尼可以作为临床实践中的优选。本次许娜教授分享的两例病例皆在前线接受达沙替尼或尼洛替尼时出现耐受性问题,因不良反应而不得不停药,在更换至氟马替尼后取得了很好的安全性,长期接受治疗中保障了较高的生活质量。
在该中心报告的数据中,氟马替尼的一线治疗疗效同样令人惊艳,提示了将其作为CML-CP患者一线治疗的巨大潜力,当然,在后线转换治疗中,氟马替尼同样可表现优异的疗效和安全性,提示了其在临床实践中良好的应用前景。
[1] Wang R, et al. Medicine (Baltimore). 2019;98(15):e15222.
[2] Zhang J, et al. Blood Cancer J. 2018;8(7):61.
[3] Song HY, et al. Cancer Med. 2018;7(10):5107-5117.
[4] 2020 EHA. EP756.
[5] Hehlmann R, et al. Am J Hematol. 2019 Jan;94(1):46-54.
[6] Curr med res opin.2014 Nov.30(11).2317.28.
[7] Efficace F, et al. Leuk Res. 2014 Mar;38(3):294-8.
[8] Marin D, et al. J Clin Oncol. 2010 May 10;28(14):2381-8.
[9] Ota S,et al Eur J Haematol 2018,101,95-105.
[10] Quintas-Cardama A, et al. J Clin Oncol. 2007;25(25): 3908-14.
[11] de Lavallade H, et al. Br J Haematol. 2008;141(5): 745-7.
[12] Zhang L, et al. Clin Cancer Res. 2021;27(1):70-77.
[13] Wang J, Shen ZX, Saglio G,et al.Blood. 2015 Apr 30;125(18):2771-8.
[14] Cortes JE, Saglio G, Kantarjian HM,et al.J Clin Oncol. 2016 Jul 10;34(20):2333-40.
[15] H Luo, et al. Leukemia, 24:1807-1809(2010)
[16] Carneiro BA, Kaplan JB, Giles FJ,et al.Expert Rev Hematol. 2015 Aug;8(4):457-79.
[17] Weisberg E, Manley PW, Breitenstein W,et al.Cancer Cell. 2005 Feb;7(2):129-41.
[18] Valent P , Hadzijusufovic E , et al. Leukemia Research, 2017:S0145212617304228.
[19] 慢性髓性白血病中国诊断与治疗指南(2020版)
排版编辑:肿瘤资讯-Phoebe











 苏公网安备32059002004080号
苏公网安备32059002004080号


